用于治疗神经退行性变疾病的α‑突出核蛋白和其疫苗的模拟表位的制作方法
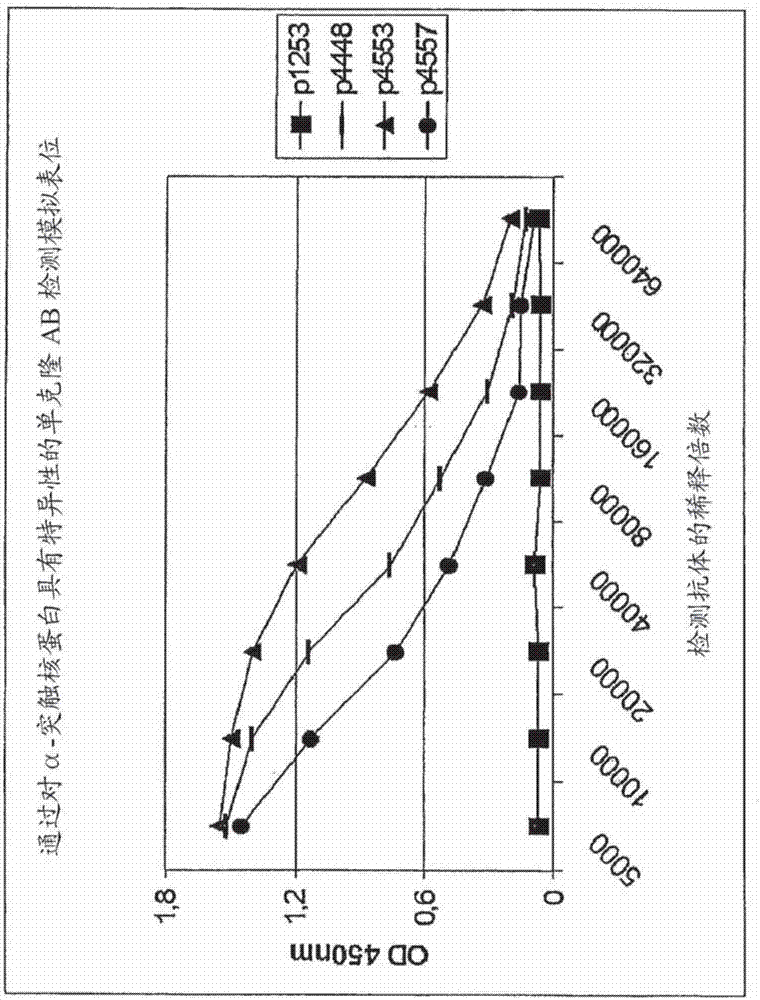
本申请是基于申请日为2009年2月23日,优先权日为2008年2月22日,申请号为200980105866.6(pct/at2009/000071),发明名称为:“用于治疗神经退行性变疾病的α-突出核蛋白和其疫苗的模拟表位”的专利申请的分案申请。本发明涉及一种待用于预防和/或治疗突触核蛋白病(synucleinopathy)的医药。突触核蛋白病是一组具有下述共同病理学特征的不同神经退行性变疾病:在神经病理学检查中可检测出含有异常α-突出核蛋白(α-syn)蛋白质聚集于选定种群的神经元和神经胶质细胞中的特征性损伤。α-syn(起初鉴别为park1和park4)是广泛表达于新皮质、海马、齿状回、嗅球、纹状体、丘脑和小脑的140个氨基酸的蛋白质。α-syn还在造血细胞,包括b-、t-和nk细胞,以及单核细胞和血小板中高表达。其在这些细胞中确切的作用尚为未知,但已发现其涉及巨核细胞(血小板的前体)的分化。最常见的突触核蛋白病包括但不仅限于lewy体病(lewybodydisorder,lbd),如帕金森氏病(pd),帕金森氏病伴痴呆(pdd),痴呆伴lewy体,以及多系统萎缩(msa)或神经退行性变伴脑铁聚集i型(brainironaccumulationtypei,nbiatype1)。对这些疾病的现行治疗手段包括针对症状的药物,如l-多巴、抗胆碱能药以及单胺氧化酶抑制剂。然而,所有现行的治疗手段仅仅导致症状缓解,而无法在患者中诱导长期持续的疾病减轻作用。lewy体病是以震颤、强直、运动徐缓(bradykinesia)和脑中多巴胺能神经元的丧失为特征的进行性的神经退行性变疾病。在dlb和pdd的情况下,症状还包括认知缺损。在西方国家高于60岁年龄的人群中高至2%发展出pd/lpd的典型症状。目前,仅有针对症状的治疗方法。不幸的是,这些疗法仅仅提供对早期症状的暂时缓解,而无法停止疾病的进行。pd/lbd的发病机理仍然未完全理解,但看来该疾病的发展牵涉到遗传易感性和环境因素。虽有遗传学方面的所有进展,pd/lbd仍主要是未知原因的散发病症(亦称为自发性pd/lpd)。罹患该疾病的患者在脑的皮质和皮质下区域内发展出称为lewy体(lb)的特征性的泛素化(ubiquitinated)胞内包涵物(inclusion)。特别是在具有高多巴胺能神经元或神经投射(neuronalprojection)的区域显示这种类型的病理学特征。近来,数个研究显示突触蛋白α-syn在lbd发病中起中心作用。在lbd中,α-syn在遍及受影响的脑区域中的lb中积聚。此外,可以表明α-syn中的单个点突变(singlepointmutation)以及双倍或多倍增殖(duplicationormultiplication)与罕见的家族型帕金森氏综合症相关。重要的是,基于来自转基因(tg)小鼠以及果蝇(drosophilamelanogaster)的过表达研究的结果,理解了其在pd/lbd发病中关键作用,这是由于这些动物模型模拟了pd的数种特征。另一种非常重要的突触核蛋白病是多系统萎缩(msa)。msa是以耐l-dopa帕金森氏综合症、小脑性共济失调和家族性自主神经异常症状为特征的自发的神经退行性变疾病。患者遭受影响不同脑区域,包括纹状体、黑质、小脑、脑桥以及下橄榄体和脊髓的多系统神经元丧失(neuronalloss)的痛苦。msa以遍及中央神经系统的α-syn-阳性的神经胶质细胞质包涵物(glialcytoplasmicinclusion,gci)和罕见的神经元包涵物(neuronalinclusion)为特征。这些包涵物与纹状体黑质变性(striatonigraldegeneration)、橄榄体脑桥小脑萎缩相关,并涉及延髓和脊髓中的自主神经核。gci对于msa发病的重要性已被广泛接受,并因近来对分析在少突胶质细胞中α-syn过表达的作用的转基因小鼠模型的分析而格外显得重要。在过表达人类α-syn的tg小鼠中,观察到了似gci聚集物和msa的生物化学标记。尽管α-syn积聚导致在突触核蛋白病中神经退行性变典型特征以及突触核蛋白病的特征性症状的准确机理尚未完全理解,最近的研究暗示α-syn寡聚物的异常形成和积聚涉及突触核蛋白病中根本的退行性变过程。现在相信上述的寡聚物形成,例如,在突出末端和轴突中的,在pd/lbd发展中起重要作用。因此减少α-syn的沉积和寡聚化应对于治疗突触核蛋白病,特别是自发性的lbd/pd和msa是有利的,并且可以首次提供除仅仅减轻症状的现行治疗策略,如施用l-dopa外的治疗这些神经退行性变疾病的策略。在iwatsubot.(neuropathology27(5)(2007):474-478)中,检查了α-突触核蛋白以及其磷酸化与α-突触核蛋白病的发病的关联。该出版物的作者发现沉积于突触核蛋白病病变中的α-突触核蛋白的丝氨酸129广泛的被磷酸化。us2007/213253涉及突变的人类α-突触核蛋白,以及自其衍生,可用于抑制野生型人类α-突触核蛋白聚集的肽。在wo2004/041067中,公开了供预防或治疗与α-突触核蛋白聚集相关疾病的手段和方法,包括使用α-突触核蛋白片段。在us2003/166558中,描述了可用于诱导针对蛋白质沉积物免疫应答的肽。us2005/198694涉及包括至少100个氨基酸并具有c-末端1到23个氨基酸缺失的α-突触核蛋白片段。尽管使用神经营养因子和移植多巴胺能细胞的实验性疗法产生让人觉得有前途的结果,仍需要设计用来减少α-syn神经元积聚的替代手段。近来,主动和被动免疫疗法作为针对神经退行性变疾病,如阿尔茨海默氏症(ad),朊疾病(priondisease)以及亨廷顿舞蹈症(choreahuntington)和淀粉状蛋白侧索硬化(amyloidlateralsclerosis,als)的潜在的新治疗策略逐渐引人注目。举例而言,最近的对ad的tg模型的研究显示,针对β-淀粉状蛋白1-42(aβ)的抗体促进淀粉状蛋白自脑中去除,导致认知能力的改善。重要的是,aβ分子主要位于胞外,因此构成免疫系统可接近的表位。与上述免疫疗法的“经典”靶相对,进行实验衡量减少胞内病源分子积聚的潜在免疫疗法。已显示靶向朊蛋白和亨廷顿蛋白(huntingtin)的免疫接种手段在tg小鼠的神经元中对减少上述两种类似α-syn在胞内积聚的分子是有效的。此外,最近的实验还描述了抗-tau和抗sod1疗法分别作为在ad和als中针对胞内病原性蛋白质聚集物的新颖治疗策略。因此,已积累了具有说服力的证据证明脑细胞中的胞内聚集可作为免疫疗法的靶。事实上,近来显示了相似的治疗突触核蛋白病的潜力。过表达人类α-syn的tg小鼠经人类α-syn蛋白质接种。在接种后产生高相对亲和力的小鼠中,在神经元细胞体和突触中聚集的α-syn积聚减少,其与神经退行性变减少相关。进一步,由经免疫化的动物产生的抗体亦检测到了以异常聚集形式存在与神经元膜相关的α-syn,并促进这些聚集物的降解,可能是通过溶酶体途径。使用以外源施加的α-syn特异性抗体的被动免疫疗法观察到相似的作用。这些结果表明接种对减少α-syn聚集物的神经元积聚是有效的,且对该方法的进一步发展可对治疗lbd和突触核蛋白病产生有益作用。本发明的目标是提供基于育苗预防和治疗突触核蛋白病的药物。因此本发明涉及使用至少一种包含下述氨基酸序列的化合物:(x1)nx2x3pvx4x5x6(x7)m(式1),其中x1是任何氨基酸残基,x2是选自下组的氨基酸残基:天冬氨酸(d)和谷氨酸(e),x3是任何氨基酸残基,x4是任何氨基酸残基,x5是选自下组的氨基酸残基:脯氨酸(p)和丙氨酸(a),x6是选自下组的氨基酸残基:天冬氨酸(d)和谷氨酸(e),x7是任何氨基酸残基,n和m,彼此独立,是0或大于0的整数,且其中式i的氨基酸序列并不包括α-突触核蛋白具有氨基酸序列dmpvdpdn的8聚体多肽片段,且并不与其等同,所述化合物具有对针对包含氨基酸序列dmpvdpdn的α-突触核蛋白表位具有特异性的抗体的结合能力,以供产生供预防和/或治疗突触核蛋白病的药物。本发明的化合物能够诱导在体内产生导向(结合)α-突触核蛋白,特别是包含氨基酸序列dmpvdpdn的α-突触核蛋白表位的抗体(亦包括含所述氨基酸序列的α-突触核蛋白片段)。然而,导向(结合)所述表位的抗体,与针对α-突触核蛋白相比较,针对β-突触核蛋白不显示或仅显示显著较低的免疫反应性。与之相对,由用含dmpvdpdn的原始α-突触核蛋白表位的免疫化诱导的抗体令人惊讶的结合于α-突触核蛋白和β-突触核蛋白两者。因此,与原始α-突触核蛋白或其片段不同,本发明的化合物提供了针对所述与疾病相关分子的特异性,并避免了与和疾病不相关的β-突触核蛋白的交叉反应性。这就效率和安全性而言显示了强烈的优越性,尤其是后者,因为已有对β-突触核蛋白的神经保护特性的描述。hashimotom.etal.,jbiolchem.2004may28;279(22):23622-9.hashimotom,neuron.2001oct25;32(2):213-23。由施用本发明化合物诱导的α-突触核蛋白特异性抗体可能不仅结合于单体形式的α-突触核蛋白,还与其多聚形式结合。这使得减少在待治疗的个体体内α-突触核蛋白寡聚物的量成为可能。减少alpha-突触核蛋白对于治疗突触核蛋白特别有益。所述氨基酸序列(x1)nx2x3pvx4x5x6(x7)m视为包含氨基酸序列dmpvdpdn的α-突触核蛋白表位的模拟表位。根据本发明,术语“模拟表位”指具有对其模拟的表位具有拓扑学等价物的构型的分子。所述模拟表位与免疫特异性的结合于所期望抗原的抗体上同一个抗原结合区相结合。所述模拟表位将在对其模拟的抗原具有反应性的宿主中产生免疫应答。所述模拟表位亦可作为其模拟的表位的竞争者在涉及所述表位和结合于所述表位的抗体的体外抑制分析法(例如,elisa抑制分析法)中起作用。然而,本发明的模拟表位并不一定在体外抑制分析法中阻止与其模拟的表位的结合,或与之竞争,尽管当其施用于哺乳动物时,能够诱导特异性免疫应答。如本文所使用的术语“表位”指由特定抗体分子识别的抗原的免疫原区域。一般而言,抗原具有一个或更多表位,每个表位能够结合识别该特定表位的抗体。本发明的模拟表位可通过本领域众所周知的化学合成方法或者作为分离的肽,或者作为另一个肽或多肽的一部分人工产生。或者,所述肽模拟表位可在产生所述肽模拟表位的微生物中产生,并随即将其分离,并且,若需要,对其进行进一步纯化。所述肽模拟表位可在微生物,如细菌、酵母或真菌中产生,或在重组病毒载体如腺病毒、痘病毒、疱疹病毒、simliki森林病毒、杆状病毒、细菌噬菌体、辛德比斯病毒或仙台病毒中产生。供产生所述肽模拟表位的合适细菌包括大肠杆菌(e.coli)、枯草杆菌(b.subtilis)或其他任何能够表达肽,如所述肽模拟表位的细菌。供表达所述肽模拟表位的合适的酵母类型包括酿酒酵母(saccharomycescerevisiae)、粟酒裂殖酵母(schizosaccharomycespombe)、假丝酵母属(candida)、巴斯德毕赤氏酵母(pichiapastoris)或任何其它能够表达肽的酵母。相应的方法在本领域是众所周知的。此外,供分离和纯化重组产生的肽的方法在本领域也是众所周知的,并包括,例如,凝胶过滤、亲和层析、离子交换层析等等。为了促进所述肽模拟表位的分离,可制备其中所述肽模拟表位在翻译中融合(共价连接)于可通过亲和层析进行分离的异源多肽所得的融合多肽。通常所述的异源多肽为his-标记(例如,his6;六个组氨酸残基)、gst-标记(谷胱甘肽-s-转移酶)等等。所述融合多肽不仅促进所述模拟表位的纯化,还可以阻止所述模拟表位多肽在纯化过程中降解。如果期望在纯化过程后去除所述异源多肽,所述融合多肽可在所述肽模拟表位和所述异源多肽间的连接处包含剪切位点。所述剪切位点由可用对在所述位点的氨基酸序列具有特异性的酶(例如,蛋白酶)剪切的氨基酸序列组成。本发明的模拟表位亦可在其n-和/或c-末端或附近修饰,从而使得在所述位置结合了半胱氨酸残基。在优选实施方案中,末端位置(位于所述肽的n-和c-末端)的半胱氨酸残基用于通过二硫键来环化所述肽。本发明的模拟表位亦可用于不同的分析法和试剂盒,特别是在免疫分析法和试剂盒中。因此,特别优选所述模拟表位是另一个肽或多肽的一部分,特别是在免疫分析法中用作报道物的酶。上述报道酶包括,例如,碱性磷酸酯酶或辣根过氧化物酶。本发明的α-突触核蛋白优选为其氨基酸序列在α-突触核蛋白或α-突触核蛋白片段的氨基酸序列间变化的抗原性多肽。在此方面,具有发明性的模拟表位可能不仅包含一个或更多天然出现的氨基酸残基,还包括一种或更多非天然出现的氨基酸残基(亦即,非选自20个“经典”氨基酸)的氨基酸取代,或者其可完全由上述非天然的氨基酸组成。另外,诱导抗-α-突触核蛋白抗体的具有发明性的抗原可由d-或l-氨基酸或dl-氨基酸的组合来组成,并且视需要,其可通过进一步修饰、环闭合(ringclosure)或衍生化进行改变。合适的抗-α-突触核蛋白抗体诱导抗原可自可市购的肽文库提供。优选的,这些肽为至少7个氨基酸,且优选的长度可高达16,优选高达14或20个氨基酸残基(例如,7或8到20个,7或8到16个等等)。然而,根据本发明,更长的肽亦可用作抗-α-突触核蛋白抗体诱导抗原。进一步,本发明的模拟表位亦可为多肽一部分并因此在其n-和/或c-末端包含至少一个另外的氨基酸残基。为了制备α-突触核蛋白模拟表位(亦即,抗-α-突触核蛋白抗体诱导抗原),理所当然噬菌体文库、肽文库亦为合适的,例如由组合化学方法产生的或通过针对变化最大的结构进行高通量筛选技术方法获取的display:alaboratorymanualbycarlosf.barbas(editor),etal.;willatswgphagedisplay:practicalitiesandprospects.plantmol.biol.2002dec.;50(6):837-54)。进一步,根据本发明,亦可使用基于核酸的抗-α-突触核蛋白-抗体诱导抗原(“适体”(aptamer)),且其可使用变化最大的(寡聚核苷酸)文库(例如,具有2-180个核酸残基的)发现(例如burgstaller等,curr.opin.drugdiscov.dev.5(5)(2002),690-700;famuloketal.,acc.chem.res.33(2000),591-599;mayer等,pnas98(2001))。在基于核酸的抗-α-突触核蛋白抗体诱导抗原中,核酸骨架可通过,例如天然磷酸二酯化合物,或亦可通过磷硫酰化合物(phosphorotioate)或化学变化的组合(例如,pna)来提供,其中根据本发明,可主要使用u、t、a、c、g、h和mc作为碱基。根据本发明可使用的核苷酸的2’残基优选为h、oh、f、cl、nh2、o-甲基、o-乙基、o-丙基或o-丁基,其中所述合适亦可经区别修饰,亦即,例如用保护基团,其通常用于寡聚核苷酸合成。因此,基于适体的抗-α-突触核蛋白抗体诱导抗原亦为本发明范围内的优选抗-α-突触核蛋白抗体诱导抗原。根据本发明,术语“突触核蛋白病”包括以病理性突触核蛋白聚集为特征的所有的神经退行性变疾病。数种神经退行性变疾病包括帕金森氏症(pd)、lewy体病(lbd)、弥散性lewy体病(dlbd)、痴呆伴lewy体病(dlb)、帕金森氏综合症伴痴呆(pdd)、多系统萎缩(msa)和神经退行性变伴脑铁积聚类型i(nbiatypei)共同归组为突触核蛋白病。本发明的化合物不仅可用于治疗突触核蛋白病,还可以用于在有发展突触核蛋白病风险的个人(例如,易患,例如因遗传原因易于发展突触核蛋白病)中预防所述疾病。本发明中公开的氨基酸残基的缩写遵循iupac的推荐:氨基酸三字母代码一字母代码丙氨酸alaa精氨酸argr天冬氨酸asnn天冬酰胺aspd半胱氨酸cysc谷氨酸glue谷氨酰胺glnq甘氨酸glyg组氨酸hish异亮氨酸ilei亮氨酸leul氨基酸三字母代码一字母代码赖氨酸lysk甲硫氨酸metm苯丙氨酸phef脯氨酸prop丝氨酸sers苏氨酸thrt色氨酸trpw酪氨酸tyry缬氨酸valv根据本发明的优选实施方案,x1和/或x7是乙酰化的氨基酸残基或半胱氨酸(c)。根据本发明的另一个优选实施方案,x2是谷氨酸,且所述谷氨酸亦可经衍生化产生焦谷氨酸。若x2包含叫谷氨酸,x1是0。根据本发明进一步的另一个优选实施方案,x3是选自下组的氨基酸残基:谷氨酰胺(q)、丝氨酸(s)、苏氨酸(t)、精氨酸(r)、天冬酰胺(n)、缬氨酸(v)、组氨酸(h)、甲硫氨酸(m)、酪氨酸(y)、丙氨酸(a)和亮氨酸(l)。根据本发明的优选实施方案,x4是选自下组的氨基酸残基:谷氨酰胺(q)、色氨酸(w)、苏氨酸(t)、精氨酸(r)、天冬氨酸(d)、异亮氨酸(i)、缬氨酸(v)、组氨酸(h)、脯氨酸(p)、酪氨酸(y)、丙氨酸(a)、丝氨酸(s)和亮氨酸(l)。本发明的化合物亦可为7到16个氨基酸残基的多肽的一部分。因此n和m可彼此独立的为选自下组的整数:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20和25。本发明的化合物可由氨基酸序列(x1)nx2x3pvx4x5x6(x7)m组成,其中n和m彼此独立的为0或1,或者是包含至少7个氨基酸残基,优选至少10个氨基酸残基,较优选至少15个氨基酸残基和/或最多50个氨基酸残基,有序最多30个氨基酸残基,较优选为16个氨基酸残基的多肽的一部分。根据本发明的优选实施方案,所述化合物包含具有选自下组的氨基酸序列的肽:(c)dqpvlpd、(c)dmpvlpd、(c)dspvlpd、(c)dspvwae、(c)dtpvlae、(c)dqpvlpdn、(c)dmpvlpdn、(c)dspvlpdn、(c)dqpvtaen、(c)dspvwaen、(c)dtpvlaen、(c)hdrpvtpd、(c)drpvtpd、(c)dvpvlpd、(c)dtpvypd、(c)dtpvipd、(c)hdrpvtpdn、(c)drpvtpdn、(c)dnpvhpen、(c)dvpvlpdn、(c)dtpvypdn、(c)dtpvipdn、(c)dqpvlpdg、(c)dmpvlpdg、(c)dspvlpdg、(c)dspvwaeg、(c)drpvapeg、(c)dhpvhpds、(c)dmpvspdr、(c)dspvppdd、(c)dqpvypdi、(c)drpvypdi、(c)dhpvtpdr、(c)eypvypes、(c)dtpvlpds、(c)dmpvtpdt、(c)dapvtpdt、(c)dspvvpdn、(c)dlpvtpdr、(c)dspvhpdt、(c)dapvrpds、(c)dmpvwpdg、(c)dapvypdg、(c)drpvqpdr、(c)ydrpvqpdr、(c)dmpvdpen、(c)dmpvdadn、dqpvlpd(c)、dmpvlpd(c)、(c)empvdpdn以及(c)dnpvhpe。令人惊讶的是,发现包括上面列举的氨基酸序列或由其组成的本发明化合物特别适用于生产待用于治疗或预防突触核蛋白病的医药。这些肽(模拟表位)能够在体内诱导形成导向包含氨基酸序列dmpvdpdn的人类α-突触核蛋白原始表位以及人类α-突触核蛋白自身的抗体。然而,所述肽(模拟表位)针对人类β-突触核蛋白不能够诱导,或仅能诱导非常有限的免疫反应性。令人惊讶的是,由原始α-突触核蛋白诱导抗体(包含氨基酸序列dmpvdpdn)特异性的结合于α-突触核蛋白以及β-突触核蛋白。因此,所述肽(模拟表位)与所述原始肽相较,诱导更加精确(refined)的免疫应答(抗体)。然而,模拟表位诱导的免疫应答并不一定区分α-突触核蛋白(synuclein)和β-突触核蛋白。在个体中,肽诱导的抗体负责去除α-突触核蛋白(其涉及α-突触核蛋白聚集物,lewy体的形成),和/或α-突触核蛋白聚集物(lewy体)的解离。上面列举的肽可在其n-末端包含或不包含半胱氨酸残基,当然所述c-残基亦可添加至c-末端。因此,本发明涵盖下列其n-末端或c-末端无半胱氨酸残基的肽:dqpvlpd、dmpvlpd、dspvlpd、dspvwae、dtpvlae、dqpvlpdn、dmpvlpdn、dspvlpdn、dqpvtaen、dspvwaen、dtpvlaen、hdrpvtpd、drpvtpd、dvpvlpd、dtpvypd、dtpvipd、hdrpvtpdn、drpvtpdn、dnpvhpen、dvpvlpdn、dtpvypdn、dtpvipdn、dqpvlpdg、dmpvlpdg、dspvlpdg、dspvwaeg、drpvapeg、dhpvhpds、dmpvspdr、dspvppdd、dqpvypdi、drpvypdi、dhpvtpdr、eypvypes、dtpvlpds、dmpvtpdt、dapvtpdt、dspvvpdn、dlpvtpdr、dspvhpdt、dapvrpds、dmpvwpdg、dapvypdg、drpvqpdr、ydrpvqpdr、dmpvdpen、dmpvdadn、empvdpdn以及dnpvhpe。本发明的化合物可用于制备医药,特别是疫苗,其可用于治疗α-突触核蛋白病,藉此,所述医药特别适于治疗选自下组的突触核蛋白病:帕金森氏症(pd)、lewy体病(lbd)、弥散性lewy体病(dlbd)、痴呆伴lewy体病(dlb)、帕金森氏综合症伴痴呆(pdd)、多系统萎缩(msa)和神经退行性变伴脑铁积聚类型i(nbiatypei)。根据本发明的优选实施方案,所述化合物与药学上可接受的载体,优选klh(钥孔戚血蓝素(keyholelimpethemocyanin))、破伤风毒素、白蛋白结合蛋白、牛血清白蛋白、树状体(dendrimer)(map;biol.chem.358:581)、肽接头(或其两端区域)以及singh等,nat.biotech.17(1999),1075-1081(特别是该文件中表1所描述的)和o'hagan等,naturereviews,drugdiscovery2(9)(2003),727-735(特别是其中所描述的内源免疫增强化合物和递送系统)所描述的佐剂物质以及其他,或上述混合物相偶联。在此背景下的结合化学反应(conjugationchemistry)(例如,通过异型双功能(heterobifunctional)化合物,如gmbs,当然亦包括其他描述于“bioconjugatetechniques”,gregt.hermanson中的)可选自本领域技术人员已知的反应。另外,疫苗合剂(vaccinecomposition)可用佐剂,优选低溶解度铝成分来进行配制。当然,佐剂如mf59磷酸铝、磷酸钙、细胞因子(例如,il-2、il-12、gm-csf)、皂苷(例如,qs21)、mdp衍生物、cpg寡聚物、ic31、lps、mpl、聚磷杂烯(polyphosphazene)、乳化剂(例如,freund’s、saf)、脂质体、病毒颗粒(virosome)、免疫刺激复合物(iscoms)、蜗形物(cochleate)、plg微颗粒、泊洛沙姆颗粒(poloxamerparticle)、类病毒颗粒、热不稳定性肠毒素(lt)、伤寒毒素(ct)、变异体毒素(例如,ltk63和ltr72)、微颗粒和/或多聚化脂质体亦可使用。本发明的化合物优选通过接头结合于所述载体或佐剂,所述接头选自下组:nhs-聚环氧乙烷(peo)(例如nhs-peo4-马来酰亚胺)。包含本发明化合物(模拟表位)的疫苗和所述药学上可接受的载体可通过任何合适方法的使用法,例如、i.d.、i.v.、i.p.、i.m.、鼻内、经口、皮下等等,并在任何合适的递送装置进行给药(o'hagan等,naturereviews,drugdiscovery2(9),(2003),727-735)。本发明的化合物优选配制为供静脉内、皮下、皮内或肌肉内给药(参见,例如“handbookofpharmaceuticalmanufacturingformulations”,sarfarazniazi,crcpressinc,2004)。一般而言,所述疫苗含有自0.1ng到10mg,优选10ng到1mg,特别是100ng到100μg,或者,例如100fmol到10μmol,优选10pmol到1μmol,特别是100pmol到100nmol的本发明的化合物。一般而言,所述疫苗亦含有辅助性的物质,例如缓冲液,稳定剂等等。本发明的另一个方面涉及具有选自下组氨基酸序列的肽:(c)dqpvlpd、(c)dmpvlpd、(c)dspvlpd、(c)dspvwae、(c)dtpvlae、(c)dqpvlpdn、(c)dmpvlpdn、(c)dspvlpdn、(c)dqpvtaen、(c)dspvwaen、(c)dtpvlaen、(c)hdrpvtpd、(c)drpvtpd、(c)dvpvlpd、(c)dtpvypd、(c)dtpvipd、(c)hdrpvtpdn、(c)drpvtpdn、(c)dnpvhpen、(c)dvpvlpdn、(c)dtpvypdn、(c)dtpvipdn、(c)dqpvlpdg、(c)dmpvlpdg、(c)dspvlpdg、(c)dspvwaeg、(c)drpvapeg、(c)dhpvhpds、(c)dmpvspdr、(c)dspvppdd、(c)dqpvypdi、(c)drpvypdi、(c)dhpvtpdr、(c)eypvypes、(c)dtpvlpds、(c)dmpvtpdt、(c)dapvtpdt、(c)dspvvpdn、(c)dlpvtpdr、(c)dspvhpdt、(c)dapvrpds、(c)dmpvwpdg、(c)dapvypdg、(c)drpvqpdr、(c)ydrpvqpdr、(c)dmpvdpen、(c)dmpvdadn、dqpvlpd(c)、dmpvlpd(c)、(c)empvdpdn以及(c)dnpvhpe。根据本发明的优选实施方案,所述肽与药学上可接受的载体,优选klh(钥孔戚血蓝素)偶联。本发明的另一个方面涉及药学配制剂,优选疫苗,包括至少一个本发明的肽,且选自下组:(c)dqpvlpd、(c)dmpvlpd、(c)dspvlpd、(c)dspvwae、(c)dtpvlae、(c)dqpvlpdn、(c)dmpvlpdn、(c)dspvlpdn、(c)dqpvtaen、(c)dspvwaen、(c)dtpvlaen、(c)hdrpvtpd、(c)drpvtpd、(c)dvpvlpd、(c)dtpvypd、(c)dtpvipd、(c)hdrpvtpdn、(c)drpvtpdn、(c)dnpvhpen、(c)dvpvlpdn、(c)dtpvypdn、(c)dtpvipdn、(c)dqpvlpdg、(c)dmpvlpdg、(c)dspvlpdg、(c)dspvwaeg、(c)drpvapeg、(c)dhpvhpds、(c)dmpvspdr、(c)dspvppdd、(c)dqpvypdi、(c)drpvypdi、(c)dhpvtpdr、(c)eypvypes、(c)dtpvlpds、(c)dmpvtpdt、(c)dapvtpdt、(c)dspvvpdn、(c)dlpvtpdr、(c)dspvhpdt、(c)dapvrpds、(c)dmpvwpdg、(c)dapvypdg、(c)drpvqpdr、(c)ydrpvqpdr、(c)dmpvdpen、(c)dmpvdadn、dqpvlpd(c)、dmpvlpd(c)、(c)empvdpdn和(c)dnpvhpe。本发明的医药配制剂,其可作为供,例如,皮下、静脉内和/或肌肉内给药的疫苗进行配制,可用于治疗任何类型的突触核蛋白。本发明进一步在下述附图和实施例中加以说明,但并不仅限于此。图1显示通过elisa使用对人类α-突触核蛋白115-122位具有特异性的单克隆抗体检测α-突触核蛋白的特异性表位。肽p4446(α-突触核蛋白)、p4449和p4448(人类表位)由所述抗体检测。阴性对照肽p4447(β-突触核蛋白)和p4450、p4451(小鼠表位)未检测出来。不相干的肽p1252在所述elisa分析法中不显示结合。数据以线性尺度表示。图2显示通过elisa使用对人类α-突触核蛋白115-122位具有特异性的单克隆抗体检测模拟表位。显示了两个模拟表位(p4553,p4557)的数据。肽p4557与原始肽p4448相较,显示较弱的结合。肽p4553对检测抗体显示强结合。不相干的肽p1253并未在elisa分析法中根据预测显示任何结合。当接种小鼠时,两个模拟表位均诱导>1/20000的效价,并视为强结合剂。图3显示通过elisa使用对人类α-突触核蛋白115-122位具有特异性的单克隆抗体检测检测模拟表位的竞争作用。描述的值是通过elisa使用40μg肽在抑制分析法中测定的。与原始肽p4448相较,不相干的肽p1253和模拟表位p4492并不显示竞争作用。模拟表位p4490和p4491显示与原始肽p4448相似的竞争作用。竞争作用通过在elisa中与原始表位比较在40μg肽浓度下的od来进行计算。将所有的模拟表位与该参照比较得到竞争指数(competitionindex)。1左右的指表明高抑制能力。具有5以上的竞争指数的肽评价为非竞争性的。图4显示针对注射入的肽和不相关肽的免疫应答。a)在四次接种后经免疫化的小鼠血清针对其注射入的肽(原始表位(p4448)和模拟表位(分别为p4456、p4466和p4467))显示高效价。用elisa测定的效价为1:10000(1:10.000)左右(od半最大值),数据以对数尺度表示。作为elisa的阳性对照,使用α-突触核蛋白特异性单克隆抗体(ctrlpos)。b)免疫化的小鼠同样的血清未能检测出不相关的肽(p1253)。用elisa测定的效价小于1:100(od半最大值),低于来自针对所述不相干的肽有特异性的单克隆抗体的信号(ctrlpos)超过一百倍。作为阳性对照,不使用第一抗体(primaryantibody)。数据以线性尺度表示。图5显示在重复的模拟表位免疫化后针对突触核蛋白免疫应答。a)在其相应组中所有的动物汇集的血清显示针对p4448,一种位于α-突触核蛋白c-末端的蛋白质的抗体效价。数据以对数尺度表示。b)经免疫化的小鼠(p4448、p4457和p4463)的汇集的血清在四次接种后显示针对α-突触核蛋白的效价。经免疫化的小鼠(p4466和p4467)的汇集的血清未检测出α或β-突触核蛋白(用elisa测定的效价远小于1:100的半最大值)。经原始表位(p4448)免疫化的汇集的血清检测出α和β-突触核蛋白。以elisa测定的效价,其中小于1:100半最大值的用星号标出,对应于接近背景的值。所述经测试的模拟表位中大部分诱导不与β-突触核蛋白交叉反应的抗体。数据以对数尺度表示。图6a显示使用可市购的、特异性检测人类α-syn的抗体的阳性对照染色。在6b中,同样的抗体用于对非转基因小鼠脑的同一区域进行染色,未能检测出任何α-syn阳性组织,这是因为该动物不表达人类α-syn。在6c中,与6a中存在的染色相似的特异性α-syn染色通过经模拟表位诱导的血清(p4498诱导血清)引发(elicit)。在鼠类丘脑中的α-syn阳性染色以如示于6a和6c的斑点状染色样式为特征。箭头指示分别见于6a和6c的上述α-syn阳性包涵物的三个实例。实施例可用于本发明的模拟表位鉴定的抗体检测人类α-突触核蛋白衍生氨基酸序列dmpvdpdn(=原始表位,seqidno.1)和全长人类α-突触核蛋白。其并不识别人类β-突触核蛋白。所述抗体可为单克隆或多克隆抗体制备物或其任何抗体部分或衍生物,且特异性的结合于人类α-突触核蛋白的dmpvdpdn表位,亦即,其确实结合于肽和全长蛋白质,但不结合于人类β-突触核蛋白。所述模拟表位用上述单克隆抗体(检测在人类α-突触核蛋白蛋白质氨基酸115-112内的序列)和肽文库识别并进一步表征。实施例1:产生特异性检测原始人类α-突触核蛋白表位c-dmpvdpdn和人类α-突触核蛋白但非人类β-突触核蛋白的单克隆抗体由融合蛋白“affiris3”衍生的单克隆抗体:balb/c小鼠用与btg(牛甲状腺球蛋白)和cfa(弗氏完全佐剂,首次注射)偶联,以及ifa(弗氏不完全佐剂,三次加强注射)作为佐剂的原始α-突触核蛋白表位c-dmpvdpdn免疫化。dmpvdpdn肽特异性的产生抗体的杂交瘤通过elisa(dmpvdpdn肽覆被的elisa平板)检测。人类α-突触核蛋白(重组蛋白质)用作阳性对照肽:包括了识别固化于elisa平板上的所述重组蛋白质的杂交瘤,这是因为其特异性的结合肽和全长α-突触核蛋白。人类β-突触核蛋白(重组蛋白质)用作阴性对照:排除了识别固化于elisa平板上的两种肽的杂交瘤,这是因为其不区分两种不同的突触核蛋白蛋白质。对所得杂交瘤克隆(affiris3/9(内部名“a509”;igg1)分析其对天然人类α-突触核蛋白表位dmpvdpdn的特异性检测。a509在elisa中识别注射入的表位以及全长α-突触核蛋白蛋白质(重组蛋白质,自rpeptide,bogart,ga,usa获得)。然而其并不在elisa中识别β-突触核蛋白(重组蛋白质,自rpeptide,bogart,ga,usa获得)。进一步,所述a509抗体并不检测编码α-突触核蛋白小鼠变体的肽。同样的结果可用可市购的mab克隆(亦即,α-突触核蛋白(lb509)单克隆抗体,目录号sig-39725;covance(princton,nj,usa))获取。实施例2:噬菌体呈递,体外结合和抑制性elisa用于该实施例的噬菌体呈递文库为:ph.d.7:newenglandbiolabse8102l(线性七聚体文库)andph.d.12:newenglandbiolabse8111l(线性十二聚体文库)。噬菌体呈递根据生产商的实验规程完成(www.neb.com)。在2到3后续轮次的淘洗(panning)后,挑取单独的噬菌体克隆,并对噬菌体上清在覆被以用于淘洗过程的抗体的平板上进行elisa。对在该elisa中为阳性的噬菌体克隆(对靶有强信号,但对非特异性的对照无信号)进行测序。通过dna序列推导出肽序列。合成这些肽,并用结合和抑制性elisa对其进行表征。对一些肽,在其c-末端附加额外的aa。此外,一些新颖的模拟表位通过合并来自在所述筛选中识别的模拟表位的序列信息进行构建。两个含有新设计出的模拟表位的组均用于支持对模拟表位疫苗共有序列的识别。1.体外结合分析法(elisa)将自噬菌体呈递衍生的肽以及其在c-末端延长的变体与bsa并结合于elisa平板(1μm;如相应的附图所示)并随后与供对识别出的肽的结合能力进行分析的筛选过程中使用的单克隆抗体一起温育。2.体外抑制性分析法(elisa)将自噬菌体呈递衍生的不同量的肽(浓度范围从40μg到0.3μg(系列稀释)如相应的附图所示)与用于所述筛选过程的单克隆抗体一起温育。减弱所述抗体对覆被于elisa平板上的所述原始的人类α-突触核蛋白表位(人类α-突触核蛋白蛋白质的氨基酸115-122)后续结合的肽在该分析法中视为抑制性的。实施例3:模拟表位的体内测试:对免疫原性和交叉反应性的分析1.模拟表位的体内测试将抑制性以及非抑制性肽与klh偶联并与合适的佐剂(氢氧化铝)一起注射入小鼠(野生型c57/b16小鼠;皮下注射入胁腹部(flank))。对动物以两周的间隔进行4-6次接种,并同样每两周取一次血清。对每份血清确定其针对注射入的肽以及不相关的肽的效价。自血清3起分别确定针对重组人类α-突触核蛋白蛋白质和重组人类β-突触核蛋白的效价。针对原始人类α-突触核蛋白表位(aa115-122)对汇集的血清进行测试。一般而言,血清通过针对与其牛血清白蛋白(bsa)偶联的肽和固化于elisa平板的重组全长蛋白质之间的反应进行分析。效价通过使用抗小鼠igg特异性抗体加以确定。详细结果参见图4和5。2.模拟表位的原位测试亦对选定的引发α-syn交叉反应性的血清分析其在小鼠脑切片中原位检测人类α-syn的能力。详细结果参见图6。3.结果3.1识别α-突触核蛋白特异性mab:图1描绘了对自融合蛋白affiris3衍生的α-突触核蛋白特异性单克隆抗体affiris3/9(内部名“a509”;igg1)的识别。3.2.1噬菌体呈递文库ph.d.7和123.2.1.1用针对dmpvdpdn的单克隆抗体进行筛选在该筛选中通过筛选phd7和phd12噬菌体呈递文库识别出51个序列:表1总结了识别出的肽及其与所述原始表位相比较的结合能力:图1:结合于亲本抗体的α-突触核蛋白模拟表位:表1的图例:结合能力的编码通过下述结合编码进行:1:x描述亲本ab的稀释因子。结合编码od半最大值1:x0无结合:01弱结合:<50002中等结合:5000-200003如原始表位的结合(强结合):20000-1280003.3在用针对α-突触核蛋白的单克隆抗体筛选噬菌体呈递文库中识别出的模拟表位的体外表征图2和3显示了用于体外表征模拟表位的结合和抑制性分析法的代表性实例。获得的数据分别在表1和表2中总结。在列举的51个序列中,29个序列在体外竞争性实验中抑制α-突触核蛋白特异性单克隆抗体的结合;另外识别出22个不在体外竞争性实验中抑制单克隆抗体结合,但仍旧保留针对亲本抗体结合能力的序列。表2:在本发明中识别的在抑制性分析法中给出阳性结果的α-突触核蛋白表位表2的图例:抑制能力的编码通过下述编码进行:弱抑制指与原始表位相比较需要更多肽来降低ab结合;强抑制指对于模拟表位和原始表位需要相同量的肽来降低ab结合。将模拟表位与作为标准的所述原始肽相比较。在所述分析法中使用40μg的od用于计算与原始多肽相比较的竞争能力。竞争编码0无抑制(40μg肽的od高于原始肽的5倍)1较原始表位弱(40μg肽的od低于原始肽的5倍)2强抑制(如原始表位;40μg肽的od低于原始肽的2倍)表3:非模拟表位的肽和蛋白质3.4.在用针对α-突触核蛋白的单克隆抗体进行的噬菌体呈递文库筛选中识别出的模拟表位的体内表征对每组5-6只雌性c57/b16小鼠皮下用30μg与klh偶联的肽进行免疫化。对对照组施用p4448-klh偶联物。使用明矾作为佐剂(总是每个小鼠1mg)。施用的肽均能够结合于与人类α-突触核蛋白的aa115-122特异性结合的单克隆抗体,尽管一些肽并不抑制原始表位在体外对其亲本抗体的结合(通过体外抑制性分析法)。确定抗体效价的体外elisa分析法用单独小鼠的血清或汇集的血清(参见图5)在每次接种后以两周的间隔进行(分别参见图4和图5)。elisa平板的孔用模拟表位-bsa偶联物和不相关的肽-bsa偶联物(阴性对照)覆被。阳性对照通过用亲本抗体与相应的模拟表位-bsa聚合物反应来进行。检测用抗小鼠igg进行。此外,重组蛋白质固化于elisa平板上,并用血清相应的进行反应。对于所有在c57/b16小鼠中测试的模拟表位,针对单独注射入的肽反应的抗体可在反复接种后检测出来。此外,在4个描绘的模拟表位中的2个(分别参见图5和表1)发展出与人类α-突触核蛋白但非人类β-突触核蛋白反应的抗体。2/4不显示与重组蛋白质的交叉反应性。重要的是,原始表位dmpvdpdn导致不区分两种重组突触核蛋白蛋白质的免疫应答。图4和5显示用于体内表征模拟表位的分析法的代表性实例。图4通过分析针对注射入的肽和含有不相关序列的不相关的肽的免疫应答来显示体内表征由模拟表位接种引发的免疫应答的实例。原始表位p4448,即阳性对照肽,和模拟表位p4456、p4466和p4467引发针对注射入的肽(其自身)的免疫应答,但无法诱导针对不相关序列(p1253)的非特异性免疫应答。图5显示体内表征由模拟表位接种引发针对全长α-突触核蛋白和β-突触核蛋白的免疫应答的实例。所有在该实例中测试的疫苗针对原始α-突触核蛋白表位115-122导致可检测出的免疫应答。几乎所有在该实例中测试的模拟表位和所述原始表位(例外:p4466和p4467)还进一步显示与全长α-突触核蛋白的反应性。然而,原始表位诱导的免疫应答还检测全长β-突触核蛋白,从而减弱了针对α-突触核蛋白的特异性以及区分两种蛋白质的能力。与该发现相反,大部分(但并非所有的)模拟表位诱导的血清无法检测出β-突触核蛋白,从而保留了区分两种突触核蛋白蛋白质的能力,并保证活性免疫化程序针对α-突触核蛋白的高特异性,以获取效率和优异的安全性模式(profile)。3.5.模拟表位的原位测试引发α-syn特异性免疫应答的模拟表位亦可在转基因小鼠脑组织中检测出α-syn免疫反应性包涵物。如图6所描绘,来自经模拟表位接种的动物的血清能够对来自过表达人类α-syn的小鼠的脑切片中存在的α-syn阳性结构进行染色。简言之,对人类α-syn在elisa中具有阳性反应性的血清已用于免疫组织化学(ihc)。对加载于superfrostplus玻璃载玻片上经石蜡包埋的小鼠脑的7μm切片进行ihc。切片与血清(在pbs中1:100和1:400稀释)一起温育,并随后根据免疫组织化学的标准试验规程使用vectastainabc系统进行染色,使用dab和mom封闭(所有的反应使用分别自vector实验室获取的可市购的的试剂并根据生产商的实验设计来进行)。复染色使用苏木精进行。载玻片加载于entellan并随后使用常规亮视野显微镜进行归档。对人类α-syn具有特异性的单克隆抗体(lb509,covance)以1/250的最终稀释用作突触核蛋白检测的阳性对照。在图6a中,描绘了阳性对照染色。在6b中,同样的抗体用于非转基因小鼠脑的同一区域,结果无法检测出任何α-syn,这是因为该动物并不表达人类α-syn。在6c中,与6a中表现的染色相似特异性α-syn染色由模拟表位诱导的血清(p4498诱导的血清)引发。在鼠类丘脑中α-syn阳性染色以如图6a和6c中所示的斑点状的染色样式为特征。潜在诱导α-syn特异性抗体的实例包括但不仅限于分别基于p4456、p4498和p4562的疫苗。本发明包括以下项:1.包含下列氨基酸序列的至少一种化合物在制备用于预防和/或治疗突触核蛋白病的药物中的用途:(x1)nx2x3pvx4x5x6(x7)m(式1),其中x1是任何氨基酸残基,x2是选自下组的氨基酸残基:天冬氨酸(d)和谷氨酸(e),x3是任何氨基酸残基,x4是任何氨基酸残基,x5是选自下组的氨基酸残基:脯氨酸(p)和丙氨酸(a),x6是选自下组的氨基酸残基:天冬氨酸(d)和谷氨酸(e),x7是任何氨基酸残基,n和m,独立地,是0或大于0的整数,且其中式i的氨基酸序列并不包括α-突触核蛋白具有氨基酸序列dmpvdpdn的8聚体多肽片段,或并不与其等同,所述化合物具有对针对包含氨基酸序列dmpvdpdn的α-突触核蛋白表位具有特异性的抗体的结合能力。2.项1的用途,其中x1和/或x7是乙酰化的氨基酸残基或半胱氨酸(c)。3.项1或2所述的用途,其中x3是选自下组的氨基酸残基:谷氨酰胺(q)、丝氨酸(s)、苏氨酸(t)、精氨酸(r)、天冬酰胺(n)、缬氨酸(v)、组氨酸(h)、甲硫氨酸(m)、酪氨酸(y)、丙氨酸(a)和亮氨酸(l)。4.项1-3中任一所述的用途,其中x4是选自下组的氨基酸残基:谷氨酰胺(q)、色氨酸(w)、苏氨酸(t)、精氨酸(r)、天冬氨酸(d)、异亮氨酸(i)、缬氨酸(v)、组氨酸(h)、脯氨酸(p)、酪氨酸(y)、丙氨酸(a)、丝氨酸(s)和亮氨酸(l)。5.项1-4中任一所述的用途,其中所述化合物是包含7到16个氨基酸残基的多肽。6.项1-5中任一所述的用途,其中所述化合物包含具有选自下组的氨基酸序列的肽:(c)dqpvlpd、(c)dmpvlpd、(c)dspvlpd、(c)dspvwae、(c)dtpvlae、(c)dqpvlpdn、(c)dmpvlpdn、(c)dspvlpdn、(c)dqpvtaen、(c)dspvwaen、(c)dtpvlaen、(c)hdrpvtpd、(c)drpvtpd、(c)dvpvlpd、(c)dtpvypd、(c)dtpvipd、(c)hdrpvtpdn、(c)drpvtpdn、(c)dnpvhpen、(c)dvpvlpdn、(c)dtpvypdn、(c)dtpvipdn、(c)dqpvlpdg、(c)dmpvlpdg、(c)dspvlpdg、(c)dspvwaeg、(c)drpvapeg、(c)dhpvhpds、(c)dmpvspdr、(c)dspvppdd、(c)dqpvypdi、(c)drpvypdi、(c)dhpvtpdr、(c)eypvypes、(c)dtpvlpds、(c)dmpvtpdt、(c)dapvtpdt、(c)dspvvpdn、(c)dlpvtpdr、(c)dspvhpdt、(c)dapvrpds、(c)dmpvwpdg、(c)dapvypdg、(c)drpvqpdr、(c)ydrpvqpdr、(c)dmpvdpen、(c)dmpvdadn、dqpvlpd(c)、dmpvlpd(c)、(c)empvdpdn以及(c)dnpvhpe。7.项1-6中任一所述的用途,其中所述突触核蛋白病选自下组:lewy体病(lbd),优选帕金森氏病(pd)、帕金森氏病伴痴呆(pdd)和痴呆伴lewy体(dlb),以及多系统萎缩(msa)或神经退行性变伴脑铁积聚i型(nbiatypei)。8.项1-7中任一所述的用途,其中所述化合物与药学上可接受的载体,优选klh(钥孔戚血蓝素)偶联。9.项1-8中任一所述的用途,其中所述化合物经配制以供静脉内、皮下、皮内或肌肉内施用。10.项1-9中任一所述的用途,其中所述化合物与佐剂,优选氢氧化铝一起配制。11.项1-10中任一所述的用途,其中所述化合物以0.1ng到10mg,优选10ng到1mg,特别是100ng到100μg的量包含于药物中。12.具有选自下组的氨基酸序列的肽:cdqpvlpd、cdmpvlpd、cdspvlpd、cdspvwae、cdtpvlae、cdqpvlpdn、cdmpvlpdn、cdspvlpdn、cdqpvtaen、cdspvwaen、cdtpvlaen、chdrpvtpd、cdrpvtpd、cdvpvlpd、cdtpvypd、cdtpvipd、chdrpvtpdn、cdrpvtpdn、cdnpvhpen、cdvpvlpdn、cdtpvypdn、cdtpvipdn、cdqpvlpdg、cdmpvlpdg、cdspvlpdg、cdspvwaeg、cdrpvapeg、cdhpvhpds、cdmpvspdr、cdspvppdd、cdqpvypdi、cdrpvypdi、cdhpvtpdr、ceypvypes、cdtpvlpds、cdmpvtpdt、cdapvtpdt、cdspvvpdn、cdlpvtpdr、cdspvhpdt、cdapvrpds、cdmpvwpdg、cdapvypdg、cdrpvqpdr、cydrpvqpdr、cdmpvdpen、cdmpvdadn、dqpvlpdc、dmpvlpdc以及cempvdpdn和cdnpvhpe。13.项12的肽,其中所述肽与药学上可接受的载体,优选klh(钥孔戚血蓝素)偶联。14.包含项12或13中至少一种肽的药物制剂,优选为疫苗。序列表<110>阿费里斯股份公司(affirisag)<120>用于治疗神经退行性变疾病的α-突出核蛋白和其疫苗的模拟表位<130>r53709<150>a297/2008<151>20080222<160>57<170>patentinversion3.4<210>1<211>8<212>prt<213>人工的<220><223>人工肽<400>1aspmetprovalaspproaspasn15<210>2<211>8<212>prt<213>人工的<220><223>人工肽<400>2cysaspglnprovalleuproasp15<210>3<211>8<212>prt<213>人工的<220><223>人工肽<400>3cysaspmetprovalleuproasp15<210>4<211>8<212>prt<213>人工的<220><223>人工肽<400>4cysaspserprovalleuproasp15<210>5<211>8<212>prt<213>人工的<220><223>人工肽<400>5cysaspserprovaltrpalaglu15<210>6<211>8<212>prt<213>人工的<220><223>人工肽<400>6cysaspthrprovalleualaglu15<210>7<211>9<212>prt<213>人工的<220><223>人工肽<400>7cysaspglnprovalleuproaspasn15<210>8<211>9<212>prt<213>人工的<220><223>人工肽<400>8cysaspmetprovalleuproaspasn15<210>9<211>9<212>prt<213>人工的<220><223>人工肽<400>9cysaspserprovalleuproaspasn15<210>10<211>9<212>prt<213>人工的<220><223>人工肽<400>10cysaspglnprovalthralagluasn15<210>11<211>9<212>prt<213>人工的<220><223>人工肽<400>11cysaspserprovaltrpalagluasn15<210>12<211>9<212>prt<213>人工的<220><223>人工肽<400>12cysaspthrprovalleualagluasn15<210>13<211>9<212>prt<213>人工的<220><223>人工肽<400>13cyshisaspargprovalthrproasp15<210>14<211>8<212>prt<213>人工的<220><223>人工肽<400>14cysaspargprovalthrproasp15<210>15<211>8<212>prt<213>人工的<220><223>人工肽<400>15cysaspasnprovalhisproglu15<210>16<211>8<212>prt<213>人工的<220><223>人工肽<400>16cysaspvalprovalleuproasp15<210>17<211>8<212>prt<213>人工的<220><223>人工肽<400>17cysaspthrprovaltyrproasp15<210>18<211>8<212>prt<213>人工的<220><223>人工肽<400>18cysaspthrprovalileproasp15<210>19<211>10<212>prt<213>人工的<220><223>人工肽<400>19cyshisaspargprovalthrproaspasn1510<210>20<211>9<212>prt<213>人工的<220><223>人工肽<400>20cysaspargprovalthrproaspasn15<210>21<211>9<212>prt<213>人工的<220><223>人工肽<400>21cysaspasnprovalhisprogluasn15<210>22<211>9<212>prt<213>人工的<220><223>人工肽<400>22cysaspvalprovalleuproaspasn15<210>23<211>9<212>prt<213>人工的<220><223>人工肽<400>23cysaspthrprovaltyrproaspasn15<210>24<211>9<212>prt<213>人工的<220><223>人工肽<400>24cysaspthrprovalileproaspasn15<210>25<211>9<212>prt<213>人工的<220><223>人工肽<400>25cysaspglnprovalleuproaspgly15<210>26<211>9<212>prt<213>人工的<220><223>人工肽<400>26cysaspmetprovalleuproaspgly15<210>27<211>9<212>prt<213>人工的<220><223>人工肽<400>27cysaspserprovalleuproaspgly15<210>28<211>9<212>prt<213>人工的<220><223>人工肽<400>28cysaspserprovaltrpalaglugly15<210>29<211>9<212>prt<213>人工的<220><223>人工肽<400>29cysaspargprovalalaproglugly15<210>30<211>9<212>prt<213>人工的<220><223>人工肽<400>30cysasphisprovalhisproaspser15<210>31<211>9<212>prt<213>人工的<220><223>人工肽<400>31cysaspmetprovalserproasparg15<210>32<211>9<212>prt<213>人工的<220><223>人工肽<400>32cysaspserprovalproproaspasp15<210>33<211>9<212>prt<213>人工的<220><223>人工肽<400>33cysaspglnprovaltyrproaspile15<210>34<211>9<212>prt<213>人工的<220><223>人工肽<400>34cysaspargprovaltyrproaspile15<210>35<211>9<212>prt<213>人工的<220><223>人工肽<400>35cysasphisprovalthrproasparg15<210>36<211>9<212>prt<213>人工的<220><223>人工肽<400>36cysglutyrprovaltyrprogluser15<210>37<211>9<212>prt<213>人工的<220><223>人工肽<400>37cysaspthrprovalleuproaspser15<210>38<211>9<212>prt<213>人工的<220><223>人工肽<400>38cysaspmetprovalthrproaspthr15<210>39<211>9<212>prt<213>人工的<220><223>人工肽<400>39cysaspalaprovalthrproaspthr15<210>40<211>9<212>prt<213>人工的<220><223>人工肽<400>40cysaspserprovalvalproaspasn15<210>41<211>9<212>prt<213>人工的<220><223>人工肽<400>41cysaspleuprovalthrproasparg15<210>42<211>9<212>prt<213>人工的<220><223>人工肽<400>42cysaspserprovalhisproaspthr15<210>43<211>9<212>prt<213>人工的<220><223>人工肽<400>43cysaspalaprovalargproaspser15<210>44<211>9<212>prt<213>人工的<220><223>人工肽<400>44cysaspmetprovaltrpproaspgly15<210>45<211>9<212>prt<213>人工的<220><223>人工肽<400>45cysaspalaprovaltyrproaspgly15<210>46<211>9<212>prt<213>人工的<220><223>人工肽<400>46cysaspargprovalglnproasparg15<210>47<211>10<212>prt<213>人工的<220><223>人工肽<400>47cystyraspargprovalglnproasparg1510<210>48<211>9<212>prt<213>人工的<220><223>人工肽<400>48cysaspmetprovalaspprogluasn15<210>49<211>9<212>prt<213>人工的<220><223>人工肽<400>49cysaspmetprovalaspalaaspasn15<210>50<211>8<212>prt<213>人工的<220><223>人工肽<400>50aspglnprovalleuproaspcys15<210>51<211>8<212>prt<213>人工的<220><223>人工肽<400>51aspmetprovalleuproaspcys15<210>52<211>9<212>prt<213>人工的<220><223>人工肽<400>52cysglumetprovalaspproaspasn15<210>53<211>9<212>prt<213>人工的<220><223>人工肽<400>53cysaspmetprovalaspproaspasn15<210>54<211>9<212>prt<213>人工的<220><223>人工肽<400>54aspmetprovalaspproaspasncys15<210>55<211>9<212>prt<213>人工的<220><223>人工肽<400>55cysaspmetprovalaspproglyser15<210>56<211>9<212>prt<213>人工的<220><223>人工肽<400>56aspmetprovalaspproglysercys15<210>57<211>9<212>prt<213>人工的<220><223>共有序列<220><221>misc_feature<222>(1)..(1)<223>xaa=(任一氨基酸残基)n,其中n=0或大于0的整数<220><221>misc_feature<222>(2)..(2)<223>xaa=选自天冬氨酸(d)与谷氨酸(e)的氨基酸残基<220><221>misc_feature<222>(3)..(3)<223>xaa=任一氨基酸残基<220><221>misc_feature<222>(6)..(6)<223>xaa=任一氨基酸残基<220><221>misc_feature<222>(7)..(7)<223>xaa=选自脯氨酸(p)与丙氨酸(a)的氨基酸残基<220><221>misc_feature<222>(8)..(8)<223>xaa=选自天冬氨酸(d)与谷氨酸(e)的氨基酸残基<220><221>misc_feature<222>(9)..(9)<223>xaa=(任一氨基酸残基)n,其中n=0或大于0的整数<400>57xaaxaaxaaprovalxaaxaaxaaxaa15当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- SeZn7MT3的组成、制备方法及其在防治阿尔茨海默症中的应用与流程
- 纤维支架材料、其制备方法、及亚甲蓝负载量的调节方法与流程
- 大驳骨在制备预防和/或治疗神经退行性疾病的药物中的应用及药物的制造方法与工艺
- 花叶假杜鹃在制备预防和/或治疗神经退行性疾病的药物中的应用及药物的制造方法与工艺
- 大脑内稳态调节蛋白的组成、制备方法及其在防治阿尔茨海默症中的应用与流程
- 一种药物组合物及其制备方法和在制备防治神经退行性疾病的药物中的应用与流程
- 片层碳‑四氧化三铁复合体在抑制Aβ聚集中的应用的制造方法与工艺
- 一种干细胞球切割收集装置及干细胞球的切割分离传代方法与流程
- 一种具有改善记忆功效的多肽及其分离制备方法和应用与制造工艺
- 治疗或预防神经退行性病症的组合物和方法与制造工艺