共定位手术导航系统和相机头的制作方法
本发明涉及分子成像技术领域,特别涉及一种共定位手术导航系统和相机头。
背景技术:
癌症治疗最有疗效的方法是手术切除和化疗。而手术切除后遗留的癌症细胞的数量是衡量手术切除成功与否的一个指标:遗留的癌症细胞的多少和彻底清除的程度极大的影响了病情后期的发展,手术后如果有过多的癌症细胞遗留在器官上,则可能直接降低了随后的化疗效果和病人的存活几率。
对于尺寸较小的癌症组织或肿瘤边界,医生很难从肉眼和触摸的经验上给予准确判断。并且在病人的病灶区,癌症组织和血管、神经等正常组织交错,肉眼无法分辨,在手术时,医生如果在切除癌症细胞的同时,过多的切除血管和神经等正常组织,会对病人的健康和功能造成巨大伤害。
因此,能为医生提供病灶区实时影像且能够精确分辨癌症组织和正常组织的设备,成为现在研究的热点。
技术实现要素:
本发明解决的问题是体积小、精确度高且能够对可见光波段的荧光的靶向药物摄影合成的共定位手术导航系统和相机头。
为解决上述问题,本发明提供一种共定位手术导航系统,包括:第一光源和第二光源,其中所述第一光源提供可见光;所述第二光源提供近红外光,且所述第一光源提供的可见光与所述第二光源提供的近红外光中心重叠;图像采集单元,所述图像采集单元包括第一图像传感器和第二图像传感器;所述第一图像传感器基于所述第一光源提供的可见光成像;所述第二图像传感器基于所述第二光源提供的近红外光所激发的荧光成像;其中,第一图像传感器和第二图像传感器共享光路。
可选的,还包括二向色镜,所述二向色镜适于透射所述可见光和反射所述荧光,或所述二向色镜适于透射所述荧光和反射所述可见光。
可选的,还包括,壳体,所述壳体用于容纳第一光源、第二光源和图形采集单元。
可选的,还包括,依次设置于第一光源前的非球面镜和第一滤光片。
可选的,还包括,依次设置于第二光源前的工程漫射体和第二滤光片。
可选的,还包括,设置于图像采集单元前的第三滤光片。
可选的,所述第一图像传感器为彩色电荷耦合元件或彩色cmos图像传感器。
可选的,所述第二图像传感器为近红外电荷耦合元件或近红外cmos图像传感器。
可选的,所述第一图像传感器和第二图像传感器集成于图像采集单元内。
本申请还提供一种相机头,包括如上述任一实施例的共定位手术导航系统。
本实施例提供的共定位手术导航系统和相机头体积小,精确度高,干扰小。能够提供肿瘤的精确位置。
附图说明
图1-3为本申请一实施例的共定位手术导航系统示意图;
图4为一实施例的图像采集单元示意图;
图5为采用第二图像传感器采集成像的第一图片,和将获取的第一图片中的肿瘤的数据信息,与采用第一图像传感器采集成像的照片叠加的照片;
图6示出采用本申请实施例的共定位手术导航系统的合成图像灵敏度曲线示意图。
具体实施方式
目前的大多数荧光影像系统为了能够实现同时采集病灶区的荧光标记图像的能力,往往都设计成由两台或三台摄像机同时工作,分工完成实时采集不同光谱影像的任务,然后将不同光谱影像合成药物靶向的手术图像。
现有两台或三台摄像机的荧光影像系统体积较大,无法小型化,可移动性差;而且两台或三台摄像机同时工作,位置无法精确重叠,影像合成难度高且有误差。
更需要指出的是,两台或三台摄像机同时工作的荧光影像系统,由于必须对整体的病灶区采用可见照明光摄影,如果对病灶区的部分组织(例如癌症细胞)采用可见光波段的荧光的靶向药物,在合成摄影时,整体的病灶区影像和可见波段的荧光影像互相干扰,合成的图像不能为医生提供导引。
为此,本申请的发明人提供共定位手术导航系统,包括:第一光源和第二光源,其中所述第一光源提供可见光;所述第二光源提供近红外光,且所述第一光源提供的可见光与所述第二光源提供的红外光中心重叠;图像采集单元,所述图像采集单元包括第一图像传感器和第二图像传感器;所述第一图像传感器基于所述第一光源提供的可见光成像;所述第二图像传感器基于所述第二光源提供的红外光所激发的荧光成像;其中,第一图像传感器和第二图像传感器共享光路;图像合成器,将第一图像传感器和第二图像传感器成像的图像合成。本申请的实施例将第一光源、第二光源和图像采集单元集成为一体,且所述图像采集单元的第一图像传感器和第二图像传感器能够共享光路的分别对可见光和激发荧光成像,不但减小的设备的体积,并且采集的影像互不干扰,合成的影像精确度高,能够为医生提供病人癌症细胞与其他正常组织的精确分辨的实时影像,为医生切除荧光标记的癌症肿瘤和靶向的其他病灶提供精确引导,减少癌症细胞认定过程中的不确定性和误判,提高医生手术的成功率。
为使本发明的上述目的、特征和优点能够更为明显易懂,下面结合附图对本发明的具体实施例做详细的说明。
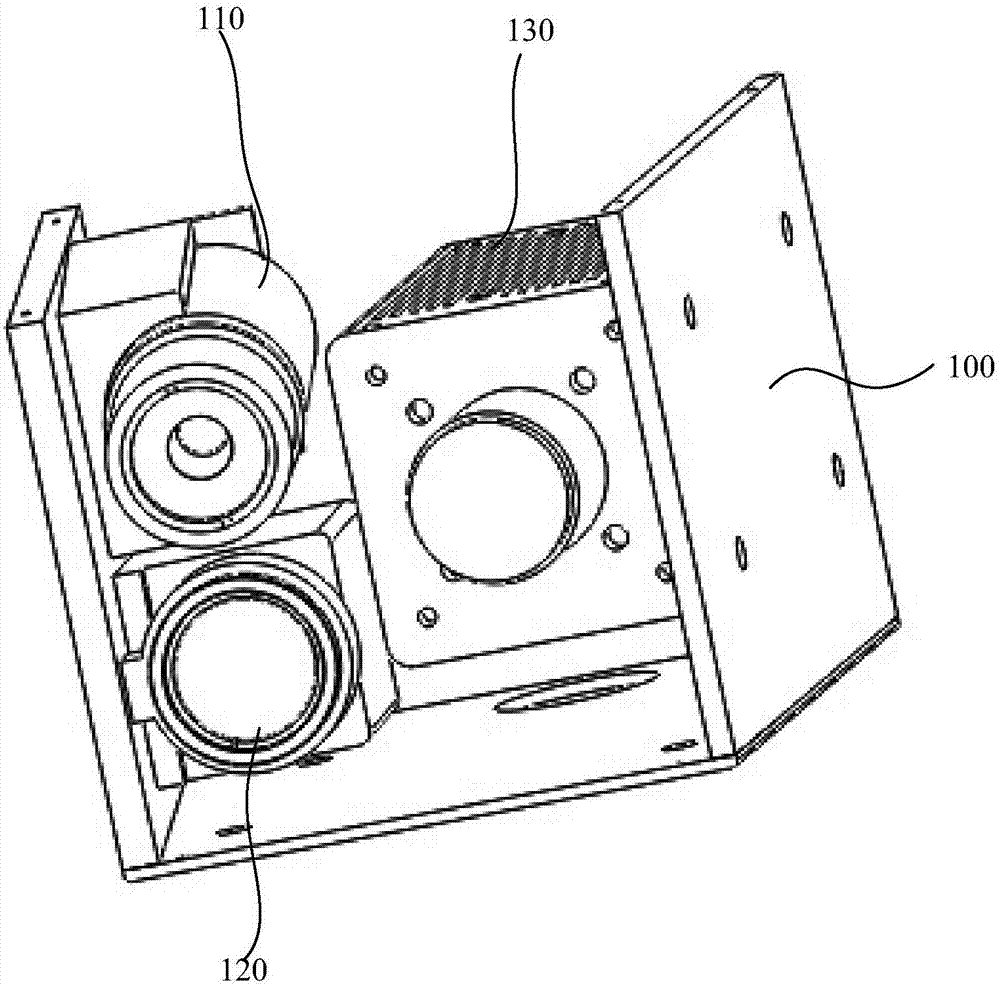
请参考图1-图3,其中,图1-3为本申请一实施例的共定位手术导航系统示意图。其中,该共定位手术导航系统包括:壳体100,所述壳体100可以为塑料、金属、玻璃、合金或高分子材料。所述壳体100具有空腔,用以容纳共定位手术导航系统的其他部件,例如第一光源、第二光源和图像采集单元等等。
在一些实施例中,所述壳体100为长方体、正方体、圆柱体、类长方体、类正方体、类圆柱体等形状。本领域的技术人员可以根据实际需要,选择合适的形状。
在一些实施例中,所述壳体100具有近端101和远端102,其中,所述近端101为靠近病灶区的一端,所述远端102为远离病灶区的一端。所述近端101的表面具有若干开口,所述开口用于为第一光源、第二光源和图像采集单元提供光路进出口。作为一些实施例,所述开口的数量可以为三个。在其他实施例中,所述开口也可以为2个、4个或者其他数量。
所述共定位手术导航系统还包括:第一光源110、第二光源120和图像采集单元130。在一些实施例中,所述第一光源110、第二光源120和图像采集单元130设置在所述壳体100内,所述壳体内部具有卡嵌或者挂扣结构,用于固定所述第一光源110、第二光源120和图像采集单元130。在一些实施例中,所述壳体的远端102或侧壁具有若干线路开口,用于容纳为所述第一光源110、第二光源120和图像采集单元130提供能量和数据的线路。
在一些实施例中,所述第一光源110为白光光源,例如,所述第一光源110为白光led,所述白光led的波长范围为380-760nm。
在一些实施例中,为了使得所述第一光源110的光能够较佳地通过所述壳体100的开口,较佳的照射在病灶区,所述第一光源110的前面设置有非球面镜111。所述非球面镜111用于将led发散发射的光进行收束,使得led发射的可见光发散角减小,可以顺利通过传输的通道。
在一些实施例中,在非球面镜111的前面设置有第一滤光片112,所述第一滤光片为低通滤光片,其只允许通过665以下的可见光。以防止图像采集单元130采集的彩色图像失真。所述低通滤光片能够防止多余的光经过组织反射后进入到图像采集单元130可见光图像传感器,又不影响图像采集单元130的近红外图像传感器,为此,需要通过尽可能多的红色波段。在一些实施例中,考虑到近红外图像传感器开始的感光为700nm,800nm左右达到峰值,为此,允许通过665nm以下的可见光的低通滤光片为较佳选择。
在一些实施例中,所述第二光源120可以为近红外激光光源,所述近红外激光光源的波长范围785±2nm。例如,所述第二光源120可以为近红外激光二极管。
在一些实施例中,所述第二光源120的前面可以设置有工程漫射体121。所述工程漫射体121用于将第二光源120发出的高斯光变均匀。
在一些实施例中,所述工程漫射体121前面设置有第二滤光片122。所述第二滤光片122用于过滤通过工程漫射体121的光,通过所述第二滤光片122的光的光谱范围约为785nm左右。
在一些实施例中,通过所述第二滤光片122的光照射于病灶区,所述病灶区预先包含靶向药物,例如叶酸-异硫氰酸荧光素、c61h67n9o17s4衍生药物、c61h67n9o17s4衍生药物或吲哚菁绿,靶向药物通过服用或者注射,注入到病灶区,包含靶向药物的所述病灶区在接受到通过所述第二滤光片122的光照射后,吸收光能进入激发态,退激发并发出荧光。
在一些实施例中,所述第一光源110提供的可见光与所述第二光源120提供的近红外光中心重叠,从而能够使得后续第一图像传感器和第二图像传感器成像能够精确识别病灶区的实体肿瘤的大小及边界。从而能够高效的鉴别和帮助清除癌细胞。为精准医疗提供了可能。并且由于所述第一光源110提供的可见光与所述第二光源120提供的近红外光中心重叠,在后续图像合成时,不需要进行每个像素的对应,能够较快的进行图像合成,提高了图像合成的速度,能够很好的得到实时图像。
在一些实施例中,所述共定位手术导航系统还包括:图像采集单元130,所述图像采集单元130用于采集病灶区的图像。作为一些实施例,所述图像采集单元130包括第一图像传感器131和第二图像传感器132;所述第一图像传感器131基于所述第一光源110提供的可见光成像;所述第二图像传感器132基于所述第二光源120提供的近红外光所激发的荧光成像。作为一些实施例,第一图像传感器131和第二图像传感器132共享光路;
在一些实施例中,所述第一图像传感器131为彩色电荷耦合元件或彩色cmos图像传感器。所述第二图像传感器132为近红外电荷耦合元件或近红外cmos图像传感器。
在一些实施例中,考虑到所述第二图像传感器132是基于近红外光激发的荧光成像,为了避免近红外光经过病灶区的组织表面反射而干扰所述第二图像传感器132成像,在该图像采集单元前的设置有第三滤光片133。所述第三滤光片133能够过滤第二光源发射的近红外激光,而允许可见光跟近红外激光激发的荧光通过。作为一些实施例,所述第三滤光片133过滤785nm左右的光。
在一些实施例中,请参考图4,图4为一实施例的图像采集单元示意图。其中,所述图像采集单元230包括:二向色镜234,所述二向色镜234用于透射所述可见光和反射所述荧光,或所述二向色镜适于透射所述荧光和反射所述可见光。
在一些实施例中,所述二向色镜234用于透射所述可见光和反射所述荧光,请依旧参考图4,第一图像传感器231放置于所述二向色镜234的透射部后,用于接收透射过来的可见光成像;第二图像传感器232放置于所述二向色镜234的反射部后,用以接收反射过来的荧光成像。
在另一些实施例中,若所述二向色镜透射所述荧光和反射所述可见光,则相应的将第二图像传感器和第一图像传感器放置于透射部和反射部后,用以相应地接收可见光和荧光成像。
由上述可知,所述第一图像传感器和第二图像传感器可以集成于图像采集单元内,且能够共享光路。从而减小了共定位手术导航系统体积,且互不干扰,成像精确度高。
请参考图5,图5左边的图片为采用第二图像传感器采集成像的第一图片,根据预设的灰度阈值,获取第一图片中的肿瘤的数据信息;所述灰度阈值可以根据实验或经验设定;然后将获取的第一图片中的肿瘤的数据信息,叠加至采用第一图像传感器采集成像的第二照片,形成图5右边的图片。需要说明的是,由于第一图像传感器和第二图像传感器可以设定为获取相同的病灶区,并且由于第一图像传感器和第二图像传感器共享光路,为此,第一图片中的肿瘤的数据信息可以直接叠加至第二照片,并且进行相应像素对应的准确度高,图像的重建性好,减低了图像处理软件的计算的难度,图像实时性佳。
在一些实施例中,所述共定位手术导航系统还包括图像合成器(未示出),所述图像合成器将第一图像传感器和第二图像传感器成像的图像合成,所述图像合成器基于所述第一图像传感器和第二图像传感器成像的图片进行合成,从而为病灶区肿瘤的精确位置。
请参考图6,图6示出采用本申请实施例的共定位手术导航系统的合成图像灵敏度曲线示意图。其中标示为r、g、b的三条曲线是白色相机的通道,标示为nir的曲线是近红外相机的通道。图中还示意性的合成了第一滤光片112、第二滤光片122和第三滤光片133。通过本申请实施例的共定位手术导航系统形成了一个实时观测肿瘤成像的仪器,通过简化系统,使得系统可以做的很小,只通过相机,激光器,led选择合适的位置就实现系统的研制。白光led照亮病灶区,防止白光过多的波段影响成像,使用低通滤光片阻止665nm之后的光通过,并且尽可能多的使得通过的白光在相机的rgb感光部分;如果红色的感光较少会形成图片颜色的失真;激光通过滤光片后只通过785nm左右的光通过,使用785nm带通滤光片。激光通过激发荧光药剂产生荧光。反射的激光与荧光同时通过相机接收,为了防止785nm激光通过反射直接进入相机,影响成像质量,故需要滤除785nm激光。能够同时通过白光与荧光,简单方便可小型化。
本申请还提供一种相机头,其特征在于,包括如上任一实施例的共定位手术导航系统。
本申请提供的共定位手术导航系统和相机头体积小,精确度高,干扰小。能够提供肿瘤的精确位置。
虽然本发明披露如上,但本发明并非限定于此。任何本领域技术人员,在不脱离本发明的精神和范围内,均可作各种更动与修改,因此本发明的保护范围应当以权利要求所限定的范围为准。
- 还没有人留言评论。精彩留言会获得点赞!