肺癌细胞KI‑67表达指数的术前预测模型的建立方法与流程
本发明涉及医学领域,尤其涉及一种基于三维测量影像学参数肺癌细胞ki-67表达指数的术前预测模型的建立方法。
背景技术:
随着高分辨率ct(highresolutionct,hrct)的发展与普及,肺磨玻璃结节(ground-glassopacity,ggo)的检出率显著提高。国内外研究表明局灶性ggo多为肺腺癌的早期病变。ggo是一个非特异性病灶,可以是多种疾病在ct上的表现,是在hrct上发现的肺部局灶影,通常被学者描述为云絮状肺密度增高影,同时内部仍可显示支气管或血管结构影像。但目前国内外公认其多倾向于肺部早期肿瘤。已有多项国内外研究及临床病理资料提示,多数ggo组织病理学为早期肺腺癌。早期肺腺癌的病理类型按演进发展过程,可分为了非典型腺瘤样增生(atypicaladenomatoushyperplasia,aah),原位腺癌(adenocarcinomainsitu,ais),微浸润腺癌(minimallyinvasiveadenocarcinoma,mia)及浸润性腺癌(invasiveadenocarcinoma,iac)。即便是随访观察,仅靠二维ct影像学的一般征像包括传统的边缘、大小、胸膜牵拉与否、有无毛刺等很难准确鉴别其病理类型。作为一种量化指标,ct影像学参数在对ggo研究中越来越受到学者们的青睐。另外,三维ct相比于传统二维ct对肺部小结节的评价更具灵敏性和准确性。
另一方面,从病理学的角度来看,细胞增殖活性的增加是肺癌发生发展的始作俑者。而细胞核增殖抗原ki-67常被临床病理医师用来检测标本中细胞的增殖活性,多表达于增殖活跃的细胞的细胞核中,为调控分裂增殖细胞的细胞周期相关调节基因,其表达指数与细胞增殖活性呈正相关,多高表达于恶性肿瘤细胞,与肿瘤的发生发展关系密切,在多项研究中被用来探索恶性肿瘤增殖的生物学行为。国内外的研究者们预测ki-67所表达的细胞增殖活性与肺癌患者的预后具有很好的相关性。据文献记载,ki-67蛋白最初定义为标准单克隆抗体ki-67,是由霍奇金淋巴瘤细胞株l428的细胞核免疫小鼠所得。事实上ki-67蛋白出现在细胞周期的所有活跃期(g1,s,g2,有丝分裂),但是静止细胞(g0期)中常不表达,这使其成为检测特定细胞群体增殖活性或生长分数极好标志物。高增值率是肿瘤最显著的特点,因此增殖活性在多项研究中被用来估计多发性骨髓瘤、前列腺癌、乳腺癌的预后。
尽管大量国内外学者的研究分析了不同病理类型ggo的ct特征,但很少研究ggo三维重建中影像学参数和量化的病理学参数如细胞增殖活性标志物ki-67li之间的关系。过往诊断方法所作分析仅限于影像学水平,未涉及评价作为诊断金标准的病理水平情况,使得诊断过于主观且准确性不高。
所以,如果能将ki-67指数与相关ct参数相关联,得到术前预测模型,是十分具有实用价值的,但是现有技术领域,这一块还尚属空白。
技术实现要素:
为了克服上述现有技术的不足,本发明提供了一种基于肺结节ct三维重建影像学参数的肺癌细胞ki-67表达指数的术前预测模型。
本发明提供的肺癌细胞ki-67表达指数的术前预测模型的建立方法,其特征在于,包括以下步骤:
步骤(1):对病例进行筛选,得到符合标准的患者;
步骤(2):检测所述的患者ki-67表达指数;
步骤(3):对所述的患者肺部进行ct影像扫描及三维重建,得到各ct参数数据及三维图像;
步骤(4):对所述的ct参数数据及ki-67表达指数进行统计学处理分析及交叉验证,并建立ki-67的预测模型。
较佳地,所述的患者为符合下列标准:
术前行ct检查且首次诊断为ggo患者;
术后有明确病理诊断结果;
直径小于3cm的单纯性ggo和混合性ggo。
较佳地,ki-67表达指数的检测采用免疫组化二步法。
较佳地,所述的ct参数数据为平均直径、总体积、最大ct值、平均ct值和ct值分布标准差。
较佳地,所述步骤(5)还包括以下步骤:
步骤(5.1):采用levene检验检测ct参数数据及ki-67表达指数方差齐性;
步骤(5.2):对于方差不齐的ct参数数据运用kruskal-wallis检验来计算各组间参数数据是否具有显著性差异;
步骤(5.3):对于方差齐性的ki-67表达指数则用单因素方差来分析组间差异,并运用lsd检验来进行ki-67的组间两两配对检验;
步骤(5.4):用tamhane’st2来对ct参数数据及ki-67表达指数预测值进行两两间配对检验;
步骤(5.5):用受试者工作特征曲线分析来检测各ct参数数据及ki-67表达指数对于鉴别不同病理类型的ggo病灶的灵敏性和特异性;
步骤(5.6):采用spearman相关性分析和多元回归分析并十折交叉验证来建立ki-67表达指数的预测模型。
与现有技术相比,本发明的有益效果如下:
本发明开创性的将具有较好客观性和准确性的ggo三维重建模型中所测量的相关ct参数与病理标本中肺癌细胞ki-67表达指数(labelingindex,li)相联系,通过研究二者的量化相关性来建立以三维重建参数预测ki-67li的多元回归模型,从而对术前ggo的病理性质的鉴别诊断提供更准确可量化的评估,为医生判断提供了一个较好的中间值。将比以往单纯的通过影像学特征来主观判断更加精确。
附图说明:
图1a和图1b为本发明实施例中的ki-67表达指数的免疫组化定量测量图。
图2a、图2b及图2c为本发明实施例中肺磨玻璃结节的三维重建处理和参数测量图;
图3为本发明实施例中非浸润腺癌(pia)、微浸润性腺癌(mia)及浸润性腺癌(iac)之间各参数的比较图;
图4为本发明实施例中表示肺部磨玻璃结节(ggo)直径、体积(tv)、最大ct值(max)、平均ct值(avg)和ct值分布标准差(std)的受试者工作特征曲线(roc)分析的曲线图。
图5为本发明实施例中肺磨玻璃结节(ggo)的直径、体积(tv)、最大ct值(max)、平均ct值(avg)和ct值分布标准差(std)与ki-67li之间spearman相关性分析的散点图。
图6为本发明实施例中ki-67表达指数(li)实际值和预测值在不同病理类型肺磨玻璃结节(ggo)包括非浸润腺癌(pia)、微浸润腺癌(mia)及浸润性腺癌(iac)之间的箱线比较图。
图7为本发明实施例中不同病理类型肺磨玻璃结节的ki-67的roc曲线图。
具体实施方式
下面结合具体的实施例对本发明作进一步地说明,以更好地理解本发明。
一、方法
1、临床资料采集
收集2012年10月至2014年10月来院就诊的手术切除后有明确病理结果的并且术前有完整hrct和三维重建的160例ggo患者的临床病史、病理报告、手术记录及ct影像资料,对患者的年龄、性别、病理分型、ggo形状、边缘、直径(diameter)、体积(totalvolume,tv)、最大ct值(themaximumctattenuationvalue,max)、平均ct值(averagectattenuation,avg)及ggo整体ct值分布的标准差(standarddeviationofthedistributionofctattenuationwithinthewholeggo,std)进行统计整理。所有病例在首次被检出为ggo后均接受抗炎治疗2周,3个月随访后复查ct。只有随访后对比ggo病灶稳定或直径减小的病例方可纳入研究,对于抗炎后病灶消失的病例应予以排除,多为炎性病灶。
病例被纳入研究的标准:
①术前于本院行ct检查且首次诊断为ggo患者;
②术后有明确的病理诊断结果;
③直径小于3cm的单纯性ggo和混合性ggo。
henschke等人研究报道ggo比全实性肺部小结节(full-solidnodules)恶性程度更高,fengli等人研究发现137例全实性肺部小结节中,仅有15例为恶性病灶,其余122例皆为良性病灶,且全实性结节中多角形、边缘光滑或稍光滑的病例恶性者比良性者明显少(多角形:恶性7%-良性38%,p=0.02;边缘光滑或稍光滑:恶性0%-良性63%,p=0.001);98%的多角形实性结节(46/47)和100%的边缘光滑的实性结节(77/77)均为良性病变。故本研究排除了全实性结节的病例。
排除病例的标准:
①ct影像上直径大于3cm的ggo或病灶为全实性小结节者或随访抗炎治疗后消退者;
②病理结果为转移性肺癌者、病理结果为鳞癌或小细胞癌者及病理虽为腺癌,但分期超过t1n0m0者;
③无术后病理结果或无本院的术前ct扫描数据者(部分患者为当地医院ct诊断后转至本院);
④术前接受过肺部放化疗及活检穿刺者,会导致影像学参数测量不准确;
⑤过去有肺癌肺外癌症病史者。
最终160例ggo病例纳入研究,其中男性54例,女性106例,平均年龄为56.59±9.9岁。所有病例进行三维重建参数测量的ct扫描至手术获得病理标本的时间间隔平均为11±4天(1-23天)。所有纳入研究的病例病理诊断结果包括非典型腺瘤样增生(atypicaladenomatoushyperplasia,aah)26例、原位腺癌(adenocarcinomainsitu,ais)11例、微浸润腺癌(minimallyinvasiveadenocarcinoma,mia)106例及浸润性腺癌(invasiveadenocarcinoma,iac)17例。表1总结了所纳入研究病例的临床资料、影像学资料及病理学资料。
表1不同病理类型的ggo病例的临床、影像学及病理学资料统计(160例)
注:
按照最新的美国iaslc/ats/ers国际多学科肺腺癌分类系统进行分类;
所有数据均以平均值±标准差(sd)进行记录,*表示p<0.05;
性别、吸烟史及ggo类别均通过卡方检验进行分析;
平均年龄、直径、总体积(tv)、最大ct值(max)、平均ct值(avg)、ct值分布标准差(std)及ki-67表达指数预测值均通过kruskal-wallis和tambane’st2检验进行分析;
ki-67表达指数通过单因素方差分析(one-wayanova)最小显著性差异检验(lsdtest)进行分析;
p表示所有ggo病例方差分析结果的p值;
p1表示非浸润肺腺癌(pia)和微浸润肺腺癌(mia)组间显著性差异的p值;
p2表示微浸润肺腺癌(mia)和浸润肺腺癌(iac)组间显著性差异的p值;
2、免疫组化法检测ki-67表达指数
ki-67的检测采用国际标准的免疫组化二步法进行检验,具体操作如下:
1.玻片的准备:首先把准备的载玻片和盖玻片置于酸性溶液中24h,取出后流水冲洗,再用ddh20冲洗3-4遍,然后浸入95%酒精2h,待玻片干后还需作防脱片处理,将洗净的载玻片放入新鲜配制的3-氨基丙基-三乙氧基硅烷(apes)工作液中30s,取出后再用纯丙酮溶液或ddh20洗去未结合的apes,晾干后装入盒中备用。
2.切片:用10%的中性福尔马林对所有手术切除的标本进行固定,再石蜡包埋后连续切片,切片厚度为4μm,每例连续切片三张进行常规he染色观察病理形态,免疫组织化学染色观察ki-67、egfr、p53、cea表达情况;可用电热干燥箱恒温60℃条件下烤片6-8h。
3.脱蜡:首先用二甲苯于60℃下脱蜡3次,每次15min;再用梯度酒精脱水,依次为无水酒精2次、95%酒精2次、80%酒精1次、70%酒精1次,每次均为5min;再用自来水冲洗片刻后ddh20冲洗5min;0.01mpbs冲洗3次,每次3min。
4.配置3%过氧化氢阻断内源性过氧化物酶,室温下维持10min,再用pbs冲洗3次,每次3-5min。
5.抗原修复:先把经过上述步骤处理的切片放在盛有ph为6.0的柠檬酸缓冲液的烧杯中,再把烧杯放入高压蒸汽锅内,煮沸至高压锅喷气并维持10min;然后取出切片后使其自然冷却至室温,先用蒸馏水冲洗2次,再用pbs冲洗3次,每次3min。
6.封闭:擦净表面多余水分,滴加4%羊血清封闭后室温孵育2h,减少非特异性染色。
7.一抗:甩去羊血清,滴加准备好的第一抗体,各抗体稀释后室温孵育1h后于4℃下过夜;滴加0.01mpbs作为阴性对照;0.01mpbs冲洗3次,每次3min。
8.去除表面水分,滴加试剂盒中的试剂l,37℃孵育20min,0.01mpbs冲洗3次,每次3min;滴加试剂盒中的试剂2,37℃孵育30min;0.01mpbs冲洗3次,每次3min。
9.甩去pbs液,将经上述处理后的切片浸入新鲜配制的dab显色液中5min,同时在显微镜下观察显色程度,染色阳性常表现为棕黄色或棕褐色,阳性反应显色明显后则将切片于流水下冲洗,及时终止反应,一般显色时间为5分钟左右。
11.苏木素复染30s-2min后流水冲洗,再用l%盐酸-酒精分化,氨水返蓝或自来水返蓝,自来水冲洗。
12.梯度酒精脱水:依次使用70%酒精、80%酒精、95%酒精、无水酒精脱水,每次均为5min;二甲苯浸泡2次,每次8min。
13.用中性树胶脂封片,然后显微镜下阅片,记录染色结果。
目前尚无有关ki-67表达强弱分级的统一标准。研究文献和临床病理工作中通常采用粗略的百分比来表示ki-67标记指数,即在40×10倍镜下,每张玻片中随机选择10个视野,计算10个视野中阳性细胞平均所占视野的比例来粗略估算ki-67li,细胞核染为棕黄色或棕褐色的细胞则为阳性细胞。如图1所示,本实施例中使用图像测量软件imageproplus6.0来对ki-67免疫组化检测后的图片进行定量测量。图1a表示增殖细胞的胞核中灰黑色颗粒即为ki-67的阳性表达;图1b表示定量检测时根据灰度值不同,软件自动识别灰色区域的灰度值并进行测量。
3、ct影像扫描及三维重建后处理
对肺部先行常规普通平扫,再对病灶进行薄层容积螺旋扫描。嘱病人深吸气后屏住,由胸廓入口扫描至肺底部。
扫描条件:
电压120~140kv
电流200~400ma
重建层厚0.625mm
矩阵512×512
算法:骨算法轴向重建、滤波反投影(filteredbackprojection,fbp)及双肺最小视野法。
所有病例的ct诊断和后处理均由两位分别有8年和12年的影像医师读片,当结节超过一个层面方可诊断为ggo。hrct图像保存于医院dicm(digitalimagingandcommunicationsinmedicine)计算机系统内以供查询和研究。
本实施例中选取了5项ggo三维重建模型相关的参数作为变量:平均直径、总体积(totalvolume,tv)、最大ct值(max)、平均ct值(avg)和ct值分布标准差(std)。
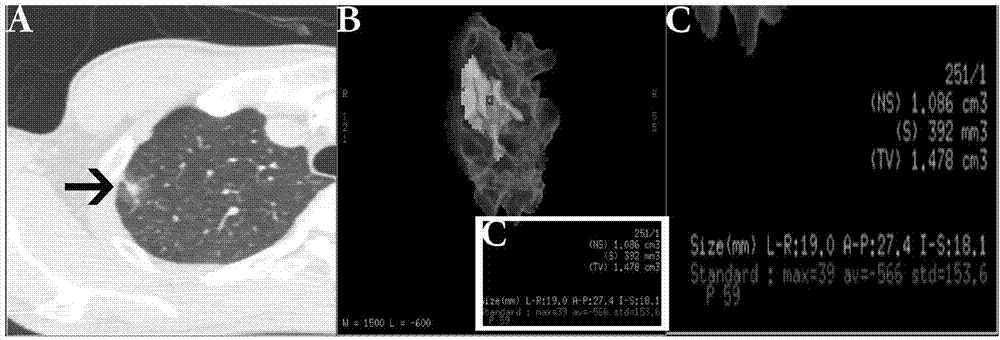
三维重建处理:应用adw3.1工作站(advantageworkstation4.3;gehealthcare),利用重建软件(lungvcar;gehealthcare)进行三维重建,主要方法采用容积显示重建(volumerendering,vr)。在vr图像重建中,点击结节后软件根据ct值差别自动检测并划定兴趣区域(regionofinterest,roi),即ggo结节及周围相邻结构,包括结节内部的血管和细支气管;再通过切割技术对结节周围不属于结节的结构按照各部分ct值差异辨别后进行自动切割;三维容积图像显示后,适当调节对比度、亮度,使图像达到最佳视觉效果;然后可使用旋转技术从720°全角度观察结节三维形态、内部血管或细支气管结构、及与边缘胸膜的关系等情况;最后自动对ggo三维直径、tv、max、avg和std进行准确测量并列出。图2显示肺磨玻璃结节(ground-glassopacity,ggo)的三维重建处理与参数测量,图2a表示高分辨率ct(hrct)上典型的ggo(箭头);图2b表示软件自动生成的重建后的ggo模型以及自动测量相关参数;图2c表示2b中的参数列表放大,包括三维直径、体积(tv)、最大ct值(max)、平均ct值(avg)和ct值分布标准差(std)。
4、统计分析
所有数据均记录为平均值±标准差。采用levene检验检测变量方差齐性,结果除了ki-67li以外所有变量均为方差不齐,如表2所示。故对于方差不齐的变量运用kruskal-wallis检验来计算各组间变量是否具有显著性差异,方差齐性的ki-67li则用单因素方差分析(anova)来分析组间差异。另外,运用lsd检验来进行ki-67li的组间两两配对检验,用tamhane’st2来对结节直径、tv、max、avg、std及ki-67li预测值进行两两间配对检验。用受试者工作特征曲线(receiveroperatingcurve,roc)分析来检测各变量对于鉴别不同病理类型的ggo病灶的灵敏性和特异性。spearman相关性分析和多元回归分析并十折交叉验证来建立ki-67li的预测模型。统计分析所用软件为spss22.0,p<0.05为差异有统计学意义。
表2以levene检验进行变量方差齐性检验结果
注:
变量包括ggo结节直径、总体积、最大ct值、平均ct值、ct值分布标准差、ki-67表达指数及ki-67表达指数预测值;
p(sig.)<0.05表示变量方差不齐,需用tamhane’st2检验,p(sig.)>0.05则表示方差齐性,需用最小显著差异检验(lsd);
二.结果
1、影像学特征及病理组织学诊断
ggo的三维重建ct参数由后处理软件自动测量,各病理的参数比较如图3所示,图3表示非浸润腺癌(pia)、微浸润性腺癌(mia)及浸润性腺癌(iac)之间各参数的比较。ki-67表达阳性细胞表现为位于过度增殖细胞的细胞核内棕褐色颗粒,相关统计数据见仍见表1。
2、不同病理类型的各参数roc曲线鉴别分析
通过roc曲线分析得到结节直径、tv、max、avg、std和ki-67li对于pia和mia组间鉴别的曲线下面积(auc)分别分0.801、0.822、0.890、0.857、0.901和0.907,对于mia和iac组间鉴别的auc分别为0.812、0.793、0.749、0.731、0.684、0.901;在各自变量曲线上的点同时选取最大真阳性率(即灵敏性)和最小假阳性率(即1-特异性)就可得到各个变量对于组间的鉴别阈值,通常是最靠近曲线左上角的那点[37]。故所得直径、tv、max、avg、std和ki-67li对于pia和mia组间最佳鉴别阈值分别为10.55mm,217mm3,-126.5hu,-615.5hu,135.5和4.38%,而对于mia和iac组间最佳鉴别阈值分别为21.8mm,1708.5mm3,189hu,-464hu,169.4和9.88%,如图4所示,图4表示肺部磨玻璃结节(ggo)直径、体积(tv)、最大ct值(max)、平均ct值(avg)和ct值分布标准差(std)的受试者工作特征曲线(roc)分析。根据曲线下面积(auc)可以看出ki-67li有着比其他各项三维ct参数更好的灵敏性和特异性。各项参数对于鉴别pia和mia组间差别比mia和iac组间差别效率更高。
3、三维ct参数与ki-67li之间的相关性
通过spearman相关性分析,ggo直径(p<0.001)、tv(p<0.001)、max(p<0.001),avg(p<0.001)和std(p<0.001)与ki-67li之间均有显著性相关,各自相关系数分别为0.575,0.559,0.605,0.585and0.639,如图5所示,图5为肺磨玻璃结节(ggo)的直径、体积(tv)、最大ct值(max)、平均ct值(avg)和ct值分布标准差(std)与ki-67li之间spearman相关性分析的散点图(r为相关系数);各参数均与ki-67li成显著性正相关;图5(s)证明了ggo具有异质性,随着实性成分的增多,当超过50%时并不会出现std的抛物线式下降。
另外,通过多元线性回归分析来进一步定量探索三维ct参数与ki-67li之间的相关性,并进行十折交叉验证(10-foldcross-validation)即将160例ggo病例均分为10组,依次定义1组为测试组(testingsets),另外9组为训练组(trainingsets)来进行回归模型构建,然后用测试组代入检测验证。最后得到10个关于ki-67li的多元回归方程,并计算每个方程的平均绝对误差(meanabsoluteerror,mae),平均相对误差(meanrelativeerror,mre)和均方根误差(rootmeansquareerror,rmse)来评价各自方程的回归效率。
上述公式中n表示测试组病例数即10,
表3160例ggo病例三维ct参数对ki-67表达指数(li)多元线性回归模型的十折交叉验证
注:r表示多元相关系数,r2表示决定系数,mae表示平均绝对误差,mre表示平均相对误差,rmse表示根均方误差;
r和r2表示回归模型的契合度;
mae、mre及rmse表示回归模型的预测精准度,三者越低则回归模型预测越准确。
最终10个回归方程中,通过交叉验证比较得出第5组方程具有相对较高的预测准确率,回归方程如下:
ki-67li=0.022*std+0.001*tv+2.137(4)
将纳入研究的160病例三维ct参数全部代入得到整体的ki-67li预测值,pia、mia和iac的ki-67li预测值均值分别为4.27±0.76(range,2.67~6.05%),6.50±1.69(range,3.00~11.74%)和8.81±3.73(range,3.75~16.65%),且两两组间均有显著性差异(anovap<0.001,lsdpiavs.miap<0.001,miavs.iacp=0.014,piavs.iacp<0.001)其如图6所示,图6图6为ki-67表达指数(li)实际值和预测值在不同病理类型肺磨玻璃结节(ggo)包括非浸润腺癌(pia)、微浸润腺癌(mia)及浸润性腺癌(iac)之间的箱线图比较。结果显示ki-67li实际值和与预测值组间均有显著性差异。另外通过roc曲线分析,我们比较了ki-67li预测值和实际值的auc,尽管ki-67li预测值的auc(pia/mia:0.893;mia/iac:0.841)没有真实值的auc(pia/mia:0.907;mia/iac:0.901)高,但也比影像学参数对于不同病理类型ggo组间鉴别的准确度高,其如图7所示,图7roc曲线分析比较ki-67li的实际值和预测值对于鉴别判断不同病理类型肺磨玻璃结节(ggo)的灵敏性和特异性。
本发明开创性的将具有较好客观性和准确性的ggo三维重建模型中所测量的相关ct参数与病理标本中肺癌细胞ki-67表达指数(labelingindex,li)相联系,通过研究二者的量化相关性来建立以三维重建参数预测ki-67li的多元回归模型,从而对术前ggo的病理性质的鉴别诊断提供更准确可量化的评估,为医生判断提供了一个较好的中间值。将比以往单纯的通过影像学特征来主观判断更加精确。
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!