外泌体在皮肤美白制剂中的应用的制作方法
本发明涉及干细胞领域,具体涉及干细胞产生高活性的外泌体在皮肤美白制剂中的应用。
背景技术:
外泌体(exosome)是细胞向胞外分泌的囊泡类小体,直径约为30-150纳米之间,具有典型的脂质双分子层膜结构,可存在于细胞培养上清液、血浆、血清、唾液、尿液、羊水和恶性腹水以及其它生物体液中;其携带有母细胞的多种蛋白质、脂类、dna和rna等重要信息,在细胞-细胞间的物质和信息传递中起重要作用。
各种不同细胞来源的外泌体参与了重要的生理和病理过程,如抗原呈递、遗传物质交换、免疫反应、血管生成、炎症、肿瘤转移和处理,病原菌或癌基因传播。这些功能都依赖于外泌体的内容物,尤其是蛋白质和rna。
现有研究已证明间充质干细胞分泌的外泌体在促进皮肤损伤修复、减轻炎症反应、促进血管再生等方面有重要作用。
相关研究认为人脐带间充质干细胞的外泌体介导wnt4信号通路,参与皮肤创伤修复。在小鼠体内,人脐带间充质干细胞介导的wnt/b-连环蛋白活性在上皮形成和细胞增殖中发挥重要作用。当人脐带间充质干细胞的外泌体wnt4敲除后,b-连环蛋白活性消失,在体内的皮肤修复疗效明显下降。说明干细胞对皮肤修复是通过外泌体发挥作用的。
解放军总医院的韩卫东等用内毒素预处理间充质干细胞增强其旁分泌作用,增加了干细胞的营养支持和再生修复性能。研究发现,间充质干细胞通过释放大量的外泌体,来构建一个稳态的组织修复的微环境,从而消除炎症反应,促进伤口愈合。
血液学研究所等人研究,人骨髓间充质干细胞的外泌体具有免疫调节功能与支持血管形成的作用。正常人骨髓间充质干细胞分泌的外泌体可抑制人外周血单个核细胞分泌ifn-γ,内含有免疫相关microrna如mir301、mir22和mir-let-7a等,能促进人脐静脉内皮细胞网状结构形成和血管形成。血管新生是内皮细胞发生增殖和游走形成小血管的过程,k562细胞来源的外泌体mir-92可促进人脐静脉血管内皮细胞细胞的游走和管状结构形成,从而促进血管新生。如果外泌体能作用于人的肌肤促进血管生成,就会对皮肤输送营养,运输代谢废物,使得皮肤年轻化。
韩国科学家研究,脂肪干细胞及其分泌因子对紫外线诱导的皱纹具有除皱效果,并且除皱效果主要是通过减少中波紫外线b诱导的细胞凋亡和促进人成纤维细胞合成胶原蛋白达到的。
近年随着对皮肤美白的追求,越来越多的人使用美白护肤产品。皮肤中的黑色素由黑色素细胞合成,黑素通过渗透作用向相邻细胞扩散,在皮肤上形成颜色。颜色的深浅主要是由皮肤中黑色素的含量决定。黑素细胞内发生的生化反应过程:脂肪酸酪氨酸在酪氨酸酶的作用下,生成多巴醌,其在酶或非酶的氧化作用下,经红色素及无色色素转变为黑色素,此过程即为黑色素的主要成因。因此,阻碍或抑制该反应第一阶段中酪氨酸酶的作用,即可抑制黑素生成,探求能够阻碍或抑制酪氨酸酶作用的药物,对阻止或抑制因酪氨酸酶作用而生成的黑素而言极为重要。
本发明的目的在于提供一种干细胞产生高活性的外泌体在皮肤美白制剂中的应用。
技术实现要素:
本发明的第一技术方案为一种间充质干细胞来源的外泌体在皮肤美白制剂中的应用。
第二技术方案基于第一技术方案,其特征在于,所述间充质干细胞为人胎盘间充质干细胞。
第三技术方案基于第二技术方案,其特征在于,所述间充质干细胞为围产期人脐带或胎盘来源的间充质干细胞。
第四技术方案基于第三技术方案,其特征在于,所述外泌体浓度为800μg/ml以上。
第五技术方案基于第四技术方案,其特征在于,所述皮肤美白制剂为外敷的制剂或局部注射、水光微针注射的制剂。
第六技术方案基于第五技术方案,其特征在于,所述间充质干细胞用以下方法制备:
取足月剖腹产胎儿的胎盘,在无菌条件下从胎盘中将绒毛膜机械分离,用pbs冲洗去除红细胞,组织剪将绒毛膜剪成10-20mm3小的组织块,加入胶原酶消化液,37℃附近的温度磁力搅拌消化若干时间,取消化后的组织悬块100目滤网过滤后,加入装有少许1×pbs的离心管中,其剩余组织用胰蛋白酶再次37℃附近温度磁力搅拌消化若干时间,将消化悬浮物100目滤网过滤,收集滤液到离心管中加入血清终止消化,组织块几乎全被消化后离心分离,小心地弃去上清,收集离心获得的细胞,取少许细胞样品进行计数,以2×106/cm2接种至含10%fbs的dmem-lg培养基,在37℃附近的温度、饱和湿度、5%co2培养箱中培养若干天后首次换液,去除未贴壁细胞,以后隔一段时间换液一次,在显微镜下逐日观察细胞形态和生长情况,达到80%~90%融合时,消化细胞进行传代培养。
所述间充质干细胞外泌体用以下方法制备:
取人胎盘间充质干细胞培养的3-6代,用添加了10%胎牛血清的dmem培养基培养,待细胞融合率达到70-80%时,添加生物聚合材料,继续培养待细胞融合率达到90%,收集上清2000g离心20min除去细胞以及碎片等,再经0.22μm无菌滤膜过滤到离心管中,加入10%终浓度的聚乙二醇8000溶液,涡旋混匀后,4℃孵育过夜,4000g离心20min,倾倒上清,用原上清1/100-1/50体积的pbs液重悬沉淀,8%终浓度的聚乙二醇再次孵育1h,pbs液重悬沉淀。分装-80℃保存。
作为皮肤美白制剂,所获外泌体可以用于局部注射,或添加玻尿酸等成分后用微针注射,也可以外用涂抹于皮肤。
附图说明
图1为cs-no组人胎盘绒毛膜间充质干细胞的流式鉴定图;
图2为外泌体经10%聚丙烯酰胺凝胶电泳后的蛋白分布图;
图3外泌体经cd63+磁珠富集后的cd81表型鉴定图;
图4为外泌体包含细胞因子hgf和bfgf浓度图;
图5表示外泌体对细胞内黑色素含量的影响。
具体实施方式
下面将结合附图对本发明的实施方式做出详细说明。
胎盘间充质干细胞来源的外泌体的制备:
(1)人围产期间充质干细胞的分离培养与扩增:
取足月剖腹产胎儿的胎盘,在无菌条件下从胎盘中将绒毛膜机械分离。分离时注意防止有底蜕膜母体来源细胞污染。用pbs(磷酸缓冲盐溶液)冲洗去除红细胞。将绒毛膜组织剪成10-20mm3小的组织块,加入胶原酶消化液,37℃磁力搅拌消化30min。取消化后的组织悬块用100目滤网过滤后,加入装有少许1×pbs的离心管中。
过滤后的剩余组织用胰蛋白酶再次37℃磁力搅拌消化30min,将消化悬浮物100目滤网过滤,收集滤液到50ml离心管中加入血清终止消化,此时组织块几乎全被消化。3000rpm离心15min,小心地弃去上清,收集离心获得的细胞。取少许细胞样品进行计数,以2×106/cm2接种至含10%fbs的dmem-lg培养基,在37℃、饱和湿度、5%co2培养箱中培养,3天后首次换液,去除未贴壁细胞,以后每3~4天换液一次,在显微镜下逐日观察细胞形态和生长情况,达到80%~90%融合时,消化细胞进行传代培养。
(2)无外泌体血清培养基的制备
将胎牛血清于4℃,12000×g离心12小时后弃去沉淀,加入l-dmem培养基而获得无外泌体血清培养基。
(3)制备外泌体所需的间充质干细胞上清液
选择处于对数生长期的增殖能力强、状态好的第2-5代人胎盘间充质干细胞,以较高的起始细胞浓度接种至无外泌体血清培养基(dmem培养基)培养,待培养待细胞融合率达到90%。图1为cs-no组人胎盘绒毛膜间充质干细胞的流式鉴定图,细胞表型鉴定结果如图1所示,间充质干细胞cd73、cd90、cd105阳性,cd11b、cd19、hla-dr阴性。
收集上清2000g离心20min除去细胞以及碎片等,再经0.22μm无菌滤膜过滤到离心管中,加入10%终浓度的聚乙二醇8000溶液,涡旋混匀后,4℃12h,4000g离心20min,小心倾倒上清,1/100培养基体积的dpbs重悬沉淀,吸入1.5mlep管,再加入8%终浓度的聚乙二醇8000溶液4℃孵育1h,10000g离心10min,dpbs清洗沉淀表面,200ul重悬沉淀,分装-80℃保存。
作为对比,以下用传统超速离心法进行分离外泌体
传统超速离心法:4℃,2000×g,10min除去死细胞碎片杂质,0.22um无菌滤膜过滤上清液进一步除杂质。4℃,100000×g,120min超速离心,弃上清液,加入50μlpbs洗涤一遍,再次4℃,100000×g,120min超速离心。加入50μlpbs重悬,分装-80℃保存。
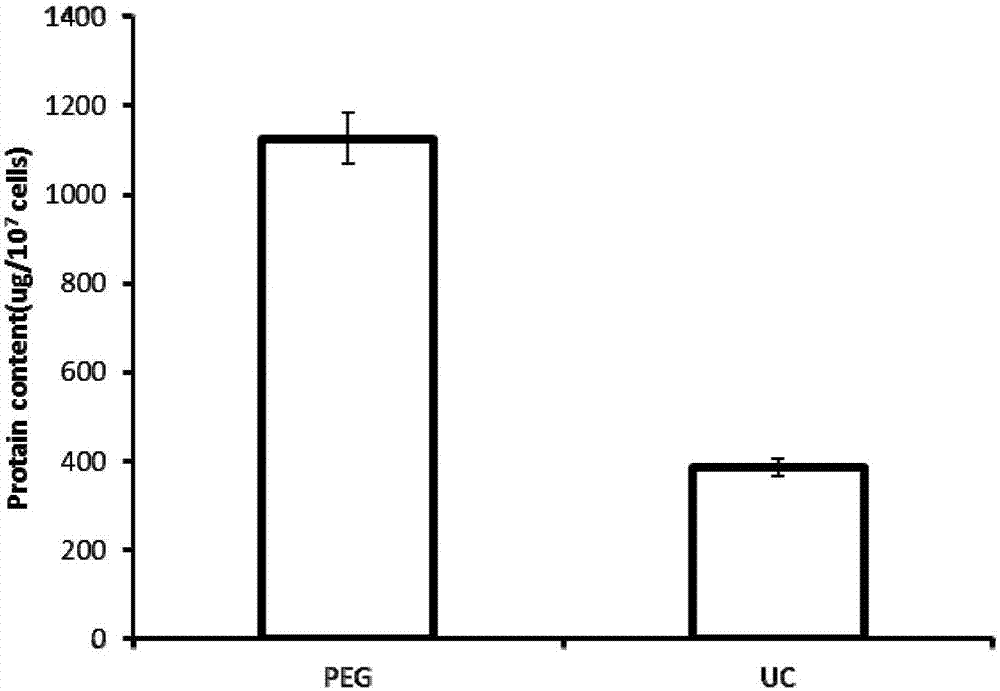
bca蛋白质试剂盒检测以上两种方法提取的外泌体的蛋白含量。聚乙二醇沉淀为peg,超速离心为uc。图2为外泌体经10%聚丙烯酰胺凝胶电泳后的蛋白分布图,如图所示,peg沉淀法所获得外泌体蛋白含量明显高于超速离心组。
以下对外泌体进行分析,分析所用的外泌体均为peg沉淀法所获得外泌体。
流式指标检测成功分离的胎盘间充质干细胞外泌体
采用一种包被cd63抗体的磁珠,该磁珠能与外泌体的膜表面的cd63抗原结合。cd63+磁珠200μl0.1%bsa溶液冲洗后置于磁极上1min,并丢弃上清液。除去磁极加入100μl分离纯化后的外泌体4℃冰箱搅拌过夜。加入300μl0.1%bsa清洗,移液枪吹打混匀。置于磁极上1min,丢弃上清。300ul分离缓冲液悬浮。将分装ep管中100ul0.1%bsa的pbs重悬的磁珠,分别加入2ul的cd81-pe,同时用同型igg1-pe作阴性对照。在室温下避光孵育45-60min,不时轻轻摇匀。经流式细胞仪检测cd81阳性表达率。
图3外泌体经cd63+磁珠富集后的cd81表型鉴定图,如图所示,cd81阳性表达率为85.3%。
elisa试剂盒检测外泌体包含细胞因子含量。
图4为外泌体包含细胞因子hgf和bfgf浓度图。如图所示,用本实施方式中的方法分离得到的外泌体包含较高的肝细胞生长因子(hgf)和碱性成纤维细胞生长因子(bfgf)。
通过流式指标检测成功分离的围产期间充质干细胞,结果显示本实施方式中的分离方法可以得到相对纯的间充质干细胞,参考国际细胞治疗协会提出的间充质干细胞表型方面的标准,cd73、cd90和cd105阳性率不低于95%;cd19、cd34、cd45、cd11b、hla-dr阳性率不高于2%;利用生物材料刺激人胎盘间充质干细胞,能有效提高一倍以上的外泌体的产量。本实施方式中的化学沉淀法提取制备的外泌体,采用bca蛋白定量法测得其蛋白浓度高达8000-12000μg/ml,远远高于文献报道的超速离心法。
通过磁珠富集后流式检测,制备的外泌体77.3%能被cd63+磁珠富集捕获,证明其纯度很高,流式检测对照组(exo)外泌体cd81阳性表达率为85.3%、cs-no环境下的获得外泌体(no-exo)cd81阳性表达率89.8%。
经过凝胶蛋白电泳检测发现,本实施方式中的化学沉淀法所获得外泌体并没有出现过多的杂蛋白,且exo和no-exo组蛋白分布结构并没有发生很大变化。
胎盘间充质干细胞分泌的外泌体美白功效评价
(1)外泌体对黑色素细胞增殖的影响
1)实验选4-5代的黑色素细胞。取对数生长期的细胞,0.25%胰酶消化,用黑色素细胞培养基调节细胞密度为1×104/ml,100μl加入96孔培养板中,每组均重复5孔。
2)12小时后培养基稀释外泌体成100、200、400、800、1600μg/ml的浓度,吸取原培养液弃掉,加入含不同浓度外泌体的100ul培养基加入每孔。
3)于37℃、5%co2恒温培养箱中培养24h。
4)加入10ulcck-8溶液。
5)在细胞培养箱内继续孵育2小时后酶联免疫检测仪在450nm测定吸光度。细胞存活率=(a实验组-a空白组)/(a对照组-a空白组)×100%。(2)外泌体对黑色素细胞内黑色素含量的影响
1)取对数期的黑色素细胞,弃去培养液,用pbs液清洗2次,24孔板培养。
2)培养12h,细胞贴壁。
3)将原来培养基移走,加入含有不同浓度外泌体的培养基。并设置对照组和空白对照组,每个浓度组设置3个复孔。于37摄氏度5%co2恒温培养箱中培养。
4)继续培养72h。
5)吸去培养液,pbs清洗细胞,用胰酶-edta消化细胞,将不同实验组的细胞收集到ep管中,以1000r/min离心5min弃上清液。
6)取100μl每个处理因素下的细胞加入200ul含10%二甲基亚砜(dmso)的naoh(1mol/l)溶液裂解细胞。
7)于65摄氏度水浴20min完全溶解黑色素颗粒。
8)酶标仪检侧490nm处吸光度。黑色素形成率=(b实验组-b空白组)/(b对照组-b空白组)×100%。结果除以细胞数,作为评价黑色素含量高低的指标。
图5表示外泌体对细胞内黑色素含量的影响;结果显示:800μg/ml的人围产期间充质干细胞外泌体能够抑制黑色素的合成,黑色素生成率是对照组的60%。
(3)外泌体对黑色素细胞内酪氨酸酶活性的影响
1)同步骤(2)中1)-5)。
6)各加入1%tritonx-100溶液200μl。
7)4℃下超声波破碎细胞。
8)吸取100μl转移至96孔板,每孔再加20μl质量分数为0.1%的左旋多巴溶液。
9)振摇5min后放入37℃培养箱孵育1h。
10)于分光光度计上测a490值。
酪氨酸活性率=(b实验组-b空白组)/(b对照组-b空白组)×100%。结果除以细胞数,作为评价酪氨酸酶活性高低的指标。400ug/ml的外秘体能较好抑制酪氨酸活性。
本实施方式中采用cck-8法测定人围产期间充质干细胞外泌体对人黑色素细胞生长的影响,结果显示人围产期间充质干细胞外泌体在≤800μg/ml时对人黑色素细胞无明显的抑制作用,镜下观察也无明显的死亡症状。实验组的细胞存活率与对照组相比,都没有出现显著的细胞死亡,但是在外泌体浓度为800μg/ml时,能够抑制黑色素的合成,抑制细胞内酪氨酸酶的活性,具有极佳的美白护肤潜力。
所获外泌体可以用于局部注射,或添加玻尿酸等成分后用微针注射,也可以外用涂抹于皮肤。
本实施方式提供的方法与现有技术方法相比的积极效果如下:
(1)人脐带、胎盘干细胞分泌的大量的外泌体。
(2)外泌体所包含的肝细胞生长因子(hgf)和碱性成纤维细胞生长因子(bfgf)含量增加,外泌体的活性提高。
(3)先后用10%、8%终浓度的聚乙二醇两次沉淀提取外泌体,与传统超速离心法相比较,提高了外泌体的产量,简化了提取工艺。
(4)应用广泛,既可以通过水凝胶组合物形式外敷,又可以生理盐水局部注射。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,这种变形均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!