NADPH在拮抗药物致线粒体毒性中的应用的制作方法
本发明属于药品或保健品领域,具体涉及nadph在拮抗药物致线粒体毒性中的应用。
背景技术:
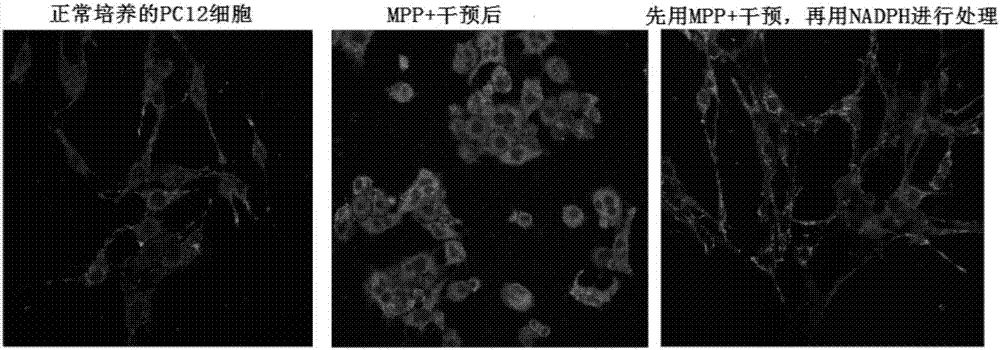
:线粒体是细胞生理活动中不可或缺的细胞器,线粒体主要负责atp的产生,相当于人体细胞的“发电厂”,为细胞所有的生理活动提供能量。大量研究表明,线粒体对细胞生长、增殖、分化和死亡等生命活动具有十分重要的调控作用。特别是在病理条件下,线粒体的功能状态很大程度上决定着细胞的存活与死亡。近年来,越来越多的研究表明,线粒体损伤是许多药物毒性作用的重要特征,并提示线粒体可能是药物毒性作用的重要靶标。自20世纪90年代以来,人们在研究抗病毒药物核苷酸转录酶抑制剂(nrtis)时发现,一些nrtis可显著抑制mtdna复制的多聚酶而阻断线粒体的复制,并导致多种组织细胞线粒体功能出现紊乱,从而引起肌肉毒性、肝脏毒性以及脂肪萎缩等不良反应。此后,大量的证据显示线粒体毒性可能是多种药物致靶器官毒性的主要原因,包括一些抗病毒药物、抗肿瘤药物、抗糖尿病药物、解热镇痛药物和抗生素等。任何通过直接或间接作用而破坏线粒体结构和功能的药物均可导致线粒体毒性,并有可能引起严重的靶器官毒性。由于药物在不同组织中可能存在生物转化、吸收及分布的差异,而且不同组织细胞线粒体本身结构和分布特征也有所不同,因此不同组织细胞对药物引起的线粒体毒性的敏感性可能存在较大差异。一般而言,药物诱导的线粒体毒性最容易出现在肝脏,这可能与肝脏代谢及肝脏血流丰富有关。此外,体内一些高耗能器官也易于出现线粒体损伤,如心脏、中枢神经系统和肾脏等。与细胞内的其他细胞器相比,线粒体对药物诱导的毒性可能更为敏感。药物诱导的线粒体损伤主要包括结构改变和功能紊乱。线粒体结构改变可表现为线粒体肿胀、内膜和/或外膜完整性破坏甚至出现膜溶解、线粒体嵴断裂以及大量空泡化等。线粒体结构破坏往往伴随着功能紊乱,表现为线粒体呼吸链复合物酶抑制、电子传递受阻、线粒体耗氧量改变以及线粒体通透性转运孔呈不可逆地开放,从而导致线粒体膜电位下降和atp合成减少,最终可能迅速引起细胞坏死或凋亡。有研究表明,线粒体功能紊乱有可能是一些药物诱导靶器官细胞死亡的重要诱因。以阿霉素(doxorubicin,dox)为例,dox是一种临床常用的高效抗肿瘤药物,但存在严重的心脏毒性。心肌线粒体损伤是dox心脏毒性的重要特征,可表现为心肌细胞线粒体功能和形态学改变、线粒体膜电位丧失、线粒体生成抑制、ros大量形成以及mnsod和bax/bcl-2等线粒体基因与蛋白表达改变等。体外试验研究结果表明,dox可显著诱导心肌细胞线粒体功能紊乱,是心肌细胞死亡发生的早期重要事件。这些研究提示,线粒体是药物毒性的重要靶标,可能在介导靶器官毒性中发挥着关键作用。此外,其他的可致线粒体毒性的药物如:真菌毒素3-nitropropionicacid(3-np)能抑制线粒体呼吸酶复合物ii,摄入人体后能够造成大脑纹状体透射神经元退变,产生类似以亨廷顿舞蹈病样的神经病理损害和症状;mptp,中文全称为1-甲基-4-苯基-1,2,3,6-四氢吡啶,它是线粒体呼吸酶复合物i的抑制剂,摄入人体后可以透过血脑屏障,mpp+为其代谢后的活性形式,转运进入多巴胺神经元后,造成大脑中脑黑质多巴胺神经元的退变,产生运动功能失调的症状;鱼藤酮是一种常用的杀虫剂,但由于其抑制线粒体呼吸酶复合物ii,摄入人体后可以造成大脑皮层、纹状体神经元退变和中枢炎症反应,主要损伤中脑黑质多巴胺神经元;cccp中文全称为羰基氰化物间氯苯腙,作为一种氧化磷酸化解偶联剂抑制线粒体电子传递链,摄入人体后导致大脑细胞凋亡。因此,研究对药物致线粒体毒性具有拮抗作用的药品具有重要意义。还原型烟酰胺腺嘌呤二核苷酸磷酸(triphosphopyridinenucleotide,nadph)由葡萄糖经过磷酸戊糖途径(ppp)代谢产生,作为细胞内最为重要的电子供体和生物合成的还原剂,可为还原性生物合成提供氢离子。nadph是谷胱甘肽(gsh)的还原酶的辅酶,可使氧化型谷胱甘肽(gssg)生成还原型gsh,维持还原型的gsh的正常含量。gsh是细胞内重要的抗氧化剂,可保护一些含巯基的蛋白质、脂肪和蛋白酶类免受氧化剂的破坏,特别在维持红细胞膜的完整性方面起着重要作用。nadph除了参与胆固醇、脂肪酸、单加氧酶系、类固醇激素等的生物合成,还参与体内羟化反应和药物、毒物及某些激素的生物转化。例如,nadph可利用解毒细胞的电子供体,通过体内代谢减少生物体氧化型化合物,维持其氧化还原的平衡,在氧化防御系统发挥重要作用。nadph也可以借助于异柠檬酸穿梭作用进入呼吸链产生atp:由于线粒体内膜对物质的通透性很低,线粒体外产生的nadph不能直接进入呼吸链被氧化。nadph上的h可以在异柠檬酸脱氢酶的作用下被交给nad+,然后由nad+进入呼吸链产生能量。细胞能量代谢的维持和减少ros(活性氧簇)对细胞生存,特别对缺血缺氧的组织至关重要,普遍认为能量代谢障碍和氧化应激是心脑缺血疾病的重要机制。研究表明增加细胞能量代谢能力,降低细胞ros产生可减轻缺血缺氧引起的细胞损伤。目前,尚无nadph拮抗药物致线粒体毒性的报道。技术实现要素:为此,本发明提供nadph在制备拮抗药物致线粒体毒性的药品中的应用。本发明还提供nadph在拮抗药物致线粒体毒性中的应用。优选地,本发明上述应用,所述药物不包括羰基氰化物间氯苯腙(cccp)。进一步优选地,本发明上述应用,所述药物选自1-甲基-4-苯基-1,2,3,6-四氢吡啶(mptp)、mpp+、鱼藤酮中的至少一种。进一步优选地,本发明上述应用,所述药品包括药学上有效量的nadph和药学上可接受的载体。进一步优选地,本发明上述应用,所述载体选自常用的药用辅料、生理盐水、蒸馏水中的至少一种。进一步优选地,本发明上述应用,所述药品为nadph按照常规工艺,加入常规辅料制成临床上可接受的片剂、胶囊剂、散剂、合剂、丸剂、颗粒剂、糖浆剂、贴膏剂、栓剂、气雾剂、软膏剂或注射剂。所述药学上可接受的辅料为:填充剂、崩解剂、润滑剂、助悬剂、粘合剂、甜味剂、矫味剂、防腐剂、基质等。填充剂包括:淀粉、预胶化淀粉、乳糖、甘露醇、甲壳素、微晶纤维素、蔗糖等;崩解剂包括:淀粉、预胶化淀粉、微晶纤维素、羧甲基淀粉钠、交联聚乙烯吡咯烷酮、低取代羟丙纤维素、交联羧甲基纤维素纳等;润滑剂包括:硬脂酸镁、十二烷基硫酸钠、滑石粉、二氧化硅等;助悬剂包括:聚乙烯吡咯烷酮、微晶纤维素、蔗糖、琼脂、羟丙基甲基纤维素等;粘合剂包括,淀粉浆、聚乙烯吡咯烷酮、羟丙基甲基纤维素等;甜味剂包括:糖精钠、阿斯帕坦、蔗糖、甜蜜素、甘草次酸等;矫味剂包括:甜味剂及各种香精;防腐剂包括:尼泊金类、苯甲酸、苯甲酸钠、山梨酸及其盐类、苯扎溴铵、醋酸氯乙定、桉叶油等;基质包括:peg6000、peg4000、虫蜡等。进一步优选地,本发明上述应用,所述药品的给药方式选自口服给药、注射给药、舌下给药、直肠给药、经皮给药、喷雾吸入中的至少一种。本发明还提供nadph在制备线粒体保护剂中的应用。优选地,本发明上述应用,所述线粒体保护剂用于延缓细胞衰老、消除因线粒体损伤导致的亚健康状态和延缓神经退行性疾病。所述神经退行性疾病选自亨廷顿舞蹈病、血管性痴呆,路易小体病伴额叶痴呆、肌萎缩侧束硬化症和多发性硬化症。本发明的技术方案具有如下优点:(1)本发明通过研究发现,nadph对由mptp、鱼藤酮引起的线粒体损伤有保护作用,并通过此作用发挥神经保护作用,但对cccp引起的线粒体损伤没有保护作用,从而可以用于涉及线粒体功能失常的衰老、亚健康和亨廷顿舞蹈病、血管性痴呆,路易小体病伴额叶痴呆、肌萎缩侧束硬化症和多发性硬化症等神经退行性疾病的防治;(2)本发明通过研究还发现,nadph维护线粒体膜电位,降低线粒体产生自由基,通过线粒体保护作用,维护神经元免受环境毒素介导的损伤,给予nadph能降低神经元死亡率,遏制神经退行性疾病进展,即:nadph是一个有效的线粒体保护药物,这将为具有线粒体损伤特征的细胞衰老、亚健康和某些神经退行性疾病的病理机制研究和治疗提供新的思路和策略。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍:图1为本发明实验例1中nadph对mpp+干预的pc12细胞线粒体膜电位的影响;图2为本发明实验例1中nadph对鱼藤酮干预的pc12细胞线粒体膜电位的影响;图3为本发明实验例1中nadph对cccp干预的pc12细胞线粒体膜电位的影响;图4为本发明实验例1中nadph对mpp+干预的pc12细胞活性的影响,其中*表示与mpp+模型组相比,p<0.05;图5为本发明实验例1中nadph对鱼藤酮干预的pc12细胞活性的影响,其中*表示与鱼藤酮模型组相比,p<0.05;图6为本发明实验例1中nadph对cccp干预的pc12细胞活性的影响;图7为本发明实验例3中nadph对mptp小鼠黑质区da神经元的影响;图8为本发明实验例3中小鼠中脑免疫组化图的定量分析结果,其中*表示与模型对照组相比,p<0.05;图9为本发明实验例3中nadph对mptp小鼠纹状体区th的影响;图10为本发明实验例3中小鼠纹状体免疫组化图的定量分析结果,其中*表示与模型对照组相比,p<0.05;图11为本发明实验例3中nadph对中脑th蛋白表达的影响;图12为本发明实验例3中小鼠中脑th蛋白表达的定量分析结果,p<0.05,其中*表示与模型对照组相比,p<0.05;图13为本发明实验例3中nadph对mptp模型小鼠纹状体th蛋白表达量的影响;图14为本发明实验例3中小鼠纹状体th蛋白表达的定量分析结果,其中*表示与模型对照组相比,p<0.05。具体实施方式本发明以下实施例和实验例中,nadph可以通过人工合成、半合成或生物提取获得;mptp指的是:1-甲基-4-苯基-1,2,3,6-四氢吡啶,mpp+为其代谢后的活性形式;cccp指的是:羰基氰化物间氯苯腙。实施例1nadph胶囊剂的制备本实施例nadph胶囊剂的组成为:nadph20g,助悬剂微晶纤维素60g,防腐剂叔丁基-4-羟基苯甲醚0.04g,润滑剂硬脂酸镁2g,填充剂乳糖加至200g。其制备方法包括以下步骤:分别称取上述处方量的nadph和各药用辅料,混合均匀,60目筛过筛3次,装入胶囊壳,即得。实验例1nadph减少mptp的体内活性形式mpp+及鱼藤酮对pc12细胞的损伤实验1、实验目的研究nadph对mptp的体内活性形式mpp+、鱼藤酮及cccp对pc12细胞的损伤的影响。2、实验方法2.1实验材料分化型pc12细胞系,购自中科院上海细胞所。2.2实验方法2.2.1pc12细胞予mpp+、鱼藤酮体外模型的建立pc12细胞以10%胎牛血清dmem培养,mpp+5mm或鱼藤酮500nm或cccp10m干预24h造模。2.2.2给药方法nadph分别10μm、30μm或100μm在mpp+干预前1h加入,cck-8法检测细胞活力。mpp+干预24h后,每孔100μl细胞培养液中加入cck-8显色剂10μl,放至37℃培养箱孵育2.5h,450nm测光吸收值。2.2.3mpp+或鱼藤酮干预的pc12细胞线粒体膜电位检测jc-1是一种广泛用于检测线粒体膜电位δψm的理想荧光探针,可以检测细胞的线粒体膜电位。在线粒体膜电位较高时,jc-1聚集在线粒体的基质,发出红色荧光;线粒体膜电位较低时,jc-1不能聚集在线粒体的基质中,则发出绿色荧光。pc12细胞干预方法同前述,nadph100μm在mpp+或鱼藤酮或cccp干预前1h加入,6孔板每孔加入荧光染料jc-1工作液1ml,充分混匀。细胞培养箱中37℃孵育20分钟,37℃培养箱内孵育30min。37℃孵育结束后,吸除上清,用jc-1染色缓冲液(1x)洗涤2次,加入2ml细胞培养液,激光共聚焦显微镜下观察或用流式细胞仪进行分析。2.2.4数据统计与分析数据均以均数±sd(mean±sd)表示,统计分析采用单因素方差分析(one-wayanova),p<0.05为统计学差异有显著性。3、实验结果nadph对mpp+干预的pc12细胞线粒体膜电位的影响如图1所示。由图1可知,在正常培养的pc12细胞,jc-1荧光染色呈现红色,mpp+干预后线粒体膜电位下降,呈现绿色;nadph能够提升线粒体膜电位水平,使绿色荧光减少。nadph对鱼藤酮干预的pc12细胞线粒体膜电位的影响如图2所示。由图2可知,在正常培养的pc12细胞,jc-1荧光染色呈现红色,鱼藤酮干预后线粒体膜电位下降,呈现绿色;nadph能够提升线粒体膜电位水平,使绿色荧光减少。nadph对cccp干预的pc12细胞线粒体膜电位的影响如图3所示。由图3可知,在正常培养的pc12细胞中,jc-1为聚集体,荧光染色呈现红色,cccp干预后线粒体膜电位下降,jc-1为单体,呈现绿色,其荧光强度比值可反映细胞膜电位高低;而nadph对cccp引起的膜电位下降并没有明显作用。nadph对mpp+干预的pc12细胞活性的影响如图4所示。由图4可知,应用nadph后,中、高剂量组可以抑制mpp+引起细胞活力下降(p<0.05)。nadph对鱼藤酮干预的pc12细胞活性的影响如图5所示。由图5可知,应用nadph后,中、高剂量组可以抑制鱼藤酮引起细胞活力下降(p<0.05)。nadph对cccp干预的pc12细胞活性的影响如图6所示。由图6可知,应用nadph后,对cccp引起的细胞活力下降(p<0.05)并无明显作用。4、实验结论(1)nadph对mpp+或鱼藤酮干预的pc12细胞的线粒体膜电位具有显著升高作用,对mpp+或鱼藤酮引起的细胞活力下降具有显著抑制作用;这表明nadph可以减少mptp的体内活性形式mpp+及鱼藤酮引起的pc12细胞的损伤;(2)nadph对cccp干预的pc12细胞的线粒体膜电位的下降无明显作用,对cccp引起的细胞活力下降无明显作用;这表明cccp引起的pc12细胞的损伤,nadph无明显作用。实验例2nadph减少mptp对小鼠中脑神经元线粒体损伤1、实验目的研究nadph对mptp模型小鼠中脑神经元线粒体损伤的影响。2、实验方法2.1实验材料与实验环境清洁级雄性c57bl/6小鼠,质量25~30g,雄性,苏州大学实验动物中心提供,实验动物生产许可证号:xcyk(苏)2002-2008,实验动物使用许可证号:syxk(苏)2002-0037。室温22℃,湿度50-60%,通风良好,人工昼夜(12h/12h),自由摄食摄水。实验前,将小鼠在饲养环境中适应2天。2.2实验分组取c57bl/6小鼠,随机分为5组,分别为:正常对照组、模型对照组、实验组1-3组。2.3mptp小鼠中脑神经元损伤模型的建立模型对照组给予mptp30mg/kg腹腔注射,每天1次,连续注射5天;实验组1-3组分别给予2.5mg/kgnadph、5mg/kgnadph、10mg/kgnadph腹腔注射,在随后21天内每天注射2次,术后将动物置于放有清洁垫料的饲养盒中,自由饮水、进食;正常对照组给予等体积的生理盐水。2.4nadph对mptp模型小鼠中脑组织线粒体组分atp酶活性的影响21天后,将小鼠处死后分离出中脑成分,加入线粒体分离试剂盒匀浆,600g,4℃离心10分钟,把上清转移到另一离心管中,在11000g,4℃离心10分钟,弃上清,沉淀即为分离得到的细胞线粒体。取线粒体组分悬液按照南京建成生物工程研究所提供的atp检测试剂盒操作,检测中脑线粒体成分中na+-k+-atpase,ca2+-mg2+-atpase的活性。2.5nadph对mptp模型小鼠中脑组织线粒体组分sod、mda的影响小鼠中脑成分线粒体分离步骤同前述,脑组织线粒体组分悬液中蛋白质含量测定均采用考马斯亮蓝法,使用南京建成生物工程研究所提供的sod、mda检测试剂盒进行检测。2.6数据统计与分析数据均以均数±sd(mean±sd)表示,统计分析采用单因素方差分析(one-wayanova),p<0.05为统计学差异有显著性。3、实验结果nadph对mptp模型小鼠中脑组织线粒体组分atp酶活性的影响如表1所示。表1nadph对mptp模型小鼠中脑组织线粒体组分atp酶活性的影响由表1可知,和正常对照组比较,模型对照组中脑线粒体组分na+-k+-atpase和ca2+-mg2+-atpase的活性明显降低,实验组2-3组的atp酶活性部分恢复。nadph对mptp模型小鼠中脑组织线粒体组分sod、mda的影响如表2所示。表2nadph对mptp模型小鼠中脑组织线粒体组分sod、mda的影响组别sod/u·mg-1promda/μmol·mg-1pro正常对照组199.23±20.721.56±0.20模型对照组110±9.224.22±0.34实验组1组121±21.184.05±0.23实验组2组135±14.31*3.11±0.69*实验组3组147±23.02*2.35±0.44*由表2可知,与正常对照组比较,模型对照组中的脑线粒体组分mda含量明显增高、sod活性下降,实验组2-3组的mda含量降低,sod活性上调。4、实验结论nadph能够部分恢复对mptp模型小鼠中脑神经元线粒体组分atp酶活性,使其mda含量降低和sod活性上调。这表明,nadph可以减少mptp对小鼠中脑神经元线粒体的损伤。实验例3nadph减少mptp对中脑神经元的损伤实验1、实验目的研究nadph对mptp对中脑神经元的损伤的影响。2、实验方法2.1实验材料与实验环境同实验例22.2实验分组同实验例22.3mptp小鼠中脑神经元损伤模型的建立同实验例22.4免疫组化方法21天后小鼠以4%戊巴比妥钠麻醉,顺序灌注pbs(ph值7.4)和4%多聚甲醛(ph值7.4),灌流后鼠脑在4%多聚甲醛中后固定6h,冰冻切片机制备中脑、纹状体脑片(40μm)。0.5%tritonx-100透膜,5%山羊血清封闭,酪氨酸羟化酶抗体(1:2000)一抗孵育过夜,生物素二抗(1:500),abc法用于检测抗原(1:100)(),dab染色拍片。中脑40μm每连续4张取一张脑片,使用立体计数仪分析中脑黑质区神经元数量;纹状体脑片dab染色后计算光密度值。2.5westernblot方法小鼠处死后中脑、纹状体取材,超声波裂解,蛋白定量;配制8%sds-page,上样,电压积层胶70v、分离胶100v;电泳结束后恒流0.3a,2.5h,采用湿转法将样品转移至nc膜。nc膜用含5%脱脂奶粉的tbst中室温下封闭1h,th一抗4℃过夜。荧光二抗室温孵育1h后odyssey显影压片。2.6数据统计与分析数据均以均数±sd(mean±sd)表示,统计分析采用单因素方差分析(one-wayanova),p<0.05为统计学差异有显著性。3、实验结果nadph对mptp小鼠黑质区da神经元的影响如图7所示,小鼠中脑免疫组化图的定量分析结果如图8所示。由图7和图8可知,th免疫组化染色发现,模型对照组小鼠的黑质区da神经元数量明显减少;实验组2、3组小鼠的黑质区da神经元的损伤显著减轻。nadph对mptp小鼠纹状体区th的影响如图9所示,小鼠纹状体免疫组化图的定量分析结果如图10所示。由图9和图10可知,th免疫组化染色发现,模型对照组小鼠的纹状体区th明显丢失;实验组2、3小鼠的组纹状体区的th光密度值显著增加。nadph对中脑th蛋白表达的影响如图11所示,小鼠中脑th蛋白表达的定量分析结果如图12所示。由图11和图12可知,模型对照组小鼠的中脑th蛋白表达明显减少;实验组2、3小鼠的中脑th蛋白表达量显著上调。nadph对mptp模型小鼠纹状体th蛋白表达量的影响如图13所示,小鼠纹状体th蛋白表达的定量分析结果如图14所示。由图13和图14可知,模型对照组小鼠的纹状体th蛋白表达明显减少;实验组3组小鼠的纹状体th蛋白表达量显著上调。显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1