紫檀茋在制备抗动脉粥样硬化药物中的应用的制作方法
本发明属于动脉粥样硬化药物研究技术领域,具体涉及紫檀茋在制备抗动脉粥样硬化药物中的应用。
背景技术:
动脉粥样硬化(as)是一种在动脉及其分支的动脉血管壁内膜下有大量血脂附着,伴有血管壁内膜增厚,形成黄色形状像粥一样斑块的动脉类疾病。血脂异常,尤其是血清中的总胆固醇指数或高密度脂蛋白胆固醇指数等上升,是引发as病变的重要因素,积极控制血脂上升在一定程度上可以减少as的发病几率。通常意义上血脂指的是血液中所包含的脂类物质总称,其中包括总胆固醇指数(tc),甘油三酯指数(tg),低密度脂蛋白胆固醇(ldl-c)指数,高密度脂蛋白胆固醇(hdl-c)指数等。血液中的胆固醇和tg与体内特殊蛋白质即载脂蛋白结合成脂蛋白后,才可以在血浆中相容并进行血脂的转运和代谢。有研究调查证明ldl-c指数是诱发as早期阶段的最重要脂类因素。尽管大多数西方国家的血脂水平和血脂异常率尚且高于国内的指数,但伴随着社会经济的迅猛提升,国人生活水平的提高和生活中不良习惯的增加,平均血清tc水平近年逐步升高,导致我国as发病率逐年攀升,已成为严重危害人民健康的主要疾病。
在人体抗氧化防御体系中,超氧化物歧化酶(sod)作为一种活性物质,具抗氧化作用,可以缓解机体组织自由基的积累和减轻过氧化的损伤。脂质过氧化代谢过程中,丙二醛(mda)是脂质过氧化代谢的一种终产物,对机体有毒性,实验及检测中,常参考其含量,进而了解机体脂质发生过氧化的情况。mda水平升高,提示脂质过氧化加剧;而sod活性降低,反映机体抗氧化功能下降,最终会导致的结果是组织细胞的损伤甚至死亡。因此,为了避免组织细胞的氧化性损伤,保持合适的sod活性,并且降低mda的水平很有必要。
紫檀茋(pte)又名蝶茋,是一种天然活性成分,属于白藜芦醇衍生物,是葡萄、蓝莓、血竭制品、印度吉纳树及印度抗糖尿病草药“bijasar”中的重要活性成分。pte已报道具有多种生物活性,如:对白色念珠菌的生物膜产生体外抑制作用;对神经细胞模型的产生保护作用;具有抵抗多种恶性肿瘤的作用;对人体肺腺癌a549细胞系增值及凋亡的影响;对局灶性脑缺血的保护作用等。迄今为止,尚未见以pte对as进行治疗的报道。
技术实现要素:
本发明要解决的技术问题是提供紫檀茋在制备抗动脉粥样硬化药物中的应用。
为解决上述技术问题,本发明采用如下技术方案:
本发明所述紫檀茋能够调节as家兔模型血脂水平,提高sod活性,降低mda含量。所述紫檀茋的结构式如图8所示。
本发明所采用的实验方法:
1、分组及给药。
用统计学的方法对60只家兔进行按tc随机分组,分成六组,正常对照组,as模型组,pte高、中、低剂量组,阳性对照药阿伐他汀(ato)组。正常对照组喂养普通饲料,其余各组喂养高脂饲料。饲养一月后,各给药组按实验设计给予相应剂量药物,模型组给予0.5%cmc-na,持续8周。
2、家兔的解剖及样品采集处理。
对家兔进行动脉取血,离心取血清。用解剖刀解剖家兔,用镊子把整个血管剥离出来,放入4%多聚甲醛中固定。血样和组织样本于超低温冷冻箱保存。
3、tc、tg、hdl-c、ldl-c含量测定。
按照相关试剂盒,检测4种脂类物质含量。结果显示随着紫檀茋剂量的升高,高血脂症动物血液中的四种脂类物质均下降,说明该药物在降低血脂方面具有很显著的功效,且存在剂量依赖效应。
4、组织形态学观察。
主动脉4%多聚甲醛固定24h,常规石蜡包埋切片,he染色,后在光镜下作病理学检查。结果显示pte能显著减轻和改善高脂饮食造成的主动脉组织病理变化。
5、sod的活力测定。
用sod检测试剂盒检测家兔动脉组织sod活性。结果显示pte能够提升sod活力,说明pte能显著提升主动脉组织抗氧化系统活性,。
6、mda含量测定。
用mda检测试剂盒检测家兔动脉组织匀浆中的mda含量。结果显示pte能够降低mda含量。说明pte能有效降低主动脉组织氧化应激水平,从而发挥抗as作用。
7、数据处理与统计分析。
本实验采用统计软件spss13.0进行数据分析,以mean.±sd表示。选用one-wayanova结合post-hoc(lsd法)方法进行组间差异分析。以p<0.05表示统计学差异显著性
有益效果:
1、本发明提供的紫檀茋,能够以剂量依赖性的方式降低as家兔模型血脂水平,减轻和改善高脂饮食造成的主动脉组织病理变化,诱导sod活性提高,抑制mda含量上升,因而为as提供了一类新型治疗药物。
2、由于紫檀茋为天然小分子化合物,可以通过提取或直接化学合成的方法获得,因而生产成本较低,有利于工业化生产。
附图说明
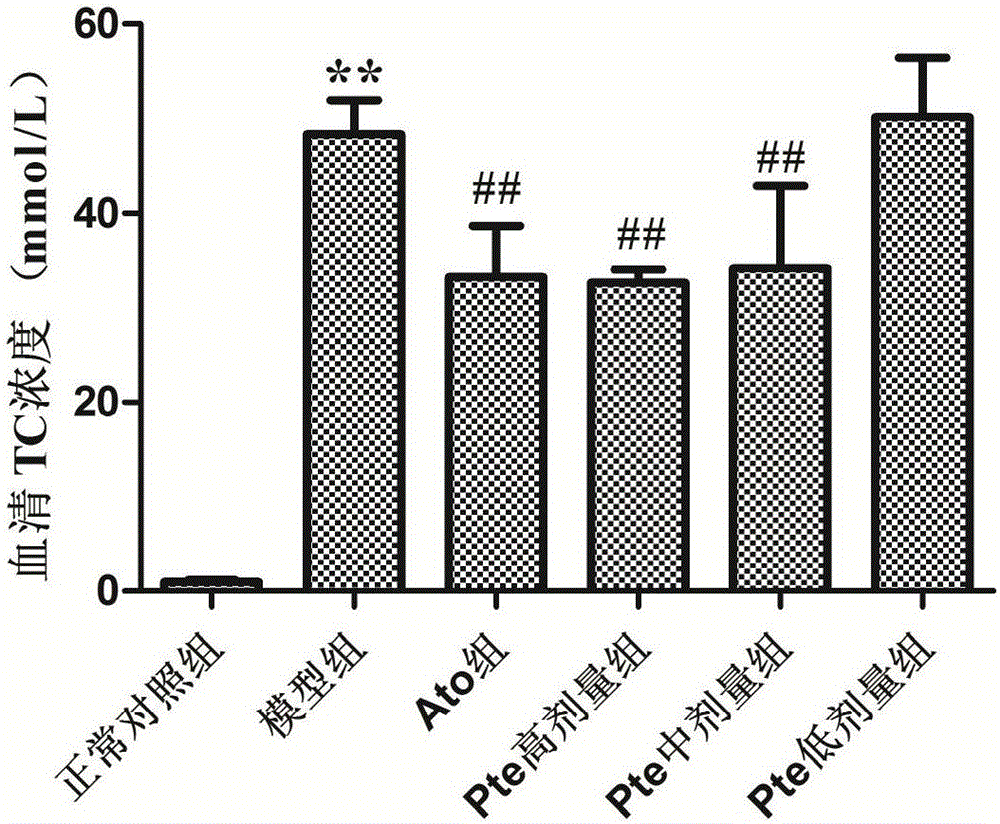
图1是实施例4所述紫檀茋给药后as家兔血清tc水平变化情况,图中,正常对照组;以正常饲料喂养的家兔组;as模型组:以高脂饲料喂养的家兔组;ato组:给予阳性对照药ato的高脂饲料喂养的家兔组;pte高剂量组:给予pte20mg/kg的高脂饲料喂养的家兔组;pte中剂量组:给予pte10mg/kg的高脂饲料喂养的家兔组;pte低剂量组:给予pte5mg/kg的高脂饲料喂养的家兔组。
图2是实施例5所述紫檀茋给药后as家兔血清tg水平变化情况,图中,正常对照组;以正常饲料喂养的家兔组;as模型组:以高脂饲料喂养的家兔组;ato组:给予阳性对照药ato的高脂饲料喂养的家兔组;pte高剂量组:给予pte20mg/kg的高脂饲料喂养的家兔组;pte中剂量组:给予pte10mg/kg的高脂饲料喂养的家兔组;pte低剂量组:给予pte5mg/kg的高脂饲料喂养的家兔组。
图3是实施例6所述紫檀茋给药后as家兔血清ldl-c水平变化情况,图中,正常对照组;以正常饲料喂养的家兔组;as模型组:以高脂饲料喂养的家兔组;ato组:给予阳性对照药ato的高脂饲料喂养的家兔组;pte高剂量组:给予pte20mg/kg的高脂饲料喂养的家兔组;pte中剂量组:给予pte10mg/kg的高脂饲料喂养的家兔组;pte低剂量组:给予pte5mg/kg的高脂饲料喂养的家兔组。
图4是实施例7所述紫檀茋给药后as家兔血清hdl-c水平变化情况,图中,正常对照组;以正常饲料喂养的家兔组;as模型组:以高脂饲料喂养的家兔组;ato组:给予阳性对照药ato的高脂饲料喂养的家兔组;pte高剂量组:给予pte20mg/kg的高脂饲料喂养的家兔组;pte中剂量组:给予pte10mg/kg的高脂饲料喂养的家兔组;pte低剂量组:给予pte5mg/kg的高脂饲料喂养的家兔组。
图5是实施例8所述紫檀茋给药后as家兔主动脉组织病理形态学变化情况,图中,正常对照组;以正常饲料喂养的家兔组;as模型组:以高脂饲料喂养的家兔组;ato组:给予阳性对照药ato的高脂饲料喂养的家兔组;pte高剂量组:给予pte20mg/kg的高脂饲料喂养的家兔组;pte中剂量组:给予pte10mg/kg的高脂饲料喂养的家兔组;pte低剂量组:给予pte5mg/kg的高脂饲料喂养的家兔组。
图6是实施例9所述紫檀茋给药后as家兔主动脉组织sod活性变化情况,图中,正常对照组;以正常饲料喂养的家兔组;as模型组:以高脂饲料喂养的家兔组;ato组:给予阳性对照药ato的高脂饲料喂养的家兔组;pte高剂量组:给予pte20mg/kg的高脂饲料喂养的家兔组;pte中剂量组:给予pte10mg/kg的高脂饲料喂养的家兔组;pte低剂量组:给予pte5mg/kg的高脂饲料喂养的家兔组。
图7是实施例10所述紫檀茋给药后as家兔主动脉组织mda水平变化情况,图中,正常对照组;以正常饲料喂养的家兔组;as模型组:以高脂饲料喂养的家兔组;ato组:给予阳性对照药ato的高脂饲料喂养的家兔组;pte高剂量组:给予pte20mg/kg的高脂饲料喂养的家兔组;pte中剂量组:给予pte10mg/kg的高脂饲料喂养的家兔组;pte低剂量组:给予pte5mg/kg的高脂饲料喂养的家兔组。
图8是紫檀茋的结构式。
具体实施方式
以下结合实施例对本发明作进一步说明。下属实施例中,凡未注明具体实验条件的,均为按照本领域技术人员熟知的常规条件及实验步骤,或按照制造厂商所建议的条件及实验步骤,这些实施例仅用于例证的目的,决不限于本发明的保护范围。
实施例1:分组
随机挑选60只健康雄性家兔(新西兰白耳雄兔,安徽医科大学实验动物中心提供),分别对其进行标记,称重记录,取血,离心,取血清。按血清tc测定试剂盒(南京建成)测定血清tc后,对60只家兔进行随机分组,分成六组,设正常对照组、as模型组、ato(sigma)组(5mg/kg)、pte(杭州瑞树生化有限公司)高、中、小剂量组(20、10、5mg/kg),共6组,每组10只。
实施例2:造模及给药
正常对照组给予普通饲料,as模型组和各给药组给予高脂饲料(含5%猪油和1%胆固醇)。4周后,各给药组家兔除给予高脂饲料外,每天按实验设计剂量灌胃给予相应剂量的药物,药物采用0.5%cmc-na混悬。正常对照组和as模型组大鼠则灌胃给予等体积0.5%cmc-na,每天1次,共8周。实验过程中,每周称量体重1次,按体重变化调整给药量。
实施例3:家兔的解剖及样品采集处理
1、对家兔依次进行动脉取血,对血样进行离心,取血清。然后注射麻醉剂,待其麻醉后,对耳缘静脉推入空气针,使其致死。用解剖刀解剖家兔,用镊子把整个血管剥离出来,放入4%多聚甲醛中固定。将采集到的血样和组织样本放到超低温冷冻箱保存,待到检测的时候取出。
2、血液样本处理:将保存的血清从超低温冷冻箱取出,用碎冰机准备好碎冰放在泡沫盒中保存血清样本,用移液枪按tc,tg,hdl-c,ldl-c等四项指标测定试剂盒(南京建成)说明书要求用酶标仪检测四项指标。
3、组织样本处理:将保存的血管组织样本从超低温冷冻箱取出,用碎冰机准备好碎冰放在泡沫盒中保存组织样本,按照试剂盒要求匀浆主动脉组织,用酶标仪检测mda和sod两项指标(江苏碧云天生物技术有限公司)。
蛋白质浓度的检测:由于检测组织中sod和mda活性和含量,组织块有大有小,需用到测试时匀浆液蛋白浓度去校正检测结果,使用bca蛋白浓度测定试剂盒检测(江苏碧云天生物技术有限公司)。
苏木精-伊红(he)染色:取主动脉组织样品,4%多聚甲醛固定24小时,常规石蜡包埋切片,用he染色,并在光学显微镜下作病理学检查。
实施例4:tc测定
本实施例用来测定家兔血清tc水平。按照tc测定试剂盒(南京建成生物工程研究所)说明书操作步骤,如表1表添加试剂,充分混匀后37℃孵育10分钟,波长510nm,酶标仪测定各孔吸光度值。
表1微量血清中tc/tg检测步骤
计算公式:tc含量(mmol/l)=(样本od值-空白od值)/(校准od值-空白od值)×校准品浓度
实验结果(图1)显示:与正常对照组相比,as模型组血清tc水平显著升高(p<0.01);与as模型组相比,pte高、中剂量组和ato组血清tc水平显著降低(p<0.01)。
实施例5:tg测定
本实施例用来测定家兔血清tg水平。按照tg测定试剂盒(南京建成生物工程研究所)说明书操作步骤,如表1添加试剂,充分混匀后37℃孵育10分钟,波长510nm,酶标仪测定各孔吸光度值。
计算公式:tg含量(mmol/l)=(样本od值-空白od值)/(校准od值-空白od值)×校准品浓度
实验结果(图2)显示:与正常对照组相比,as模型组血清tg水平显著升高(p<0.01);与as模型组相比,pte高、中剂量组和ato组血清tg水平显著降低(p<0.05或p<0.01)。
实施例6:ldl-c测定
本实施例用来测定家兔血清ldl-c水平。按照ldl-c测定试剂盒(南京建成生物工程研究所)说明书操作步骤,如表2添加试剂,充分混匀后于波长546nm,酶标仪测定各孔吸光度值。
计算公式:ldl-c含量(mmol/l)=[(样本a2-样本a1)-(空白a2-空白a1)]/[(标准a2-标准a1)-(空白a2-空白a1)]×
校准品浓度
实验结果(图3)显示:与正常对照组相比,as模型组血清ldl-c水平显著升高(p<0.01);与as模型组相比,pte高剂量组和ato组血清ldl-c水平显著降低(p<0.01)。
实施例7:hdl-c测定
本实施例用来测定家兔血清hdl-c水平。按照hdl-c测定试剂盒(南京建成生物工程研究所)说明书操作步骤,如表2添加试剂,充分混匀后于波长546nm,酶标仪测定各孔吸光度值。
表2hdl-c/ldl-c测定表
计算公式:hdl-c含量(mmol/l)=[(样本a2-样本a1)-(空白a2-空白a1)]/[(标准a2-标准a1)-(空白a2-空白a1)]×校准品浓度
实验结果(图4)显示:与正常对照组相比,as模型组血清hdl-c水平无显著性差异(p>0.05);但与as模型组相比,pte高、中剂量组和ato组血清hdl-c水平显著升高(p<0.01)。
实施例8:组织形态学观察
经兔耳缘静脉将3%戊巴比妥钠(合肥美丰化工仪器公司)以30mg/kg的剂量注入,将其麻醉后,注射空气针致死。用手术剪刀剖开兔胸腔,分离主动脉。用镊子小心刮去外膜残余脂肪组织后,将其横切,用浓度为4%的多聚甲醛溶液固定24h后,石蜡包埋,进行he染色,后在光镜下作病理学检查。
实验结果(图5)显示:对照组家兔主动脉壁的各层结构正常,内膜光滑,中膜弹力纤维在正常状态。as模型组可见明显内皮部分细胞脱落,内中膜呈明显增厚现象,且凸向管腔内。此外,可见大量的平滑肌细胞移行至内膜下形成纤维帽,内膜下的泡沫细胞及沉积的脂质形成了脂质核心,部分可见钙化。外膜上可见有炎性细胞聚集于此。阳性对照ato组内膜尚光滑,中膜呈现增厚,相对于模型组,泡沫细胞明显减少,且未见脂质核心形成。
pte高、中剂量组主动脉内膜尚光滑,中膜增厚,泡沫细胞明显减少,未见脂质核心形成。此结果说明,pte能显著减轻和改善高脂饮食诱导的主动脉粥样硬化性病理性改变。
实施例9:sod的活力测定
取适量兔动脉血管于离心管中,加1mlripa裂解液(江苏碧云天生物技术有限公司),利用组织匀浆机进行冰浴匀浆,低温离心后,取上清。根据蛋白浓度和预计的蛋白使用量,用sod检测试剂盒(江苏碧云天生物技术有限公司)提供的sod检测缓冲液适当稀释样品。同时参照说明书,根据待测样品的数量,配制好足够量的试剂后需冰浴,且现配现用。使用96孔板设置样品孔和各种空白对照孔。并按表3依次加入待测样品和其它溶液。混合后37℃孵育30min,使用酶标仪在450nm处测定各孔的od值。
表3sod活力测定操作表
计算公式:抑制百分率=[(a空白对照1-a空白对照2)-(a样品-a空白对照3)]/(a空白对照1-a空白对照2)×100%
样品的抑制百分率需在30%~70%范围内,才能根据公式计算出sod酶活力,并将酶活力单位换算为u/mgprotein。否则需要稀释样品直到抑制百分率处在合理范围。
待测样品中sod酶活力单位(u)=抑制百分率/(1-抑制百分率)。
实验结果(图6)显示:与正常对照组相比,as模型组主动脉sod活性显著降低(p<0.01);与as模型组相比,pte各剂量组和ato组主动脉sod活性显著升高(p<0.05,p<0.01)。
实施例10:mda含量测定
取适量兔动脉血管于离心管中,加1mlripa裂解液(江苏碧云天生物技术有限公司),利用组织匀浆机进行冰浴匀浆,低温离心后,取上清。根据蛋白浓度和预计的蛋白使用量,用mda检测试剂盒(江苏碧云天生物技术有限公司)提供的mda检测缓冲液适当稀释样品。同时参照说明书,根据待测样品的数量,配制好足够量的试剂后需冰浴,且现配现用。按表4,将各试剂及样品加入0.5ml的ep管中,将ep管置于金属浴中,100℃,15min。冷却至室温后,离心,取200μl上清于96孔板中,在酶标仪上于532nm测吸光度。样品中的mda含量可根据标准曲线来计算,通过单位重量的蛋白含量表示,如μmol/mg蛋白。
表4mda活力测定操作表
实验结果(图7)显示:与正常对照组相比,as模型组主动脉mda含量显著升高(p<0.01);与as模型组相比,pte高、中剂量组和ato组主动脉mda含量显著降低(p<0.05)。
实施例11:数据处理级统计学分析
本实验采用统计软件spss13.0进行数据分析,以mean.±sd表示。选用one-wayanova结合post-hoc(lsd法)方法进行组间差异分析。以p<0.05表示统计学差异显著性。
- 还没有人留言评论。精彩留言会获得点赞!