臭灵丹酸在制备预防或治疗流感药物中的应用的制作方法
本发明属于医药领域,涉及预防或治疗流感药物,以及一种倍半萜的医药新用途,具体而言,是指臭灵丹酸在制备防治流感药物中的应用。
背景技术:
流行性感冒(简称流感)是由流感病毒引起的急性呼吸道疾病,具有高度传染性。人流感病毒分为甲、乙、丙三型,其中甲型流感对人类威胁最大,h1n1是最主要的季节性甲型流感病毒。全球每年流感发病率在成人中约为5%-10%,在儿童中约为20%-30%,在高危人群如婴幼儿、老年人或慢性病患者中易造成住院和死亡。全世界每年流感造成约300万至500万例严重疾病和约25万至50万例死亡,严重威胁人类的生命健康,并造成巨大经济损失。预防及控制流感传播的最有效方法是接种疫苗,但是由于流感病毒的抗原变异能力强,疫苗的生产仅针对已流行流感亚型毒株,对于抗原漂移和变异产生新型流感病毒感染不产生机体的保护作用,且对高危人群如老人与免疫力低下儿童的保护作用低下。因此,流感疫苗预防流感具有一定的滞后性,保护率也有限。目前用于流感治疗的化学药物主要有两类:金刚烷胺类(金刚烷胺和金刚乙胺)和神经氨酸酶抑制剂(奥司他韦和扎那米韦),通常需在疾病早期(症状出现后48小时内)给药,且由于作用靶点单一已出现耐药,极大影响了疗效。因此,临床迫切需求具有不同靶点的新型抗流感药物。
在流感病毒感染过程中,宿主启动固有免疫反应产生抗病毒因子(如干扰素)和炎症反应以抑制入侵的病毒,适度的炎症反应有利于流感病毒的清除。但过度炎症反应会引起“炎症因子风暴”,导致机体严重的组织损伤,这是流感导致死亡的主要原因之一。因此,以抑制流感病毒诱发宿主产生过度炎症反应为靶标的药物研发已成为研究热点。该类药物调控宿主固有免疫反应相关的信号通路及炎症因子的分泌,不针对病原体,故不易产生耐药。
臭灵丹酸(pterodonticacid,i)是一种倍半萜化合物,已知具有抗菌、抗肿瘤等生物活性[药学学报,2007,42(5):511‐515;天津大学,2004,刘永彬硕士论文]。本品抑制流感病毒、下调流感病毒介导的炎症应答的作用未见报道。臭灵丹酸具有如下结构式:
技术实现要素:
本发明的目的在于提供一种作用机理新颖的抗流感药物。
通过对大量天然产物的随机筛选,发明人首次发现,臭灵丹酸具有抑制流感病毒复制、下调流感病毒介导的炎症应答的活性,能成为一种安全有效的新型抗流感药物。
本发明提供了臭灵丹酸在制备用于预防或治疗流感药物中的新应用。
上述药物可制成药学上允许的任意剂型,包括消化道、呼吸道和注射给药剂型,包括但不限于胶囊剂、片剂、软胶囊、滴丸、颗粒剂、糖浆、口服液、吸入剂、喷雾剂、乳膏、霜剂、凝胶剂、注射剂等。
根据临床用药所需,上述药物含有适当剂量的臭灵丹酸,其在药剂中的份量为0.1%~99.9%(w/w),亦可配伍其他药用许可的活性物质;制剂载体或辅料包括但不限于填充剂、黏合剂、崩解剂、润滑剂、助溶剂等。其中,填充剂具体可选择淀粉、糊精、糖粉、预胶化淀粉、乳糖、葡萄糖、微精纤维素、碳酸钙、硫酸钙、碳酸氢钙等一种或多种;黏合剂具体可选择羟丙甲纤维素、聚维酮、淀粉浆、糊精浆、胶浆、糖浆、聚乙二醇、海藻酸钠、阿拉伯胶、桃胶等一种或多种;崩解剂具体可选择交联聚维酮、交联羧甲基纤维素钠、羟丙基淀粉、羧甲淀粉钠、酒石酸、柠檬酸、碳酸氢钠、碳酸钠、酸酐等一种或多种;润滑剂可选滑石粉、硬脂酸镁、液体石蜡、微粉硅胶、聚乙二醇一种或多种;助溶剂可选碳酸氢钠(钾)、碳酸钠(钾)、氢氧化钠(钾)、吐温、植物油等一种或多种。
所述流感病毒包括但不限于甲、乙型流感病毒和禽流感病毒;所述甲、乙型流感病毒和禽流感病毒包括但不限于人流感病毒h1n1亚型、h3n2亚型、禽流感病毒h6n2、h7n3、h9n2亚型以及infb型,所述的人流感病毒h1n1亚型包括新甲型h1n1流感病毒。
本发明公开了一种倍半萜化合物——臭灵丹酸在制备抗流感药物中的新用途。发明人首次发现,臭灵丹酸能够明显抑制多种亚型流感病毒的复制,并有效改善流感病毒导致的炎症应答,揭示臭灵丹酸可用于流感的预防和治疗。该活性成分来源于植物,原料价廉易得,无明显毒性,极具应用前景。
本发明提供的臭灵丹酸的制备方法包括以下步骤:取臭灵丹干燥药材,用90%酒精渗漉提取得浸膏,浸膏加水搅拌使混悬,依次用石油醚、醋酸乙酯、正丁醇萃取,回收溶剂;将石油醚提取物加硅胶适量拌样,干法装柱(200~300目),常压下用石油醚‐醋酸乙酯混合溶剂梯度洗脱,溶剂配比依次为1:0、20:1、10:1和5:1;分别接收,浓缩;石油醚洗脱段继续用硅胶柱层析反复分离,交替使用石油醚和氯仿洗脱,用tlc指导合并,浓缩,得到白色结晶性粉末即为臭灵丹酸。
本发明实验包括抗流感病毒实验和抗炎实验两部分。
抗病毒实验:本发明采用细胞病变抑制法在治疗模式下验证臭灵丹酸对流感病毒复制的抑制作用,以奥司他韦为阳性对照药,观察臭灵丹酸对mdck细胞的毒性以及对流感病毒复制的抑制作用。利用mtt法测得臭灵丹酸的半数有毒浓度(tc50)为278.9μg/ml,臭灵丹酸抑制多个亚型流感病毒(a/pr/8/34、09h1n1、季h1n1等)的半数有效浓度ic50为9.47~37.14μg/ml,证实臭灵丹酸在治疗模式下对流感病毒有明显抑制作用,其选择指数si=7.5~29.5,为低毒高效。流感病毒神经氨酸酶(na)抑制实验表明臭灵丹酸对na的抑制活性,ic50=668.1μg/ml。免疫荧光实验显示臭灵丹酸(100μg/ml)可抑制流感病毒rnps核输出。
抗炎实验:应用稳定转染的nf‐κb启动荧光素酶表达的报告质粒的hek293细胞系研究臭灵丹酸对流感病毒诱导的与病毒复制相关信号通路的调控作用,分别用20ng/ml的tnf-α和流感病毒h1n1刺激,同时给予不同剂量臭灵丹酸(20μg/ml、40μg/ml)干预,均发现药物可抑制nf‐κb介导的荧光素酶的表达,并呈剂量依赖关系。提示药物具有抑制nf‐κb信号通路活化的药理活性。由于nf‐κb信号通路激活与促炎因子的高表达密切相关,因此通过qrt-pcr方法测定臭灵丹酸对于流感病毒感染后介导的促炎因子表达的实验证实,不同剂量臭灵丹酸(6.25μg/ml、25μg/ml、100μg/ml)能够明显抑制h1n1病毒和h9n2病毒感染a549细胞炎症因子(il-6、ip-10、mip-1、mcp-1)的异常表达,并呈剂量依赖关系。
附图说明
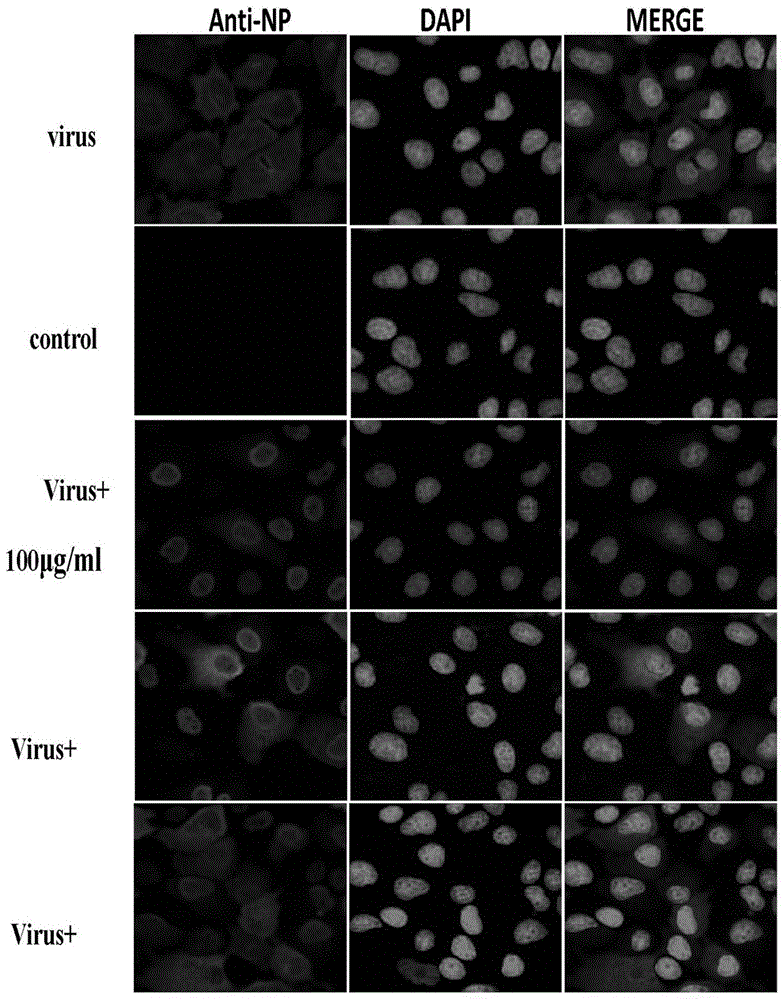
图1臭灵丹酸对流感病毒rnps核输出的影响。
图2臭灵丹酸对tnf‐α和流感病毒h1n1介导的nf‐κb信号通路活化的影响。
图3采用实时定量pcr(qrt‐pcr)技术检测臭灵丹酸对流感病毒h1n1感染介导的炎症因子il-6、ip-10、mip‐1α、mcp-1表达的影响。
图4采用实时定量pcr(qrt‐pcr)技术检测臭灵丹酸对流感病毒h9n2感染介导的炎症因子ccl‐5、ip‐10、mip‐1α、tnf‐α、mcp‐1表达的影响。
具体实施方式
实施例1:臭灵丹酸的制备
取臭灵丹干燥药材(采自昆明市近郊)1kg,通过90%酒精渗漉提取得浸膏135g;浸膏加800ml水搅拌使混悬,依次用石油醚、醋酸乙酯、正丁醇萃取(各5×500ml),回收溶剂;将石油醚提取物加硅胶适量拌样,干法装柱(200~300目,650g),常压下用石油醚‐醋酸乙酯混合溶剂梯度洗脱,溶剂配比依次为1:0、20:1、10:1和5:1;分别接收,浓缩;石油醚洗脱段重约3.8g,继续用硅胶柱层析反复分离,交替使用石油醚和氯仿洗脱,用tlc指导合并(碘熏显色),浓缩,得到白色结晶性粉末(0.1g),经nmr波谱解析鉴定为臭灵丹酸:
1h-nmr(400mhz,cdc13)δppm:6.31(1h,brs,h-12),5.68(1h,brs,h-12),5.20(1h,brs,h-6),1.16(3h,s,h-14),1.18(3h,d,j=8.0hz,h-15),3.32(1h,m,h-7),2.47(1h,m,h-4),2.0~1.4(10h,m,h-1、2、3、8、9);13c-nmr(100mhz,cdcl3)δppm:42.87(c-1),17.52(c-2),33.20(c-3),38.14(c-4),144.90(c-5),122.80(c-6),38.20(c-7),26.60(c-8),41.51(c-9),34.41(c-10),149.14(c-11),171.93(c-12),125.76(c-13),27.22(c-14),23.19(c-15)。上述数据与文献值一致[药学学报,2007,42(5):511‐515;云南植物研究,1996,18(3):349‐352]。
实施例2:臭灵丹酸抑制流感病毒活性
1.材料
细胞:狗肾细胞(madindarbycaninekidney,mdck)细胞引自中国科学院典型培养物保藏委员会细胞库。
病毒:
甲型流感病毒pr8株(a/pr/8/34,h1n1)、甲型h3n2流感病毒aichi株(a/aichi/2/68,h3n2)购自美国经典培养物收藏中心(americantypeculturecollection,atcc);新甲型h1n1流感病毒株(a/guangzhou/gird07/09,h1n1,genebankno.hm014332.1)为本室临床分离株,上述毒株流感病毒通过接种于9日龄的鸡胚尿囊腔中扩增,35℃孵育2d,收获尿囊液。用mdck细胞滴定病毒,以细胞病变抑制法(cpe)判定这些毒株的半数感染量(tcid50/100μl)作为病毒原始滴度。
试剂与药物:
dmso(美国sigma公司);mem(美国gibco公司)批号:8114414;胎牛血清(美国gibco公司)批号:10099;pbs(美国gibco公司)批号:20150122;1mg/mltpck批号:20140220购自广州捷倍斯生物科技有限公司;mtt(3-(4,5-二甲基噻唑-2)-2)购自genebase;阳性对照药:奥司他韦羧酸盐,购自美国gibco公司,货号:y0001337;臭灵丹酸:自制。
2.实验方法
药物毒性实验(mtt法)
按每孔约2.5×104mdck细胞接种到96孔板,24h后待细胞长成单层,弃去培养液,加入不同稀释度的药物100μl/孔,空白对照和正常细胞对照孔加入100μl/孔mem,37℃,5%co2继续培养36‐48小时,每孔加mtt溶液(5mg/ml)20μl,置37℃,5%co2温箱中继续孵育4小时。吸弃培养上清液,每孔加100μl二甲基亚砜(dmso)低速振荡10分钟,使结晶物充分融解。选择490nm波长,在酶联免疫监测仪上测定各孔光吸收值。按照下列公式计算抑制率,并用reed-muench法计算50%毒性浓度为药物半数有毒浓度(tc50)。抑制率=[(正常组平均od值-空白组平均od值)-(给药组平均od值-空白组平均od值)]/(正常组平均od值-空白组平均od值)×100%。
药物抑制流感病毒cpe实验
病毒与不同浓度的药物37℃孵育1h后接种于细胞中,置于4℃孵育1h,吸弃上清,换含tpck的无血清培养基37℃、5%co2环境下培养8h。细胞出现病变程度按以下6级标准记录:
“-”为细胞生长正常,无病变出现;
“±”为细胞病变少于整个单层细胞的10%;
“+”为细胞病变约占整个单层细胞的25%;
“++”为细胞病变约占整个单层细胞的50%;
“+++”为细胞病变约占整个单层细胞的75%:
“++++”为细胞病变约占整个单层细胞的75%以上。
用reed-muench法计算半数抑制浓度(ic50),并以选择指数si表示(si=tc50/ic50),si>2表示低毒高效;si=1~2表示高毒低效;si<1表示无效。
3.实验结果
臭灵丹酸的细胞毒性:利用mtt法测得受试药物的半数有毒浓度(tc50)为278.9μg/ml。
臭灵丹酸抑制流感病毒药效:
结果显示臭灵丹酸对不同亚型的流感病毒就有不同程度的抑制作用,具体结果见表1。
表1臭灵丹酸对多种亚型流感病毒的抑制作用
实施例3:臭灵丹酸抑制流感病毒神经氨酸酶
1.材料、仪器
试剂与药物:臭灵丹酸,自制。
仪器:heracell150i恒温co2培养箱(美国thermo公司)、du800紫外及可见光分光亮度计(美国beckman公司)
病毒和细胞:新甲型h1n1流感病毒株(a/guangzhou/gird07/09,h1n1,genebankno.hm014332.1)、狗肾细胞(madindarbycaninekidney,mdck)细胞引自中国科学院典型培养物保藏委员会细胞库
2.实验方法
用0.5%鸡血球细胞测出病毒株的病毒滴度(达到16个血凝单位),然后用16个血凝单位的病毒25μl与不同浓度的药物(臭灵丹酸和奥司他韦)25μl,同时设立病毒对照组和空白对照组。然后加盖,轻微振荡混匀,置37℃孵育30min;然后各个孔加入10μl底物,避光反应30min;各孔再分别加入催化剂60μl/孔即时读数。
3.实验结果
臭灵丹酸对09年新甲型h1n1流感病毒的na有抑制作用,ic50=668.1μg/ml。
实施例4:臭灵丹酸抑制流感病毒rnps核输出
1.材料、仪器
试剂与药物:臭灵丹酸(自制),小鼠np抗体(英国,abcam公司),fitc标记山羊抗小鼠igg(碧云天),dapi(瑞士,rocheappliedscience),4%多聚甲醛溶液(广州威佳科技有限公司),bovineserumalbumin(bsa)(vectorlab公司),
仪器:heracell150i恒温co2培养箱(美国thermo公司),蔡司axiovert135荧光显微镜(德国,蔡司公司)
病毒和细胞:甲型流感病毒pr8株(a/pr/8/34,h1n1)购自美国经典培养物收藏中心(americantypeculturecollection,atcc)、狗肾细胞(madindarbycaninekidney,mdck)细胞引自中国科学院典型培养物保藏委员会细胞库
2.实验方法
细胞爬片:用胰酶消化好mdck细胞,充分吹打,使之成单细胞悬液加于培养皿中的玻片上,置于37℃的5%co2孵箱24小时,用pbs润洗一次。根据对照组、病毒组、药物组分组,病毒组和药物组分别用流感病毒pr8毒株(moi=1)感染爬片上的细胞,2小时后,药物组加入不同浓度臭灵丹酸(25μg/ml、50μg/ml、100μg/ml)。8小时后收集爬片细胞,用1×pbst洗细胞3次,5min/次,用pbs洗3遍。采用4%多聚甲醛rt固定15min,用1×pbst洗细胞3次,5min/次。0.5%的tritonx-100打孔15min,用1×pbst洗细胞3次,5min/次。3%bsa封闭30min,吸去封闭液,加入稀释好的鼠np抗体(1:500)(一抗),4℃过夜。用1×pbst洗细胞3次,5min/次,加入稀释好的fitc标记山羊抗小鼠lgg(二抗),室温避光孵育1h。用1×pbst洗细胞3次,5min/次,1μg/mldapi染色细胞核。用1×pbst洗细胞1次,甘油封片,荧光镜下观察。
3.实验结果
流感病毒核蛋白(np)相对保守,是流感病毒的型特异性抗原。在病毒复制早期,np蛋白与病毒的rna及多聚酶结合形成复合体(rnps),参与病毒的转录、复制、装配及转运功能,所以np蛋白是新生病毒复制的重要标志。如附图1所示,甲ⅰ型流感病毒pr8株侵入细胞复制后,产生的np蛋白弥散于细胞浆和细胞核内(无药物处理组)。然而,经过不同剂量臭灵丹酸(25μg/ml、50μg/ml、100μg/ml)处理后,在细胞核中可见强烈的绿色荧光,而在胞浆中仅见少量绿色荧光,表明np蛋白大部分聚集于受感染细胞的细胞核中。随着药物浓度降低,细胞核绿色荧光强度稍减弱,而胞浆中绿色荧光强度增强,表明臭灵丹酸对np蛋白细胞核定位效应越来越弱。由此可见,臭灵丹酸通过抑制np蛋白核输出,从而抑制病毒的有效复制,并显示出剂量依赖关系。
实施例5臭灵丹酸对流感病毒介导的宿主nf‐κb的调节作用
1.材料、仪器
药物、试剂:臭灵丹酸(自制)、dmem培养基(批号:8114176);dmem/f12培养基(批号:1292607);pbs(批号:20150122),胎牛血清(批号:10099)均购自gibco公司;tpck(批号:20140220)购自广州捷倍斯公司,tnf‐α(r&dsystems)。
细胞、病毒株:人肺腺癌549细胞株(a549细胞)和狗肾上皮细胞(mdck细胞)购自中国科学院上海细胞库,人胚肾293细胞株(hek293细胞)由广州呼研所李楚芳博士赠送;甲型流感病毒a/pr/8/34(h1n1)购自atcc,以reed-muench法测定其感染复数(moi),以moi=0.1作为病毒滴度感染细胞。
2.实验方法
能够持续表达nf‐κb荧光素酶报告基因的hek293细胞以每孔5×104个/ml接种于96孔板,待细胞长成单层,弃去培养液,用pbs冲洗两遍。用不含血清的dmem将甲型流感病毒h1n1(pr8)稀释至m.o.i=0.1感染细胞,或用不含胎牛血清的dmem(含20ng/ml的tnf‐α)刺激细胞,同时用不同浓度的臭灵丹酸干预细胞。24h后用荧光素酶检测试剂盒(promege)检测荧光素酶表达水平。
3.实验结果
20μg/ml、40μg/ml的臭灵丹酸均能够明显抑制tnf‐α及流感病毒诱导的nf‐κb荧光素酶报告基因的表达,并呈剂量依赖关系(见图2),说明臭灵丹酸能够抑制nf‐κb信号通路的活化。
实施例6臭灵丹酸抑制流感病毒介导的炎症应答
1.材料、仪器
药物:臭灵丹酸,自制。
细胞、病毒:人肺腺癌549细胞株(humanalveolarepithelialcell,a549)购自中国科学院典型培养物保藏委员会细胞库、甲型h1n1流感病毒(a/pr/8/34,h1n1)、甲型h9n2禽流感病毒(a/chicken/guangdong/1996)购自atcc,以reed-muench法测定其感染复数(m.o.i),以m.o.i=0.2作为病毒滴度感染细胞。
试剂:试剂dmem培养基(批号:8114176);pbs(批号:20150122),胎牛血清(批号:10099)均购自gibco公司;tpck(批号:20140220)购自广州捷倍斯公司。reat-timepcr试剂购买自takarra公司,cat#rr390a。ripa裂解液购自美国sigma公司。
仪器:
heracell150i恒温co2培养箱,美国thermo公司
bhc-1300iia/b3二级生物安全柜,苏州净化设备有限公司
leicadm3000倒置显微镜,徕卡公司
tgl-16m高速台式冷冻离心机,德国eppendorf公司
avantij-26高速冷冻离心机,美国beckmancoulter公司
sigmaj-26冷冻离心机,德国sigma公司
bs115-eshk01水平摇床,太仓科教器材厂
al201电子天平,梅特勒-托利多仪器(上海)有限公司
du800紫外及可见光分光亮度计,美国beckman公司
jy-1000m型电热恒温鼓风干燥箱,吴江市志胜烘箱设备厂
multiscanmk3型酶标仪,美国thermo公司
real-timepcr仪,abi7500
荧光显微镜
2.实时荧光定量pcr实验方法
a549细胞以每孔5×104个/ml接种于96孔板,待细胞长成单层,弃去培养液,用pbs润洗一遍。用不含血清的dmem将甲型流感病毒h1n1(a/pr/8/34(h1n1)(moi=0.2)、h9n2(a/chicken/guangdong/1996)(moi=0.2)分别感染细胞,于37℃孵箱吸附细胞2小时。用不含胎牛血清的dmed/f12将药物(臭灵丹酸)稀释成不同浓度(100、25、6.25μg/ml)加入细胞干预,24h后分别收集细胞上清液,用trizol(invitrogen)提取rna,随后用反转录试剂盒将500ng的rna反转录成cdna,使用定量pcr(abi7500real‐timepcr)进行炎症因子的分析。qpcr反应条件:变性95℃、30s;退火95℃、5s(40个循环);延伸60℃、40s。本实施例中进行实时定量pcr反应时所用的炎症因子的引物序列及探针序列如下:
引物名称引物序列(5'--3')
ip-10(human)-f:gaaattattcctgcaagccaattt
ip-10(human)-r:tcacccttctttttcat-tgtagca
ip-10(human)-probefam-tccacgtgttgagatca-3'mgb
il-6(human)-fcgggaacgaaagagaagctcta
il-6(human)-rcgcttgtggagaaggagttca
il-6(human)-probefam-tcccctccaggagcccagct-tam
ccl-5(human)-fcagcagtcgtctttgtcacc
ccl-5(human)-rgttgatgtactcccgaaccc
ccl-5(human)-probefam-cgccaagtgtgtgccaaccc-tam
tnf‐α(human)-faacatccaaccttcccaaacg
tnf‐α(human)-rgaccctaagcccccaattctc
tnf‐α(human)-probefam-ccccctccttcagacaccctcaacc-tam
mip‐1α(human)-fctgcatcacttgctgctgaca
mip‐1α(human)-rcactggctgctcgtctcaaag
mip‐1α(human)-probefam-ttcagctacacctcccggcagattcc-tam
mcp-1(human)-fcaagcagaagtgggttcaggat
mcp-1(human)-ragtgagtgttcaagtcttcggagtt
mcp-1(human)-probefam-catggaccacctggacaagcaaacc-tam
3.实验结果
结果见附图3所示,臭灵丹酸(100、25、6.25μg/ml)干预后明显抑制了h1n1流感病毒诱导的炎症因子(il-6,ip-10,mip-1α,mcp-1)的基因转录水平,呈剂量依赖关系;如附图4所示抑制了h9n2流感病毒诱导的炎症因子(ccl-5,tnf‐α,ip-10,mip‐1α,mcp-1)的过度表达,并呈剂量依赖关系。提示臭灵丹酸干预抑制流感感染诱导过度炎症应答。
- 还没有人留言评论。精彩留言会获得点赞!