一种治疗缺血性中风的中药组合的制作方法
本发明涉及中药领域,具体是一种治疗缺血性中风的中药组合。
背景技术:
缺血性脑卒中具有发病率、致残率、致死率、复发率高等特点,且发病还有逐年增高的趋势。脑卒中是世界上人类第二致死疾病,87%脑卒中为缺血性脑卒中(血栓形成或栓塞);2008年,卫生部第3次全国死因调查表明我国脑卒中死亡人数(136.64/10万)已超过恶性肿瘤死亡人数(135.88/10万)列为第一致死疾病;我国每年有150万人死于脑卒中,占每年总死亡病因的51%;幸存者有600~700万,40%重度残疾,70%不同程度丧失劳动力。缺血性中风存在着复杂的脑缺血损伤病理变化,包括兴奋性神经毒性、酸中毒、电解质失衡、氧化应激等,有些病理机制尚不十分明确,还缺乏有效的治疗途径和治疗药物;
西药多采用抗栓、改善微循环等为主,如谷氨酸受体阻断剂虽然研究多年,但因其严重的不良反应而很难适用于临床,钙离子阻断剂虽具有一定疗效,但其神经毒副作用严重影响其临床疗效,西药治疗该病尚无突破性治疗方法。中医药在防治缺血性中风方面具有独特的优势。目前治疗该病中成药多以气虚血瘀立论,益气活血或活血药治之(补阳还五汤、脑心通胶囊,脑复康、脑络安等),虽有疗效,但易加重热瘀,易致伤阴化燥,脑出血、脑缺血再灌注损伤等弊端,疗效也有待提高。因此开发出治疗该病既有疗效好稳定,并副作用小的中药新药,已成为社会和医学界广泛关注的重要课题,必将具有很大的市场潜力;
根据50余年治疗中风经验,提出的“气虚、阴亏、热毒、血瘀”是缺血性中风(急性期等)病机四要素,互为因果。“气阴亏虚,热瘀阻络(脑)”是缺血性中风常见证型,宜用扶正解毒化瘀方,处方:黄芪,葛根,川芎,巴戟天,地龙,麦冬,黄芩,赤芍,川断。方以黄芪为君,甘、微温,补气以推动血行,且利水消肿。巴戟天为臣,辛甘,微温,补肾益精填髓,助黄芪补益脾肾治本。地龙咸、性寒,清热活血、搜风通络,治脑中风热毒瘀滞;黄芩,苦寒,清热解毒;葛根养阴清热,濡润经脉、通络;川芎活血行气,引药上行,祛瘀血,麦冬滋阴,赤芍活血凉血,川断补肾气,共为佐使药。诸药合用祛热瘀而不伤正,扶正而不留滞,共奏益气养阴,清热解毒,化瘀通络之功。适用于缺血性中风中经络气阴亏虚,热瘀阻络证,见半身不遂,口舌歪斜,言语蹇涩,偏身麻木,乏力,舌暗红,脉涩、或沉弦细等。
技术实现要素:
为解决上述技术问题,本发明提供了一种治疗缺血性中风的中药组合;
一种治疗缺血性中风的中药组合,其特征在于其由以下重量份数的原料药制成:黄芪10-40份,葛根10-40份,川芎5-30份,巴戟天5-30份,地龙5-30份,麦冬5-30份,黄芩5-30份,赤芍5-30份,川断5-30份;
一种治疗缺血性中风的中药组合,优选以下重量份数的原料药制成:黄芪20份,葛根20份,川芎15份,巴戟天10份,地龙10份,麦冬10份,黄芩10份,赤芍10份,川断10份;
一种治疗缺血性中风的中药组合,其特征在于其剂型是颗粒剂;
一种治疗缺血性中风的中药组合制备方法,其特征在于包括以下步骤:
1)将黄芪,葛根,川芎,巴戟天,地龙,麦冬,黄芩,赤芍,川断,用10倍量70%乙醇作溶剂,浸渍3小时后,回流提取2次,每次1.5h,提取液滤过,滤液减压回收乙醇至无醇味,并浓缩成相对密度1.10±0.02(50-60℃)的清膏,备用;
2)将步骤1)所得药渣再用8倍量水作溶剂,沸腾提取2次,每次1.5h,提取液滤过,滤液浓缩成相对密度1.10±0.02(50-60℃)的清膏;
3)将步骤1)与步骤2)所得清膏合并,喷雾干燥,加糊精、乳糖及硬脂酸镁适量,干法制成颗粒,检验合格,包装即成;
本发明剂型选择根据中医用药特点及方中各药所含化学成分的理化性质,由于本处方量较大,每日服用生药量为85g,每日3次,按口服液制备工艺制成的制剂,贮存一段时间后,逐渐有沉淀生成,因此本方不宜制成口服液制型。其次,制成全浸膏片或胶囊剂,则一次服用量较大,临床上患者难以接受,所以本方也不宜制成片剂或胶囊剂。在实验比较的基础上,选择颗粒剂较为适宜,其制备工艺相对简单,生产技术也较液体制剂易于掌握,同时制品体积较小,服用方便,经过研究,选择的工艺在生产上亦可行,药效学试验结果与原汤剂的作用一致,颗粒剂型具有增加药物稳定性,便于贮存等优点,不仅保持了汤剂药效发挥迅速的特点,又克服了汤剂服用体积大,易变质霉败的缺点;
本发明补益脾肾,活血通络,清热解毒。适用于缺血性中风中经络气阴亏虚,热瘀阻络证,见半身不遂,口舌歪斜,言语蹇涩,偏身麻木,乏力,舌暗红,脉涩、或沉弦细等。口服,一次1-2袋,一日2次。孕妇慎用;
本发明质量可控。所有中药材基元鉴定可靠,通过对葛根中葛根素和黄芩中黄芩苷工艺研究确定其为工艺评价和制剂含量测定指标,通过单因素以及正交实验确定工艺参数,确保了制剂的有效性和可控性。在质量标准研究中,建立了葛根和黄芩的含量测定方法和限度及四味药材的薄层色谱鉴别方法,为确保临床用药的有效性提供了物质基础保证。此外,通过重金属、砷盐、微生物限度检查,确保其使用的安全有效。内包装材料采用药品药用复合膜包装,在该包装条件下进行的加速稳定性试验表明,本品除水分有增加趋势外,其余各项指标均无明显变化,需进一步确定包装材料的适用性;
本发明药效显著,安全可靠。具有减轻脑水肿和能减轻脑血管通透性,抗缺氧作用,可通过激活纤溶酶原使纤维蛋白溶解,具有溶栓作用。同时本发明经过动物毒性实验等严格控制;
下面将结合附图、实施例对本发明的实施方式作进一步详细描述。
附图说明
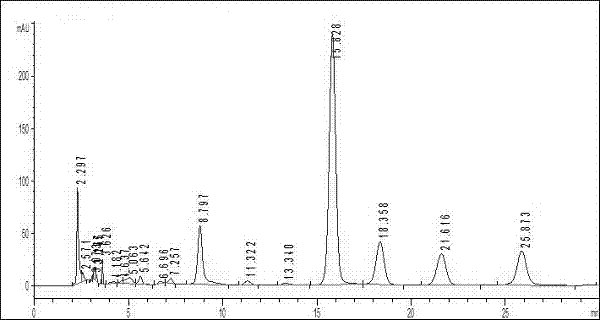
图1葛根素对照品色谱图;
图2本发明中葛根素测定色谱图;
图3黄芩苷对照品色谱图;
图4本发明中黄芩苷测定色谱图;
图5本发明对雄性大鼠体重的影响;
图6本发明对雌性大鼠体重的影响。
具体实施方式
实施例1
原料药配方:黄芪20份,葛根20份,川芎15份,巴戟天10份,地龙10份,麦冬10份,黄芩10份,赤芍10份,川断10份;
制备方法:将黄芪,葛根,川芎,巴戟天,地龙,麦冬,黄芩,赤芍,川断,以上9味中药,用10倍量70%乙醇作溶剂,浸渍3小时后,回流提取2次,每次1.5h,提取液滤过,滤液减压回收乙醇至无醇味,并浓缩成相对密度1.10±0.02(50-60℃)的清膏,备用;所得药渣再用8倍量水作溶剂,沸腾提取2次,每次1.5h,提取液滤过,滤液浓缩成相对密度1.10±0.02(50-60℃)的清膏;将两次所得清膏合并,喷雾干燥,加糊精、乳糖及硬脂酸镁适量,干法制成颗粒,检验合格,包装即成;
实施例1的质量控制
(1)取本品8克,研细,加乙醚50ml,加热回流60分钟,滤过,滤液挥干,残渣用2ml乙酸乙酯溶解作为供试品溶液。另取川芎对照药材1g,同法制成对照药材溶液。照薄层色谱法(中国药典2010年版一部附录vib)试验,吸取上述三种溶液各3ul,分别点样于同一硅胶g薄层板上,以正己烷-乙酸乙酯(9:1)为展开剂,展开,取出,晾干,置紫外光灯(366nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点;
(2)取本品4克,研细,加甲醇10ml,放置2小时,滤过,滤液挥干,残渣加0.5ml甲醇溶解作为供试品溶液。另取葛根素对照品,加甲醇制成每1ml含1mg的溶液,作为对照品溶液。照薄层色谱法(中国药典2010年版一部附录vib)试验,分别吸取供试品1ul,对照品2ul,分别点于同一硅胶g薄层板上,以三氯甲烷-甲醇-水(7:2.5:0.25)为展开剂,展开,取出,晾干,置紫外光灯(366nm)下检视。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点;
(3)取本品10克,研细,加甲醇50ml,加热回流1小时,滤过,滤液加于中性氧化铝柱上(100目过筛,5g,柱高3.5cm,柱内径1.5cm,干法装柱),用40%甲醇100ml洗脱,收集洗脱液,蒸干,残渣加水30ml使溶解,用水饱和的正丁醇溶液振摇提取2次,每次20ml,合并正丁醇液,用水洗涤2次,每次20ml,弃去水液,再用10%氨水洗涤两次,每次20ml,弃去氨水溶液,正丁醇液挥干,残渣加甲醇0.5ml使溶解,作为供试品溶液。另取黄芪对照药材2g,同法制成对照药材溶液。再取黄芪甲苷对照品,用甲醇溶解,制成每1ml含1mg的溶液,作为对照品溶液。照薄层色谱法(中国药典2010年版一部附录vib)试验,吸取上述各种溶液各2ul,分别点于同一硅胶高效g板上,以三氯甲烷-甲醇-水(13:7:2)下层液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇,用电吹风吹至斑点显色清晰,置日光灯和紫外光灯(366nm)下检视。供试品色谱中,在与对照药材及对照品色谱相应的位置上,显相同颜色的斑点;
(4)取本品8克,研细,加乙酸乙酯-甲醇(3:1)的混合溶液40ml,加热回流30分钟,放冷,滤过,滤液蒸干,残渣加甲醇5ml使溶解,取上清液作为供试品溶液。另取黄芩苷,汉黄芩素,黄芩素对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。照薄层色谱法(中国药典2010年版一部附录vib)试验,分别吸取供试品1ul,对照品1ul,分别点于同一聚酰胺薄膜上,以甲苯-乙酸乙酯-甲醇-甲酸(10:3:1:2)为展开剂,预饱和30分钟,展开,取出,晾干,喷以1%三氯化铁溶液,用电吹风吹至斑点显色清晰,置日光灯下检视。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点;
结果:中试产品呈阳性反应,表明该方法准确可靠,可作为本品的鉴别方法列入质量标准;
检查:按《中国药典》2010版一部的要求,对本制剂进行了水分、粒度、装量差异、溶化性及微生物限度等的检查;
粒度:按《中国药典》2010年版一部附录ⅰc中的要求,对三批中试产品进行了粒度的检查,均符合药典要求;
装量差异:对三批中试产品进行了装量差异的检查,结果均符合《中国药典》2010版要求;
溶化性:取本品中试产品三批,按颗粒剂项下规定(《中国药典》2010年版一部附录ic)进行检查,结果均符合药典要求;
水分:取本品中试产品三批,按颗粒剂项下规定(《中国药典》2010年版一部附录ic)进行检查,结果均符合标准规定;
重金属:按照电感耦合等离子体原子发射光谱法测试本品三批中试产品重金属,结果140101批:铅0.58mg/kg,汞未检出(检出限0.2mg/kg);140102批:铅0.55mg/kg,汞未检出;140103批:铅0.64mg/kg,汞未检出。重金属检查均符合规定(<10ppm),因此重金属检查未列入质量标准中;
砷盐:按照电感耦合等离子体原子发射光谱法测试本品三批中试产品砷含量,结果140101批:0.26mg/kg;140102批:0.13mg/kg;140103批:0.26mg/kg。三批中试产品砷均小于2ppm,因此未列入质量标准中;
微生物限度:依据《中国药典》2010年版一部附录xiiic微生物限度检查法,经过方法学验证,采用培养基稀释法对中试产品进行检查,结果微生物限度符合规定;
含量:含量测定以葛根素和黄芩苷为指标建立了hplc测定法,经过方法学考察和验证建立方法如下:
①葛根素:照高效液相色谱法(中国药典2005年版一部附录vid)测定;
色谱条件与系统适用性试验:用十八烷基硅烷键合硅胶为填充剂;甲醇-水(25:75)为流动相;检测波长为250nm。理论板数按葛根素峰计算应不低于4000;
对照品溶液的制备:取葛根素对照品适量,精密称定,加水-甲醇(30:70)制成每1ml含0.02mg的溶液,即得;
供试品溶液的制备:取本品内容物,研细,取约0.5g,精密称定,置50ml容量瓶中,加入30%乙醇至50ml,超声处理30分钟(功率:100w;频率:40khz),加30%乙醇补充减失体积,摇匀,滤过,取续滤液,即得;
测定方法:分别取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,见谱图1,2;
本品每袋含葛根以葛根素计,不得少于108.25mg;
②黄芩苷:照高效液相色谱法(中国药典2010版附录ⅵd)测定;
色谱条件与系统适应性试验:用十八烷基硅烷键合硅胶为填充剂;甲醇-0.4%磷酸溶液(45:55)为流动相;检测波长为280nm。理论板数按黄芩苷峰计算应不低于4000;
供试品溶液的制备:取本品内容物,研细,取约0.25g,精密称定,加入70%乙醇25ml,超声处理(功率:100w;频率:40khz)二次,每次1h,离心(3500r/m,10min),合并二次上清液,置50ml容量瓶,加70%乙醇至刻度,摇匀,滤过,取续滤液,即得;
对照品溶液的制备:取黄芩苷对照品适量,精密称定,加甲醇制成每1ml含0.03mg的溶液,即得;
测定方法:分别取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,见谱图3,4;
本品每袋含黄芩以黄芩苷计,不得少于179.09mg;
结论:本品按所附质量标准检验,结果符合规定;
实施例1的包装材料和容器的选择依据及质量标准
直接接触药品的包装材料为药用复合膜,为中药颗粒剂制剂常用的包装材料,对水、气、光具有良好的阻隔性能。我们用三批中试样品(批号:140101、140102、140103),均采用药用复合膜包装,经40±2℃/rh75±5%加速6个月试验、室温初步稳定性留样12个月试验考察,除水分有增加趋势外,各项指标合格,质量稳定;
结果表明:本产品选择的包装材料是合理的,相容性符合相关要求,能满足贮藏、使用要求;
实施例1的药效学实验
(一)对大鼠脑缺血脑含水量和脑指数的影响
采用大鼠急性不完全性脑缺血模型,观察本发明对大鼠脑缺血脑含水量和脑指数等方面的影响;
1.动物:健康雄性sd大白鼠,体重280-320g,饲育条件合格证:syxk(浙)2013-0184;上海西普尔-必凯实验动物有限公司,许可证号scxk(沪)2013-0016;
2.药物:本发明。步长脑心通,为阳性对照药,陕西步长制药有限公司生产,国药准字z20025001,批号131169,具有活血化瘀等功效,主治脑血栓等症,成人日用量为6.0g。伊文思蓝:fluka进口分装;
3.分组与给药:按下表将sd大白鼠随机分为6组,即正常对照组(假手术对照组);缺血再灌注组(脑缺血再灌注损伤模型组);再灌注本发明治疗组(分1.5g·kg-1/24h、3g·kg-1/24h、6g·kg-1/24h低中高三个剂量组);步长脑心通(324mg·kg-1/24h,阳性药对照组)。实验时将上药配成所需浓度的口服液,于实验前2天上、下午及实验当天术前1小时各灌胃给药1次。由模型组和假手术对照组则按同样方法灌服等量的生理盐水;
4.动物模型:急性不完全性脑缺血模型:结扎sd大鼠双侧颈总动脉形成急性实验性不完全性脑缺血模型。假手术组除不行颈总动脉结扎外,余手术过程相同;
5.脑含水量及脑指数测定:双侧颈总动脉结扎3小时以后,快速断头,开颅取脑,称重,从断头至称重在5分钟内完成。计算脑指数(脑指数=脑重×100/体重)。然后在85℃恒温干燥箱内烤60小时至恒重,计算脑含水量%=(湿重-干重)/湿重×100%;
6.毛细血管通透性检查:假手术对照组于股静脉注射伊文思蓝50mg/kg,不结扎双侧颈总动脉。缺血模型组及各药物实验组则在结扎双侧颈总动脉前5分钟由股静脉注射伊文思蓝50mg/kg,结扎3小时以后,快速断头、开颅、取脑、称重,并分别浸泡于甲酰胺溶液中,在45℃恒温箱中温育72小时,待脑组织中色素全部浸出,取色素液200μl,用384型酶标仪,630nm进行测定。根据标准曲线计算出脑组织内伊文思蓝的含量,以μg/g(脑湿重)表示;
7.结果:
(1)对大鼠脑缺血脑含水量和脑指数的影响
结果(表2)可见,脑缺血模型组脑含水量及脑指数与正常对照组相比具有极显著差异,提示脑含水量显著增加;本发明中、高剂量组、步长脑心通组与脑缺血模型组相比脑含水量均显著减少。本发明量效关系呈正相关,中、高剂量组与脑缺血模型相比,其脑含水量和脑指数均显著降低;
(2)对大鼠脑缺血脑血管通透性的影响
结果(表3)可见,脑缺血模型组伊文思蓝含量与正常对照组相比具有极显著差异;本发明各剂量组、步长脑心通组与脑缺血模型组相比具有显著性差异;本发明各治疗组量效关系呈正相关。表明脑缺血后脑组织内伊文思蓝含量明显增加,脑血管通透性增加,各给药组可显著降低脑血管通透性;
8.小结:
以结扎大鼠双侧颈总动脉3小时造成实验性不完全性脑缺血模型,观察到脑缺血模型脑含水量增加,并观察到脑缺血后脑内伊文思蓝含量明显增加,表明脑血管通透性增加。本实验以这种不完全性脑缺血模型观察到本发明能减轻脑水肿和能减轻脑血管通透性;
9.结论:
本发明对脑缺血性损伤具有保护作用,提示本发明对闭塞性脑血管疾患的治疗作用与减轻脑水肿、减轻脑血管通透性的作用有关;
(二)对小鼠减压缺氧耐力影响的实验研究
为观察本发明对小鼠缺氧耐力的影响,给健康icr小鼠灌服不同剂量本发明和尼莫地平一定时间后,采用小鼠减压缺氧耐力实验方法,记录动物死亡时间来观察其作用;
1.动物:icr小鼠,雌雄各半,体重20-22g,饲育条件合格证:syxk(浙)2013-0184;上海西普尔-必凯实验动物有限公司,许可证号scxk(沪)2013-0016;
2.药物:本发明。尼莫地平胶囊,国药准字h46020242,海南普利制药有限公司产,批号130628;
3.仪器:shb-ⅲa循环水式多用真空泵,河南省太康科教器材厂生;
4.分组与给药:按下表要求将icr小鼠按雌雄随机分5组。即缺氧模型组;尼莫地平组(8.1mg.kg-1/24h);本发明高中低三个剂量组(1.5g·kg-1/24h、3g·kg-1/24h、6g·kg-1/24h三个剂量组)。将本发明和尼莫地平胶囊在临用前用生理盐水配制成混悬液,灌胃给药,每日早晚各一次,连续3天,并于手术前1h追加一次。模型组灌服等量的生理盐水;
5.小鼠减压缺氧耐力实验:将icr小鼠放入密闭真空玻璃瓶中,每次两只,打开真空泵减压至0.08mpa后,开始记录动物死亡时间,并将真空泵减压衡定在0.08mpa水平;
6.数据处理:数据以平均值±标准误表示,使用统计软件进行单因素方差分析;方差不齐数据对数转换后进行tamhane’st2组间均数比较;
7.结果:
小鼠减压缺氧耐力试验结果见表4。本发明高、中剂量组、尼莫地平组与模型组相比均具有显著差异;本发明各组量效呈正相关;本发明各组与尼莫地平组相比无显著差异;
8.小结:
脑组织对缺氧是极度敏感的。脑组织对任何原因引起的缺血、缺氧所发生的病理生理演变基本上是一致的。脑缺血、缺氧后,细胞内外电解质发生紊乱,同时由于酸性代谢产物的影响引起脑肿胀和脑水肿而致脑组织损害。再则,缺血、缺氧时间较长,使脑组织呈不完全性灌注,当低灌流量不能维持脑组织的最低耗氧量,会进一步加重脑组织的病理损害,并可致死亡,脑缺氧对脑血管病的发生发展起着重要作用;
小鼠减压缺氧耐力试验综合反映了本发明抗缺氧的作用。试验结果表明本发明具有显著延长减压缺氧小鼠存活时间,提高其生存能力。尼莫地平为钙离了拮抗剂,能扩张脑血管,增加脑血流,本发明抗小鼠缺氧的作用与尼莫地平作用相似;
9.结论:本发明可显著提高小鼠抗缺氧能力;
(三)对纤维蛋白溶解活性的影响
为观察本发明对纤溶的作用,本实验采用纤维蛋白平板法,开展了其对纤维蛋白溶解活性影响的试验;
1.药物与试剂:本发明。复方地龙胶囊(阳性对照药),具有溶解血栓作用,南京恒生制药有限公司生产,批准文号:国药准字z19991007,批号140111。凝血酶试剂:sigma公司。纤维蛋白原试剂,sigma产品。其它实验器材:恒温箱、直径为9cm的平皿12只、卡尺;
2.试验分组:按下表要求分5组。即a.生理盐水组(对照组);b.复方地龙胶囊(0.1g/ml);c.本发明(0.15g/ml,0.3g/ml,0.6g/ml三个剂量组),共5组。临用前用生理盐水稀释配置成所需的本发明和复方地龙胶囊溶液;
3.纤维蛋白平板的制备:参照《中药药理研究方法学》,采用纤维蛋白平板法,用0.5%纤维蛋白原溶液(溶于0.1mol/l磷酸缓冲液,ph7.4),20u/ml凝血酶液(溶于0.1mol/l磷酸缓冲液,ph7.4)。在平皿内加9ml纤维蛋白原溶液,再加1ml凝血酶液,立即打旋混匀10秒钟,即形成1mm厚的纤维蛋白凝块,在平皿盖上衬以滤纸,在水平处放置30分钟,在4℃环境保存备用(不超过4天);
4.测定步骤:将20µl不同浓度的本发明和复方地龙胶囊溶液分别滴加到纤维蛋白平板上,每点间距离为2cm,并滴加20µl生理盐水作为对照,每一平皿内加样5个。将平板平置于湿盒内,放入37℃恒温箱中,6小时后观察有无溶解圈,并用卡尺测定溶解圈的直径,计算溶解圈面积,以溶解圈面积的大小衡量溶栓效果。不同浓度药液和生理盐水重复10次;
溶解圈面积的计算方法如下:
5.结果:
结果(下表5)表明,生理盐水在同样条件无溶解圈产生,而本发明和复方地龙胶囊对纤维蛋白溶解过程均具有促进作用;本发明各组量效呈正相关。用阳性药复方地龙胶囊目的在作参照;
6.小结:
人纤维蛋白原中含有纤溶酶原和前活化素,前活化素变成活化素后可使纤溶酶原变成纤溶酶,该酶能使纤维蛋白凝块发生溶解。本实验表明本发明可通过激活纤溶酶原使纤维蛋白溶解;
7.结论:本发明对纤维蛋白溶解过程有促进作用,具有溶栓作用;
实施例1的大鼠长期毒性试验
观察本发明长期灌胃给药对大鼠可能的毒性反应及严重程度,提示毒性靶器官和可逆性,并为确定临床安全剂量提供实验依据;
1.药物:本发明,含生药2.255g/g。纯净水配制成60%(g/ml)浓度药液作为大剂量用药,以30%和15%(g/ml)浓度的药液作为中、小剂量组灌胃的药物;
2.试验动物:sd大鼠,清洁级,120只,雌雄各半,体重70~80g,由浙江省实验动物中心提供,动物合格证:scxk(浙)2008-0033。动物饲养环境:温度:18-24℃,相对湿度:60-80%,昼夜明暗交替时间12h/12h,实验动物使用许可证号:syxk(浙)2011-0166;
3.仪器:日立mek5126型血细胞记数仪,日本日立公司生产。ba-815型半自动生化分析仪,上海三科仪器有限公司生产。德国micronhm355型组织切片机。日本liborael200型电子分析天平。dt200型电子秤,常熟市意欧仪器仪表有限公司生产。camryek3252型电子秤,广东香山衡器集团股份有限公司生产。motic显微数码摄像系统,厦门麦克澳迪实业有限公司生产。uritest-100a尿分析仪,桂林市医疗电子仪器厂生产。lby-nj4血小板聚集仪,北京普利生仪器有限公司。lby-n6compact全自动血液流变仪,北京普利生仪器有限公司;
4.给药周期:本品拟用于治疗脑卒中,疗程较长,本实验设计给药周期为6个月,为新药注册要求的大鼠最长给药周期,每周给药6天。根据《中药新药临床前药理毒理研究指南》要求,在给药13周和26周时测定尿常规、血常规和血清生化指标,每组各取10只和14只大鼠(雌、雄各半)处死,观察对主要脏器重量和组织形态的影响,以了解可能的毒性反应及其严重程度;余每组雌、雄各3只大鼠在停药后4周处死观察相关指标,以了解毒性的可逆性和可能的迟发毒性反应;
5.剂量选择:本品拟临床规格9g/袋(含辅料30%),推荐使用方法1-2袋/次,2次/天,剂量为18-36g/天,相当于300-600mg/kg体重(按60kg体重计),相当于生药210-420mg/kg体重;小鼠ld50>175.89g/kg(生药),是推荐临床最大剂量的418.8倍。设计大鼠长毒试验用3个剂量组,大剂量12g/kg(相当于生药27.06g/kg),是推荐临床最大剂量的64.4倍,基本为最大可给药量;中剂量6g/kg(相当于生药13.53g/kg),是推荐临床最大剂量的32.2倍;小剂量3g/kg(相当于生药6.76g/kg),是推荐临床最大剂量的16.1倍,并经预试验确认方案可行;
6.分组和给药方法:sd大鼠120只,雌、雄各半,体重70~80克。按体重分成4组,每组30只,分别为正常对照组(给纯净水)、本发明大、中和小剂量组。每笼5只大鼠饲养于不锈钢笼具中,动物饲养在屏障系统中,喂以标准颗粒饲料,并自由进食和饮水。正常对照组灌胃给予纯净水,本发明大、中和小剂量组分别灌胃含干浸膏60%、30%和15%(g/ml)的药液20ml/kg,相当于生药27.06g/kg、13.53g/kg、6.76g/kg(为推荐临床最大剂量的64.4、32.2、16.1倍)。每天上午给药,每次20ml/kg体重。每周给药6天,休息1天,连续6个月(26周)。在给药13周后每组雌、雄大鼠各取5只处死,最后1次给药(26周)后1天,每组雌、雄大鼠各取7只处死,剩余雌、雄大鼠各3只在停药后4周处死,分别检测相关指标;
7.观察指标:
7.1一般状况
7.1.1每天上午给药时观察大鼠的活动、呼吸、毛色等外观状况和大、小便情况,并观察眼、口、鼻部和泄殖区等有无明显异常分泌物;
7.1.2每周称1次体重,并根据新的体重调整给药体积;
7.1.3每周测1次进食量和饮水量,以笼为独立计算单位,计算每100g体重的进食量和饮水量(按100g体重计算,雌雄大鼠的进食和饮水量无明显差异,可合并进行统计学处理);
7.2血常规:在给药13周、给药26周和停药2周后,眼眶静脉丛取全血约0.5ml置于edta-k2抗凝管中,血细胞计数仪测定红细胞数(rbc)、血红蛋白浓度(hb)、红细胞压积(hct)、血小板数(plt)和白细胞数(wbc)等,并另取2-3滴血用焦黄油蓝染液染色后制作血涂片,进行网织红细胞计数;
7.3血清生化指标:给药13周、26周和停药2周后,眼眶静脉丛取全血2ml,分离血清,测定总胆红素(t-bil)、丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、碱性磷酸酶(akp)、γ-谷氨酰基转移酶(ggt)、肌酸激酶(ck)、总胆固醇(cho)、总甘油三脂(trg)、尿素氮(bun)、肌酐(cr)、葡萄糖(glu)、总蛋白(tp)和白蛋白(alb)等指标,并计算球蛋白(glb)及glb和alb比值;
7.4凝血指标:给药13周、26周和停药2周后,眼眶静脉丛取全血1.0ml置于3.8%枸橼酸钠抗凝管中(9:1),分离血浆测定凝血酶原(pt)时间、活化部分凝血活酶(aptt)时间、凝血酶(tt)时间及纤维蛋白原(fib)含量;
7.5尿常规:给药13周、26周和停药2周后,接取一定量尿液,uritest11项尿试纸测定ph、白细胞(wbc)、酮体(ket)、尿胆素原(uro)、胆红素(bil)、尿比重(sg)、隐血(bld)、蛋白质(pro)、葡萄糖(glu)、亚硝酸盐(nit)及维生素c(vc);
7.6脏器系数:在给药13周、26周和停药2周,每组分别取雌、雄大鼠各5只、7只和3只股动脉在放血处死后,解剖取心、肝、脾、肺、肾、大脑、胸腺、肾上腺、睾丸、前列腺+精囊腺、附睾、子宫和卵巢等脏器,称重,并除以体重,按每100g体重计算脏器系数;
7.7骨髓涂片检查:在给药13周、26周和停药2周,每组分别取雌、雄大鼠各5只、7只和3只股动脉在放血处死后,取右侧股骨骨髓进行涂片,染色,镜检;
7.8病理学检查:
7.8.1巨检:对处死大鼠进行系统解剖,取心、肝、脾、肺、肾、大脑、垂体、胃、空肠、结肠、腹淋巴结、唾液腺、甲状腺、食管、气管、胸腺、肾上腺、睾丸、前列腺、精囊腺、附睾、胰腺、膀胱、子宫和卵巢等脏器,作肉眼检查,观察记录脏器组织的宏观病变;
7.8.2病理组织学检查:心、肝、脾、肺、肾、大脑、胸腺、肾上腺、卵巢、子宫、睾丸、附睾、前列腺、储精囊、颌下腺、甲状腺、气管、食管、胃、胰腺、小肠、大肠、腹淋巴结、膀胱、坐骨神经、小脑、脑干、垂体、脊髓等器官以4%甲醛溶液固定,石腊包埋切片,常规he染色后镜检、摄影;
8.统计方法:
所有计量数据均表示为平均值±标准差,进行组间t检验,与纯净水对照组比较,*p<0.05,**p<0.01。计数数据(尿常规部分指标)则进行x2检验;
9.实验结果:
9.1对大鼠一般状态的影响:
本发明各剂量组给药期间大鼠毛色、活动、呼吸和二便等一般状况无明显异常,眼、口、鼻部和泄殖区等均无明显异常分泌物;
9.2对大鼠体重的影响
本发明大剂量组雄性大鼠从第15周开始体重增长速度比对照组慢,并一直维持到实验结束,但无统计差异;小剂量组雄性大鼠第3-8周体重增长明显快;大剂量组雌性大鼠第2-6周体重增长比对照组快,小剂量组雌性大鼠第14-26周体重增长比对照组慢。停药后体重差异扩大系部分宰杀后留下的大鼠体重本身存在较大差异所致。结果见图5,6;
9.3对大鼠进食量和饮水量的影响
按每100g体重计,各组大鼠的进食量和饮水量均程逐渐下降趋势,本发明各剂量组大鼠的进食量和饮水量和对照组比较均无明显差异。结果见表6,7;
9.4对大鼠血常规的影响
给药13周,本发明大剂量组hgb明显低于对照组;给药26周,本发明大、中、小剂量组eo比例明显低于对照组,大、中剂量组hgb显著下降,大剂量组hct显著下降,大、小剂量plt显著下降;停药4周,中剂量组eo比例明显低。其余指标各时段和对照组相比均无明显差异。结果见表8;
9.5凝血指标的影响
给药13和26周,本发明大、中、小剂量组pt时间显著延长;停药4周,中剂量组pt时间延长,小剂量组aptt显著降低。其他各指标和对照组相比均无明显差异。结果见表9;
9.6对大鼠血液生化指标的影响
给药13周时本发明大、中、小剂量组ast、alt、cho、glu水平显著降低,大剂量组ck活性明显下降;给药26周时本发明大、中、小剂量组ast、alt、ck、cho水平显著降低,大、中剂量组的ggt活性降低和bun含量上升,中剂量组tpo、glb略有下降,白蛋白/球蛋白比例明显升高;停药4周后大剂量组ast活性明显低于对照组,其他生化指标和对照相比均无明显差异。结果见表10;
9.7对大鼠脏器系数的影响
给药13周,雄性大、中剂量组肝脏和肾脏系数显著增加,雌鼠大、中剂量组心、肝系数上升,大剂量脾脏系数上升,大、中、小剂量组肾脏和卵巢系数上升,中剂量组肾上腺系数上升;给药26周,雄性大、中剂量组肝脏和脾脏系数上升,大、中、小剂量组肾脏系数上升,雌性大、中、小剂量组的肝脏和肾脏系数显著增加,大剂量脾脏系数上升,中、小剂量组脑系数上升;停药4周,雌性大鼠大、中、小剂量组胸腺系数明显下降。其他脏器重量系数在各时间段和对照组相比均无明显差异。结果见表11,12;
9.8对大鼠血清电解质的影响
给药13周,大剂量组cl含量升高,小剂量组nc含量升高;给药26周,小剂量组na下降,cl上升,中、小剂量组nca下降。结果见表13;
9.9对大鼠骨髓的影响
给药13周中、小剂量组大鼠的晚幼粒细胞比例升高,大、中、小剂量组早幼红细胞升高,大剂量组中幼红细胞降低,小剂量组晚幼红细胞降低;给药26周大剂量组早幼粒细胞升高,中、小剂量组杆状粒细胞降低,中剂量组晚幼红细胞升高,小剂量组分叶粒细胞升高、单核细胞降低;停药4周小剂量组中幼和晚幼粒细胞升高、晚幼红细胞降低,大剂量组杆状粒细胞降低,中剂量组中幼红细胞升高。结果见表14;
9.9对大鼠尿常规的影响
给药13周大、中、小剂量组大鼠的尿液ph升高,其他各项尿常规指标均和对照组无明显差异。结果见表15;
9.10对大鼠主要脏器组织病理学的影响
巨检:对中期、末期和恢复期大鼠的心脏、主动脉、(腹)淋巴结、脾、胸腺、颌下腺、食道、胃、小肠、大肠、肝、胰腺、气管、肺、肾、膀胱、睾丸、附睾、前列腺、储精囊、子宫、卵巢、大脑和小脑、颈脊髓、胸脊髓、腰脊髓、坐骨神经、视神经、垂体、甲状腺、肾上腺等脏器组织进行了巨检,未发现有明显异常;
镜检:
中期:本发明大剂量1只雄性大鼠(11号)前列腺腺体松散分布,腺腔内可见红染的分泌液,间质宽窄不一,间质可见大量炎症细胞浸润。未发现其它脏器组织病理形态学异常;
10.小结:
本试验采用sd大鼠120只,初始体重70-80g,随机分成4组,每组30只(雌雄各半),药物分设3个剂量组,分别为12、6和3g/kg,相当于生药27.06、13.53和6.76g/kg,是推荐临床最大剂量的64.4、32.2和16.1倍,另设纯净水对照组,每周给药6天,连续灌胃给药6个月(26周),结果显示:
本发明各剂量组对大鼠毛色、活动、呼吸和二便等一般状况无明显异常,对大鼠的进食量和饮水量无明显影响;
本发明大剂量组雌、雄大鼠早期有促进体重增长加快的趋势,后期的体重增长不对照组慢;小剂量早期加快雄鼠体重增长,后期无明显影响,对雌性大鼠体重无明显影响;
本发明可引起大鼠hgb、hct和血小板降低,停药可以恢复。各剂量组的pt时间显著延长,停药后部分恢复;
给药组的血清主要酶活性均有不同程度降低,cho和glu水平也显著降低,大、中剂量组的bun含量上升,中剂量组tpo、glb略有下降,白蛋白/球蛋白比例明显升高;停药4周后上述指标基本恢复。血清电解质水平变化尽管有统计意义,但变化幅度很小;
给药13周大、中、小剂量组大鼠的尿液ph上升,其他各项尿常规指标均和对照组相比无明显差异;
雌雄大鼠的肝脏和肾脏系数均显著增加,停药后恢复。组织脏器的巨检为发现异常,镜检显示中期大剂量组1只雄性大黄素前列腺有炎症细胞浸润;
骨髓象检查显示各组动物均处于活跃状态;
11.结论:
本发明长期给药可引起肝、肾重量明显增加,但肝酶活性无不良影响,肝组织液无形态学异常;肾功能指标血清bun水平小剂量组给药中期,大、中剂量组给药末期显著升高,但停药后均恢复,肾组织液无形态学异常。本发明可能有可逆性的肾毒性;
实施例1的小鼠急性毒性试验
1.样品:本发明,含生药2.255g/g。药物配制方法:本发明65g,加蒸馏水50℃温热搅拌混匀,继续加蒸馏水至100ml(基本为小鼠可灌胃最大浓度);
2.动物:icr小鼠,清洁级,雌雄各半,体重18-22g,由浙江省实验动物中心生产、提供,动物生产合格证:scxk(浙)2008-0033。动物饲养环境:温度:18-24℃,相对湿度:40-70%,昼夜明暗交替时间12h/12h,实验动物使用许可证号:syxk(浙)2011-0166;
3.方法:icr小鼠40只,雌雄各半,18-22g,随机分成2组,即正常对照组和本发明颗粒组,每组20只,雌雄各半。小鼠禁食过夜,称重,正常对照组灌胃给予蒸馏水,本发明颗粒组灌胃给予0.65g/ml的本发明颗粒(最大可灌胃浓度),体积均为0.40ml/10g,每间隔6h给药一次,共3次,总剂量78g/kg(相当于生药175.89g/kg),观察每次灌胃后及14天内小鼠状况;
4.结果:小鼠在灌胃给予本发明溶液后,均有少动、静伏等现象,第二次至第三次给药间出现雄鼠1/10,雌鼠2/10只死亡,第三次给药至给药后第二天累计出现雄鼠3/10,雌鼠3/10只死亡,死亡小鼠解剖可见胃部有残留药液,主要脏器巨检未见明显异常,存活小鼠个别可见肛门处粘附深色排泄物,其余未见明显异常,14天观察期内体重增长较对照组略缓慢,但无显著差异。见表16;
本发明颗粒拟临床规格9g/袋(含辅料30%),推荐使用方法1-2袋/次,2次/天,剂量为18-36g/天,相当于300-600mg/kg体重(按60kg体重计),相当于生药210-420mg/kg体重。小鼠以最大浓度最大体积给药3次,累计30%动物死亡,因此本发明颗粒小鼠ld50大于78g/kg,即175.89g生药/kg,为拟推荐临床最大剂量的418.8倍;
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种多花黄精保健酒的酿造方法与制造工艺
- 一种防治仔猪咳喘的中药组合物及其制备方法与制造工艺
- 一种双齿围沙蚕抗凝血肽及其用途的制造方法与工艺
- 一种治疗中风的药物及其制备方法与制造工艺
- 一种防治乳汁不下的中药组合物的制造方法与工艺
- 四氢异喹啉-3-甲酰-K(GRPAK)RGDV,其合成,活性及应用的制造方法与工艺
- 1-羟基-2-(氧乙酰基十肽苯基)-四甲基咪唑啉,其合成,活性及应用的制造方法与工艺
- 二羟基二甲基四氢异喹啉-3-甲酰-Lys(Lys),其合成,活性及应用的制造方法与工艺
- 二羟基二甲基四氢异喹啉-3-甲酰-Lys(Ala-Lys),其合成,活性及应用的制造方法与工艺
- 1-羟基-2-(取代苯基)-4,4,5,5-四甲基咪唑啉,其合成,活性及应用的制造方法与工艺