分枝杆菌噬菌体裂解酶Lysin-Guo1的制备与应用的制作方法
本发明涉及分子生物学
技术领域:
,具体涉及分枝杆菌噬菌体裂解酶Lysin-Guo1的制备与应用。
背景技术:
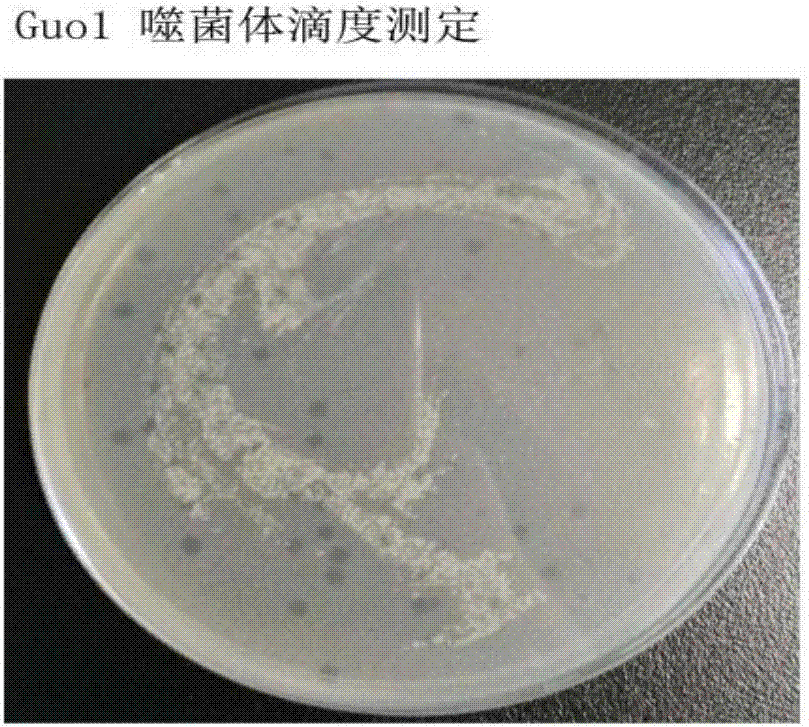
:分枝杆菌(Mycobacterium),种类较多,可分为结核分枝杆菌复合群、非结核分枝杆菌和麻风分枝杆菌三类。结核分枝杆菌(M.tuberculosis),俗称结核杆菌,为专性需氧、革兰氏阳性菌,为细长略带弯曲的杆菌,大小1-4*0.4μm。近年发现结核分枝杆菌在细胞壁外尚有一层荚膜,荚膜对结核分枝杆菌有一定的保护作用。结核分枝杆菌不产生内、外毒素。其致病性可能与细菌在组织细胞内大量繁殖引起的炎症,菌体成分和代谢物质的毒性以及机体对菌体成分产生的免疫损伤有关。结核杆菌是引起结核病的病原菌,可侵犯全身各器官。结核病至今仍为重要的传染病。据2016年WHO报道,结核病是全世界十大死因之一;2015年,1040万人患有结核病,180万人因该病死亡;结核病在世界各地都会发生。2015年,亚洲发生的新发结核病病例最多,占全球新发病例的61%。抗结核药物已经使用了几十年,对一种或更多药物产生耐药的菌株已在所调查的每个国家得到记载。当抗结核病药物得不到正确使用时就会出现耐药性,这缘于卫生保健提供者开具的处方不正确,药品质量低劣,以及病人过早中断治疗。耐多药结核病是一种由对异烟肼和利福平这两种最有效的一线抗结核药物都没有反应的细菌导致的结核病。通过使用二线药物,可以治疗和治愈耐多药结核病。但二线治疗方案具有局限性,且需要用价格昂贵且有毒性的药物进行长期化疗(长达两年治疗时间)。某些情况下,也可能出现更严重的耐药性。广泛耐药结核病是一种更为严重的由对最为有效的二线抗结核药物没有反应的细菌导致的耐多药结核病,往往会导致病人无药可治情况。2015年,全世界约有48万人染上了耐多药结核病。耐多药结核病负担大都出现在3个国家——中国、印度和俄罗斯联邦,这些国家共占到全球病例数的近一半。2015年,约有9.5%的耐多药结核病为广泛耐药结核病。随着抗痨药的不合理应用,结核菌的耐药性问题日益加剧,新型抗生素的研发速度远远赶不上耐药菌的产生速度,寻找新的抗菌制剂迫在眉睫。而噬菌体及其裂解酶因其高效的杀菌能力及高度的宿主专一性而成为新一代抗菌制剂的候选之一,对于噬菌体及其裂解酶的研究在近些年被许多研究者提上日程。噬菌体(bacteriophage)是一类能特异性识别并感染细菌的病毒,可以是RNA或DNA病毒,没有细胞结构,仅由衣壳蛋白和其内部的遗传物质组成,必须以细菌为宿主进行复制和繁殖。噬菌体是细菌的天然杀手,广泛存在于自然界中,几乎所有细菌无论多么严重地耐药都可以很容易分离到其天然敌军。相对于传统的抗生素治疗细菌感染,噬菌体治疗具有其独特的优势:噬菌体具有十分严格的宿主特异性,对人、动物、植物和环境(包括细菌微生态环境)具有绝对的安全性。噬菌体可以采用活噬菌体制剂,这些活噬菌体可以利用宿主菌进行大量繁殖,因此噬菌体产品往往只需要小剂量,并且只需要一次用药,即可达到杀灭所有感染菌。除了活噬菌体制剂,来源于噬菌体的裂解酶也是防治细菌性疾病的另一种手段。噬菌体裂解酶在噬菌体裂解细菌的过程中水解细菌细胞壁肽聚糖,从而破坏细胞壁释放子代噬菌体,作为潜在的新型杀菌剂,它具有抗生素所无法比拟的优势。噬菌体裂解酶的杀菌机制与抗生素完全不同,细菌的细胞壁肽聚糖结构在细菌的进化过程中十分保守,因此裂解酶导致细菌耐药性的可能性远小于抗生素。而对于分枝杆菌噬菌体裂解酶,目前研究还比较少,且裂解酶是否对结核分枝杆菌具有抑菌作用仍缺乏相关数据。技术实现要素:本发明的目的是为抗生素耐药性提供一种新选择。本发明通过下述技术方案实现:一种抑菌剂,其主要活性成分为分枝杆菌噬菌体裂解酶Lysin-Guo1、含有Lysin-Guo1表达元件的载体、含有Lysin-Guo1表达元件的表达盒或含有Lysin-Guo1表达元件的宿主细胞中的至少一种,Lysin-Guo1具有如SEQIDNO.1所示的氨基酸序列。其中,分枝杆菌噬菌体裂解酶Lysin-Guo1的编码基因具有如SEQIDNO.1所示的核苷酸序列。具体的,所述抑菌剂的抑菌谱为:结核分枝杆菌、耻垢分枝杆菌、大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌。本发明还提供了分枝杆菌噬菌体裂解酶Lysin-Guo1的制备方法,包括如下步骤:分枝杆菌噬菌体裂解酶Lysin-Guo1的编码基因克隆至T/A克隆载体上,经验证为阳性的质粒进行酶切,回收分枝杆菌噬菌体裂解酶Lysin-Guo1的编码基因,与相同酶切后的表达载体骨架连接,验证为阳性的重组表达载体pET-Lysin-Guo1经液体培养基培养,诱导表达,收集菌液,提取,纯化;分枝杆菌噬菌体裂解酶Lysin-Guo1具有如SEQIDNO.1所示的氨基酸序列。其中,所述的T/A克隆载体为pMD20-T。其中,分枝杆菌噬菌体裂解酶Lysin-Guo1的编码基因的T/A克隆的引物1具有如SEQIDNO.3所示的核苷酸序列,引物1的5’端设计有NdeI内切酶的识别位点;引物2具有如SEQIDNO.4所示的核苷酸序列,引物2的5’端设计有XhoI内切酶的识别位点。其中,所述的酶切采用NdeⅠ和XhoⅠ双酶切。其中,所述的表达载体骨架为pET28a。其中,所述的纯化采用亲和层析法,收集的蛋白质进行复性。本发明的有益效果:本发明分离出一株分枝杆菌噬菌体Guo1,并从中克隆得到了裂解酶蛋白Lysin-Guo1的编码基因。该裂解酶蛋白Lysin-Guo1能够抑制多种分枝杆菌的生长,具有杀结核分枝杆菌的作用,还发现该裂解酶对其他细菌包括大肠杆菌、金黄色葡萄球菌、鲍曼不动杆菌和铜绿假单胞菌也具有一些抑菌作用。本发明为耐药结核菌的新型抗痨替代疗法打下了基础。附图说明图1为结核分枝杆菌噬菌体Guo1的一步生长曲线。图2结核分枝杆菌噬菌体Guo1噬菌体滴度测定。图3为PCR扩增Lysin-Guo1的电泳结果,其中M为Marker,泳道1和2为Lysin-Guo1基因,约1400bp大小。图4为双酶切验证重组质粒PET28a-Lysin-Guo1,其中M为Marker,泳道1为重组质粒PET28a-Lysin-Guo1经双酶切后形成的双条带(分别在1317bp和5360bp附近);泳道2为重组质粒PET28a-Lysin-Guo1(约5500bp大小)。图5为SDS-PAGE验证Lysin-Guo1蛋白的表达,其中泳道1为蛋白Marker,泳道2为BL21(DE3)-pET28a-Guo1未经IPTG诱导,泳道3/5为BL21(DE3)-pET28a-Guo1经IPTG诱导后上清,泳道4/6为BL21(DE3)-pET28a-Guo1经IPTG诱导后沉淀。箭头所示为表达的Lysin-Guo1蛋白,蛋白大小约48.3kD。图6为纯化的Lysin-Guo1蛋白,其中泳道1为蛋白Marker,泳道2/3/5/6为纯化的蛋白,蛋白大小约48.3kDa,与预期的蛋白大小相符。图7为平板裂解法检测Lysin-Guo1蛋白的裂解活性,供试菌为耻垢分枝杆菌(Mycobacteriumsmegmatismc255)。图中箭头所示为噬菌斑。图8为平板法测Lysin-Guo1蛋白活性。结果显示Lysin-Guo1处理组与PBS对照组相比,受试菌明显被抑制。图9为刃天青法检测Lysin-Guo1蛋白对受试菌的裂解活性。刃天青为一种氧化还原指示剂,在有活菌存在时显示为粉红色,在无活菌存在时仍保持天蓝色。结果显示Lysin-Guo1处理组的受试菌均为青蓝色,说明无活菌存在,而对照组刃天青变为粉红色,说明存在活菌。图10为Lysin-Guo1蛋白抗结核分枝杆菌标准株(MycobacteriumtuberculosisH37Rv)H37Rv的最小抑菌浓度(minimalinhibitoryconcentration,MIC)的测定,结果显示Lysin-Guo1(2.8μg/μL)稀释16倍后达到H37Rv的MIC(58ng/mL)。图11编码基因功能预测,通过NCBIblast网页预测(https://www.ncbi.nlm.nih.gov)显示基因17具有肽酶、酰胺酶、肽酶结合域,Lysin-Guo1裂解酶编码基因可能编码含肽酶:PeptidasefamilyM23;酰胺酶:Amidase_2;肽酶结合域:PG_binding_1的肽段样蛋白。图12编码基因功能预测显示肽酶、酰胺酶、肽酶结合域的3D构象(肽酶:PeptidasefamilyM23;酰胺酶:Amidase_2;肽酶结合域:PG_binding_1)。图13Lysin-Guo1编码基因与pubmed已经发表5株噬菌体裂解酶的系统进化树。图14Lysin-Guo1与pubmed已发表的gp2-Ms6裂解酶两者氨基酸序列比对。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的菌株材料、试剂等,如无特殊说明,均可从商业途径得到。1、菌株及质粒结核分枝杆菌噬菌体Guo1分离方法见文献“姚义勇,江莉莎,张莉,等.分枝杆菌噬菌体Guo1环状基因组特征及生物学特性分析[J].微生物学通报,2015,42(8):1529-1538.”大肠杆菌感受态JM109:购自宝生物工程(大连)有限公司;大肠感受态BL21(DE3):购自北京天根生化科技有限公司。表达载体pET28a:购自Novengen公司。T载体:购自宝生物工程(大连)有限公司。2、培养基和试剂LB培养基:购自BD公司,胰蛋白胨10g,酵母提取物5g,氯化钠10g,补水至1L。LB固体培养基:在LB培养基基础上加入加入15g琼脂粉。121℃高压灭菌20min。7H9培养基:购自BD公司,7H9middlebrothis0.47g,98%甘油0.2mL,吐温终浓度0.05%,补水至100mL。7H9半固体培养基,在7H9液体培养基的基础上添加0.4g琼脂粉。121℃高压灭菌20min。7H10固体培养基:购自BD公司,7H10middlebrothis1.9g,98%甘油0.5mL,补水至100mL。121℃高压灭菌20min。λ噬菌体DNA提取试剂盒:购自北京艾比根生物技术有限公司。NdeI和XhoI限制性内切酶:购自NEB公司。DNAMarker:购自宝生物工程(大连)有限公司。噬菌体缓冲液(Phagebuffer)用于稀释噬菌体,配方:Tris-base1.211g,MgSO41.204g,NaCl4g,ddH2O980mL,pH7.5。实施例1分分枝杆菌噬菌体Guo1的分离与鉴定一、分枝杆菌噬菌体的分离利用耻垢分枝杆菌作为指示菌,从医院结核病房的花盆土壤中分离噬菌体,具体操作步骤如下:1、标本的处理:取泥土5g,用10mL噬菌体缓冲液(phagebuffer)浸泡30min。使噬菌体充分进入缓冲液中,4500g离心10min,小心吸取上清,用0.22μm过滤器过滤除菌。2、噬菌体扩增:1)取1mL上述上清加入4mL培养至对数生长期的耻垢分枝杆菌,充分混匀后室温静置15min,使分枝杆菌噬菌体吸附耻垢分枝杆菌。2)将混合液加入10mL7H9液体培养基,37℃,160rpm摇床震荡过夜培养。3)12h后收集培养基,4500g离心10min,小心吸取上清,0.22μm滤器过滤除菌。4)取上清10μL,用phagebuffer梯度稀释至10-10,分别将每个稀释梯度的噬菌体10μL与培养至对树生长期的耻垢分枝杆菌100μL混合室温静置15min,然后混合于4mL55℃7H9半固体培养基铺于下层为7H10的固体培养基上。待上层培养基凝固后置于37℃孵育箱静止培养24h后观察噬菌斑。二、噬菌体的纯化1)培养24h后可见10-7培养板上出现单个噬菌斑,用高压灭菌后的200μL枪头吸取单个噬菌斑,溶于100μL噬菌体缓冲液(Phagebuffer)。2)取10μL噬菌体用phagebuffer梯度稀释至10-10,分别将每个稀释梯度的噬菌体10μL与培养至对树生长期的耻垢分枝杆菌100μL混合室温静置15min,然后混合于4mL55℃7H9半固体培养基铺于下层为7H10的固体培养基上。待上层培养基凝固后置于37℃孵育箱静止培养24h后观察噬菌斑。三、噬菌体滴度的测定噬菌体的滴度,为每毫升样品中所含有的噬菌体个数,可通过双层平板法测定。具体测定方法如下:将噬菌体原液用7H9培养基倍比稀释102~107倍,分别取10μL与100μL对数生长期的耻垢分枝杆菌(Mycobacteriumsmegmatismc255)混合,室温静置15min;分别将上述混合悬液加入4mL55℃7H9半固体培养基中,适当吹吸混匀后倒入下层7H10培养板上,静置于水平台面30min,待上层半固体凝固后倒置放入37℃温箱过夜培养;观察噬菌斑并按照不同稀释倍数平板上的噬菌斑个数来计算噬菌体的滴度。结果如图2所示,106倍稀释的平板上长出47个噬菌斑,可计算得到噬菌体效价约为4.7×107pfu/mL。四、提取结核分枝杆菌噬菌体Guo1核酸参照λ噬菌体DNA提取试剂盒说明书,提取10mL噬菌体DNA,具体操作如下:将0.5%氯仿处理后的Guo1噬菌体,10000g,4℃离心10min。取10mL上清,加入20μLRNA酶(20mg/mL)和20μLDNA酶(50mg/mL),充分混匀37℃温育30min。加入2mL冰预冷的噬菌体沉淀液,轻柔充分混合后置冰上冷却。10000g,4℃离心10min,弃上清,干燥1min,沉淀下来的噬菌体外观为透亮或者稍白的沉淀。加入500μL裂解缓冲液,吹打重悬噬菌体,加入100μL20%SDS,立即轻柔颠倒混匀4-6次,70℃温育10min,然后置冰上冷却。加入100μL杂质沉淀液,立即轻柔颠倒混匀4-6次,最高速12000g,4℃离心10min。仔细将上清(约350μL)转入新的离心管,加入350μL结合液,轻柔旋涡混匀。将上述混合物加入一个吸附柱中(吸附柱放入收集管中),12000rpm离心60s,倒掉收集管中的废液。加入700μL漂洗液,12000rpm离心60s,弃废液。重复一遍。将吸附柱放回空收集管,12000rpm离心2min,尽量除去漂洗液,以免漂洗液中的乙醇影响下游反应。取出吸附柱,放入一个干净的离心管中,在吸附膜的中间部位加100μL洗脱液(洗脱液预先置于50℃水浴预热,洗脱液根据需要可为纯水)。室温放置2min,12000rpm离心1min。将得到的溶液重新加入离心吸附柱中,室温放置2min,12000rpm离心1min。电泳检测DNA提取结果,并测其浓度,存于-20℃备用。五、Guo1全基因组序列测定以及功能预测将提取的Guo1核酸送北京六合华大基因科技股份有限公司(北京,中国)按照鸟枪法策略进行测序,经Phred/PhraD/Consedh软件组装重叠群和PCR扩增连接重叠群缺口,完成全基因组测序,上传序列信息至GenBank,登录号为KJ725374。采用Glimmer软件预测分枝杆菌噬菌体Guo1基因组的编码基因功能,显示“基因17可能编码裂解酶系统”,但预测仅止步于其DNA序列,对该基因编码的蛋白质实际上是否具有裂解细菌细胞壁功能?具有裂解何种细菌细胞壁?特别是对分枝杆菌宿主菌细胞壁有无裂解作用?这些问题仍需进行实验验证得知,本申请旨在进一步验证基因17是否具有外源性裂解细菌细胞壁的功能。Lysin-Guo1裂解酶结构功能预测如图11所示,Lysin-Guo1裂解酶编码基因可能编码含肽酶:PeptidasefamilyM23;酰胺酶:Amidase_2;肽酶结合域:PG_binding_1的肽段样蛋白。Lysin-Guo1裂解酶结构的3D构象预测如图12所示,分别为肽酶、酰胺酶、肽酶结合域的3D空间构象预测图。经研究,Lysin-Guo1与pubmed已发表的分枝杆菌噬菌体Ms6裂解酶以及与以往已研究的分枝杆菌噬菌体(L5、D29、Che12、TM4)裂解酶DNA序列、氨基酸序列都不同,来源于不同噬菌体基因簇(cluster),其系统进化树如图13所示。利用了MEGA6.0软件构建了Lysin-Guo1裂解酶的系统进化树,比对了pubmed已发表的6株分枝杆菌噬菌体裂解酶的同源性,标尺代表进化距离,从图13中可以看出Lysin-Guo1具有与其余5株噬菌体裂解酶明显不同的来源分支,通过对Guo1全基因组序列BLAST比对发现:Guo1与分枝杆菌噬菌体G群具有明显的同源性。Lysin-Guo1与gp2-Ms6两者氨基酸序列比对结果如图14所示:两株噬菌体裂解酶氨基酸序列的比对使用ClustalW软件,相同的氨基酸基序具有相同的蓝色底色。从图14中也可看出,本研究Lysin-Guo1裂解酶与以往已发表的分枝杆菌噬菌体裂解酶不同,具有研究价值。六、噬菌体的生物学特性1、最佳感染复数的测定:感染复数(Multiplicityofinfection,MOI)是指初始感染时加入的噬菌体数量与宿主菌数量的比值。采用梯度稀释和双层琼脂培养法测定噬菌体滴度。具体测定方法为:(1)按MOI分别为10-3、10-2、10-1、100、101、102的比例加入分枝杆菌噬菌体Guo1和对数生长期的耻垢分枝杆菌宿主菌悬液;(2)各个MOI均采用双份复板培养取平均值,同时设置不加噬菌体的宿主菌和不加宿主菌的噬菌体为对照组;(3)37℃双层琼脂培养24h后收集噬菌体,采用梯度稀释测定噬菌体滴度,能产生最高滴度噬菌体的MOI即为最佳感染复数。表1所示为分枝杆菌噬菌体Guo1最佳感染复数的测定。可见当MOI=10-2时噬菌体滴度最高,可以得出噬菌体Guo1的最佳感染复数为10-2。表1感染复数的测定2、噬菌体的一步生长曲线一步生长曲线(One-stepgrowthcurve)是可定量描述毒性噬菌体生长规律的实验曲线,用于研究噬菌体的复制情况。具体操作时将适量噬菌体接种于高浓度细菌培养物中以建立同步感染,以感染时间为横坐标,以噬菌体效价为纵坐标而绘制出的特征曲线即为一步生长曲线,分为潜伏期、裂解期和平稳期。通过绘制一步生长曲线,可以得出噬菌体的三个重要的特性参数:潜伏期、裂解期和裂解量。具体操作如下:(1)按照MOI=10的比例加入噬菌体和宿主菌,37℃孵育15min,10000×g离心1min,弃上清,7H9液体培养基洗涤2次后,重悬于5mL的7H9液体培养基。(2)置于37℃摇床培养(160r/min),300min,每30min取样100μL,10000×g离心1min,吸取上清,采用梯度稀释和双层琼脂培养法测定噬菌体滴度(方法同上)。(3)各时间点做双份复管培养取平均值,实验重复3次。(4)以感染时间为横坐标,实际测得的噬菌体滴度(×104PFU/mL)为纵坐标,绘制一步生长曲线。结果如图1所示,从图中可以看出:分枝杆菌噬菌体Guo1感染宿主菌的潜伏期约为120min,裂解期约为120min,240min后进入平台期,噬菌体的滴度不再增加,裂解量约为47pfu。实施例2、Lysin-Guo1蛋白的表达纯化一、基因扩增、重组体构建1、Lysin-Guo1基因的获得以噬菌体Guo1的基因组DNA为模板,采用引物1和引物2进行PCR扩增。反应体系如下:Guo1基因组DNA0.5μL,5×Buffer10μL,dNTPs4μL,Taq酶0.5μL,引物12μL,引物22μL,去离子水补足至50μL。反应条件:95℃预变性5min;95℃变性30s,60℃退火30s,72℃延伸1min,30循环;72℃延伸1min。引物1:5’-CGCCATATGGTCAGAACACCAGCCCGAGT-3’(下划线部分为NdeI的识别位点,其后的序列为SEQIDNO.2的第1-19位);引物2:5’-CCGCTCGAGATGGCCGATCGTTTCTTCC-3’(下划线部分为XhoI的识别位点,其后的序列为SEQIDNO.2的第1298-1317位的反向互补序列)。反应结束后,取5μLPCR扩增产物,加入1μLDNA6×LoadingBuffer缓冲液,2%琼脂糖凝胶电泳30min后于紫外透射仪下观察结果并记录。结果如图3出现单一大小约1320bp的目的条带,即可用EasyPureQuickGelExtractionKit回收。进一步,将纯化后的PCR扩增连接入pMD20-T载体,并转化入感受态细胞JM109。挑取含ampR的LB平板上单克隆菌落于5mLLB液体培养基,过夜培养后用天根生化科技有限公司的质粒小提试剂盒提取质粒,将重组质粒进行PCR扩增验证。将初步鉴定正确的重组质粒送样测序。测序表明在pMD20-T载体中插入“CGCCATATG+SEQIDNO.2+CCGCTCGAG”的重组质粒命名为pMD20-T-Lysin-Guo1。其中,将序列表中SEQIDNO.2所示基因命名为Lysin-Guo1基因。Lysin-Guo1基因编码序列表中SEQIDNO.1所示的Lysin-Guo1蛋白。2、重组表达载体pET-Lysin-Guo1的构建分别用NdeI和XhoI双酶切步骤一已鉴定正确的重组质粒pMD20-T-Lysin-Guo1和载体pET28a,回收经双酶切的目的基因片段Lysin-Guo1(大小约为1317bp)及酶切后的pET28a载体骨架片段,并将二者进行连接。将连接产物转化至大肠杆菌感受态细胞BL21(DE3)。采用菌落PCR的方法鉴定重组质粒pET28a-Lysin-Guo1。具体操作如下:从平板上挑取单菌落入1mlLB液体培养基继续培养3h,然后取3μL菌液作为模板加入配置好的PCR体系中,反应体系和反应程序同步骤一1,反应结束后,1%琼脂糖凝胶电泳观察条带大小。菌落PCR鉴定结果同图3,大约在1317bp附近出现单一清晰条带,与目的条带大小相符,初步鉴定重组载体构建成功。进一步将单克隆菌摇菌后提取质粒进行NdeI和XhoI双酶切验证,结果如图4,重组质粒经双酶切后形成双条带(大约在5370bp和1317bp),未被双酶切的重组质粒形成单一条带(大约在6680bp附近)。进一步将上述验证正确的重组菌送测序,结果显示在多克隆位点NdeI和XhoI之间插入序列2所示的Lysin-Guo1的基因序列。理论上,重组表达载体表达的Lysin-Guo1蛋白的N端和C端均含有His标签。二、Lysin-Guo1蛋白的表达1、重组蛋白的表达(1)将步骤一构建的测序正确的重组表达菌,划线于LB平板过夜培养;(2)挑取单克隆,加入5mLKan+的LB培养基中,37℃200rpm震荡培养至对数生长期后转入500mLKan+的LB培养基,于37℃震荡培养至OD600为0.6左右;(3)加入终浓度为0.5mM的IPTG(同时设置未加IPTG的对照),37℃180rpm震荡培养6h。(4)于4℃,4500rpm离心20min收集细菌沉淀,将其重悬于20mLPBS中,4500rpm离心20min,重复2次;(5)向沉菌中加入10mL细菌裂解液(含溶菌酶50mg/mL2μL、DNA酶20mg/mL2μL),-80℃与37℃反复冻融3次至菌液变清亮。4℃离心20min,弃上清,得到Lysin-Guo1蛋白粗提液。将Lysin-Guo1蛋白粗提液进行SDS-PAGE电泳检测,电泳结束后将胶块进行考马斯亮蓝快速染色,脱色液脱色,观察并记录结果。SDS-PAGE鉴定结果如图5所示,从图中可以看出,未诱导的重组菌无明显目的条带(泳道2)。转入重组表达载体pET28a-Lysin-Guo1的大肠杆菌BL21(DE3)经IPTG诱导后表达了与预期大小(约为48.3kDa)一致的目的蛋白条带,但目的蛋白大部分存在于反复冻融离心后的沉淀中(泳道4/6),而上清无明显条带(泳道3/5),说明表达的重组蛋白以包涵体形式表达。2、重组蛋白的纯化亲和层析法(镍柱)纯化回收His标记的重组蛋白,按照所购买的镍柱纯化说明书,具体纯化步骤如下:缓冲液的准备:包涵体蛋白纯化缓冲液配方见表2。表2包涵体蛋白纯化缓冲液配方组装层析柱:将Ni-AgaroseResin填料3mL混匀后加入层析柱,室温静置10分钟,待凝胶与溶液分层后,把底部的出液口打开,让乙醇通过重力作用缓慢流出。向装填好的柱中加入5倍柱体积的去离子水将乙醇冲洗干净后,再用8倍柱体积的BindingBuffer平衡柱子,平衡结束后即可上样。包涵体蛋白的纯化:将上述步骤获得Lysin-Guo1蛋白粗提液4℃离心20min,弃去上清,用含8M尿素的BindingBuffer10mL~20mL溶解沉淀,混匀充分溶解,可置于30℃促进溶解。4500rpm,4℃离心15min,分离上清与沉淀,收集上清。将上清负载上柱,流速为10倍柱体积/小时,通过控制加入的上清(菌体裂解液)的速度来控制流速,收集流穿液。使用15倍柱体积的BindingBuffer冲洗柱子,洗去杂蛋白。使用20mL的ElutionBuffer洗脱Lysin-Guo1蛋白,收集洗脱峰。洗脱后,依次使用5倍柱体积的BindingBuffer,5倍柱体积的去离子水洗涤柱子,再用3倍柱体积的20%乙醇平衡(乙醇要将填料浸没),封柱后2~8℃保存。用SDS-PAGE分析纯化结果。结果如图6所示,其中泳道1为蛋白Marker,泳道2/3/5/6为纯化的蛋白,泳道2上样为5μL,泳道3上样10μL,泳道5/6上样15μL。从图中看出,得到高浓度且纯度较大的Lysin-Guo1蛋白。3、重组蛋白的透析复性由于蛋白表达过快,来不及折叠形成正确三级结构,所得到的重组蛋白Lysin-Guo蛋白为包涵体形式,在纯化过程中添加了较强变性剂尿素,因此后续关于该蛋白的活性研究需要复性透析去除变性剂,使重组蛋白恢复自然活性。1)透析袋的处理:把透析袋剪成适当15cm长度的小段,在大体积2%(W/V)碳酸氢钠、1mmol/LEDTA(pH8.0)溶液中将透析袋煮沸10min。蒸馏水彻底清洗透析袋,再1mmol/LEDTA(pH8.0)溶液中将透析袋煮沸10min。冷却后存于PBS置于4℃。2)将需要透析的Lysin-Guo1蛋白装入透析袋,透析袋两端用透析夹夹紧。3)加入100倍样品体积的PBS透析液,其中透析液中含尿素分别为6M、4M、2M、0M,进行梯度透析。另外,透析液还包含0.1%PEG2000、0.1mM氧化型谷胱甘肽、1mM还原型谷胱甘肽、1%蔗糖。分别在2h,4h,8h,10-10h更换透析液。4)透析后的蛋白见少量白色浑浊。混匀后测其浓度并分装存于-20℃。三、Lysin-Guo1蛋白抗菌活性及抗菌谱检测为了进一步验证分枝杆菌噬菌体裂解酶Lysin-Guo1蛋白的抗菌活性,选用耻垢分枝杆菌(MS,快生长型分枝杆菌),结核分枝杆菌标准株(H37Rv,慢生长型分枝杆菌),结核分枝杆菌临床分离株(TB)作为宿主待试菌。同时为了进一步了解该研究表达的蛋白的抗菌谱,选用大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌和鲍曼不动杆菌作为候选待试菌。分别采用点滴法、平板培养法和刃天青显色法测定步骤二所得Lysin-Guo1蛋白的裂解酶活性。实验重复三次。表3Lysin-Guo1抑菌活性的测定待试宿主菌敏感性待试候选菌敏感性耻垢分枝杆菌Ms.+++大肠杆菌++结核分枝杆菌标准株H37Rv+++铜绿假单胞菌+结核分枝杆菌临床分离株+++金黄色葡萄球菌+/-鲍曼不动杆菌+1、点滴法取培养至对数生长期的耻垢分枝杆菌100μL,混合于55℃的7H9半固体培养基倒于下层为7H10的培养板上,置于平台上冷却30min,然后滴加20μLLysin-Guo1蛋白于双层培养物上,置于37℃恒温箱静止培养48h后观察结果。结果如图7,在双层培养板上出现明显噬菌斑。初步说明Lysin-Guo1蛋白具有裂解活性。2、平板培养(1)取100μL培养至对数生长期的待试菌株于2mLEP管,向EP管中加入100μL的Lysin-Guo1蛋白,对照组加入100μLPBS缓冲液。置于37℃恒温箱培养5天(结核分枝杆菌标准株H37Rv、结核分枝杆菌临床分离株TB)和24h(耻垢分枝杆菌、大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌和鲍曼不动杆菌)。(2)取培养后100μL菌,加入4mL于55℃预热的7H9半固体培养基中,吹吸混匀后,倒入下层7H10固体平板上,室温静置于水平台面30min(限分枝杆菌);取培养后100μL菌,加入4mL于55℃预热的LB半固体培养基中,吹吸混匀后,倒入下层LB固体平板上,室温静置于水平台面30min。48h或者14~21天后观察结果。3、刃天青显色法(1)同上述步骤(1)。(2)向(1)培养管中加入20μL0.2%的刃天青,置于37℃孵育箱继续培养24h,观察并记录颜色的变化。3、结果平板法宿主菌处理后24h(耻垢分枝杆菌、大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌和鲍曼不动杆菌)或者14天(结核分枝杆菌标准株H37Rv、结核分枝杆菌临床分离株TB)后,实验组培养平板上未见菌落形成,而对照组培养平板见菌落生长,如图8所示。刃天青法如图9见Lysin-Guo1蛋白处理组刃天青仍保持蓝色,说明无活菌生长;而PBS缓冲液对照组刃天青变为粉红色,说明有活菌生长。从图中可以看出,两种方法测定结果一致,说明Lysin-Guo1蛋白不仅具有抑制宿主菌耻垢分枝杆菌、结核分枝杆菌生长的作用,还具有抑制大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌和鲍曼不动杆菌的生长。四、Lysin-Guo1蛋白抗结核分枝杆菌标准株H37Rv最小抑菌浓度(MIC)的测定最小抑菌浓度(minimalinhibitoryconcentration,MIC),定义为能够抑制细菌生长、繁殖的最低药物浓度。具体操作如下:1)取培养2-3周的结核分枝杆菌标准株H37Rv(MycobacteriumtubercμLosisH37Rv),用生理盐水稀释成1号比浊管比浊,约相当于3×107cfu/mL菌浓度。用7H9液体培养基20倍稀释结核分枝杆菌。2)分别取100μL7H9液体培养基入48孔板的1~10孔,重复2组平行实验。3)取100μLLysin-Guo1蛋白入第1孔,枪吹打混匀,然后从1孔取100μL入第2孔,继续吹打混匀,进行2倍稀释至第8孔。第9孔为无Lysin-Guo1蛋白的阳性对照。重复2组平行实验。4)取步骤1)100μL菌液入48孔板的1~9孔,第10孔为培养液无菌对照。重复2组平行实验。5)48孔板封膜后置于37℃孵育箱培养5天,在第6天,加入30μL过滤除菌的0.02%(W/V)的刃天青,继续孵育24h,第9孔变为粉红色,添加刃天青至其余孔,再孵育24h。结果如图10,在Lysin-Guo1(原浓度2.8μg/μL)稀释16倍后达到H37Rv的MIC(58ng/mL)。序列表<110>重庆医科大学附属第一医院<120>分枝杆菌噬菌体裂解酶Lysin-Guo1的制备与应用<130>2017<141>2017-10-24<160>5<170>SIPOSequenceListing1.0<210>1<211>438<212>PRT<213>ArtificialSequence<400>1MetAlaAspArgPhePheProMetArgAspGlyThrTyrThrLeuSer151015SerGlyPheGlyAlaArgTrpGlyThrGlnHisArgGlyLeuAspPhe202530AlaAlaLysAspGlyThrProIleTyrAlaAlaGlnAlaGlyThrVal354045AlaTyrIleGlyProAlaGlnGlyPheGlyGlnTrpIleValIleAsp505560HisProAlaAlaAspGlyAlaGlyThrThrValTyrGlyHisMetTrp65707580AsnAlaPheAlaThrGlyLeuLysAlaGlyAspArgValGlnAlaGly859095GlnLeuIleAlaTyrValGlyAlaAsnGlyGlnSerThrGlyProHis100105110LeuHisPheGluValHisProThrValTrpArgGlnGlySerGlnIle115120125AspProProProTrpLeuHisGlySerArgAsnProGlyAspAlaPro130135140AlaProAlaProAlaAspProProAlaSerAlaProLeuGlyGlyGln145150155160ArgMetGlnAspProPheThrGlyGluValTrpSerProAsnArgSer165170175ValArgGlnLysProAlaProArgTrpIleAlaIleHisThrGlnGlu180185190GlyGlyArgThrAlaArgAspLeuCysGluGlyTrpLeuAlaLysArg195200205GluSerGlnValSerTyrHisValAlaValAspAspArgGluIleLeu210215220LysValValAlaGluSerAspArgProTrpAlaAlaAlaAsnAlaAsn225230235240AspTyrAlaPheHisValValAlaAlaGlySerTyrAlaGlyTrpSer245250255ArgGlyLysTrpLeuGluThrAspAlaSerAspGlyLysAsnGluAsp260265270ValGluLeuThrAsnLeuAlaLysValCysAlaTrpTrpCysGlnLys275280285TyrGlyIleProAlaGluTrpIleGlyGlyArgGlyValProTrpGly290295300LeuAspGlyIleCysGlyHisGluAspPheGlyAlaTrpGlyGlyGly305310315320HisHisAspProGlyProGlyPheProAlaAspGluLeuIleArgArg325330335ValArgAlaLeuLeuGlyGlySerThrProGluProLeuProProAla340345350ProProValAlaLeuProGlyThrAsnProAspGlnTyrAlaGlyVal355360365LeuLeuTyrArgGlyArgProGlyGlnAspProArgGlnValArgVal370375380LeuGlnThrArgLeuLysArgAlaTyrSerLysLeuAspValAspGly385390395400IlePheGlyProHisThrGluAlaCysValArgAspTyrGlnHisLeu405410415HisProProLeuValAlaAspGlyIleValGlyProAlaThrAlaAla420425430AlaLeuGlyLeuValPhe435<210>2<211>1317<212>DNA<213>ArtificialSequence<400>2tcagaacaccagcccgagtgcggcagcggtcgccggcccgacgatgccgtcggcgaccag60gggcgggtgcaagtgctggtagtcgcggacgcacgcttcggtgtgcggcccgaagatgcc120gtcgacgtcgagcttcgagtaggcccgtttcagccgtgtttgcagcacgcggacctgtcg180cggatcctgcccaggccggccgcggtagagcagaacgccggcgtattggtcgggattcgt240gccaggcagcgccaccggcggcgccggcggtagcggttccggtgtggatccgccgagcag300cgcgcgtacgcgccgaatcagctcgtcggccgggaatccgggtccggggtcatggtgtcc360cccgccccaagcgccgaagtcctcatgtccacagatgccgtcgaggccccatggcacgcc420tcgcccgccgatccattcggccgggatgccgtacttctggcaccaccacgcgcagacctt480cgcgagattggtcagctcgacgtcttcgttcttgccgtcggacgcgtcggtttcgagcca540cttgccgcgggaccagccggcgtagctgccggcggcgacgacgtgaaacgcgtagtcgtt600ggcgttcgccgcggcccatggacggtcggactcggcgacgaccttcagaatctcgcggtc660gtcgacggcgacgtggtagctcacctgagactcacgcttcgccagccagccttcgcacag720atcgcgcgcggttcgaccgccttcctgcgtgtgaatcgcgatccaccgcggcgccggctt780ctgccgtaccgagcggttcggcgaccagacttcgccggtgaacggatcctgcattcgctg840acctcctagtggagcggacgccggcggatcggccggcgcgggtgccggcgcatcgccggg900attccgggagccgtgcagccacggcggcgggtcgatctgggagccttggcgccacacggt960cggatgaacttcgaagtgcaggtgcgggcccgtcgactgcccgttggcgccgacgtaggc1020aatgagttggccggcctggacgcgatcgccggccttgagcccggtcgcgaacgcgttcca1080catgtgcccgtagacagttgtgccggcgccgtccgcggccgggtggtcaatcacgatcca1140ttgcccgaagccttgcgccggcccgatataggccacggtgccggcctgcgccgcatagat1200cggcgttccgtccttggcggcgaagtcgagcccgcggtgctgtgttccccagcgagctcc1260gaacccggacgacagggtgtaagtcccgtcgcgcatcgggaagaaacgatcggccat1317<210>3<211>29<212>DNA<213>ArtificialSequence<400>3cgccatatggtcagaacaccagcccgagt29<210>4<211>28<212>DNA<213>ArtificialSequence<400>4ccgctcgagatggccgatcgtttcttcc28<210>5<211>384<212>PRT<213>ArtificialSequence<400>5MetThrThrLysAspGlnValAlaGlnIleThrIleAlaGluAlaLys151015AlaArgGlyTyrThrArgSerGluCysLeuAlaIleMetSerThrPhe202530TyrGlnGluSerGlyTrpAsnAspThrIleTrpAspProThrHisThr354045ThrTyrGlyIleAlaGlnGlnAspGlySerTyrProHisArgPheAsp505560GlyAlaAlaAlaGlnIleLysGlyPhePheAspLysLeuAspValTrp65707580ArgAlaLysProGlyAlaSerThrAspIleTrpLeuAsnIleCysTrp859095MetGlnGlnAlaProAsnTrpProSerAlaAspTyrTrpTyrAlaAsn100105110GlyArgArgAlaTyrLeuThrGluIleLysSerArgIleAlaThrVal115120125ThrProTyrLeuAspLysTyrTrpProAlaAspGlyGlyThrAlaVal130135140ProAspGluProArgProAspPheAsnGluPheProIleTrpSerAsn145150155160AsnAsnSerAlaArgSerGlyLysProThrMetPheLeuIleHisThr165170175GlnGluGlyGlyGlyGlyAspAlaAlaAlaGluAsnLeuAlaLysTrp180185190PheGlnAsnGlyAsnGlyValSerTyrHisTyrThrIleSerGlnAla195200205SerAspGlyGlyValThrValValAspCysValAspThrAspArgAla210215220AlaTrpSerValGlyAsnAlaAsnSerIleSerIleAsnLeuCysPhe225230235240AlaGlySerArgAlaSerTrpMetArgAspGlnTrpMetLysGlnSer245250255AsnAlaIleAspValAlaAlaTyrLeuAlaValGlnAspAlaLysLys260265270TyrGlyPheThrProLeuValValProProProTyrThrAsnGlyArg275280285ProGlyIleSerAspHisArgTrpValThrAspValPheLysTrpGly290295300ThrHisThrAspValGlyAspTrpPheProTrpAspTyrPheAlaGlu305310315320ArgValAsnHisTrpAlaAsnGlyGlyLysThrGluProGluProPro325330335LysValLysArgPheProAspAspTrpSerAspArgGluIleLeuVal340345350GluIleLeuArgGlnLeuArgGlyTyrAsnLeuThrGlyTrpProGln355360365LeuGlyGlyLysThrLeuValAspAlaValAlaGluLeuLeuGlyHis370375380当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1