Pin1抑制剂ATRA的新型可生物降解控释制剂及其制备方法和应用与流程
本发明涉及pin1抑制剂atra的新型控释制剂及其在pin1相关疾病治疗中的应用。
背景技术:
分子靶向药物在癌症等疾病治疗中起重要作用,但是在实体瘤的长期治疗中效果较差。其主要原因是当前的分子靶向药物大多是针对单一信号通路进行肿瘤治疗,而恶性肿瘤中往往存在多条致癌信号通路的同时激活,具有高度异质性和复杂病因的肝癌尤为如此。为了提高对肝癌等肿瘤的治疗效果,迫切需要开发能够同时阻断多条癌症信号通路并无害的新型分子靶向药物。
在细胞增殖和转化信号通路中,其主要共同机制是受诸多激酶和磷酸酶调控的脯氨酸指导的蛋白磷酸化作用,而磷酸化蛋白的结构和功能又进一步受到pin1的调节。pin1是一种独特的依赖于磷酸化修饰的肽基脯氨酰顺反异构酶(peptidylprolylcis-transisomerase,ppiase),pin1在大部分肿瘤中过表达或高度活化,可同时激活超过40种癌基因和抑制超过20种抑癌基因。pin1通过扰乱一系列致癌因子和抑癌因子的平衡而促进肿瘤和肿瘤干细胞的生长。更重要的是,pin1基因敲除小鼠正常发育和生长,这提示pin1抑制剂的副作用微乎其微。很多科研机构和公司已经通过多种方式进行了pin1抑制剂的开发,例如肽基脯氨酰顺反异构酶试验法、结构或表型相似法、基于结构的设计法、基于底物模仿的设计法等。但是,这些pin1抑制剂的功效和细胞渗透性较差,不能满足要求。近期,我们开发了基于机制的高通量筛选法高通量药物筛选方法,并鉴定出来pin1的特异性抑制剂—全反式维甲酸(atra)(s.wei,s.kozono,l.kats,m.nechama,w.z.li,j.guarnerio,etal.,activepin1isakeytargetofall-transretinoicacidinacutepromyelocyticleukemiaandbreastcancer,naturemedicine21(2015)457-466)。我们的研究证明atra可以选择性地在肿瘤细胞中降解pin1,然后同时阻断多条受pin1调控的致癌信号通路。
atra是维生素a的活性衍生物,目前已成为临床上治疗急性早幼粒细胞白血病的前线药物,但是atra治疗实体瘤的效果较差。其主要原因是atra的半衰期短,在人体仅45分钟。此外,atra的水溶性差,容易受到光照、热和氧化失效。因此,需要开发新的剂型,以克服这些缺点,增强atra的功效。目前,人们已尝试采用多种方法制备atra的缓释剂如负载atra的脂质体,但是目前还没有一种atra缓释剂应用于临床,特别是用于实体瘤的治疗。商品化的atra缓释片虽然可以有效抑制肿瘤生长,但该缓释片仅能用于动物。此外,现已报道的atra缓释剂的包封率、稳定性和缓释性能还较差。而且,现有的缓释剂制备方法复杂、费时、耗钱,制备条件剧烈,需要额外步骤进行有机溶剂去除和产品干燥,这些处理可能会破坏载体的结构,影响负载药物的活性。因此,需要开发简便、快速、性价比高的路线制备生物相容性好、可生物降解和高效缓释atra的新剂型,以用于临床治疗肿瘤、炎症、关节炎、红斑狼疮、哮喘等pin1相关疾病。
技术实现要素:
本发明的目的在于提供一种pin1抑制剂atra的新型可生物降解控释制剂及其制备方法和应用,避免传统制备方法操作繁琐、费时、耗钱、制备条件剧烈的问题,一步法制备干燥的载药微球,并阐明该载药微球增强药物抗癌功效的作用机制。
本发明的目的通过以下技术方案实现:
一种pin1抑制剂atra的新型可生物降解控释制剂的制备方法,其特征在于,包括以下步骤:
a.将atra、包封材料添加到有机溶剂二氯甲烷中,通过搅拌获得均匀的油相;所述的包封材料在超临界二氧化碳中不溶或微溶,且能够与atra共沉淀形成微米或纳米粒;
b.在超临界气体的条件下,将步骤a得到的油相泵入反应釜中,获得负载atra的plla微球,然后继续用超临界气体干燥微球30min,充分去除二氯甲烷,获得pin1抑制剂atra的新型可生物降解控释制剂。
上述步骤a中所述的包封材料包括plla、pla-peg嵌段共聚物。
上述步骤a中所述的油相中plla的质量体积百分比浓度为0.5%~5%,其中plla的分子量mw为10~100kda,atra与plla的质量比率为1%~5%。
上述步骤b中所述的超临界气体的条件为超临界二氧化碳的压力为7.4~15mpa,反应釜温度为35~55ºc,二氧化碳流速为20~40g/min,油相泵入反应釜的速度为0.5~4ml/min。
上述步骤b中所述的超临界气体包括二氧化碳气体。
本发明上述制备方法制得的pin1抑制剂atra的新型可生物降解控释制剂。
本发明上述制备方法制得的pin1抑制剂atra的新型可生物降解控释制剂在制备治疗pin1相关疾病包括肿瘤、炎症、关节炎、红斑狼疮、哮喘的药物中应用。
本发明上述pin1抑制剂atra的新型可生物降解控释制剂在制备增强atra治疗pin1相关疾病包括肿瘤、炎症、关节炎、红斑狼疮、哮喘的药物中应用。
本发明上述pin1抑制剂atra的新型可生物降解控释制剂在制备抑制pin1相关疾病包括肿瘤、炎症、关节炎、红斑狼疮、哮喘的药物中应用。
具体地说,本发明的目的通过以下技术方案实现,所述的pin1抑制剂atra的新型可生物降解控释制剂的制备方法,包括以下步骤:
a)将atra、plla添加到有机溶剂二氯甲烷中,通过搅拌获得均匀的油相,其中plla的质量体积百分比浓度为1%,atra与plla的质量比率为3%;
b)在超临界二氧化碳的条件下(压力为7.6mpa;温度为45ºc,二氧化碳流速为40g/min),将步骤a得到的油相泵入(流速为1.0ml/min)反应釜中,获得负载atra的plla微球,然后继续用超临界二氧化碳干燥微球30min,充分去除二氯甲烷,即制得atra-plla缓释微球;
c)体外抗癌试验:培养人肝癌细胞和正常肝细胞,用不同浓度的空白plla微球、未包封的atra、atra-plla缓释微球分别处理细胞不同时间,以未处理的细胞为对照,采用mtt法测定药物处理对人肝癌细胞和正常肝细胞增殖的影响,采用结晶紫染色法测定药物处理对人肝癌细胞克隆形成的抑制作用,采用westernblotting测定药物处理对肝癌细胞中pin1及其调控的癌基因表达的影响,采用流式细胞仪检测药物处理对细胞周期进展和细胞凋亡的影响;
d)atra抗癌作用靶点试验:采用慢病毒感染法敲减人肝癌细胞中的pin1表达,测定pin1敲减对atra抑制肝癌细胞增殖的影响。
e)体内抗癌试验:将人肝癌细胞移植到裸鼠皮下,形成肿瘤,然后分别用空白plla微球、未包封的atra、商品化的atra缓释片、atra-plla缓释微球治疗裸鼠,以生理盐水注射组为对照,测定药物对肿瘤体积和重量的抑制作用,收集瘤块,采用westernblotting测定肿瘤组织中pin1及其调控的癌基因的表达,并采用免疫荧光染色测定肿瘤组织中pin1及ki67的表达;
步骤a中所述的溶液中plla的质量体积百分比浓度为0.5%~5%,其中plla的分子量mw为10~100kda,atra与plla的质量比率为1%~5%。
步骤a中所述的包封材料在超临界二氧化碳中不溶或微溶,能够与atra共沉淀形成微米或纳米粒,符合上述要求的材料包括plla、pla-peg嵌段共聚物。
步骤b中所述的超临界二氧化碳的压力为7.4~15mpa,反应釜温度为35~55ºc,二氧化碳流速为20~40g/min,油相泵入反应釜的速度为0.5~4ml/min。
步骤b中所述的超临界气体包括二氧化碳气体。
步骤c中所述的atra-plla微球能够增强atra对肝癌细胞生长的抑制作用。
atra通过降解pin1和抑制多条受pin1调控的致癌信号通路及细胞周期进展来发挥其抗癌作用。
步骤e中所述的atra-plla微球能够增强atra对肝癌肿瘤生长的抑制作用。
atra-plla微球抑制的肿瘤包括肝癌。
与现有技术相比,本发明具有以下优点:
本发明以超临界二氧化碳为抗溶剂,无毒,价廉,环境友好,不受传统制备方法中产生的静电、化学降解、相转变及高表面能对载药微粒结构和药物活性的破坏,以及难以去除有机溶剂的影响;在温和条件下,一步法制备负载atra的干燥微球,制备过程为物理过程,不影响药物自身的活性;所制备的atra-plla微球粒径均匀、包封率和产率高,能够在体内外有效缓释atra,其主要的药代动力学指标优于商品化的atra缓释片(该缓释片仅能用于动物),释放出的atra及atra-plla微球都能够被肝癌细胞摄取;atra-plla微球的生物相容性好,在体外能够增强atra对肝癌细胞生长的抑制作用,而不影响正常肝细胞生长;atra-plla微球通过腹腔注射到裸鼠体内后,无毒副作用,能够增强atra对肿瘤生长的抑制作用,其抗癌功效优于商品化的atra缓释片;atra-plla微球是通过选择性降解癌症细胞中的pin1并同时抑制多条受pin1调控的致癌信号通路和细胞周期进展来发挥其抗肝癌功效。
附图说明
图1为实施例1制备的atra-plla微球的形貌和结构图,图1中(a)sem图,图1中(b)tem图。
图2为实施例3中atra-plla微球在四种不同介质溶液中的体外释放谱图。
图3为实施例4中atra-plla微球(atra含量为0.34mg)和商品化atra缓释片(atra含量为5mg)在裸鼠体内的药代动力学曲线。
图4为实施例5中负载fitc的plla微球的细胞摄取图。
图5为实施例6中空白plla微球、atra和atra-plla微球处理对人肝癌细胞huh7和plc、人正常肝细胞l-02活力的影响图。图5中(a)空白plla微球处理huh7细胞72h对细胞活力的影响;图5中(b-d)atra和atra-plla微球处理huh7细胞24h、48h、72h对细胞活力的影响;图5中(e)空白plla微球处理plc细胞72h对细胞活力的影响;图5中(f-h)atra和atra-plla微球处理plc细胞24h、48h、72h对细胞活力的影响;图5中(i)atra和atra-plla微球对人肝癌细胞huh7和plc的ic50值;图5中(j和k)atra和atra-plla微球处理人正常肝细胞l-02不同时间对细胞活力的影响;图5中(l)人肝癌细胞huh7和plc、人正常肝细胞l-02中pin1表达。
图6为实施例6中atra和atra-plla微球处理人肝癌细胞huh7对细胞克隆数量和面积的影响图。图6中(a)克隆照片;图6中(b)克隆数量;图6中(c)克隆面积。
图7为实施例6中空白plla微球、atra和atra-plla微球处理对人肝癌细胞huh7和plc中pin1及pin1调控的蛋白表达的影响图。图7中(a-c)空白plla微球处理对人肝癌细胞huh7和plc中pin1表达的影响;图7中(d-r)atra和atra-plla微球处理对人肝癌细胞huh7和plc中pin1及pin1调控的蛋白表达的影响。
图8为实施例6中空白plla微球、atra和atra-plla微球处理对人肝癌细胞huh7的细胞周期和细胞凋亡的影响图。图8中(a)细胞周期和细胞凋亡的直方图;图8中(b)细胞周期的定量图;图8中(c)细胞凋亡的定量图。
图9为实施例7中pin1敲减对atra抑制肝癌细胞huh7和plc的影响。图9中(a)shv−huh7和shpin1‒huh7的细胞增殖曲线;图9中(b和c)atra和atra-plla微球处理对shv−huh7和shpin1‒huh7细胞增殖的影响;图9中(d)shv‒plc和shpin1‒plc的细胞增殖曲线;图9中(e和f)atra和atra-plla微球处理对shv‒plc和shpin1‒plc细胞增殖的影响;图9中(g和h)空白plla、atra和atra-plla微球处理对shv−huh7、shpin1‒huh7和shv‒plc、shpin1‒plc细胞pin1表达的影响。
图10为实施例8中atra-plla缓释微球的体内抗癌效果。图10中(a-c)生理盐水、atra、空白plla微球、商品化atra缓释片、atra-plla缓释微球处理对裸鼠肿瘤大小、体积和重量的抑制作用;图10中(d)各组处理对裸鼠体重的影响;图10中(e-h)各组处理对瘤块中pin1及其调控的蛋白表达的抑制作用(westernblotting检测)。
图11为实施例8中生理盐水、atra、空白plla微球、商品化atra缓释片、atra-plla缓释微球处理对裸鼠瘤块中pin1和ki67表达的抑制作用图(免疫荧光染色检测,pin1和ki67的表达量由荧光强度指示)。
具体实施方式
下面结合附图和实施例对本发明进行详细说明:
本发明下述实施例中所用的atra购自美国sigma公司;plla购自中国济南岱罡生物工程有限公司,其分子量mw在10~100kda范围内。
实施例一
将atra、plla添加到有机溶剂二氯甲烷中,通过搅拌获得均匀的油相,其中plla的浓度为1%(%为质量体积百分比,本发明的实施例%指千克/l),atra与plla的质量比率为3%;将油相泵入(流速为1.0ml/min)反应釜中,在超临界二氧化碳的条件下(压力为7.6mpa;温度为45°c,二氧化碳流速为40g/min),获得负载atra的plla微球,然后继续用超临界二氧化碳干燥微球30min,以充分去除二氯甲烷。用同样的实验条件制备空白plla微球和负载fitc的plla微球。扫描电镜(sem)结果显示,atra-plla微球的球形度好、粒径均匀。透射电镜(tem)结果显示,atra-plla微球为实心微球。
图1为实施例1制备的atra-plla微球的形貌和结构图。图1中(a)sem图,图1中(b)tem图。
实施例二
称取4mgatra-plla微球,加入到4ml二氯甲烷中,磁力搅拌充分溶解,用酶标仪在360nm处测定溶液的吸光值。将空白plla微球溶于二氯甲烷,作为背景对照。用atra标准品建立atra的标准曲线,计算二氯甲烷溶液中atra的浓度。另外称取4mgatra-plla微球,加入到4ml75%乙醇中,以洗脱掉微球表面松散吸附或结合的atra,然后用0.22μm滤膜进行过滤,用酶标仪在360nm处测定乙醇溶液的吸光度值。根据atra标准曲线计算乙醇溶液中atra的浓度。根据公式计算载药量、包封率和产率。载药量(%)=(微球中atra重量/微球总重量)×100。包封率(%)=(洗脱后微球中的atra重量/洗脱前微球中的atra重量)×100。产率(%)=(载药微球重量/初始投入的atra和plla重量)×100。结果,atra-plla微球的载药量为2.4±0.2%、包封率为91.4±4.05、产率为68.3±3.3%。
实施例三
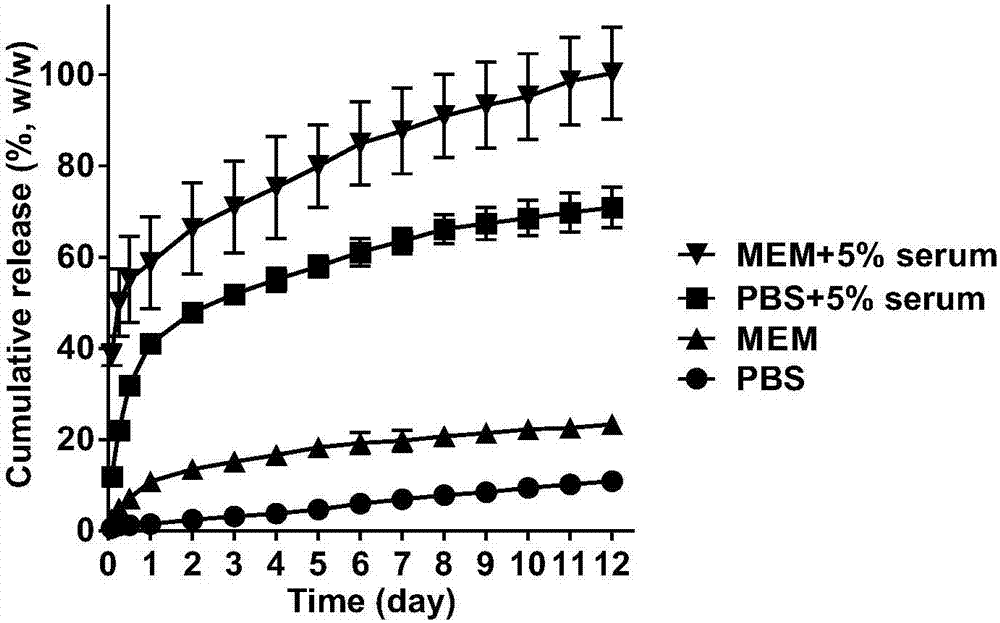
称取2mgatra-plla微球,分别分散于1ml的pbs(ph7.4)、含5%血清的pbs、mem培养基、或含5%血清的mem培养基中,置于37°c、100rpm的摇床中,于不同时间点(2h、6h、12h、1d、2d、3d、4d、5d、6d、7d、8d、9d、10d、11d、12d),取出实验样品,10000rpm离心5min,收集上清液,然后用新鲜的上述释放介质重悬微球,放回摇床中继续实验。测定各上清液中atra浓度,计算atra的累计释放率。结果,atra-plla微球即使在含血清的mme培养基中,仍然能够缓释atra达12天;在不含血清的介质溶液中,atra-plla微球无突释现象。即,atra-plla微球能够在体外有效缓释atra。
图2为实施例3中atra-plla微球在四种不同介质溶液中的体外释放谱图。
实施例四
8周龄的雄性balb/c裸鼠(购于上海斯莱克实验动物有限公司),随机分为2组,一组为atra-plla微球的腹腔注射组(给药剂量为15mg/kg,即每只裸鼠注射的atra含量为0.34mg),另一组为atra缓释片的颈背部埋置组(每只裸鼠植入一片atra缓释片,即每只裸鼠埋置的atra含量为5mg)。atra缓释片购自美国innovativeresearchofamerica。在每个实验时间点,每实验组含4只裸鼠。分别于给药后0.5h、1h、3h、4h、6h、24h、48h,从裸鼠眼眶后静脉丛取血约0.2ml。血液样品于4°c、3000rpm离心10min,分离血浆样品。取0.1ml血浆,加入1ml乙酸乙酯,涡旋混合5min,于10000rpm离心10min,挥干,以100μl流动相溶液充分溶解残渣,lc-ms/ms法测定atra含量,acitretin为内标。lc-ms/ms条件为:美国agilent1260液相色谱系统和agilent6410三重四级杆质谱,色谱柱为welchultimatexb-c18column(2.1×50mm,3.5μm);等度洗脱,流动相a为含0.00625%氨水的水、流动相b为甲醇(相a和相b的比率为33:67),流速为1.0ml/min,温度为30°c,进样量为3μl,总的运行时间为5min;质谱采用多反应监测模式,atra和内标的母离子和子离子分别为m/z299.2−255.2和m/z325.2−266.2;质谱碎片电压为115v,碰撞能为8ev,毛细管电压为3500v,雾化气压为30psi,气流为10l/min,气温为325°c。
用药代动力学软件das3.2.3计算药代动力学参数,包括最大药物浓度(cmax值)药物浓度—时间曲线(auc值)、半衰时间(t1/2)。结果,atra-plla微球的血药浓度在4h内维持在2000ng/ml,在第6h降低为60ng/ml,然后在48h内维持在2ng/ml。商品化atra缓释片在3h达到最大药物浓度(620ng/ml),在第6h降低为49ng/ml,然后在48h内维持在7ng/ml。atra-plla微球的cmax值显著高于atra缓释片(2704.21±495.42vs.622.17±216.56);atra-plla微球的auc值也显著高于atra缓释片(10498.52±3061.31vs.2633.29±664.01);atra-plla微球的t1/2值与atra缓释片无统计学差异。即atra-plla微球的主要药代动力学指标显著优于商品化atra缓释片(该缓释片仅能用于动物)。
图3为实施例4中atra-plla微球(atra含量为0.34mg)和商品化atra缓释片(atra含量为5mg)在裸鼠体内的药代动力学曲线。
实施例五
培养人肝癌细胞huh7,用负载fitc的plla微球(0.13mg/ml)处理细胞4h和24h,用多聚甲醛固定细胞,用dapi对细胞核进行染色,然后进行荧光显微镜观察。结果,fitc能够从fitc-plla微球中释放出来,并被细胞摄取;fitc-plla微球自身也能够被细胞摄取。即,plla载药微球能够释放药物,释放的药物能够被细胞摄取,并且负载药物的plla微球自身能够被细胞摄取。
图4为实施例5中负载fitc的plla微球的细胞摄取图。
实施例六
将人肝癌细胞huh7(3000个细胞/孔)、plc(6000个细胞/孔)和正常肝细胞l-02(5000个细胞/孔)接种于96孔板,用不同浓度的空白plla微球(浓度为0~0.5mg/ml)、未包封的atra和atra-plla缓释微球(atra含量为0~40μm)处理人肝癌细胞huh7和plc不同时间(24h、48h、72h),以未处理的细胞为对照,采用mtt法测定药物处理对人肝癌细胞增殖的影响,并采用spss20.0软件计算atra和atra-plla缓释微球的半最大抑制浓度(ic50)。将500个或2000个人肝癌细胞huh7接种于12孔板或6孔板,培养过夜后,用atra和atra-plla缓释微球(atra含量为10μm、20μm)处理细胞72h,去掉旧液,更换新鲜培养液,继续培养10~14天以形成克隆,然后采用结晶紫染色法对细胞克隆进行显色,并用image-proplus6.0软件对克隆面积进行定量。培养人肝癌细胞huh7和plc,用不同浓度的空白plla微球(浓度为0~0.5mg/ml)、未包封的atra和atra-plla缓释微球(atra含量为0~20μm)处理细胞72h,用ripa裂解液抽提细胞总蛋白,用bca试剂盒对蛋白质进行定量,用westernblotting检测pin1及pin1调控的蛋白表达。培养人肝癌细胞huh7,用空白plla微球(浓度为0.25mg/ml)、未包封的atra和atra-plla缓释微球(atra含量为10μm、20μm)处理细胞72h,用细胞周期和细胞凋亡试剂盒,在流式细胞仪分析细胞周期和细胞凋亡。细胞增殖结果显示,空白plla微球处理不影响细胞增殖,atra-plla缓释微球能够显著提高atra对肝癌细胞增殖的抑制作用,降低atra的ic50值达3倍,atra和atra-plla缓释微球处理基本不影响正常肝细胞的增殖,即plla微球本身具有优良的生物相容性,而atra和atra-plla缓释微球选择性的抑制肝癌细胞增殖。细胞克隆形成结果显示,atra-plla缓释微球能够显著提高atra对肝癌细胞克隆形成的抑制。westernblotting结果显示,plla微球本身不影响细胞pin1表达,atra-plla缓释微球能够显著增强atra对pin1及pin1调控的蛋白表达的抑制作用。流式细胞仪分析结果显示,plla微球本身不影响细胞周期和细胞凋亡,atra-plla缓释微球能够显著增强atra对细胞周期进展的抑制,但不影响细胞凋亡。
图5为实施例6中空白plla微球、atra和atra-plla微球处理对人肝癌细胞huh7和plc、人正常肝细胞l-02活力的影响图。图5中(a)空白plla微球处理huh7细胞72h对细胞活力的影响;图5中(b-d)atra和atra-plla微球处理huh7细胞24h、48h、72h对细胞活力的影响;图5中(e)空白plla微球处理plc细胞72h对细胞活力的影响;图5中(f-h)atra和atra-plla微球处理plc细胞24h、48h、72h对细胞活力的影响;图5中(i)atra和atra-plla微球对人肝癌细胞huh7和plc的ic50值;图5中(j和k)atra和atra-plla微球处理人正常肝细胞l-02不同时间对细胞活力的影响;图5中(l)人肝癌细胞huh7和plc、人正常肝细胞l-02中pin1表达。
图6为实施例6中atra和atra-plla微球处理人肝癌细胞huh7对细胞克隆数量和面积的影响图。图6中(a)克隆照片;图6中(b)克隆数量;图6中(c)克隆面积。
图7为实施例6中空白plla微球、atra和atra-plla微球处理对人肝癌细胞huh7和plc中pin1及pin1调控的蛋白表达的影响图。图7中(a-c)空白plla微球处理对人肝癌细胞huh7和plc中pin1表达的影响;图7中(d-r)atra和atra-plla微球处理对人肝癌细胞huh7和plc中pin1及pin1调控的蛋白表达的影响。
图8为实施例6中空白plla微球、atra和atra-plla微球处理对人肝癌细胞huh7的细胞周期和细胞凋亡的影响图。图8中(a)细胞周期和细胞凋亡的直方图;图8中(b)细胞周期的定量图;图8中(c)细胞凋亡的定量图。
实施例七
将已验证的pin1shrna(5'-ccaccgtcacacagtatttat-3')克隆到plko.1慢病毒载体上,然后用plko.1、pvsvg、prev、pmdl转染293t细胞,生产病毒。用含病毒的上清液感染人肝癌细胞huh7和plc,用1μg/mlpuromycin筛选稳定敲减pin1的细胞株。培养pin1敲减的huh7、plc细胞(shpin1‒huh7、shpin1‒plc)以及感染空白病毒载体的细胞(shv−huh7、shv‒plc)。用空白plla微球(浓度为0.25mg/ml)、未包封的atra和atra-plla缓释微球(atra含量为20μm)处理细胞72h,用mtt法测定细胞增殖活力,用westernblotting检测细胞pin1表达。结果,pin1对肝癌细胞的增殖起重要作用,敲减pin1可取消atra对肝癌细胞增殖的抑制作用,即pin1是atra抑制肝癌细胞增殖的重要作用靶点。
图9为实施例7中pin1敲减对atra抑制肝癌细胞huh7和plc的影响。图9中(a)shv−huh7和shpin1‒huh7的细胞增殖曲线;图9中(b和c)atra和atra-plla微球处理对shv−huh7和shpin1‒huh7细胞增殖的影响;图9中(d)shv‒plc和shpin1‒plc的细胞增殖曲线;图9中(e和f)atra和atra-plla微球处理对shv‒plc和shpin1‒plc细胞增殖的影响;图9中(g和h)空白plla、atra和atra-plla微球处理对shv−huh7、shpin1‒huh7和shv‒plc、shpin1‒plc细胞pin1表达的影响。
实施例八
体外培养人肝癌细胞huh7,将4×106的huh7细胞注射到裸鼠后肢根部皮下,建立裸鼠致瘤模型。当肿瘤生长到50立方毫米时,将裸鼠随机分为5组,分别为生理盐水组、atra组、空白plla微球组、商品化atra缓释片组、atra-plla缓释微球组。用乙醇溶解atra,并用玉米稀释;用生理盐水分散空白plla微球和atra-plla缓释微球。生理盐水、空白plla微球、atra、atra-plla微球通过腹腔注射给药,其中atra和atra-plla微球按15mg/kg的剂量注射,每周注射2次,连续给药3周,即每只裸鼠总共注射约2mgatra。商品化atra缓释片通过手术器械埋置在裸鼠颈背部皮下(atra含量5mg、缓释21天)。每周用游标卡尺测定肿瘤大小,计算肿瘤体积,计算公式为=长×宽×宽×0.52,并每周测定裸鼠体重。给药3周后,处死裸鼠,收集瘤块并称重。提取瘤块中的总蛋白质,用westernblotting检测瘤块中pin1及其调控的蛋白表达。将瘤块进行冰冻切片和免疫荧光染色,切片厚度为10µm,细胞核用dapi染色,用荧光显微镜检测瘤块中pin1和ki67的表达。结果,空白plla微球和atra对肿瘤生长几乎无抑制作用,atra-plla缓释微球能够显著抑制肿瘤生长,其抑瘤效果优于商品化的atra缓释片,特别是atra-plla缓释微球的用药剂量不到商品化atra缓释片的一半,而且该缓释片仅能用于动物。westernblotting结果显示,atra-plla缓释微球能够显著增强atra对瘤块中pin1及其调控的蛋白表达的抑制作用。免疫荧光染色结果显示,空白plla微球和atra对瘤块中pin1和ki67的表达无明显影响,而atra-plla缓释微球极大的减少瘤块中pin1和ki67的表达。
图10为实施例8中atra-plla缓释微球的体内抗癌效果。图10中(a-c)生理盐水、atra、空白plla微球、商品化atra缓释片、atra-plla缓释微球处理对裸鼠肿瘤大小、体积和重量的抑制作用;图10中(d)各组处理对裸鼠体重的影响;图10中(e-h)各组处理对瘤块中pin1及其调控的蛋白表达的抑制作用(westernblotting检测)。
图11为实施例8中生理盐水、atra、空白plla微球、商品化atra缓释片、atra-plla缓释微球处理对裸鼠瘤块中pin1和ki67表达的抑制作用图(免疫荧光染色检测,pin1和ki67的表达量由荧光强度指示)。
- 还没有人留言评论。精彩留言会获得点赞!