重组疫苗及其应用的制作方法
本发明涉及生物技术药物技术领域,尤其涉及重组疫苗及其应用。
背景技术:
癌症或恶性肿瘤是威胁人类健康的杀手,肿瘤的诱发原因错综复杂,我们至今缺乏对其具体形成机制的深刻理解。最近的研究表明,机体免疫系统与肿瘤细胞间存在循环相互作用,即免疫系统能够识别“非我”成分的癌细胞,癌细胞也能通过多种途径逃避机体免疫系统的监控和攻击,造成患者体内肿瘤细胞的扩散转移。肿瘤免疫逃逸的分子机制包括:肿瘤抗原表达下调或丢失,肿瘤细胞分泌具有免疫抑制功能的可溶性细胞因子,肿瘤微环境招募免疫抑制性淋巴细胞,以及肿瘤细胞上调表达负性协同刺激信号等。其中,在肿瘤局部微环境及干扰素γ等细胞因子的诱导下,活化的t细胞上大量表达负性共刺激分子,这些免疫抑制调控分子将直接影响效应细胞毒性t淋巴细胞(ctl)的抗肿瘤活性,使其杀伤功能减弱甚至丧失。目前发现的抑制性协同刺激分子主要有ctla4/cd80(cd86)、pd1/pd-l1(pd-l2)、btla/hvem、tim3/gal9等。
人程序性细胞死亡蛋白1(programmeddeath-1,pd-1)又名cd279,它与两个配体pd-l1(b7h1,cd274)和pd-l2(b7dc,cd273)同属免疫球蛋白超家族i型跨膜糖蛋白,由胞浆区、跨膜锚定区和胞外位点结合域三部分构成。介导pd-1信号免疫抑制功能的关键结构,是位于胞内信号转导区的免疫受体酪氨酸转换基序(immunoreceptortyrosine-basedswitchmotif,itsm),当配受体偶联时,itsm基序启动酪氨酸磷酸化程序以招募相关磷酸酶,使下游的信号通路pi3k/akt(磷脂酰肌醇3激酶/丝氨酸-苏氨酸蛋白激酶)去磷酸化,从而导致细胞因子合成的中断和t细胞效应不敏感等。pd-1/pd-l1信号通路在正常组织器官及外周淋巴组织低表达或诱导性表达,对维持机体免疫耐受、防止自身免疫病的发生具重要意义;而肿瘤部位pd-1分子的高表达,则加速了活化t细胞的凋亡。
2013年,科学杂志授予免疫检查点阻断疗法年度重大科学突破,免疫治疗也真正使人们看到治愈癌症的希望。免疫检查点阻断疗法(immunecheckpointblockade)即应用抑制剂阻断负性调节t细胞的共抑制信号通路,解除t细胞抑制并重新释放其免疫活性。当前开发的抑制剂主要是人源化单克隆抗体,分别阻断两个重要的免疫检查点——细胞毒性t淋巴细胞蛋白4(ctla4)和pd-1。2014年,herbst等报导一种能有效阻断pd-1配体pd-l1的单抗药物pmdl3280a治疗65例化药治疗无效的膀胱癌患者,结果30例pd-l1阳性患者中有13例(43%)产生明显的抑瘤肿瘤的效应,其中2人达到病情完全缓解;另外,在pd-l1阴性患者中也有11%的应答率。由此,体现出检查点阻断药物的抗肿瘤免疫应答优势,为癌症免疫治疗提供了新的研究思路。与此同时,单抗类抑制剂也存在一些弊端使得药物临床应用受到限制。例如,部分患者的肿瘤组织免疫组化检测显示没有t淋巴细胞浸润现象,可能导致此部分患者单抗治疗无效;也有一些患者在接受抗ctla4抗体治疗后,出现致命的自身免疫病相关的不良反应;此外,人源化单克隆抗体制作成本较高,用药费用昂贵。这些问题都说明检查点阻断治疗需建立更加完善的适应症治疗者筛选程序和治疗方案,而目前开发的pd-1抗体形式阻断剂则无法引导抗肿瘤主动免疫,其阻断剂形式尚待进一步优化。文献资料显示,一种可溶型pd-1(spd-1)蛋白可与配体pd-l1识别并结合,可作为另一pd-1/pd-l1信号通路阻断剂的形式应用于抗肿瘤免疫。
(1)可溶性pd-1分子的生物学特性
共刺激蛋白通常存在两种形式:锚定于细胞膜上或分泌到胞外,可溶型分子保留了膜型分子的胞外配受体结合域,以游离方式通过血液循环作用于远端效应分子,参与调节机体免疫。现已证实,天然的人pd-1分子包含上述两种蛋白形式,且膜型与可溶型pd-1(solublepd-1,spd1)皆由pdcd1基因编码,其中,所编码的全长mrna翻译产物为膜型分子,而一种缺失外显子3的mrna剪接变异体则直接翻译成spd1。spd1形成的另一种方式,可能是膜型pd-1在蛋白水解酶作用下脱落产生。spd-1的igv-igc样结构,介导与配体pd-l1和pd-l2的结合,但由于缺乏胞内抑制基序,无法启动下游免疫抑制信号。wan等检测类风湿性关节炎患者的关节滑液及外周血中都有spd1分子的高表达,同时伴随ifn-γ、il-4、il-21等t细胞活化相关细胞因子水平升高。
人与小鼠pd-1和pd-l1蛋白的同源性分别达60%和70%,并且胞外结合关键位点的一级序列高度保守。体外试验结果表明重组人spd1融合蛋白与小鼠的pd-l1、pd-l2有交叉结合作用,说明人源spd-1也能阻断小鼠pd-1抑制信号通路。
(2)可溶型pd-1的生理功能
可溶型协同刺激分子参与调节机体免疫的相关研究,包括有scd80、slag3、spd1和sbtla等,这些分子在病毒感染、肿瘤和自身免疫病等中有各自的生理功能。spd1分子的免疫调节作用具体表现在四个方面:①是促进t淋巴细胞上一些激活型细胞因子的分泌(ifn-γ、il-2等),同时减少抑制型因子il-10和tgf-β;②spd1作用能促进特异性cd4阳性和cd8阳性t细胞的增殖,并且活化的t细胞上调抑凋亡基因bcl-xl的表达,使t细胞凋亡活性减弱;③流式检测spd1分子对dc细胞的影响,观察到cd80、cd86、il-12及mhc-ii类分子荧光强度均有显著提升,表明可溶性pd-1能够促进dc细胞的成熟;④spd-1可通过有靶向dc而促进cd8+t细胞的功能。有关于spd1分子激活机体免疫的具体分子机制尚待研究,但我们认为其生理功能的发挥有赖于抗原特异性细胞免疫应答,单独的spd1分子是不具备特异性免疫效应的。
(3)可溶型pd-1在抗肿瘤免疫中的应用
可溶性pd1分子作为一种形式的pd-1通路阻断剂,已有一定的临床前应用基础。shin等,以疱疹病毒胸苷激酶(hsvtk)为靶点,构建了携载重组hsvtk基因和重组可溶性spd1-ig基因双顺反子的条件复制型腺病毒载体。将此双基因联合腺病毒进行瘤内注射,基因治疗结直肠癌肿瘤模型小鼠。结果显示,联合治疗组抑瘤效果达90%,与单一的hsvtk治疗相比有良好的协同效果;而单独的spd1基因治疗组,则没有任何抗肿瘤作用;当删除小鼠体内cd8阳性t细胞后,spd1的协同抗瘤作用消失。
癌症的免疫治疗中,chen等考察了模式性spd-1-p24抗原融合核酸疫苗对表达异种抗原gag的恶性间皮细胞瘤的抑瘤效果。肌肉接种spd1-p24dna疫苗的荷瘤小鼠,生存期达到100%,八个月后检测小鼠的特异性体液免疫和细胞免疫,结果igg1/igg2a及特异性cd8+t细胞数,都依然维持在高水平,体现了spd-1抗肿瘤免疫应答是长效性。进一步研究发现,spd-1能激发ifn-γ/tnf-α双阳t细胞的大量扩增,帮助t细胞杀伤肿瘤。另外,spd1-p24极大地减少了免疫早期(六周以内)外周以及肿瘤微环境中的抑制因素,具体表现在骨髓来源抑制性细胞(myeloid-derivedsuppressorcells,mdsc)与调节性t细胞等抑制性t细胞数目的减少。
综上所述,可溶性pd1分子竞争性与pd-l抑制性通路结合而阻断pd1/pd-l1信号通路,同时具有增强特异性免疫效果。与抗体类药物相比,重组spd-1疫苗的制备过程相对简单、成本较低,我们相信spd-1用作pd-1途经阻断剂有潜在的临床应用价值。
(4)肿瘤基因疫苗
本发明的发明人前期研究表明,以生存素(survivin)和粘蛋白1(muc1)为靶点的融合基因疫苗在抗肿瘤免疫治疗中具有一定的应用价值。survivin属抑制凋亡蛋白超家族,主要功能是抵抗细胞凋亡并调控细胞分裂,survivin特异性表达于胚胎组织及癌细胞,是理想的肿瘤免疫治疗靶点;muc1是i型跨膜糖蛋白,由核心蛋白和多糖支链构成,其中核心蛋白胞外肽段包含数目不等的串联重复序列(vntrs),muc1在肿瘤中的表达因糖基化不完全而暴露多肽核心vntr区,这些新的多肽表位为t细胞提供了潜在免疫攻击目标。
发明人基于两个方面进行muc1vntrs和survivin融合表达dna疫苗抗原表位设计:一是疫苗安全性,二是疫苗免疫原性。根据文献,全长survivin在体内以二聚体形式发挥抗凋亡功能,且二聚形成关键位点是n端第6、第7和第10位氨基酸残基。因此,发明人采用了n端缺失7个氨基酸残基的survivin缺失剪切体(简称s8)来设计疫苗,如此既提高疫苗安全性,又在最大程度上保证survivin表位免疫原性;发明中所涉及的另一抗原表位为muc1vntr串联重复序列,该串联重复结构包含33拷贝muc1vntrs(简称为33m),其中包含免疫显性结构域pdtrp序列,能够介导高效的muc1特异性抗体反应并提高特异性ctl免疫效应。
前期研究结果显示,以33m和s8融合核酸为靶点的dna疫苗(即ms疫苗)能够有效增强疫苗免疫的广谱性和有效性(参见申请号为200910252427.x的申请文件)。另外,ms疫苗构建于经过发明人改造的vr1012双顺反子载体cpdv中,其载体骨架包含一段cpg基序,同时能够独立编码白介素-2(il-2)蛋白,它们作为免疫佐剂与粘蛋白1/生存素融合肿瘤抗原同步表达,其免疫增强效果已在发明人前期研究工作中开展并验证(参见专利号为zl200910252427.x和zl201110086366.1的专利文件)。在此基础上,进一步探究引入spd-1的后疫苗诱导的的免疫原性和抗肿瘤效果的增强作用。
技术实现要素:
鉴于此,本发明要解决的技术问题在于提供一种重组疫苗及其应用,本发明将spd1进一步与肿瘤抗原ms进行组合,以spd1阻断抗原呈递dc细胞过程中所涉及的pd-1/pd-l负性信号通路从而使疫苗具有更好的免疫原性和免疫效应。
本发明提供了一种分子组合,包括pd-1、muc1和survivin。
本发明所述的pd-1、muci和survivin可为蛋白分子亦可为核酸分子,本发明对此不做限定。
spd-1蛋白指能够阻断pd-1通路的可溶型pd-1蛋白,spd-1核酸指能够编码spd-1蛋白的dna分子。本发明中,所述spd-1为dna或蛋白,为人spd-1胞外段(记为spd1),其dna序列来自genbank登录号为nm_005018.2的基因。本发明采用的spd-1的dna序列如seqidno:1所示,所述spd-1的氨基酸序列如seqidno:2所示。
muc1蛋白衍生自野生muc1vntr蛋白和(或)其突变体和(或)其截短体,muc1核酸指能够编码muc1蛋白的dna分子。本发明中,muc1的dna序列如seqidno:3所示;其氨基酸序列如seqidno:4所示。
survivin蛋白衍生自野生survivin蛋白和(或)其突变体和(或)其缺失剪接体,优选为n端缺失7个氨基酸残基的survivin。发明中,survivin的dna序列如seqidno:5所示;其氨基酸序列如seqidno:6所示。
本发明中,pd-1、muc1和survivin,三者可融合(记为spd1/ms),亦可以非融合的形式联合使用(记为spd1+ms),本发明对此不做限定。
本发明所述的分子组合在制备防治肿瘤的产品中的应用。
本发明实验表明,以本发明提供的抗原制备疫苗能够具有防治肿瘤的作用。且spd1/ms疫苗组的效果显著优于ms疫苗组(p<0.05),也显著优于spd1疫苗(p<0.05)。并且,本发明实验证明,spd1/ms融合制得的疫苗与spd1+ms联合免疫的方式相比,所诱导产生的特异性细胞免疫反应处于较为一致的水平,表明spd1和ms作为抗原,能够对肿瘤多靶点产生作用,而融合或非融合的方式对免疫效果的影响不显著(p>0.05)。
以本发明提供抗原制得疫苗能够防治的肿瘤选自黑色素瘤、结直肠癌、大肠癌、肺癌、乳腺癌、肝癌、肾癌、胆管癌、胃癌、食管癌、膀胱癌、胰腺癌、头颈癌、鼻咽癌、口腔癌、宫颈癌、卵巢癌、子宫癌、前列腺癌、睾丸癌、鳞状细胞癌、淋巴瘤、脑癌、恶性胶质细胞瘤、髓母细胞瘤、淋巴肉瘤、绒毛膜上皮癌、骨肉瘤、甲状腺癌。
本发明以乳腺癌、肺癌、肝癌、胃癌、结直肠癌、黑素瘤荷瘤小鼠作为实验对象,结果表明,以本发明提供抗原制得的疫苗能够起到良好的抑制肿瘤生长的作用,且荷瘤小鼠淋巴细胞特异性分泌ifn-γ的能力也得到显著提高(p<0.01)。
本发明所述的防治肿瘤的产品中包括疫苗。
实验表明,本发明提供抗原制得的疫苗能够起到良好的防治肿瘤的作用。所述疫苗为dna载体疫苗、病毒载体疫苗、蛋白疫苗和/或树突状细胞疫苗。在一些具体实施例中,单独给予dna载体疫苗、病毒载体疫苗或蛋白疫苗即可既起到抑制肿瘤生长的作用。而在另一些实施例中,数据表明,初免给予dna载体疫苗,而以重组腺病毒疫苗加强免疫可以显著提升免疫效果。另有数据表明,在免疫的同时给予抗肿瘤的药物,能够起到增效协同的作用。所述抗肿瘤的药物为化疗药物,优选为铂类化合物、紫杉醇和/或吉西他滨和/或顺铂。一些实施例中,化疗药物为奥沙利铂。以奥沙利铂为实验对象,结果表明,重组spd1/ms疫苗联合奥沙利铂治疗组荷瘤小鼠的生存期与单独的奥沙利铂治疗组荷瘤小鼠(生命延长14%)相比,体现显著的生命延长作用(p<0.05)。
因此,本发行提供的防治肿瘤的产品中,可包括dna载体疫苗、病毒载体疫苗、蛋白疫苗和/或树突状细胞疫苗中的一种或两者以上的组合。也可以还包括化疗药物,如奥沙利铂。
本发明还提供了包括pd-1、muc1和survivin的dna序列的重组载体。
组织型纤溶酶原激活因子(tissueplasminogenactivator,tpa),简称tpa信号肽,可有效促进蛋白的分泌,提高其诱导抗体产生的能力。为了能够提高融合蛋白spd1/ms在胞外的分泌表达能力,本发明在pd-1的dna序列的5’端修饰tpa信号肽序列。
本发明中,spd-1与tpa信号肽序列相连的dna序列如seqidno:7所示。
其中,tpa信号肽的长度为69bp,其序列如seqidno:11所示。
本发明一些具体实施例中,muc1和survivin连接的dna序列(记为ms序列)如seqidno:8所示。
根据所需构建的疫苗形式,可以不同的骨架构建不同的重组载体,但这些重组载体中,都应包括与tpa信号肽相连接的pd-1序列,muc1序列和survivin序列,本发明对所述与tpa信号肽相连接的pd-1序列,muc1序列和survivin序列的连接顺序不做限定,其实施皆在本发明的保护范围之内。在本发明的实施例中,融合片段的连接顺序为:由5’端至3’端,tpa信号肽、pd-1序列,muc1序列、survivin序列。
为了构建dna载体疫苗,本发明提供了一种重组载体,其包括骨架载体、seqidno:7所示的dna序列、seqidno:8所示的dna序列和佐剂序列。
在本发明实施例中,骨架载体为cpdv。cpdv载体由申请号为201110086366.1的发明专利构建。
所述佐剂序列为分子内佐剂,选自细胞因子类佐剂,包括但不限于白介素2(il-2)、免疫刺激dna的非甲基化cpg基序以及集落刺激因子gm-csf。本发明实施例中,采用的佐剂序列为白介素-2,其dna序列如seqidno:9所示。
一些实施例中,佐剂序列的插入位点为xbai和bamhi酶切位点之间;seqidno:7所示的dna序列和seqidno:8所示的dna序列的插入位点为bglii和ecori酶切位点之间。
一些实施例中,本发明提供的重组载体(记为cpdv-il2-spd1/ms)的图谱如图1-d所示,其制备方法为在骨架载体的xbai和bamhi酶切位点之间插入佐剂序列,然后在bglii和ecori酶切位点之间插入seqidno:7和seqidno:8所示序列。
本发明提供的重组载体在制备防治肿瘤的产品中的应用。
所述防治肿瘤的产品为dna载体疫苗。
本发明还提供了一种防治肿瘤的疫苗,其中包括本发明提供的重组载体。
优选的,所述重组载体为cpdv-il2-spd1/ms。
本发明提供的疫苗的制备方法为,在骨架载体的xbai和bamhi酶切位点之间插入佐剂序列,然后在bglii和ecori酶切位点之间插入seqidno:7和seqidno:8所示序列,制得重组载体。
接种本发明提供的dna载体疫苗的小鼠能产生高效的抗粘蛋白1抗体和抗生存素抗体,并且两者的抗体滴度可达10000以上,且产生抗体的量也较大,说明本发明提供的dna载体疫苗能够启动强烈的特异性体液免疫应答。并且,实验表明,本发明提供规定dna载体疫苗能够有效抑制肿瘤的生长,所述肿瘤包括乳腺癌、肺癌、肝癌、胃癌、结直肠癌、黑素瘤,且其效果显著优于(p<0.05)单独使用以ms为靶点的dna载体疫苗,或以spd-1为靶点的dna载体疫苗。由于肿瘤免疫治疗机制的相似性,认为本发明提供的dna载体疫苗也能够对黑色素瘤、结直肠癌、大肠癌、肺癌、乳腺癌、肝癌、肾癌、胆管癌、胃癌、食管癌、膀胱癌、胰腺癌、头颈癌、鼻咽癌、口腔癌、宫颈癌、卵巢癌、子宫癌、前列腺癌、睾丸癌、鳞状细胞癌、淋巴瘤、脑癌、恶性胶质细胞瘤、髓母细胞瘤、淋巴肉瘤、绒毛膜上皮癌、骨肉瘤、甲状腺癌起到良好的抑制作用。
为了构建重组蛋白疫苗,本发明还提供了一种重组载体,包括骨架载体、seqidno:7所示的dna序列、seqidno:8所示的dna序列。
构建重组蛋白疫苗需获得融合蛋白(spd1/ms),本发明中,融合蛋白的表达采用原核表达系统。为了获得原核表达系统表达的融合蛋白,本发明提供的重组载体中骨架载体为prsetb或pet系列载体。
一些实施例中,本发明提供的重组载体(记为pet28a-spd1/ms)的图谱如图3-b所示,其制备方法为在骨架载体的ndei和xhoi酶切位点之间插入spd1/ms片段。
为了制备融合蛋白(spd1/ms)本发明提供了一种表达载体,由本发明提供的重组载体转染宿主细胞制得。
所述宿主细胞为大肠杆菌bl21。
本发明还提供了一种融合蛋白,其由本发明提供的重组载体转染宿主细胞制得表达载体后,表达获得。
所述宿主细胞为大肠杆菌bl21。
所述表达后,还经过纯化的步骤,所述纯化为将培养后的细胞以超声裂解后,离心30min,沉淀以包涵体溶解buffer重悬后、溶解后,上清液经镍柱亲和层析,获得融合蛋白。
本发明制得的融合蛋白在制备防治肿瘤的产品中的应用。
所述防治肿瘤的产品为重组蛋白疫苗。
本发明还提供了一种防治肿瘤的疫苗,包括本发明提供的融合蛋白(spd1/ms)。
所述疫苗中还包括佐剂,所述佐剂为al(oh)3。
al(oh)3为常见的无机佐剂,其可通过诱导t细胞分化和体液免疫反应来提高疫苗的免疫原性,
接种本发明提供的重组蛋白疫苗能够抑制荷瘤小鼠肿瘤的生长,且荷瘤小鼠脾淋巴细胞特异性分泌ifn-γ的能力也得到提高。所述肿瘤为结直肠癌,由于肿瘤发病机制的相似性,认为本发明提供的dna载体疫苗也能够对黑色素瘤、大肠癌、肺癌、乳腺癌、肝癌、肾癌、胆管癌、胃癌、食管癌、膀胱癌、胰腺癌、头颈癌、鼻咽癌、口腔癌、宫颈癌、卵巢癌、子宫癌、前列腺癌、睾丸癌、鳞状细胞癌、淋巴瘤、脑癌、恶性胶质细胞瘤、髓母细胞瘤、淋巴肉瘤、绒毛膜上皮癌、骨肉瘤、甲状腺癌起到良好的抑制作用。
为了构建病毒载体疫苗,本发明提供了一种重组载体,其中包括骨架载体、seqidno:7所示的dna序列、seqidno:8所示的dna序列,所述骨架载体为psc11或pdc316。
psc11为安卡拉痘病毒(modifiedvacciniaankara,mva)常用的穿梭质粒,该载体上具有的胸苷激酶左臂和右臂(tkl、tkr)可与mva同源重组,同时通过载体上lacz基因,进行重组mva(rmva)的蓝斑筛选。一些实施例中,本发明提供的重组载体(记为psc11-spd1/ms)的图谱如图4-b所示,该重组载体的制备方法为,在psc11-ms质粒的sali酶切位点处插入spd1片段,所述spd-1片段的5’端连接有tpa信号肽片段。所述psc11-ms质粒由申请号为200910252427.x的中国发明专利构建。
pdc316为腺病毒常用穿梭质粒,一些实施例中,本发明提供的重组载体(记为pdc316-spd1/ms)的图谱如图4-d所示,该重组载体的制备方法为,在pdc316-ms质粒的ecori酶切位点处插入spd1片段,所述spd-1片段的5’端连接有tpa信号肽片段。所述pdc316-ms质粒由申请号为200910252427.x的中国发明专利构建。
为了构建病毒载体疫苗,本发明还提供了一种重组病毒,其以本发明提供的重组载体转染病毒制得。
在一些实施例中,所述重组载体为psc11-spd1/ms,所述病毒为痘病毒。
在此实施例中,所述转染为:将空mva病毒感染含有tk基因的bhk-21的突变细胞,然后使用lipo2000试剂将穿梭质粒psc11-spd1/ms共转染到bhk细胞,培养后以培养上清作种毒感染bhk细胞后,经筛选得到转染psc11-spd1/ms的痘病毒。
在一些实施例中,所述重组载体为pdc316-spd1/ms,所述病毒为腺病毒。
在此实施例中,所述转染为:将ad骨架和穿梭质粒pdc316-spd1/ms共转染293细胞,经筛选得到转染pdc316-spd1/ms的腺病毒。
所述腺病毒(ad)骨架为pbhgloxδe1,3cre。
本发明提供的重组病毒在制备防治肿瘤的产品中的应用。
本发明还提供了一种防治肿瘤的疫苗,包括本发明提供的重组病毒。
接种本发明提供的重组病毒疫苗能够显著抑制荷瘤小鼠肿瘤的生长,其中,spd1/ms重组痘病毒治疗小鼠的平均肿瘤体积比对照组的肿瘤体积减小约25%,spd1/ms重组腺病毒治疗小鼠的平均肿瘤体积则减小约23%。所述肿瘤为黑素瘤,由于肿瘤疫苗机制的相似性,认为本发明提供的病毒载体疫苗也能够对结直肠癌、大肠癌、肺癌、乳腺癌、肝癌、肾癌、胆管癌、胃癌、食管癌、膀胱癌、胰腺癌、头颈癌、鼻咽癌、口腔癌、宫颈癌、卵巢癌、子宫癌、前列腺癌、睾丸癌、鳞状细胞癌、淋巴瘤、脑癌、恶性胶质细胞瘤、髓母细胞瘤、淋巴肉瘤、绒毛膜上皮癌、骨肉瘤、甲状腺癌起到良好的抑制作用。
另外,本发明实验表明,初免给予dna载体疫苗,然后以病毒载体疫苗进行加强免疫能够起到显著提升免疫效果的作用。具体表现为,ifn-γ分泌增多,免疫应答增强。所述dna载体疫苗中包含cpdv-il2-spd1/ms,所述病毒载体疫苗为痘病毒载体疫苗(psc11-spd1/ms)或腺病毒载体疫苗(pdc316-spd1/ms)。
本发明提供了一种防治肿瘤的产品,包括本发明提供的dna载体疫苗、重组蛋白疫苗和/或病毒载体疫苗。
本发明提供的防治肿瘤的产品中,可仅包含一种疫苗,也可包含两种疫苗或两者以上的疫苗组合。
另外,本发明实验表明,在免疫的同时给予化疗药物能够起到增效的作用。具体表现为,延长荷瘤小鼠的生存期。在疫苗与化药联合治疗组中,观察到重组spd1/msdna疫苗与奥沙利铂的联合使得小鼠平均生存期较pbs组延长24%(p<0.001),其中重组spd1/msdna疫苗联合奥沙利铂治疗组的生存期与单独的奥沙利铂治疗组(生命延长14%)相比,体现显著的生命延长作用(p<0.05)。
本发明提供的防治肿瘤的产品中,还包括化疗药物。所述化疗药物选自铂类化合物、紫杉醇或吉西他滨。
另外,研究表明,融合核酸疫苗cpdv-il2-spd1/ms以及联合免疫的cpvr-spd1与cpdv-il2-ms疫苗都使得t淋巴细胞分泌ms特异性ifn-γ的elispot斑点数目明显增多(p<0.01)。同时,比较spd1/ms疫苗与spd1+ms联合免疫的方式,其所诱导产生的特异性细胞免疫反应处于较为一致的水平,表明spd1基因与ms肿瘤抗原基因制备的疫苗,具有融合核酸疫苗和联合共注射疫苗的多种疫苗形式。
本发明提供的另一种防治肿瘤的产品,包括以ms为靶点的疫苗和以spd-1为靶点的疫苗。
所述以ms为靶点的疫苗由申请号为200910252427.x的中国发明专利构建。
所述以spd-1为靶点的疫苗为cpvr-spd1,其构建方法为在载体cpvr的psti和bamhi酶切位点间插入spd1片段,所述spd-1片段的5’端连接有tpa信号肽片段。所述cpvr载体由专利号为zl201110086366.1的发明专利构建。
在疫苗与化药联合治疗组中,观察到重组ms疫苗与奥沙利铂的联合使得小鼠平均生存期较pbs组延长22%(p<0.001)。
本发明提供的防治肿瘤的产品中,还包括化疗药物。所述化疗药物选自铂类化合物、紫杉醇或吉西他滨。
本发明还提供了一种防治肿瘤的方法,该方法为给予本发明提供的防治肿瘤的产品。
一些具体实施例中,给予本发明提供的产品后,以活体基因导入仪刺激注射位点;所述刺激的电压为36v;频率1hz;脉冲6次;脉宽20ms。
一些具体实施例中,给予本发明提供的防治肿瘤的产品的方法为:给予dna载体疫苗。免疫的策略为采用dna载体疫苗进行初免,再采用dna载体疫苗进行加强免疫。所述初免的次数为1次,所述加强免疫的次数为2次。所述初免与加强免疫之间间隔7天,两次加强免疫间的时间间隔为7天。所述dna载体疫苗为cpdv-il2-spd1/ms。
一些具体实施例中,给予本发明提供的防治肿瘤的产品的方法为:给予重组蛋白疫苗。免疫的策略为采用重组蛋白疫苗进行初免,再采用重组蛋白疫苗进行加强免疫。所述初免的次数为1次,所述加强免疫的次数为2次。所述初免与加强免疫之间间隔7天,两次加强免疫间的时间间隔为7天。所述重组蛋白疫苗由vr1012-spd1/ms表达的融合蛋白制得。
一些具体实施例中,给予本发明提供的防治肿瘤的产品的方法为:给予病毒载体疫苗。免疫的策略为采用病毒载体疫苗进行初免,再采用病毒载体疫苗进行加强免疫。所述初免的次数为1次,所述加强免疫的次数为1次。所述初免与加强免疫之间间隔14天。所述病毒载体疫苗为痘病毒载体疫苗或腺病毒载体疫苗。
一些具体实施例中,给予本发明提供的防治肿瘤的产品的方法为:给予dna载体疫苗和病毒载体疫苗。免疫的策略为采用dna载体疫苗进行初免,再采用病毒载体疫苗进行加强免疫。所述初免的次数为3次,加强免疫的次数为1次。所述初免与加强免疫之间间隔2周,3次初免的时间间隔为2周。所述病毒载体疫苗为腺病毒载体疫苗。
一些具体实施例中,给予本发明提供的防治肿瘤的产品的方法为:给予dna载体疫苗和病毒载体疫苗。免疫的策略为采用dna载体疫苗进行初免,再采用病毒载体疫苗进行加强免疫。所述初免的次数为2次,加强免疫的次数为1次。所述初免与加强免疫之间间隔2周,2次初免的时间间隔为2周。所述病毒载体疫苗为痘病毒载体疫苗。
一些具体实施例中,给予本发明提供的防治肿瘤的产品的方法为:给予dna载体疫苗和病毒载体疫苗。免疫的策略为采用dna载体疫苗进行初免,再采用病毒载体疫苗进行加强免疫。所述初免的次数为2次,加强免疫的次数为1次。所述初免与加强免疫之间间隔2周,2次初免的时间间隔为2周。所述病毒载体疫苗为腺病毒载体疫苗。
一些具体实施例中,给予本发明提供的防治肿瘤的产品的方法为:给予dna载体疫苗和病毒载体疫苗。免疫的策略为采用以ms为靶点的疫苗和以spd-1为靶点的疫苗联合进行初免,再采用病毒载体疫苗进行加强免疫。所述初免的次数为2次,加强免疫的次数为1次。所述初免与加强免疫之间间隔2周,2次初免的时间间隔为2周。所述病毒载体疫苗为腺病毒载体疫苗。
一些具体实施例中,给予本发明提供的防治肿瘤的产品的方法为:给予dna载体疫苗和病毒载体疫苗。免疫的策略为采用dna载体疫苗进行初免,再采用病毒载体疫苗进行加强免疫。免疫同时给予化疗药物。所述初免的次数为2次,加强免疫的次数为1次。所述初免与加强免疫之间间隔7天,2次初免的时间间隔为7天。第1次给予化疗药物的时间为第2次初免后的次日,此后每5天给予化疗药物,共给药4次。。所述病毒载体疫苗为痘病毒载体疫苗。所述化疗药物为奥沙利铂。
本发明提供了分子组合,包括pd-1、muc1和survivin。以该抗原制备疫苗,能够具有良好的免疫原性与抗肿瘤活性。本发明提供的疫苗免疫可产生针对muc1、survivin的特异性抗体应答(见图5)和特异性细胞免疫应答(见图6)。与dna疫苗cpdv-il2-ms相比,cpdv-il2-spd1/ms在荷瘤小鼠中具有更显著的抗肿瘤效应,其中对黑素瘤的肿瘤生长抑制率约53%(见图10),对黑素瘤荷瘤小鼠的生存期的生命延长率约19%(见图10);本发明进一步提供了治疗性疫苗与化学治疗药物的联合方案。在一个实施案例中,本发明提供的疫苗与奥沙利铂联合给药抑瘤率达到74%,荷瘤小鼠肿瘤生长得到显著性抑制(见图11);而本本发明提供的疫苗和奥沙利铂给药组小鼠的平均生存期62天,其生命延长效果与阳性对照奥沙利铂组相比具统计意义(见图11);此外,将本发明提供的疫苗应用于小鼠乳腺癌、肺癌、肝癌和胃癌等模型的治疗(见图13、14、15、16,与阴性对照组相比,疫苗组的肿瘤生长速率都明显减缓。
附图说明
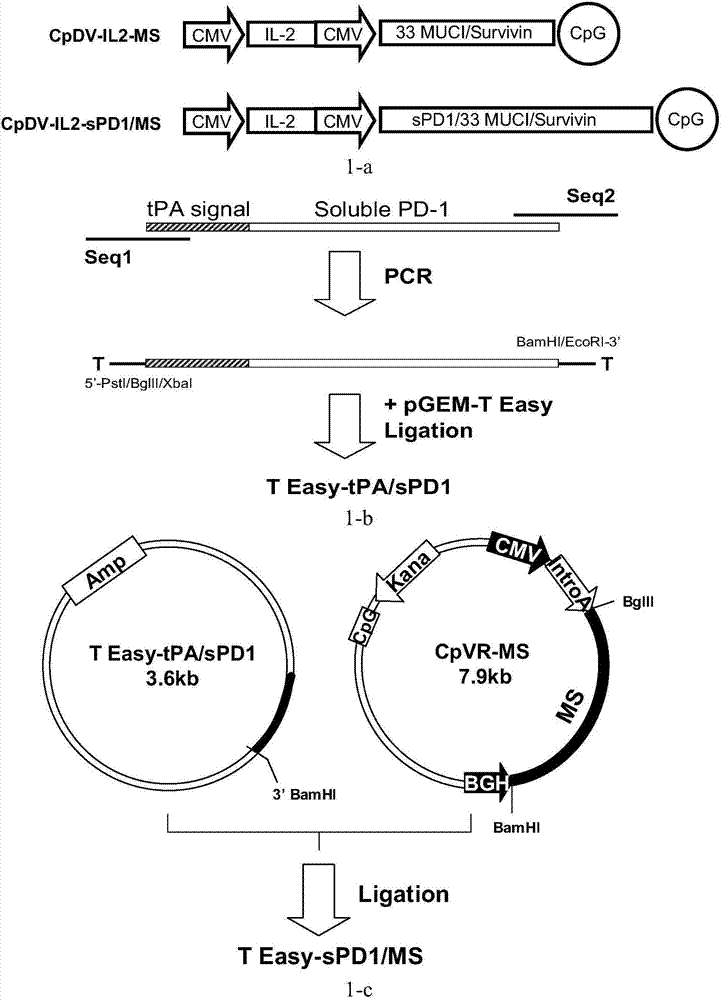
图1示dna质粒载体及质粒cpdv-il2-spd1/ms的构建策略;其中,图1-a示重组dna质粒cpdv-il2-ms和质粒cpdv-il2-spd1/ms;图1-b示质粒teasy-spd1/ms的构建策略;图1-c示质粒teasy-tpa/spd1的构建策略;图1-d示载体cpdv-il2的构建策略;图1-e示重组dna质粒cpdv-il2-spd1/ms图谱;
图2示westernblot印迹分析显示cpdv-il2-ms、cpdv-il2-spd1/ms、cpvr-spd1的真核蛋白表达情况;其中,图2-a示以抗muc1抗体检测蛋白表达情况;图2-b示以抗survivin抗体检测蛋白表达情况;图2-c示以抗pd-1抗体检测蛋白表达情况;
图3示pet28a-spd1/ms质粒的构建;其中,图3-a示重组质粒pet28a-spd1图谱;图3-b示重组质粒pet28a-spd1/ms图谱;
图4示重组spd1/ms病毒载体疫苗的构建;其中,图4-a示重组穿梭质粒psc11-ms图谱;图4-b示重组穿梭质粒psc11-spd1/ms图谱;图4-c显示重组穿梭质粒pdc316-ms图谱;图4-d显示重组穿梭质粒pdc316-spd1/ms图谱;
图5示spd1/ms重组dna疫苗诱导免疫小鼠的抗粘蛋白1和生存素的体液免疫应答;图5-a示balb/c小鼠分别免疫pbs及重组ms、spd1/ms和spd1dna质粒后的血清elisa检测抗粘蛋白1抗体,图5-b示免疫小鼠抗生存素抗体水平;图5-c示免疫小鼠抗可溶性pd1抗体水平;图5-d示免疫小鼠中粘蛋白1的igg1和igg2a抗体的血清水平;图5-e示免疫小鼠抗生存素的igg1和igg2a抗体的血清水平;
图6示spd1/ms重组dna疫苗引发小鼠体内特异性细胞免疫应答;balb/c小鼠分别免疫pbs、及重组ms、spd1/ms和spd1dna质粒,取脾淋巴细胞分析粘蛋白1和生存素特异性免疫应答水平;其中,图6-a示为各组免疫小鼠脾淋巴细胞针对muc1表位特异性的分泌ifn-γ的elispot斑点数目,图6-b示针对survivin表位特异性分泌ifn-γ的elispot斑点数目;图6-c示各组免疫小鼠的脾淋巴细胞的ctl活性,以脾淋巴细胞作效应细胞e,并选用稳定表达粘蛋白1和生存素蛋白的ct26细胞作靶细胞t,通过碘化丙啶和cfse双荧光染料染色后所标记的杀伤靶细胞群百分比来表征ctl反应强度;图6-d示spd1与ms肿瘤疫苗的联合形式对小鼠脾淋巴细胞特异性分泌ifn-γ的elispot斑点数目;
图7示spd1/ms重组dna疫苗的prime-boost免疫策略;balb/c小鼠分别免疫pbs、重组spd1/msdna疫苗、重组腺病毒疫苗rad-ms,以及dna疫苗/rad-ms疫苗,通过elispot法检测各组免疫小鼠脾淋巴细胞针对粘蛋白1和生存素的特异性免疫应答活性;其中,图7-a示各组免疫小鼠脾淋巴细胞针对muc1表位特异性的分泌ifn-γ的elispot斑点数目,图7-b示针对survivin表位特异性分泌ifn-γ的elispot斑点数目;
图8示spd1/ms重组病毒疫苗的prime-boost免疫策略;balb/c小鼠分别免疫pbs、rmva-spd1/ms,以及dna疫苗/rmva-spd1/ms疫苗,通过elispot检测各组小鼠脾淋巴细胞针对粘蛋白1和生存素的特异性免疫应答活性,其中,图8-a示各组小鼠脾淋巴细胞针对muc1表位的特异性分泌ifn-γ的elispot斑点数目,图8-b示针对survivin表位特异性分泌ifn-γ的elispot斑点数目;
图9示spd1/ms重组dna疫苗在黑素瘤模型小鼠的治疗作用;其中,图9-a示在c57bl/6小鼠皮下接种msf+b16肿瘤细胞后,分别给予pbs、ms疫苗和spd1/ms疫苗,测量肿瘤大小至接种后第17天的情况;图9-b示观察小鼠生存情况观察至肿瘤接种后第50天;
图10示spd1/ms重组病毒疫苗在黑素瘤模型小鼠的治疗作用;在c57bl/6小鼠皮下接种msf+b16肿瘤细胞后,分别给予pbs、rmva-spd1/ms重组痘病毒疫苗和rda-spd1/ms重组腺病毒医疗,接种肿瘤后第12天测量记录肿瘤生长变化曲线;
图11示spd1/ms重组dna疫苗在结直肠癌模型小鼠的治疗作用;在balb/c小鼠皮下接种msf+ct26肿瘤细胞后,分别给予pbs、ms疫苗、spd1/ms疫苗、奥沙利铂、ms/奥沙利铂和spd1/ms/奥沙利铂;其中,图11-a示测量肿瘤大小至接种后第25天的情况;图11-b示观察截止日当天处死全部小鼠,剥取肿瘤组织并测量瘤重;图11-c示小鼠生存情况观察至肿瘤接种后第65天;
图12示spd1/ms重组蛋白疫苗在结直肠癌模型小鼠的治疗作用;在balb/c小鼠皮下接种msf+ct26肿瘤细胞后,分别给予pbs、al(oh)3佐剂,以及蛋白/al(oh)3治疗,接种肿瘤后第26天处死全部小鼠;其中,图12-a示所剥取的各组小鼠肿瘤重量;图12-b示各组荷瘤小鼠脾淋巴细胞针对muc1和survivin表位的特异性分泌ifn-γ的能力;
图13示spd1/ms重组dna疫苗在乳腺癌模型小鼠的治疗作用;在balb/c小鼠皮下接种msf+4t1肿瘤细胞,分别注射pbs和spd1/ms疫苗,从接种肿瘤后第11天开始测量小鼠肿瘤体积,记录肿瘤生长曲线;
图14示spd1/ms重组dna疫苗在肺癌模型小鼠的治疗作用;c57bl/6小鼠皮下接种msf+lewis肿瘤细胞,分别注射pbs和spd1/msdna疫苗,从接种肿瘤后第8天开始测量并记录小鼠肿瘤生长曲线;
图15示spd1/ms重组dna疫苗在肝癌模型小鼠的治疗作用;balb/c小鼠皮下接种msf+h22肿瘤细胞,分别注射pbs和spd1/ms疫苗,从接种肿瘤后第12天开始测量并记录小鼠肿瘤生长曲线;
图16示spd1/ms重组dna疫苗在胃癌模型小鼠的治疗作用;615小鼠皮下接种msf+mfc肿瘤细胞,分别注射pbs和spd1/ms疫苗,从接种肿瘤后第12天开始测量并记录小鼠肿瘤生长曲线;
图17示使用活体基因导入仪器后,疫苗的细胞免疫效果得到显著提升;其中,图17-a示免疫策略;图17-b示免疫后淋巴细胞分泌ifn-γ的水平;图17-c示免疫后ctl水平;
图18示使用活体基因导入仪后,疫苗在抑制肿瘤生长方面得到显著提升;其中,图18-a示免疫策略;图18-b示免疫后肿瘤体积;图18-c示免疫后ctl水平;图18-d示免疫后elispot检测结果。
具体实施方式
本发明提供了重组疫苗及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本文中所用的细胞培养、分子遗传学、核酸化学、生物化学、免疫学实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
抗原(antigen,ag),是指能够刺激机体产生(特异性)免疫应答,并能与免疫应答产物抗体和致敏淋巴细胞在体外结合,发生免疫效应(特异性反应)的物质。抗原为能够在呈递至宿主动物后诱导免疫反应的一段dna或dna片段;多肽、表位、半抗原或其任何组合。
“多肽”和“蛋白质”在本文中可互换使用,意指连续氨基酸残基的聚合物。术语“核酸”、“核苷酸”可互换使用,是指rna、dna、cdna(互补dna)或crna(互补rna)及其衍生物,例如包含经修饰主链的形式。
“融合”是指将两种或更多种蛋白融合表达以形成融合蛋白的技术。通常,通过使用重组dna技术将编码两种或更多种蛋白的dna片段符合读框地连接在一起,并进行蛋白质表达来获得融合蛋白。融合使用是指将ms与spd-1的序列融合在一起,制得疫苗的方法。
“联合使用”或“联合免疫”是指使用超过一种的治疗物对受试者进行治疗或免疫。“联合”没有限制对受试者给予治疗的顺序。例如,第一疫苗(例如,以ms为靶点的疫苗)可以在对受试者给予第二疫苗(例如,以spd-1为靶点的疫苗)之前(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时之前)、与其同时或在其之后(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时)给予。
“防治”是指治疗、预防或改善疾病或与之相关的病况或症状。
“载体(vector)”是指,可将多聚核苷酸插入其中的一种核酸运载工具。一种载体可以含有多种控制表达的元件,包括但不限于,启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体还可含有复制起始位点。
“宿主细胞”是指可用于导入载体的细胞,其包括但不限于,如大肠杆菌或枯草菌等的原核细胞,如酵母细胞或曲霉菌等的真菌细胞,如s2果蝇细胞或sf9等的昆虫细胞,或者如bhk细胞,hek293细胞或人细胞等的动物细胞。
“佐剂”是指非特异性免疫增强剂,当其与抗原一起或预先递送入机体时,其可增强机体对抗原的免疫应答或改变免疫应答类型。佐剂有很多种,包括但不限于铝佐剂(例如氢氧化铝)、弗氏佐剂(例如完全弗氏佐剂和不完全弗氏佐剂)、短小棒状杆菌、脂多糖、细胞因子等。弗氏佐剂是目前动物试验中最常用的佐剂。氢氧化铝佐剂则在临床实验中使用较多。
“佐剂序列”是指分子内佐剂的序列,分子内佐剂是能够增强与之融合表达的目的蛋白(抗原)的免疫原性的佐剂,其通常为多肽片段。
疫苗(vaccine)是指为了预防、控制传染病的发生、流行,用于人体预防接种的疫苗类预防性生物制品。“dna载体疫苗”是指,基于dna或rna(例如质粒,如表达质粒)的疫苗,其任选地还包含佐剂。“重组蛋白疫苗”是肿瘤疫苗的另一常见形式,不同于dna疫苗或病毒载体疫苗,它是以抗原蛋白形式进入细胞,可直接激活树突状细胞;同时,由于蛋白形式无法整合到宿主细胞基因组,具有较高的安全性。“病毒载体疫苗”中所述病毒载体具有复制能力可作为外源基因的载体而保持自身传染性。
本发明采用的试材、试剂、仪器皆为普通市售品,皆可于市场购得。
本发明中涉及以ms为靶点的疫苗其构建方法参照申请号为200910252427.x的发明专利。
下面结合实施例,进一步阐述本发明:
实施例1:重组dna载体疫苗spd1/ms的构建
1.1tpa/spd1基因合成及teasy-tpa/spd1构建
根据genebank号nm_005018.2基因合成人pd-1胞外段序列,其基因序列5’端连有69bptpa信号肽序列(见seqidno:10),引入tpa信号肽的目的是为提高融合蛋白spd1/ms在胞外的分泌表达能力。其后,采用pcr技术在tpa/spd1基因两端引入酶切位点,pcr反应体系50μl,包括0.1μgseqidno:1所述的tpa/spd1dna模板,引物seqidno:12和seqidno:13终浓度20pmol,5μlextaqbuffer(10×),4μldntpmixture(各2.5mm),1.25uextaq酶(takara公司);pcr反应条件为98℃10s、55℃30s、72℃30s,共进行35个循环扩增反应。其后将胶回收的pcr产物连接于pgemteasy(promega公司)载体上,反应条件为16℃4h。取连接产物10μl,转化入感受态大肠杆菌top10(invitrogen公司),涂布氨苄青霉素抗性平板,37℃培养16h。挑取单克隆于5ml氨苄抗性lb培养基,37℃220rpm震荡培养16h。高速离心收获所培养菌体后,质粒提取试剂盒(北京天根生化科技有限公司)提取质粒,用bglii和bamhi双酶切后,0.8%琼脂糖凝胶电泳鉴定阳性克隆,获得质粒teasy-tpa/spd1(见图1-b)。
1.2cpvr-spd1质粒的构建
cpvr单顺反子是发明人前期在vr1012质粒骨架插入cpg基序改造得来(参见申请号为201110086366.1的发明专利),cpvr-spd1独立表达可溶性pd-1蛋白,是作为一种spd1/ms融合核酸疫苗的对照质粒形式。具体构建方法是:以psti和bamhi双酶切消化质粒teasy-tpa/spd1,胶回收线性spd1目的基因与载体cpvr相互连接,反应条件是16℃过夜。将连接产物10μl转化入感受态大肠杆菌top10,涂布卡那霉素抗性平板,37℃培养16h。挑取单克隆于5ml卡那抗性lb培养基震荡培养16h。高速收获培养后的菌体,所提取质粒采用用psti和bamhi双酶切消化后进行0.8%琼脂糖凝胶电泳的鉴定,筛选获得阳性克隆cpvr-spd1。
1.3cpdv-il2-spd1/ms质粒的构建
基于spd1/ms重组dna疫苗的构建主要分为两步。首先,将包含目的基因的质粒cpvr-ms(参见申请号为200910252427.x的发明专利)采用bglii和bamhi双酶切消化,通过t4dna连接酶作用,将ms融合肿瘤抗原基因插入质粒teasy-tpa/spd的多克隆酶切位点bamhi处,从而获得质粒融合核酸质粒teasy-spd1/ms(见图1-c)。
其次,构建表达白介素2(il-2)基因和spd1/ms融合核酸的双顺反子cpdv-il2-spd1/ms,具体技术方法是:应用pcr技术扩增人白介素-2(il-2)基因(序列详见seqidno:9),在50μlpcr反应体系中,加入0.1μg模板质粒cpdv-il2-ms(参见专利号为zl200910252427.x的发明专利),终浓度20pmol的引物seqidno:14和seqidno:15,其它组分和反应条件如上文所述。pcr产物经过xbai和bamhi双酶切消化反应,与载体cpdv(参见专利号为zl201110086366.1的发明专利)相连接制备过渡质粒cpdv-il2。再将包含spd1/ms融合核酸的teasy-spd1/ms进行bglii和ecori双酶切消化处理,插入到质粒骨架cpdv-il2的相应多克隆酶切位点处,制成所述dna载体疫苗cpdv-il2-spd1/ms(即spd1/ms疫苗),构建策略见图1-d。
1.4重组质粒体外表达肿瘤抗原及spd1的western印迹鉴定
以转染空载体vr1012的293t细胞裂解上清为阴性对照,将重组质粒cpdv-il2-ms(简称ms)、cpdv-il2-spd1/ms(简称spd1/ms),和cpvr-spd1(简称spd1)各2μg分别转染293t细胞,72h后收取细胞裂解上清,经sds-page分离后转移到硝酸纤维素膜上进行westernblot蛋白质印迹依次鉴定重组质粒抗原muc1、survivin和蛋白spd1的印迹鉴定情况。结果如图2所示,其中图2-a显示ms质粒、spd1/ms质粒和spd1质粒的muc1印迹,spd1作为对照质粒没有显示条带,质粒ms和spd1/ms的预期大小分别是95kd和120kd,为由图中可以看出,ms和spd1/ms实际呈现系列梯度的蛋白条带,且主条带大小都在150kd以上,这可能是muc1蛋白的糖基化修饰产物或特异性蛋白酶作用的裂解产物;图2-b显示ms质粒、spd1/ms质粒和spd1质粒的survivin印迹,由于survivin与muc1是融合抗原,所以呈现的western印迹与muc1结果相似,其主条带位置都在150kd以上;图2-c显示ms质粒、spd1/ms质粒、spd1质粒和空载体vr1012的pd-1印迹,空载体作为阴性对照没有显示条带,而spd1/ms质粒和spd1质粒的大小分别为150kd和35kd,由该图中可见,融合表达的spd1/ms蛋白没有关于spd1蛋白的糖基化修饰或水解作用,保证了spd1的结构完整性从而能够结合到pd-l1配体上。
本发明所述的cpdv-il2-spd1/ms重组基因疫苗是一种基于肿瘤抗原基因疫苗的优化形式,质粒结构示意如图1-a所示。肿瘤抗原muc1和survivin属于一类肿瘤相关抗原(taa),taa是源于自身的抗原而非外源抗原,这导致其引发的特异性t细胞免疫反应有所限制。为了提高肿瘤基因疫苗的有效性,采用把肿瘤抗原与具有阻断免疫抑制作用的可溶性程序死亡-1(pd-1)相融合的dna疫苗设计。可溶性pd-1与肿瘤抗原的融合表达,使基于spd1的融合蛋白能够通过受体介导靶向dc细胞,促进dc对抗原的摄取并激活b细胞和t细胞。
实施例2:重组蛋白疫苗spd1/ms的制备
蛋白疫苗是肿瘤疫苗的另一常见形式,不同于dna疫苗或病毒载体疫苗,它是以抗原蛋白形式进入细胞,可直接激活树突状细胞;同时,由于蛋白形式无法整合到宿主细胞基因组,具有较高的安全性。本实施例构建原核表达载体pet28a-spd1/ms,诱导表达融合蛋白疫苗(spd1/ms),具体的构建过程如下:
采用同源重组方法构建原核表达质粒pet28a-spd1/ms:将pet28a质粒(见图3-a)用ndei和xhoi双酶切后,胶回收载体序列5289bp片段。pcr扩增cpdv-il2-spd1/ms中spd1/ms顺反子的序列,引物5’端具有与切下来的pet28a载体两端同源的序列并带有相应的酶切位点(nde1和xho1),引物序列seqidno.19
gatctcagtggtggtggtggtggtgctcgagtta
atccatggcagccagctg和seqidno.20agcggcctggtgccgcgcg
gcagccatatggatgcaatgaagagagggc。
再根据无缝克隆试剂盒-seamlessassemblycloningkit(货号c5891)说明书进行操作将目的片段spd1/ms与载体连接起来得到了pet28a-spd1/ms(见图3-b)。将质粒转化至bl21感受态中进行扩增,加入iptg,37℃诱导表达,4-6小时后收集菌体,对菌体进行超声裂解后弃去上清;将沉淀以包涵体溶解buffer重悬,4℃磁力搅拌溶解过夜;离心,收上清,进行ni-nta亲和层析柱纯化,进行咪唑梯度洗脱,最后获得纯化的贮存终浓度1mg/ml的spd1/ms融合蛋白。
实施例3:重组病毒载体疫苗spd1/ms的构建
3.1重组痘病毒苗rmva-spd1/ms的获得
应用改良的安卡拉痘病毒(modifiedvacciniaankara,mva)协载肿瘤抗原免疫治疗肿瘤,其安全性较高。mva的穿梭质粒是psc11,其具有的多克隆酶切位点可以插入外源基因,本实例中将spd1基因插入前期构建完成的质粒psc11-ms(参见专利号为zl200910252427.x的发明专利),构建psc11-spd1/ms,载体上具有的胸苷激酶左臂和右臂(tkl、tkr)可与mva同源重组,同时通过载体上lacz基因,进行重组mva(rmva)的蓝斑筛选。
构建psc11-spd1/ms穿梭质粒的具体方法,首先通过引物seqidno:16和seqidno:17进行pcr反应,获得两端引入酶切位点的tpa-spd1基因,其后采用sali和xhoi同尾酶进行tpa/spd1的双酶切消化,用sali单酶切消化psc11-ms质粒(图4-a),dna凝胶回收目的基因和载体骨架,16℃连接过夜。将连接产物转化入top10感受态,使用氨苄青霉素抗性的lb培养基培养获得重组的融合psc11-spd1/ms质粒(见图4-b)。
接下来为了获得重组痘病毒,先将滴度0.05pfu/cell的空mva病毒感染含有tk基因的bhk-21的突变细胞,孵育2小时后,使用lipo2000试剂将穿梭质粒psc11-spd1/ms共转染到bhk细胞。被感染的细胞在37℃,5%co2下培养72小时后,收集细胞。超声波裂解细胞,2000rpm离心10min保留裂解上清。取适量上清作种毒,于六孔板中将痘病毒依次稀释成10-2、10-3、10-4、10-5、10-6感染bhk细胞2小时。弃去培养基,用等体积含有1%brdu(抑制野生mva生长)且42℃预温的2%低熔点琼脂糖和2×dmem-20培养基混匀,每孔加入2ml培养基,在室温下凝固,在37℃含5%co2的培养箱中培养48小时。铺上层选择性培养基,成分比下层琼脂多了1/120体积的4%x-gal。培养过夜,挑选蓝色单斑,反复冻融三次裂解释放病毒,进行下一轮筛选,步骤相同,如此进行6轮以上筛选,最后直至得到只含重组病毒mva-ms的克隆株。
3.2重组腺病毒疫苗的获得
腺病毒admaxtmadenovirus载体系统(microbix公司)包含穿梭载体和腺病毒载体。本实例采用前期构建的穿梭质粒pdc316-ms(参见专利号为200910252427.x的发明专利,图4-c),将spd1基因通过pcr方法,由引物seqidno:18和seqidno:13在基因的5’和3’端引入ecori酶切位点,对pdc316-ms和spd1基因的pcr产物ecori双酶切消化,16℃连接过夜。连接产物转化入top10感受态,并在37℃氨苄青霉素抗性的lb培养基中培养,经过质粒测序筛选获得阳性克隆pdc316-spd1/ms(见图4-d)。
其后进行腺病毒(ad)的同源重组,本实例中的腺病毒骨架为pbhgloxδe1,3cre。将ad载体和穿梭质粒pdc316-spd1/ms共转染293细胞,利用293细胞中的e1蛋白,经过10天左右即产生含有spd1/ms融合核酸的重组腺病毒噬斑。对噬斑进行pcr鉴定,反应条件95℃30s、55℃30s、72℃1min,反应30个循环,从而筛选正确的噬斑进行大量的扩增和纯化。
实施例4:spd1/ms肿瘤疫苗的免疫原性
4.1spd1/ms融合核酸疫苗的体液免疫活性
elisa方法检测spd1/ms融合dna疫苗针对muc1和survivin的抗体反应,并与ms疫苗(参见专利号为zl200910252427.x的发明专利)的体液免疫效果进行比较。选用4-6周龄balb/c小鼠,按表1设置spd1/ms疫苗实验组、ms疫苗对照组、单独spd1质粒对照组和pbs阴性对照组,上述dna质粒的制备均以无菌pbs溶解,终浓度调节至1mg/ml。具体的免疫程序是:第0周和第2周以dna载体疫苗初免,第4周以重组腺病毒疫苗加强免疫,选取小鼠后侧肢肌肉注射疫苗各50μg。最后一次免疫后两周对小鼠进行眼眦采血,离心分离的血清用于elisa抗体检测。
表1spd1/ms融合核酸疫苗与ms核酸疫苗的免疫原性
结果显示,接种spd1/ms疫苗的小鼠能产生高效的抗粘蛋白1抗体和抗生存素抗体,并且两者的抗体滴度可达10000以上。如图5-a和5-b所示,按1:125比例稀释的小鼠血清分别以原核表达并纯化收获的muc1蛋白、survivin蛋白和可溶spd1蛋白作为抗原检测特异性抗体反应,其中spd1/ms疫苗组与ms疫苗组相比,抗muc1抗体以及抗survivin抗体吸光度(450nm)读出值都有显著性提高(p<0.001),说明优化的spd1/ms融合核酸肿瘤疫苗能够启动强烈的特异性体液免疫应答;而接种cpvr-spd1质粒组与pbs组elisa抗体反应都呈阴性。另外,elisa检测到spd1/ms疫苗组以及spd1质粒组小鼠血清能产生一定的抗pd1抗体反应(见图5-c),然而pd1抗体滴度较低无法在体内产生大量的抗体来阻断pd-1负性信号通路,表明spd1融合核酸疫苗可能是通过激活小鼠的免疫系统发挥抗肿瘤作用的。同时,spd1/ms疫苗在诱导抗原特异性igg1(th2型)和igg2a(th1型)应答上也体现比ms疫苗组更为明显的优势(见图5-d、5-e)。
4.2spd1/ms融合核酸疫苗细胞免疫活性检测
为了考察重组spd1/msdna疫苗对粘蛋白1和生存素的特异性免疫应答,应用elispot法测定表1免疫小鼠脾淋巴细胞特异性分泌ifn-γ的斑点数目,同时检测各组免疫小鼠淋巴细胞ctl杀伤活性。elispot检测结果如图6-a所揭示,经过muc1蛋白刺激,spd1质粒组脾细胞对蛋白刺激无应答,显示单独spd1蛋白无法激活机体特异性细胞免疫效应;ms疫苗组脾细胞分泌的ifn-γ斑点数目较pbs阴性对照组有2倍数值的差异,而spd1/ms疫苗组脾细胞分泌ifn-γ斑点数目则明显高出pbs阴性组斑点数目数倍,spd1/ms疫苗与ms疫苗组斑点数目比较没有体现差异。另外,经过survivin蛋白刺激,结果如图6-b显示,单独的spd1质粒免疫小鼠同样没有应答反应;而ms疫苗组和spd1/ms疫苗组免疫小鼠的脾细胞分泌ifn-γ的斑点与pbs阴性对照组相比,均呈现阳性反应,spd1/ms疫苗与ms疫苗组两组之间的斑点数目相比较,spd1/ms疫苗显著多于ms,且具p值0.0141的统计学意义。
以免疫小鼠脾淋巴细胞作为效应细胞,以稳定表达融合肿瘤抗原蛋白ms的ct26细胞(命名为msf+ct26,其中f为full缩写,代表未截短n端氨基酸的全长生存素蛋白)作为靶细胞,按照一定效靶比例混合后采用碘化丙啶(pi)/cfse双色荧光染料标记法检测ctl杀伤活性,结果见图6-c。由图可知,ms疫苗组和spd1/ms疫苗组在效靶比12.5:1和50:1时,都表征出高于pbs组的ctl杀伤效应;ms疫苗组和spd1/ms疫苗组之间比较,spd1/ms疫苗对应不同效靶比的杀伤率分别为34.76%和35.56%,而ms疫苗杀伤率分别为21.65%和30.39%,显然优化的疫苗形式cpdv-il2-spd1/ms更具ctl杀伤活性。
综上,在cpdv-il2-spd1/ms疫苗与cpdv-il2-ms疫苗的免疫原性评价中,优化的疫苗形式spd1/ms能够诱导更高效的特异性体液免疫应答和细胞免疫应答。
4.3spd1与ms肿瘤疫苗的联合形式对小鼠免疫活性的作用
通常多基因疫苗的制备方式包括两种,一种是制备多基因融合表达的融合核酸疫苗,另一种则是以共注射的方式将两种或两种以上基因疫苗进行联合免疫。为了探讨spd1基因联合ms基因所制备疫苗形式的多样性,本部分实验比较spd1/ms重组dna疫苗,与spd1联合ms疫苗所诱导的小鼠免疫活性。具体实验分组如表2所示:4-6周龄小鼠随机分成pbs组、spd1/ms组和spd1+ms组,其中设置pbs组小鼠分别在第0、2和4周注射100μl无菌pbs作为阴性对照;spd1/ms组小鼠在第0和2周注射重组spd1/ms融合核酸疫苗,第4周以rad-ms重组腺病毒疫苗加强免疫;spd1+ms组小鼠在第0和2周注射事先混匀的cpvr-spd1质粒和cpdv-il2-ms质粒(各100μg),第4周同样采用重组腺病毒苗加强免疫。
表2spd1与ms疫苗的联合形式
第6周检测各组小鼠脾淋巴细胞特异性分泌ifn-γ的能力,结果如图6-d所示,与pbs阴性对照组相比,融合核酸疫苗cpdv-il2-spd1/ms以及联合免疫的cpvr-spd1与cpdv-il2-ms疫苗都使得t淋巴细胞分泌ms特异性ifn-γ的elispot斑点数目明显增多(p<0.01)。同时,比较spd1/ms疫苗与spd1+ms联合免疫的方式,其所诱导产生的特异性细胞免疫反应处于较为一致的水平,表明spd1基因与ms肿瘤抗原基因制备的疫苗,具有融合核酸疫苗和联合共注射疫苗的多种疫苗形式。
实施例5:spd1/ms肿瘤疫苗的免疫策略
5.1spd1/ms重组dna疫苗的免疫策略
本部分实验采用dna初免-重组腺病毒加强免疫的免疫策略,考察重组腺病毒疫苗rad-ms对spd1/ms疫苗所诱导的粘蛋白1和生存素特异性免疫应答的加强作用:将4-6周龄小鼠按表3进行随机分组,每组6只,其中第1组肌肉注射pbs作为阴性对照;第2组在第0周单独免疫重组腺病毒疫苗rad-ms(1×108pfu/只);第3组分别于第-4、-2和0周注射dna疫苗;第4组则在第-6、-4和-2周注射dna疫苗,第0周注射重组腺病毒疫苗。所有组别小鼠于第2周拉颈处死后无菌取脾,应用elispot法评价免疫小鼠针对粘蛋白1和生存素表位的免疫应答水平。
表3dna初免-重组腺病毒加强免疫策略
图7-a和图7-b为表2对应的各组免疫小鼠脾淋巴细胞elispot检测结果。由图可以看出,经过muc1表位(seqidno:21)或者survivin表位(seqidno:22)刺激的各组脾淋巴细胞只有第3组和第4组产生了阳性反应,且与pbs阴性对照组相比,其特异性分泌ifn-γ斑点数目依次增多(依次p<0.01),而单独的重组腺病毒rad-ms疫苗免疫组为阴性结果,说明单独免疫重组腺病毒无法诱导小鼠体内强烈的细胞免疫应答;同时,通过比较dna疫苗组和dna/rad组的结果发现,dna/rad组明显增强特异性免疫应答活性(p<0.05),说明dna初免-重组腺病毒加强免疫的免疫策略可以显著提升spd1/ms疫苗的免疫效果。
5.2spd1/ms重组病毒疫苗的免疫策略
本部分实验以spd1/ms重组痘病毒疫苗作为考察对象。将4-6周龄c57bl/6小鼠按表4随机分组,每组5只小鼠,其中阴性对照组小鼠分别在第-4、-2和0周注射无菌pbs,单独免疫痘病毒组小鼠于第0周免疫rmva-spd1/ms,每只小鼠注射剂量为1×108pfu,另一实验组小鼠在第-4和-2周采用spd1/ms重组dna疫苗进行初免,第0周用spd1/ms重组痘病毒疫苗进行免疫加强。所有组别小鼠于第2周拉颈处死后无菌取脾,应用elispot法评价免疫小鼠针对粘蛋白1和生存素表位的免疫应答水平。
表4spd1/ms重组病毒疫苗的免疫策略
结果如图8-a和8-b显示,与pbs阴性对照相比,单独免疫重组痘病毒苗的小鼠诱导产生了阳性的粘蛋白1和生存素特异性分泌ifn-γ的elispot斑点(p<0.01);而采用spd1/ms重组dna疫苗初免、重组spd1/ms痘病毒苗加强免疫的免疫策略的小鼠,其体内诱导产生高效的特异性细胞免疫应答,且与rmva免疫组相比,所产生elispot斑点数目显著增多(p<0.01)。以上结果表明融合表达spd1/ms的重组病毒疫苗具有激活小鼠特异性免疫的能力,并且应用prime-boost免疫策略有利于这种激活作用的增强。
实施例6:spd1/ms重组dna疫苗对黑素瘤模型小鼠的抗肿瘤作用
6.1疫苗对肿瘤生长的抑制作用
肿瘤接种实验检测重组spd1/msdna疫苗对黑素瘤模型小鼠的治疗作用:将4-6周龄c57bl/6小鼠按表5随机分组(8只/组)。第0天,在各组小鼠右侧近尾端背部皮下接种1×105个稳定表达融合肿瘤抗原33m和全长survivin蛋白的b16细胞(以下简称msf+b16),第1、8、15天分别给予疫苗注射,其中第1组注射pbs作为阴性对照,第2、3组则分别注射ms疫苗和spd1/ms疫苗。攻瘤后第7天开始观察肿瘤在小鼠体内的生长情况,实验以对照组小鼠发生死亡为观察结点。
图9-a为黑素瘤模型小鼠各组肿瘤生长体积变化情况。与阴性对照pbs组相比,ms疫苗与spd1/ms疫苗都减缓了黑色素瘤的生长,其中spd1/ms疫苗表现显著抑瘤作用(p<0.01),截止观察终点其肿瘤体积抑制率达52.62%。而spd1/ms疫苗与ms疫苗比较,从接种肿瘤第15天直至观察截止日,肿瘤生长速率减缓明显(p<0.05),由此看来,融合spd1的cpdv-il2-spd1/msdna疫苗能够优化疫苗对荷瘤小鼠的抑瘤作用。
表5重组spd1/msdna疫苗治疗黑色素瘤模型小鼠
6.2黑色素瘤荷瘤小鼠的生存期研究
按表5分组进行黑素瘤小鼠生存期的观察,观察截止时间到接种肿瘤后第50天。结果如图9-b所示,pbs组平均生存期为36天,全部死亡截止则为接种肿瘤后第40天。ms疫苗组小鼠平均生存38.5天,生命延长率6.94%,与阴性对照pbs组相比没有生命延长作用。而spd1/msdna疫苗组小鼠平均生存寿命43天,较对照组小鼠生命延长19.44%(p值0.0325)。尽管spd1/msdna疫苗治疗荷瘤小鼠的生存期与ms疫苗治疗组之间不具统计学意义,但从小鼠平均生存寿命和生命延长趋势上,重组spd1/msdna疫苗更具优势。
实施例7:spd1/ms重组病毒疫苗对黑素瘤模型小鼠的抗肿瘤作用
为了考察spd1/ms融合核酸疫苗的不同形式对肿瘤的抑制作用,应用rmva-spd1/ms和rad-spd1/ms重组病毒对黑素瘤荷瘤小鼠进行抗肿瘤免疫治疗。将4-6周龄的c57bl/6小鼠随机分为pbs阴性组、痘病毒疫苗治疗组和腺病毒疫苗治疗组,每组各5只小鼠。各组小鼠在第0天接种5×104个msf+b16细胞,接种后第1和15天对治疗组小鼠分别进行spd1/ms重组痘病毒疫苗或重组腺病毒疫苗的免疫,阴性组小鼠则接种等体积无菌pbs作为对照。攻瘤后第10天开始观察各组小鼠的肿瘤生长情况,结果如图10显示,与pbs阴性对照组相比,rmva-spd1/ms疫苗组和rad-spd1/ms疫苗组小鼠的肿瘤生长趋势皆有较明显的减缓(p<0.05),截止到攻瘤后第24天为止,spd1/ms重组痘病毒治疗小鼠的平均肿瘤体积比对照组的肿瘤体积减小约25%,spd1/ms重组腺病毒治疗小鼠的平均肿瘤体积则减小约23%,表明spd1/ms融合核酸的重组病毒载体疫苗形式具有有效抑制肿瘤生长的作用。
实施例8:spd1/ms重组dna疫苗对结直肠癌模型小鼠的抗肿瘤作用
8.1疫苗对肿瘤生长的抑制作用
本部分实验目的一是考察疫苗对结直肠癌模型小鼠体内肿瘤生长的抑制作用和对荷瘤小鼠的生命延长作用,另一方面,以化疗药物奥沙利铂作为阳性对照,通过疫苗与化药奥沙利铂的联合免疫治疗来考察二者对模型小鼠肿瘤治疗的协同效果。将4-6周龄balb/c小鼠按表3进行分组,每组10只,第0天在小鼠右侧近尾端后背皮下接种1×106个msf+ct26肿瘤细胞。第1、8、15天分别对各组小鼠肌肉注射疫苗,其中第1组为阴性对照注射pbs,第2、5组给予ms疫苗,第3、6组给予spd1/ms疫苗,表6中奥沙利铂(oxaliplatin,江苏海正药业)采用腹腔注射方式给药,每次注射剂量0.5mg/kg,间隔5天给药一次共5次。攻瘤后第12天开始记录肿瘤在小鼠体内的生长情况,以pbs对照组小鼠开始死亡为观察时间结点。为计算各实验组的肿瘤抑制率,在观察结点拉颈处死全部小鼠,剥离肿瘤并称量瘤重。
图11-a为结直肠癌模型小鼠肿瘤生长体积变化曲线。由图得知,spd1/ms疫苗组与pbs阴性组相比肿瘤生长明显减缓,从第23天开始即表现肿瘤体积的减小(p<0.05)。同时,从瘤重计算的各组肿瘤抑制率(见图11-b)来看,spd1/ms疫苗的抑瘤率达30.96%,比ms疫苗组17.18%的抑瘤率有提升的趋势但没有统计学意义。疫苗与化药奥沙利铂的联合治疗,结果显示spd1/ms疫苗与奥沙利铂的联合使得肿瘤生长几乎停滞,抑瘤率74.71%,而奥沙利铂组抑瘤率58.62%。spd1/ms疫苗与化药联合组与单独的奥沙利铂阳性对照相比,抑制肿瘤生长效果明显(p<0.01),相比之下,ms疫苗与化药的联合抑瘤结果则与奥沙利铂组没有统计学意义。说明spd1/ms疫苗在显著抑制肿瘤生长的同时,能够与化药奥沙利铂发挥协同抗肿瘤作用。
表6spd1/msdna疫苗治疗结直肠癌模型小鼠的免疫策略
8.2结直肠癌荷瘤小鼠的生存期研究
按表6的分组进行结直肠癌荷瘤小鼠的生存期观察,观察截止时间为接种肿瘤后第65天。结果如图11-c所示,重组ms疫苗组小鼠平均生存48.5天,重组spd1/ms疫苗组小鼠平均生存期为52天,与阴性对照(平均生存50天)均没有明显生命延长趋势;而在疫苗与化药联合治疗组中,观察到重组ms疫苗或重组重组spd1/msdna疫苗与奥沙利铂的联合使得小鼠平均生存期较pbs组分别延长22%和24%(p<0.001),其中重组spd1/msdna疫苗联合奥沙利铂治疗组的生存期与单独的奥沙利铂治疗组(生命延长14%)相比,体现一定的生命延长作用(p<0.05)。
实施例9:spd1/ms重组蛋白疫苗对结直肠癌荷瘤小鼠的抑瘤作用
根据实施例4和实施例5可知spd1/ms重组核酸形式的疫苗可以诱导小鼠体内产生强烈的muc1和survivin特异性细胞免疫,本实施例中则采用spd1/ms重组蛋白疫苗,同时结合铝佐剂al(oh)3加强免疫的策略进行结直肠癌模型的治疗。具体分组情况见表7:随机地将4-6周龄balb/c小鼠分成pbs阴性对照组、al(oh)3佐剂组以及佐剂联合重组spd1/ms蛋白疫苗治疗组,每组5只小鼠。各组小鼠于第0天接种1×106个msf+ct26肿瘤细胞,第1、8和15天则接受疫苗治疗,其中阴性组小鼠给予100μl体积的无菌pbs溶液,al(oh)3佐剂组小鼠注射等体积100μg剂量的al(oh)3佐剂(sigma公司),蛋白/佐剂组小鼠注射事先混匀的各100μg佐剂和重组spd1/ms蛋白。为计算各实验组的肿瘤抑制率,以pbs对照组小鼠开始死亡为观察时间结点,在观察结点拉颈处死全部小鼠,剥离肿瘤并称量瘤重。
表7spd1/ms蛋白疫苗治疗结直肠癌模型小鼠的免疫策略
各组治疗荷瘤小鼠的平均瘤重结果如图12-a所示。注射pbs的阴性组小鼠平均瘤重3.45g,al(oh)3佐剂组平均瘤重3.19g,与pbs组相比单独佐剂没有抑瘤效果,而spd1/ms融合蛋白与佐剂共同免疫的小鼠平均瘤重2.62g,与阴性对照组相比抑瘤率约24%,且有p<0.05的统计学意义。已知al(oh)3为常见的无机佐剂,其可通过诱导t细胞分化和体液免疫反应来提高疫苗的免疫原性,在本实例中可以看出重组spd1/ms蛋白能够抑制荷瘤小鼠肿瘤的生长,同时,分析观察终止的各组荷瘤小鼠脾淋巴细胞特异性分泌ifn-γ的能力(见图12-b),佐剂与蛋白疫苗共同免疫组也有较高的elispot斑点数目(p<0.01),体现spd1/ms重组蛋白疫苗诱导荷瘤小鼠体内特异性抗肿瘤免疫的能力。
实施例10:spd1/ms重组dna疫苗治疗乳腺癌模型小鼠
本部分实验考察spd1/ms融合核酸疫苗对乳腺癌荷瘤小鼠的治疗作用:将4-6周龄的balb/c小鼠随机分成两组,每组10只;第0天对小鼠接种稳定表达粘蛋白1和生存素的小鼠乳腺癌细胞(msf+4t1),其中实验组小鼠在第1天和第8天进行spd1/msdna疫苗的注射,第15天给予重组腺病毒rad-ms的注射,另组小鼠作为阴性对照,给予等体积的无菌pbs注射。接种肿瘤后第11天左右观察小鼠肿瘤生长变化情况,以pbs对照组小鼠开始死亡为观察时间结点。图13为乳腺癌模型小鼠肿瘤生长体积变化曲线,截至观察终点,重组spd1/ms疫苗治疗组小鼠肿瘤与pbs组相比其肿瘤生长速率明显减缓,肿瘤抑制率约40%,说明spd1/ms重组dna疫苗对乳腺癌具显著性抑瘤作用(p<0.001)。
实施例11:spd1/ms重组dna疫苗治疗肺癌模型小鼠
本部分实验考察spd1/ms融合核酸疫苗对肺癌荷瘤小鼠的治疗作用:将4-6周龄的c57bl/6小鼠按照表8随机地分为pbs阴性组和spd1/msdna疫苗治疗组,每组各15只;第0天对小鼠接种稳定表达粘蛋白1和生存素的小鼠肺癌细胞(msf+lewis),接种剂量为1×105个/只;其中pbs阴性组小鼠在第1、8和15天肌肉注射100μl无菌pbs;dna疫苗组小鼠则在第1、8和15天进行spd1/msdna疫苗的注射。接种肿瘤后第8天开始观察小鼠肿瘤生长变化,以pbs对照组小鼠开始死亡为观察时间结点。
表8spd1/msdna疫苗治疗结直肠癌模型小鼠的免疫策略
图14为肺癌模型小鼠肿瘤生长体积变化曲线,结果测量单独免疫重组spd1/msdna疫苗治疗组的小鼠肿瘤,其肿瘤生长速率明显减缓,与pbs阴性组小鼠肿瘤相比,具有显著的抑瘤效果(p<0.05)。综上表明spd1/ms重组dna疫苗治疗肺癌具有有效抗肿瘤治疗作用。
实施例12:spd1/ms重组dna疫苗治疗肝癌模型小鼠
本部分实施例考察重组spd1/ms疫苗针对肝癌荷瘤小鼠的治疗作用。将4-6周龄的balb/c小鼠进行随机分成两组,分别为pbs阴性对照组和spd1/msdna疫苗治疗组,每组各4只;第0天接种稳转粘蛋白1和生存素的小鼠肝癌细胞msf+h22,其中实验组小鼠在第1、8和15天肌肉注射spd1/msdna疫苗,在第22天注射重组腺病毒rad-ms加强免疫,另一组小鼠注射等体积无菌pbs作为阴性对照。接种肿瘤后第12天开始观察到小鼠肿瘤的生长并测量肿瘤体积变化,结果如图15所示,spd1/ms重组dna疫苗治疗的肝癌模型小鼠肿瘤生长明显趋缓(p<0.01),表明spd1/ms重组dna疫苗治疗肝癌具有显著抑瘤作用。
实施例13:spd1/ms重组dna疫苗治疗胃癌模型小鼠
本部分实施例选取前胃癌细胞(mfc)建立胃癌小鼠模型以考察spd1/msdna疫苗的抑瘤作用。将4-6周龄的615小鼠进行随机分两组,每组各4只。各组小鼠在第0天接种稳转粘蛋白1和生存素的小鼠前胃癌细胞msf+mfc,其中重组spd1/ms疫苗治疗组在第1、8和15天肌肉注射dna疫苗,第22天注射重组腺病毒rad-ms加强免疫,而另一组小鼠在同一时间注射等体积无菌pbs作为阴性对照。接种肿瘤后第12天开始测量各组小鼠的肿瘤生长曲线,图16结果表明spd1/ms重组dna疫苗治疗的胃癌模型小鼠,取得一定的抑制肿瘤效果(p<0.05)。
实施例14:活体基因导入仪促进spd1/ms重组dna疫苗的免疫原性和抗肿瘤效果
活体基因导入仪在注射位点通过电场的作用促进质粒进入细胞的效率。通过对活体基因导入仪器不同参数的研究,得到了适合我们疫苗的参数:电压:36v;频率:1hz;脉冲数:6次;脉宽:20ms。本部分实例对活体基因导入仪对dna疫苗免疫促进效果进行研究。图17结果显示使用活体基因导入仪器后,疫苗的细胞免疫效果得到显著提升。经survivin和muc1蛋白刺激后,淋巴细胞分泌ifn-γ的能力和ctl水平显著性升高,使用活体基因导入仪时20ug剂量即能达到与肌肉注射100ug的效果(p<0.05)。即使用活体基因导入增强了dna的免疫原性。图18结果显示,在抑制肿瘤生长方面,使用活体基因导入仪后,使用较低剂量的dna即可达到原来肌肉注射100ug的水平,并且当保持100ug剂量使用活体基因导入仪后,攻瘤后18天后开始,使用活体基因导入仪的100ug组小鼠肿瘤大小与肌肉注射组产生显著性差异(p<0.05)。检测荷瘤鼠体内免疫水平,ctl和elispot结果均表明,使用活体基因导入仪后,即使低剂量组较肌肉注射组的ctl和分泌ifn-γ的能力也均得到显著提升。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>长春百克生物科技股份公司;吉林大学
<120>重组疫苗及其应用
<130>mp1606888
<160>22
<170>siposequencelisting1.0
<210>1
<211>570
<212>dna
<213>人工序列(artificialsequence)
<400>1
atggatgcaatgaagagagggctctgctgtgtgctgctgctgtgtggagcagtcttcgtt60
tcgcccagcatgcagatcccacaggcgccctggccagtcgtctgggcggtgctacaactg120
ggctggcggccaggatggttcttagactccccagacaggccctggaacccccccaccttc180
tccccagccctgctcgtggtgaccgaaggggacaacgccaccttcacctccagcttctcc240
aacacatcggagagcttcgtgctaaactggtaccgcatgagccccagcaaccagacggac300
aagctggccgccttccccgaggaccgcagccagcccggccaggactgccgcttccgtgtc360
acacaactgcccaacgggcgtgacttccacatgagcgtggtcagggcccggcgcaatgac420
agcggcacctacctctgtggggccatctccctggcccccaaggcgcagatcaaagagagc480
ctgcgggcagagctcagggtgacagagagaagggcagaagtgcccacagcccaccccagc540
ccctcacccaggccagccggccagttccaa570
<210>2
<211>190
<212>prt
<213>人工序列(artificialsequence)
<400>2
metaspalametlysargglyleucyscysvalleuleuleucysgly
151015
alavalphevalserprosermetglnileproglnalaprotrppro
202530
valvaltrpalavalleuglnleuglytrpargproglytrppheleu
354045
aspserproaspargprotrpasnproprothrpheserproalaleu
505560
leuvalvalthrgluglyaspasnalathrphethrserserpheser
65707580
asnthrsergluserphevalleuasntrptyrargmetserproser
859095
asnglnthrasplysleualaalapheprogluaspargserglnpro
100105110
glyglnaspcysargpheargvalthrglnleuproasnglyargasp
115120125
phehismetservalvalargalaargargasnaspserglythrtyr
130135140
leucysglyalaileserleualaprolysalaglnilelysgluser
145150155160
leuargalagluleuargvalthrgluargargalagluvalprothr
165170175
alahisproserproserproargproalaglyglnphegln
180185190
<210>3
<211>2175
<212>dna
<213>人工序列(artificialsequence)
<400>3
atgcacggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctcca60
gctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgct120
cctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttcc180
actgctcctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccg240
ggttccactgctcctccagctgtcgagcacggcgtcacctctgccccagacaccaggccg300
gccccgggttccactgctcctccagctgtcgagcacggcgtcacctctgccccagacacc360
aggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctctgcccca420
gacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctct480
gccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtc540
acctctgccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcac600
ggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctccagctgtc660
gagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctcca720
gctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgct780
cctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttcc840
actgctcctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccg900
ggttccactgctcctccagctgtcgagcacggcgtcacctctgccccagacaccaggccg960
gccccgggttccactgctcctccagctgtcgagcacggcgtcacctctgccccagacacc1020
aggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctctgcccca1080
gacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctct1140
gccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtc1200
acctctgccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcac1260
ggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctccagctgtc1320
gagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctcca1380
gctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgct1440
cctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttcc1500
actgctcctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccg1560
ggttccactgctcctccagctgtcgagcacggcgtcacctctgccccagacaccaggccg1620
gccccgggttccactgctcctccagctgtcgagcacggcgtcacctctgccccagacacc1680
aggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctctgcccca1740
gacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctct1800
gccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtc1860
acctctgccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcac1920
ggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctccagctgtc1980
gagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctcca2040
gctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgct2100
cctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttcc2160
actgctcctccagct2175
<210>4
<211>725
<212>prt
<213>人工序列(artificialsequence)
<400>4
methisglyvalthrseralaproaspthrargproalaproglyser
151015
thralaproproalavalgluhisglyvalthrseralaproaspthr
202530
argproalaproglyserthralaproproalavalgluhisglyval
354045
thrseralaproaspthrargproalaproglyserthralapropro
505560
alavalgluhisglyvalthrseralaproaspthrargproalapro
65707580
glyserthralaproproalavalgluhisglyvalthrseralapro
859095
aspthrargproalaproglyserthralaproproalavalgluhis
100105110
glyvalthrseralaproaspthrargproalaproglyserthrala
115120125
proproalavalgluhisglyvalthrseralaproaspthrargpro
130135140
alaproglyserthralaproproalavalgluhisglyvalthrser
145150155160
alaproaspthrargproalaproglyserthralaproproalaval
165170175
gluhisglyvalthrseralaproaspthrargproalaproglyser
180185190
thralaproproalavalgluhisglyvalthrseralaproaspthr
195200205
argproalaproglyserthralaproproalavalgluhisglyval
210215220
thrseralaproaspthrargproalaproglyserthralapropro
225230235240
alavalgluhisglyvalthrseralaproaspthrargproalapro
245250255
glyserthralaproproalavalgluhisglyvalthrseralapro
260265270
aspthrargproalaproglyserthralaproproalavalgluhis
275280285
glyvalthrseralaproaspthrargproalaproglyserthrala
290295300
proproalavalgluhisglyvalthrseralaproaspthrargpro
305310315320
alaproglyserthralaproproalavalgluhisglyvalthrser
325330335
alaproaspthrargproalaproglyserthralaproproalaval
340345350
gluhisglyvalthrseralaproaspthrargproalaproglyser
355360365
thralaproproalavalgluhisglyvalthrseralaproaspthr
370375380
argproalaproglyserthralaproproalavalgluhisglyval
385390395400
thrseralaproaspthrargproalaproglyserthralapropro
405410415
alavalgluhisglyvalthrseralaproaspthrargproalapro
420425430
glyserthralaproproalavalgluhisglyvalthrseralapro
435440445
aspthrargproalaproglyserthralaproproalavalgluhis
450455460
glyvalthrseralaproaspthrargproalaproglyserthrala
465470475480
proproalavalgluhisglyvalthrseralaproaspthrargpro
485490495
alaproglyserthralaproproalavalgluhisglyvalthrser
500505510
alaproaspthrargproalaproglyserthralaproproalaval
515520525
gluhisglyvalthrseralaproaspthrargproalaproglyser
530535540
thralaproproalavalgluhisglyvalthrseralaproaspthr
545550555560
argproalaproglyserthralaproproalavalgluhisglyval
565570575
thrseralaproaspthrargproalaproglyserthralapropro
580585590
alavalgluhisglyvalthrseralaproaspthrargproalapro
595600605
glyserthralaproproalavalgluhisglyvalthrseralapro
610615620
aspthrargproalaproglyserthralaproproalavalgluhis
625630635640
glyvalthrseralaproaspthrargproalaproglyserthrala
645650655
proproalavalgluhisglyvalthrseralaproaspthrargpro
660665670
alaproglyserthralaproproalavalgluhisglyvalthrser
675680685
alaproaspthrargproalaproglyserthralaproproalaval
690695700
gluhisglyvalthrseralaproaspthrargproalaproglyser
705710715720
thralaproproala
725
<210>5
<211>411
<212>dna
<213>人工序列(artificialsequence)
<400>5
atgcctgcctggcagccctttctcaaggaccaccgcatctctacattcaagaactggccc60
ttcttggagggctgcgcctgcaccccggagcggatggccgaggctggcttcatccactgc120
cccactgagaacgagccagacttggcccagtgtttcttctgcttcaaggagctggaaggc180
tgggagccagatgacgaccccatagaggaacataaaaagcattcgtccggttgcgctttc240
ctttctgtcaagaagcagtttgaagaattaacccttggtgaatttttgaaactggacaga300
gaaagagccaagaacaaaattgcaaaggaaaccaacaataagaagaaagaatttgaggaa360
actgcgaagaaagtgcgccgtgccatcgagcagctggctgccatggattaa411
<210>6
<211>135
<212>prt
<213>人工序列(artificialsequence)
<400>6
proalatrpglnpropheleulysasphisargileserthrphelys
151015
asntrppropheleugluglycysalacysthrprogluargmetala
202530
glualaglypheilehiscysprothrgluasngluproaspleuala
354045
glncysphephecysphelysgluleugluglytrpgluproaspasp
505560
aspproileglugluhislyslyshisserserglycysalapheleu
65707580
servallyslysglnpheglugluleuthrleuglyglupheleulys
859095
leuasparggluargalalysasnlysilealalysgluthrasnasn
100105110
lyslyslysglupheglugluthralalyslysvalargargalaile
115120125
gluglnleualaalametasp
130135
<210>7
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>7
ggtggtggttcaggaggagga21
<210>8
<211>3168
<212>dna
<213>人工序列(artificialsequence)
<400>8
gatgcaatgaagagagggctctgctgtgtgctgctgctgtgtggagcagtcttcgtttcg60
cccagcatgcagatcccacaggcgccctggccagtcgtctgggcggtgctacaactgggc120
tggcggccaggatggttcttagactccccagacaggccctggaacccccccaccttctcc180
ccagccctgctcgtggtgaccgaaggggacaacgccaccttcacctccagcttctccaac240
acatcggagagcttcgtgctaaactggtaccgcatgagccccagcaaccagacggacaag300
ctggccgccttccccgaggaccgcagccagcccggccaggactgccgcttccgtgtcaca360
caactgcccaacgggcgtgacttccacatgagcgtggtcagggcccggcgcaatgacagc420
ggcacctacctctgtggggccatctccctggcccccaaggcgcagatcaaagagagcctg480
cgggcagagctcagggtgacagagagaagggcagaagtgcccacagcccaccccagcccc540
tcacccaggccagccggccagttccaaggatctaccatgcacggcgtcacctctgcccca600
gacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctct660
gccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtc720
acctctgccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcac780
ggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctccagctgtc840
gagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctcca900
gctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgct960
cctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttcc1020
actgctcctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccg1080
ggttccactgctcctccagctgtcgagcacggcgtcacctctgccccagacaccaggccg1140
gccccgggttccactgctcctccagctgtcgagcacggcgtcacctctgccccagacacc1200
aggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctctgcccca1260
gacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctct1320
gccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtc1380
acctctgccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcac1440
ggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctccagctgtc1500
gagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctcca1560
gctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgct1620
cctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttcc1680
actgctcctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccg1740
ggttccactgctcctccagctgtcgagcacggcgtcacctctgccccagacaccaggccg1800
gccccgggttccactgctcctccagctgtcgagcacggcgtcacctctgccccagacacc1860
aggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctctgcccca1920
gacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctct1980
gccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtc2040
acctctgccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcac2100
ggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctccagctgtc2160
gagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgctcctcca2220
gctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttccactgct2280
cctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccgggttcc2340
actgctcctccagctgtcgagcacggcgtcacctctgccccagacaccaggccggccccg2400
ggttccactgctcctccagctgtcgagcacggcgtcacctctgccccagacaccaggccg2460
gccccgggttccactgctcctccagctgtcgagcacggcgtcacctctgccccagacacc2520
aggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctctgcccca2580
gacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtcacctct2640
gccccagacaccaggccggccccgggttccactgctcctccagctgtcgagcacggcgtc2700
acctctgccccagacaccaggccggccccgggttccactgctcctccagctctcgacatg2760
cctgcctggcagccctttctcaaggaccaccgcatctctacattcaagaactggcccttc2820
ttggagggctgcgcctgcaccccggagcggatggccgaggctggcttcatccactgcccc2880
actgagaacgagccagacttggcccagtgtttcttctgcttcaaggagctggaaggctgg2940
gagccagatgacgaccccatagaggaacataaaaagcattcgtccggttgcgctttcctt3000
tctgtcaagaagcagtttgaagaattaacccttggtgaatttttgaaactggacagagaa3060
agagccaagaacaaaattgcaaaggaaaccaacaataagaagaaagaatttgaggaaact3120
gcgaagaaagtgcgccgtgccatcgagcagctggctgccatggattaa3168
<210>9
<211>465
<212>dna
<213>人工序列(artificialsequence)
<400>9
gccatgtatagaatgcagctgctgtcttgtatcgctctgagtctggctctggtgacaaac60
agtgctcctacatccagctccaccaagaagacacagctacagctcgaacacttactcctg120
gacttgcagatgatattgaatggcattaacaactacaagaaccctaagctgacaagaatg180
ctgaccttcaagttttacatgcctaagaaagctaccgagctgaaacatctgcagtgtctg240
gaagaagaactgaagcctctggaagaagtgctgaacttggcccaaagtaagaatttccac300
ttgagacccagagacttgattagcaacattaacgtgatcgtcctcgaactgaagggatct360
gagacaacattcatgtgtgagtacgctgacgagaccgctaccattgtggagtttctgaac420
aggtggatcacattctgtcagagcatcatctctaccctgacttga465
<210>10
<211>7
<212>prt
<213>人工序列(artificialsequence)
<400>10
glyglyglyserglyglygly
15
<210>11
<211>69
<212>dna
<213>人工序列(artificialsequence)
<400>11
atggatgcaatgaagagagggctctgctgtgtgctgctgctgtgtggagcagtcttcgtt60
tcgcccagc69
<210>12
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>12
ctgcagagatcttctagaatgg22
<210>13
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>13
gaattcggatccttggaactggc23
<210>14
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>14
tctagagccatgtatagaatgcagctgc28
<210>15
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>15
ggatcctcaagtcagggtagagatgatgc29
<210>16
<211>56
<212>dna
<213>人工序列(artificialsequence)
<400>16
tcacgagatctgtcgacctgcaggccgccaccatggatgcaatgaagagagggctc56
<210>17
<211>56
<212>dna
<213>人工序列(artificialsequence)
<400>17
atctaggatccctcgagtcctcctcctgaaccaccaccttggaactggccggctgg56
<210>18
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>18
gaattcagatcttctagaatgg22
<210>19
<211>52
<212>dna
<213>人工序列(artificialsequence)
<400>19
gatctcagtggtggtggtggtggtgctcgagttaatccatggcagccagctg52
<210>20
<211>49
<212>dna
<213>人工序列(artificialsequence)
<400>20
agcggcctggtgccgcgcggcagccatatggatgcaatgaagagagggc49
<210>21
<211>9
<212>prt
<213>人工序列(artificialsequence)
<400>21
alaproaspthrargproalaprogly
15
<210>22
<211>9
<212>prt
<213>人工序列(artificialsequence)
<400>22
serthrphelysasntrppropheleu
15
- 还没有人留言评论。精彩留言会获得点赞!