用于合成α4β7肽拮抗剂的方法与流程
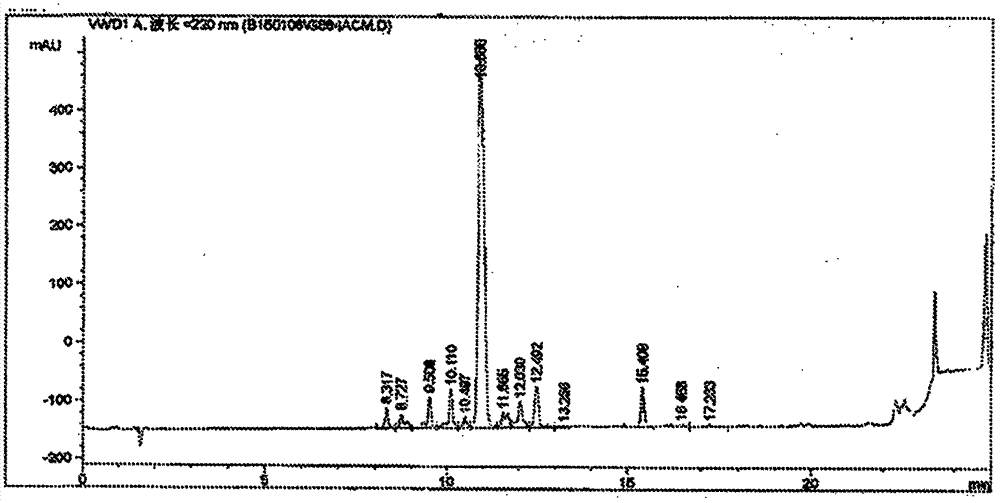
背景技术:
:整合素是非共价结合的α/β异二聚体细胞表面受体,参与从细胞粘附和迁移到基因调节的许多细胞过程(杜博瑞(dubree)等人,选择性α4β7整合素拮抗剂及其作为消炎剂的潜能(selectiveα4β7integrinantagonistandtheirpotentialasanti-inflammatoryagents),药物化学杂志(j.med.chem.)2002,45,3451-3457)。整合素的差异表达可以调节细胞的粘附特性,允许不同的白细胞群体响应不同的炎症信号而募集到特定器官。如果任其发展,那么整合素介导的粘附过程可能导致慢性炎症和自身免疫疾病。α4整合素α4β1和α4β7在整个胃肠道中的淋巴细胞迁移中起重要作用。它们在大多数白细胞(包括b和t淋巴细胞)上表达,其中它们分别通过与它们各自的主要配体血管细胞粘附分子(vcam)和粘膜地址素细胞粘附分子(madcam)结合而介导细胞粘附。蛋白质的结合特异性的差异在于vcam既结合α4β1又以较低程度结合α4β7,而madcam对α4β7具有高度特异性。除了与α4亚基配对之外,β7亚基还与αe亚基形成异二聚体复合物,从而形成αeβ7,它主要在肠、肺以及泌尿生殖道中的上皮内淋巴细胞(iel)上表达。αeβ7还在肠道中的树突状细胞上表达。αeβ7异二聚体与上皮细胞上的e-钙粘素结合。认为iel细胞提供上皮细胞隔室内免疫监视的机制。因此,将αeβ7和α4β7一起阻断可能是治疗肠道发炎病况的有用方法。已显示特异性整合素-配体相互作用的抑制剂作为治疗各种自身免疫疾病的消炎剂是有效的。例如,对α4β7表现出高结合亲和力的单克隆抗体已显示出对胃肠道自身炎症/自身免疫疾病(例如克罗恩氏病和溃疡性结肠炎)的治疗益处。然而,这些疗法中的一个干扰α4β1整合素-配体相互作用,从而导致对患者的危险副作用。利用双特异性小分子拮抗剂的疗法在动物模型中显示出类似的副作用。因此,本领域需要对α4β7整合素具有高亲和力和对α4β1整合素具有高选择性的整合素拮抗剂分子,作为各种胃肠道自身免疫疾病的疗法。这种整合素拮抗剂分子和相关的组合物和方法已在2015年10月1日提交的名称为“新型α4β7肽单体和二聚体拮抗剂”的pct申请中描述。因此,需要合成这种肽二聚体的改进方法。本文描述了这种改进的固相和溶液相方法。技术实现要素:在某些方面,本发明提供一种制备肽二聚体化合物的方法,其包含:(i)合成具有本文所述序列的肽,并在肽的两个残基之间引入分子内二硫键(或允许形成分子内键),并将接头与肽缀合;(ii)合成具有本文所述序列(例如,与步骤(i)相同的序列)的肽,并在肽的两个残基之间引入分子内二硫键(或允许形成分子内二硫键);以及(iii)通过与步骤(i)的肽连接的接头将步骤(i)的肽与步骤(ii)的肽缀合。在其它方面,本发明的方法提供一种制备肽二聚体化合物的方法,其包含(i)合成具有包含两个青霉胺残基的序列的肽,并通过肽的氧化环化在肽的两个青霉胺残基之间引入分子内二硫桥键以提供环肽,以及(ii)通过接头缀合两当量的步骤(i)的环化单体肽。在本发明的其它实施例中,肽二聚体的肽通过固相肽合成来合成。在本发明的其它实施例中,肽二聚体的肽通过溶液相肽合成来合成。在具体实施例中,本发明的方法提供了通过溶液相和/或固相化学方法使用廉价的起始材料和温和试剂以商业和/或工业量合成含有青霉胺的肽的方法,以产生高纯度肽。在本发明的某些实施例中,青霉胺的硫醇基受乙酰氨基甲基(acm)或三苯基甲基(trt)保护基团保护或作为假脯氨酸(ψr,rpro)衍生物受到保护。在本发明的某些实施例中,青霉胺作为假脯氨酸衍生物掺入肽中。在某些实施例中,本发明提供合成化合物a(seqidno:1)、其两性离子、水合、溶剂化形式以及药学上可接受的盐、溶剂合物和水合物的方法。化合物a在具体实施例中,本发明提供合成化合物b(seqidno:2)的环化肽单体的方法。化合物b.在本发明的其它实施例中,使用固相肽合成然后通过pen残基的氧化环化来制备化合物b。在本发明的其它实施例中,使用fmoc化学、固相肽合成制备化合物b。在本发明的具体实施例中,化合物b在合适的树脂上用选自由以下组成的组的氨基酸合成:fmoc-d-lys(boc)-oh、fmoc-β-homoglu(otbu)-oh、fmoc-l-(4-tbu)phe-oh、fmoc-l-pen(acm)-oh、fmoc-l-pen(trt)-oh、fmoc-pen(ψme,mepro)-oh、bpoc-pen(ψme,mepro)-oh、cbz-pen(ψme,mepro)-oh、fmoc-pen(ψh,hpropro)-oh、bpoc-pen(ψh,hpropro)-oh、cbz-pen(ψh,hpropro)-oh、fmoc-leu-pen(ψme,mepro)-oh、bpoc-leu-pen(ψme,mepro)-oh、cbz-leu-pen(ψme,mepro)-oh、fmoc-leu-pen(ψh,hpropro)-oh、bpoc-leu-pen(pro)-oh、或cbz-leu-pen(pro)-oh、fmoc-l-leu-oh、fmoc-l-thr(tbu)oh、fmoc-l-asp(otbu)-oh、fmoc-l-asp(otbu)-thr(ψme,mepro)-oh、fmoc-l-ser(tbu)-oh、fmoc-l-n(me)-arg(pbf)-oh、fmoc-l-trp(boc)-oh、fmoc-β-homoglu(otbu)-oh、fmoc-l-glu(otbu)-oh)、fmoc-d-glu(otbu)-oh和fmoc-n-d-lys(boc)-oh。在本发明的其它实施例中,化合物b在三环酰胺接头树脂(ramageresin)上制备。在本发明的其它实施例中,化合物b用以下受保护的氨基酸制备:fmoc-d-lys(boc)-oh、fmoc-β-homoglu(otbu)-oh、fmoc-l-(4-tbu)phe-oh、fmoc-l-pen(acm)-oh、fmoc-l-leu-oh、fmoc-l-thr(tbu)oh、fmoc-l-asp(otbu)-oh、fmoc-l-ser(tbu)-oh、fmoc-l-n(me)-arg(pbf)-oh。在本发明的其它实施例中,化合物b用以下受保护的氨基酸制备:fmoc-d-lys(boc)-oh、fmoc-β-homoglu(otbu)-oh、fmoc-l-(4-tbu)phe-oh、fmoc-l-pen(trt)-oh、fmoc-l-leu-oh、fmoc-l-asp(otbu)-thr(ψme,mepro)-oh、fmoc-l-ser(tbu)-oh、fmoc-n(me)-arg(pbf)-oh。在本发明的某些实施例中,在偶联受保护的pen残基之后,在脱保护、裂解、环化和纯化之前,将n端pen残基酰化。在某些实施例中,树脂的脱保护和裂解在同一步骤中发生。在本发明的其它实施例中,通过在两个pen残基之间引入分子内二硫桥键,使具有序列ac-pen-n(me)arg-ser-asp-thr-leu-pen-phe(4-tbu)-β-homoglu-d-lys-nh2(seqidno:25)的肽氧化环化以形成化合物b。在本发明的其它实施例中,将两当量的化合物b用二乙醇酸接头二聚化,得到化合物a。在本发明的具体实施例中,所述方法提供了线性十肽的合成,即:ac-pen-n(me)arg-ser-asp-thr-leu-pen-phe(4-tbu)-β-homoglu-d-lys-nh2(seqidno:25)。在本发明的其它实施例中,ac-pen-n(me)arg-ser-asp-thr-leu-pen-phe(4-tbu)-β-homoglu-d-lys-nh2(seqidno:25)通过两个pen残基之间的二硫桥键氧化形成分子内环肽。在其它实施例中,环状十肽用合适的接头二聚化以产生肽二聚体(化合物a)。在本发明的某些实施例中,受保护的片段ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使六肽ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)与四肽h-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合来制备,其中每个r独立地为acm或trt。在本发明的其它实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使六肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)与四肽h-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合来制备。在本发明的其它实施例中,六肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)是通过使ac-pen(ψme,mepro)-oh与五肽hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)缩合来制备。在本发明的其它实施例中,六肽ac-pen(acm)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)是通过使ac-pen(acm)-oh与五肽hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)缩合来制备。在本发明的其它实施例中,六肽ac-pen(trt)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)是通过使ac-pen(trt)-oh与五肽hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)缩合来制备。在本发明的其它实施例中,四肽h-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)是通过使fmoc-pen(ψme,mepro)、bpoc-pen(ψme,mepro)或cbz-pen(ψme,mepro)与三肽h-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合,然后去除n端保护基团来制备。在本发明的其它实施例中,五肽h-leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)是通过使二肽fmoc-leu-pen(ψme,mepro)-oh与三肽h-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2缩合,然后去除n端保护基团来制备。在本发明的其它实施例中,六肽ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(ψme,mepro)-leu-oh(seqidno:3)是通过使ac-pen(r)-oh与五肽hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(ψme,mepro)-leu-ome(seqidno:5)缩合来制备。其中r=acm、trt或(ψme,mepro)在本发明的其它实施例中,四肽h-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)是通过使fmoc-pen(acm)-oh与三肽h-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合,然后去除n端保护基团来制备。在本发明的其它实施例中,四肽h-pen(trt)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)是通过使fmoc-pen(trt)-oh与三肽h-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合,然后去除n端保护基团来制备。在本发明的其它实施例中,十肽ac-pen(trt)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(trt)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(trt)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:87)与fmoc-pen(trt)-oh缩合,然后去除n端保护基团并用乙酸酐进行乙酰化来制备。在本发明的其它实施例中,十肽ac-pen(acm)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:87)与fmoc-pen(acm)-oh缩合,然后去除n端保护基团并用乙酸酐进行乙酰化来制备。在本发明的其它实施例中,十肽ac-pen(trt)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(trt)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使二肽fmoc-pen(trt)-n(me)arg(pbf)-oh与八肽hser(tbu)-asp(otbu)-thr(tbu)-leu-pen(trt)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:86)缩合,然后去除n端保护基团并用乙酸酐进行乙酰化来制备。在本发明的其它实施例中,十肽ac-pen(acm)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使二肽fmoc-pen(acm)-n(me)arg(pbf)-oh与八肽hser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:86)缩合,然后去除n端保护基团并用乙酸酐进行乙酰化来制备。在本发明的其它实施例中,八肽hser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:86)是通过使四肽fmoc-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:5)与四肽hpen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合,然后去除n端保护基团来制备。在本发明的其它实施例中,九肽hn(me)arg-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:87)是通过使五肽hn(me)arg-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:5)与四肽hpen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合来制备。在本发明的其它实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使八肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-oh(seqidno:80)与二肽hβ-homoglu(otbu)-d-lys(boc)-nh2缩合来制备。在本发明的其它实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使七肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-oh(seqidno:81)与三肽hphe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2缩合来制备。在本发明的其它实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使六肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)与四肽hpen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合来制备。在本发明的其它实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使五肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-oh(seqidno:73)与五肽hleu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:83)缩合来制备。在本发明的某些实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使四肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-oh(seqidno:71)与六肽hthr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:84)缩合来制备。在本发明的具体实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使三肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-oh与七肽hasp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:85)缩合来制备。在本发明的其它实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使二肽ac-pen(ψme,mepro)-n(me)arg(pbf)-oh与八肽hser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:86)缩合来制备。在本发明的某些实施例中,区段a,即受保护的六肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)是通过使五肽hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)与ac-pen(ψme,mepro)-oh缩合,然后皂化来制备。在本发明的其它实施例中,区段b是通过使cbz-pen(ψme,mepro)、fmoc-pen(ψme,mepro)或bpoc-pen(ψme,mepro)与hphe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2缩合,然后去除cbz、fmoc或bpoc保护基团来制备。在本发明的一个具体实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使六肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)与四肽h-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合来制备。受保护的十肽用混合液tfa/水/tis(9.0:0.5:0.25)处理,一步去除假脯氨酸(ψme,mepro)基团、tbu、otbu、pbf和boc基团,得到未受保护的十肽,然后用过氧化氢氧化形成二硫键,得到环化的十肽化合物b,并用二乙醇酸酯接头二聚化,得到化合物a。在本发明的其它实施例中,受保护的片段ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(ψme,mepro)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使五肽ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(ψme,mepro)oh(seqidno:73)与五肽hleu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:83)缩合来制备。(r=acm、trt或ψme,mepro)在本发明的其它实施例中,受保护的片段七肽hasp(otbu)-thr(ψme,mepro)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:85)是通过使二肽cbz-asp(otbu)-thr(ψme,mepro)-oh与五肽h-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:73)缩合来制备。(r=acm、trt或ψme,mepro)。附图说明图1表示未纯化、未受保护的线性单体的hplc色谱图。单体的保留时间为10.888分钟。纯度67.05%(auc)。在12.4分钟和15.4分钟(总共约8%)的峰是受保护的单体。图2表示未纯化的环化单体的hplc色谱图。环化单体的保留时间为12.714分钟。纯度59.92%(auc)图3表示未环化的粗单体(rt12.158分钟)和环化的未纯化单体(rt12.714分钟)的hplc色谱图的叠加图。图4表示纯环化单体(化合物b)的hplc色谱图。纯环化单体的保留时间为12.733分钟。纯度94.09%(auc)图5表示粗二聚体(化合物a)的hplc色谱图。粗二聚体的保留时间为17.43分钟。纯度83.59%(auc)。0至5分钟之间的峰是溶剂前峰。图6表示纯二聚体(化合物a)的hplc色谱图。纯化的二聚体的保留时间为29.57分钟。纯度99.25%(auc)。50分钟后的峰是洗涤峰。图7表示未纯化、未受保护的线性单体的hplc色谱图。单体的保留时间为13.699分钟。纯度51.23%(auc)。图8表示未纯化的环化单体的hplc色谱图。环化单体的保留时间为11.04分钟。纯度40.10%(auc)具体实施方式定义如本文所用,除非上下文另外明确规定,否则单数形式“一个(a/an)”和“所述”包括复数个指代物。如本说明书中所用,以下术语具有指示的含义:如本文所用,术语“肽”泛指通过肽键连接在一起的两个或更多个氨基酸的序列。应理解,这一术语不意味着特定长度的氨基酸聚合物,也不打算暗示或区分多肽是使用重组技术、化学或酶促合成产生的,还是天然存在的。如本文所用,术语“二聚体”泛指包含两个或更多个亚基的肽,其中亚基是在c或n端连接的肽。二聚体还包括包含两个亚基的肽,所述亚基通过一个或多个内部氨基酸残基或其衍生物连接。每个亚基可以通过其n端、c端或通过其内部氨基酸或其衍生物与另一个亚基连接,所述内部氨基酸或其衍生物对于两个亚基中的每一个可以是不同的。本发明的二聚体可以包括同二聚体和异二聚体,并充当整合素拮抗剂。肽二聚体化合物可以在本文中使用以下命名法描述:[xn]2,这表明肽二聚体包含两个在方括号内定义的单体亚基(例如xn,其中x代表氨基酸,n代表肽中氨基酸的数目)。连接两个肽亚基的接头部分可以如下所示:[xn]2-λ或λ-[xn]2,其中λ是接头。其它化学部分,例如可检测标记,可以使用与接头类似的方式显示。如本文所用,术语“l-氨基酸”是指氨基酸的“l”异构形式,相反,术语“d-氨基酸”是指氨基酸的“d”异构形式。除非另有说明,否则本文所述的氨基酸残基为“l”异构形式,然而,“d”异构形式的残基可以取代任何l-氨基酸残基,只要肽保留所需的功能即可。如本文所用,术语“nh2”是指存在于多肽氨基端的游离氨基或存在于多肽c端的-conh2基团。如本文所用,术语“oh”是指存在于肽的羧基端的游离羧基。此外,如本文所用,术语“ac”是指通过多肽的n端或肽中的任何氨基酸的酰化来保护乙酰基。术语“nh2”在本文中还可用于指c端酰胺基,例如在conh2的背景下。如本文所用,术语“羧基”是指-co2h。如本文所用,术语“环化”是指其中多肽分子的一部分与多肽分子的另一部分连接以形成闭环的反应,例如通过形成分子内二硫桥键或其它类似键,例如内酰胺键。在具体实施例中,本文所述的肽二聚体化合物的肽单体化合物或单体亚基通过肽单体或单体亚基中存在的两个氨基酸残基之间的分子内键环化。如本文所用,术语“亚基”是指在c或n端连接以形成二聚体肽组合物的一对多肽单体之一。如本文所用,术语“接头”泛指能够将多个肽单体亚基连接在一起以形成二聚体的化学结构。如本文所用,术语“药学上可接受的盐”代表本发明化合物的盐或两性离子形式,它们是水溶性或油溶性或可分散的,适用于治疗疾病而无过度毒性、刺激和过敏反应;这与合理的利益/风险比相称,并且对其预期用途有效。盐可以在化合物的最终分离和纯化过程中制备,或者通过用合适的酸处理氨基来单独制备。代表性酸加成盐包括但不限于乙酸盐、己二酸盐、藻酸盐、柠檬酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、二葡糖酸盐、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、甲酸盐、富马酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、2-羟基乙磺酸盐(羟乙基磺酸盐)、乳酸盐、马来酸盐、均三甲苯磺酸盐、甲磺酸盐、萘磺酸盐、烟酸盐、2-萘磺酸盐、草酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、苦味酸盐、新戊酸盐、丙酸盐、琥珀酸盐、酒石酸盐、三氯乙酸盐、三氟乙酸盐、磷酸盐、谷氨酸盐、碳酸氢盐、对甲苯磺酸盐和十一酸盐。另外,本发明化合物中的氨基可以用甲基、乙基、丙基和丁基氯化物、溴化物和碘化物;二甲基,二乙基,二丁基和二甲基硫酸盐;癸基、月桂基、肉豆蔻基和甾醇基氯化物、溴化物和碘化物;和苯甲基和苯乙基溴化物。可用于形成治疗上可接受的加成盐的酸的实例包括但不限于无机酸,例如盐酸、氢溴酸、硫酸和磷酸;和有机酸,例如草酸、马来酸、琥珀酸和柠檬酸。在某些实施例中,本文所述的任何肽单体化合物或肽二聚体化合物是盐形式,例如乙酸盐。如本文所用,术语“n(α)甲基化”描述了氨基酸的α胺的甲基化,通常也称为n-甲基化。根据普遍接受的公约书写所有肽序列,由此α-n端氨基酸残基位于左侧,α-c端位于右侧。如本文所用,术语“α-n端”是指肽中氨基酸的游离α-氨基,术语“α-c端”是指肽中氨基酸的游离α-羧酸末端。除非另有说明,否则应理解左侧的α-n端残基具有游离的α-氨基,右侧的α-c端残基具有游离的α-羧酸基。肽序列可以在表格中显示,其可以进一步公开其它部分,例如n端或c端化学修饰、接头、缀合物和/或标记,它们存在于本发明化合物的某些实施例中。应注意,术语“包含”旨在是开放的并且允许但不要求包括额外的元件或步骤。当在本文中使用术语“包含”时,因此也涵盖和公开了术语“由……组成”。这里使用的术语“氨基酸”或“任何氨基酸”是指任何和所有氨基酸,包括天然存在的氨基酸(例如,α-氨基酸)、非天然氨基酸、经修饰的氨基酸和非天然氨基酸。它包括d-和l-氨基酸。天然氨基酸包括在自然界中发现的那些,例如,结合成肽链以形成大量蛋白质的构建块的23个氨基酸。这些主要是l立体异构体,但细菌包膜和一些抗生素中存在一些d-氨基酸。“非标准”天然氨基酸是吡咯赖氨酸(在产甲烷生物和其它真核生物中发现)、硒代半胱氨酸(存在于许多非真核生物以及大多数真核生物中)和n-甲酰基甲硫氨酸(由细菌、线粒体和叶绿体中的起始密码子aug编码)。“非天然(unnatural或non-natural)”氨基酸是天然存在或化学合成的非蛋白原氨基酸(即,并非天然编码或存在于遗传密码中的氨基酸)。已知超过140种氨基酸天然存在,并且可能有数千种组合。“非天然”氨基酸的实例包括β-氨基酸(β3和β2)、高氨基酸、脯氨酸和丙酮酸衍生物、3-取代的丙氨酸衍生物、甘氨酸衍生物、环取代的苯丙氨酸和酪氨酸衍生物、线性核心氨基酸、二氨基酸、d-氨基酸、α-甲基氨基酸和n-甲基氨基酸。非天然氨基酸还包括经修饰的氨基酸。“经修饰的”氨基酸包括已经化学修饰以包括并非天然存在于氨基酸上的基团或化学部分的氨基酸(例如天然氨基酸)。在大多数情况下,本文所用的天然存在和非天然存在的氨酰基残基的名称遵循iupac委员会关于有机化学命名法(nomenclatureoforganicchemistry)和iupac-iub委员会关于生物化学命名法(biochemicalnomenclature)建议的命名规范,如“α-氨基酸命名法(nomenclatureofα-aminoacids)(推荐,1974)”生物化学(biochemistry),14(2),(1975)中所述。在本说明书和所附权利要求书中所用的氨基酸和氨酰基残基的名称和缩写与那些建议不同的情况下,将向读者明确指出。用于描述本发明的一些缩写在下面的表1中定义。如本文所用,术语“电子等排体”或“电子等排体替代物”是指具有与指定氨基酸相似的生理化学和/或结构特性的任何氨基酸或其它类似物部分。在具体实施例中,氨基酸的“电子等排体”或“合适的电子等排体”是同一类别的另一种氨基酸,其中氨基酸基于侧链与极性溶剂如水接触的倾向属于以下类别:疏水性(与水接触的倾向低)、极性或带电的(能量上有利地与水接触)。说明性带电氨基酸残基包括赖氨酸(+)、精氨酸(+)、天冬氨酸(-)和谷氨酸(-)。说明性极性氨基酸包括丝氨酸、苏氨酸、天冬酰胺、谷氨酰胺、组氨酸和酪氨酸。说明性疏水性氨基酸包括丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、色氨酸、半胱氨酸和甲硫氨酸。氨基酸甘氨酸不具有侧链,并且难以指定上述类别之一。然而,甘氨酸通常存在于蛋白质表面,通常在环内,为这些区域提供高度灵活性,并且电子等排体可具有类似的特征。脯氨酸具有相反的作用,通过在多肽链的区段上施加一定的扭转角来为蛋白质结构提供刚性。在某些实施例中,电子等排体是氨基酸的衍生物,例如与参考氨基酸相比具有一个或多个修饰侧链的衍生物。如本文所用,术语“fmoc肽合成”是指在肽合成期间使用fmocα-氨基(n端)保护的氨基酸。fmoc保护基团可在温和的碱性条件下裂解。必要时,这些fmoc保护的氨基酸的侧链用适当的正交保护基团保护,所述保护基团在用于从肽的n端裂解fmoc保护基团的温和碱性条件下是稳定的。术语“cbz肽合成”是指在肽合成期间使用cbz(z)α-氨基(n端)保护的氨基酸。可以使用pd/c和氢气在氢解条件下裂解cbz保护基团。必要时,这些cbz保护的氨基酸的侧链用适当的正交保护基团保护,所述保护基团在用于从肽的n端裂解cbz保护基团的氢解条件下是稳定的。表1.定义和缩写在某些实施例中,本发明提供一种制备肽二聚体化合物的方法,其包含:(i)合成具有本文所述序列的肽,并在肽的两个残基之间引入分子内二硫键(或允许形成分子内键),并将接头与肽缀合;(ii)合成具有本文所述序列(例如,与步骤(i)相同的序列)的肽,并在肽的两个残基之间引入分子内二硫键(或允许形成分子内二硫键);以及(iii)通过与步骤(i)的肽连接的接头将步骤(i)的肽与步骤(ii)的肽缀合。在其它实施例中,本发明的方法提供一种制备肽二聚体化合物的方法,其包含(i)合成具有包含两个含硫醇残基(例如但不限于青霉胺或半胱氨酸)的序列的肽,并通过肽的氧化在肽的两个含硫醇残基之间引入二硫桥键以提供环化肽,以及(ii)通过接头缀合两当量的步骤(i)的环化肽。在其它实施例中,本发明的方法提供一种制备肽二聚体化合物的方法,其包含(i)合成具有包含两个青霉胺残基的序列的肽,并通过肽的氧化在肽的两个青霉胺残基之间引入分子内二硫桥键以提供环化肽,以及(ii)通过接头缀合两当量的步骤(i)的环化肽。在某些实施例中,本发明的方法提供了制备化合物b的环化肽、表2、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558;pct/us2015/053603;和美国专利号9,518,091b2中公开的那些(其全部以全文引用的方式并入本文中)、本文所述的肽单体及其药学上可接受的盐、水合物和溶剂合物的方法。化合物b(seqidno:2).在本发明的某些实施例中,化合物b可以是中性的。在本发明的其它实施例中,化合物b可以呈内盐形式。在本发明的其它实施例中,化合物b可以是无水的。在本发明的其它实施例中,化合物b可与药学上可接受的阴离子形成盐,例如但不限于表a中的阴离子。在具体实施例中,化合物b可与药学上可接受的阴离子形成盐,所述阴离子选自由盐酸根、硫酸根、氢溴酸根、柠檬酸根、甲磺酸根、马来酸根和磷酸根组成的组。表a:药学上可接受的阴离子在本发明的其它实施例中,化合物b可与药学上可接受的阴离子形成盐,例如但不限于表a中的阴离子。在本发明的其它实施例中,化合物b可与药学上可接受的阳离子形成盐,所述阳离子选自由钠、钙、钾、镁、甲葡胺、铝和锌组成的组。表b:药学上可接受的阳离子表2:肽在具体实施例中,环化肽是药学上可接受的盐形式。在一个实施例中,它是乙酸盐。在本发明的一个具体实施例中,化合物b是药学上可接受的盐形式。在一个实施例中,化合物b是乙酸盐。在某些实施例中,本发明的方法提供了制备下文所示结构(化合物a)的肽二聚体化合物(包括其药学上可接受的盐、溶剂合物和水合物)、表3的化合物、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053603和美国专利号9,518,091b2中所公开的肽二聚体、本文所述的肽二聚体及其药学上可接受的盐、溶剂合物和水合物的方法。化合物a(seqidno:1)表3:肽二聚体_____________________________________________________________________[ac-pen*-(n-me-arg)-ser-asp-thr-leu-pen*-trp-(d-lys)-nh2]2-dig(seqidno:12)[ac-pen*-(n-me-arg)-ser-asp-thr-leu-pen*-trp-bhomoglu-(d-lys)-nh2]2-dig(seqidno:13)[ac-pen*-(n-me-arg)-ser-asp-thr-leu-pen*-trp-glu-(n-me-d-lys)-nh2]2-dig(seqidno:14)[ac-pen*-(n-me-arg)-ser-asp-thr-leu-pen*-trp-glu-(n-me-lys)-nh2]2-dig(seqidno:15)[ac-pen*-(n-me-arg)-ser-asp-thr-leu-pen*-trp-(d-glu)-(d-lys)-oh]2-dig(seqidno:16)[ac-pen*-(n-me-arg)-ser-asp-thr-leu-pen*-trp-glu-(d-lys)-nh2]2-dig(seqidno:17)[ac-pen*-(n-me-arg)-ser-asp-thr-leu-pen*-trp-(d-glu)-(d-lys)-nh2]2-dig(seqidno:16)[ac-pen*-(n-me-arg)-ser-asp-thr-leu-pen*-trp-glu-(d-lys)-oh]2-dig(seqidno:17)*分子内二硫桥键本发明的实施例包括化合物a的药学上可接受的盐形式、表3的化合物、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558;pct/us2015/053603和美国专利号9,518,091b2中所公开的肽二聚体、本文所述的肽二聚体,例如化合物a的乙酸盐,以及其药学上可接受的盐、水合物和溶剂合物。在本发明的某些实施例中,化合物a可以是中性的。在本发明的其它实施例中,化合物a可以呈内盐形式。在本发明的其它实施例中,化合物a可以是无水的。在本发明的其它实施例中,化合物a可与药学上可接受的阴离子形成盐,例如但不限于表a中的阴离子。在具体实施例中,化合物a可与药学上可接受的阴离子形成盐,所述阴离子选自由盐酸根、硫酸根、氢溴酸根、柠檬酸根、甲磺酸根、马来酸根和磷酸根组成的组。在本发明的其它实施例中,化合物a可与药学上可接受的阴离子形成盐,例如但不限于表a中的阴离子。在本发明的其它实施例中,化合物a可与药学上可接受的阳离子形成盐,所述阳离子选自由钠、钙、钾、镁、甲葡胺、铝和锌组成的组。在具体实施例中,本发明涉及化合物的合成,其中所述化合物是如下所述的肽单体或肽二聚体。在本发明的某些实施例中,肽二聚体的两个连接的单体亚基通过其c端通过连接部分连接在一起。在本发明的其它实施例中,肽二聚体的两个连接的单体亚基通过其n端通过连接部分连接在一起。在其它实施例中,肽二聚体的两个连接的单体亚基通过一个或多个氨基酸残基或其衍生物连接。合适的接头包括但不限于pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558,pct/us2015/053603和美国专利号9,518,091b2中公开的那些。在某些实施例中,所述化合物是包含式(i)的单体亚基的肽单体或包含两个连接的式(i)(seqidno:18)的单体亚基的肽二聚体化合物:xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-xaa7-xaa8-xaa9-xaa10-xaa11-xaa12-xaa13-xaa14(式(i))或其药学上可接受的盐、溶剂合物或水合物,其中:xaa1是不存在、ac或任何氨基酸;xaa2是不存在、ac或任何氨基酸;xaa3是不存在、ac或任何氨基酸;xaa4是能够与xaa10形成键的任何氨基酸;xaa5选自由以下组成的组:n-me-arg、arg、n-me-lys、phe(4-胍基)、phe(4-氨甲酰基)、cit、phe(4-nh2)、n-me-homoarg、homoarg、tyr、dap、dab、arg-me-sym、arg-me-asym、cav和his;xaa6是ser、gly、thr或ile;xaa7是asp、asp(ome)或n-me-asp;xaa8选自由以下组成的组:thr、val、ile、leu、homoleu、gln、ser、asp、pro、gly、his、ala、phe、lys、arg、asn、glu、tyr、trp、met、nle和n-甲基氨基酸,包括n-me-thr;xaa9选自由以下组成的组:gln、ser、asp、pro、gly、ala、phe、glu、ile、val、n-丁基ala、n-戊基ala、n-己基ala、环丁基ala、环戊基ala、leu、nle、cba、homoleu、cpa、aoc和n-me-leu;xaa10是能够与xaa4形成键的任何氨基酸;xaa11不存在或选自由以下组成的组:芳香族氨基酸、经取代的芳香族氨基酸、tic、gly、gln、asn、asp、ala、ile、leu、val、met、thr、lys、trp、tyr、his、glu、ser、arg、pro、phe、sar、1-nal、2-nal、hphe、phe(4-f)、o-me-tyr、二氢-trp、dap、dab、dab(ac)、orn、d-orn、n-me-orn、n-me-dap、d-dap、d-dab、bip、ala(3,3二苯基)、联苯-ala、芳环取代的phe、芳环取代的trp、芳环取代的his、杂芳香族氨基酸、n-me-lys、n-me-lys(ac)、4-me-phe、phe(2-氨甲酰基)、phe(3-氨甲酰基)、phe(4-cooh)、phe(4-ome)和phe(4-tbu)、phe(4-cooh)、homophe和相应的d-氨基酸及其合适的电子等排体,xaa12不存在或选自由以下组成的组:芳香族氨基酸、经取代的芳香族氨基酸、glu、d-glu、homoglu、asp、d-asp、d-homoglu、gla、β-homoglu、tic、aic、gln、cit、glu(ome)、asn、d-his、tic、phe(3-cooh)、d-arg、bip、d-trp、phe、d-phe、d-val、d-thr、d-tyr、d-lys、d-ile、d-his、n-me-glu、n-me-asp、α-homoglu、联苯-gly、联苯-ala、homo-phe、d-1-nal、d-2-nal、thr和val,以及相应的d-氨基酸和电子等排体;xaa13不存在或是pro或任何氨基酸;以及xaa14选自由以下组成的组:具有胺侧链的任何氨基酸、lys、d-lys、n-me-lys、d-n-me-lys、orn、dab、dap、homolys、d-dap、d-dab、d-orn、cys、homocys、pen、d-homocys、d-cys、d-pen、asp、glu、d-asp、d-glu和homoser、homoglu、d-homoglu、n-me-glu、n-me-asp、n-me-d-glu和n-me-d-asp,其中所述肽二聚体化合物的一个或两个单体亚基包含xaa4和xaa10之间的键。在一个实施例中,xaa4是cys或pen,xaa10是pen或cys,并且xaa4和xaa10通过二硫键连接。在某些实施例中,xaa4和xaa10都是pen。在其它实施例中,xaa4和xaa10都是l-pen。在其它实施例中,xaa4和xaa10都是d-pen。在式(i)的具体实施例中,xaa5选自由以下组成的组:cit、phe(4-氨甲酰基氨基)和n-me-homoarg;xaa8选自由以下组成的组:leu、homoleu、nle和val;xaa9选自由以下组成的组:cba、homoleu和cpa;xaa11选自由以下组成的组:tic、phe(2-氨甲酰基)、phe(3-氨甲酰基)、phe(4-cooh)、phe(4-ome)和phe(4-tbu);xaa12选自由以下组成的组:aic、gln、cit、glu(ome)、d-his、tic、phe(3-cooh)、d-arg、bip、d-trp、phe、d-phe、d-val、d-thr、d-1-nal、d-2-nal、thr、val;和/或xaa13是pro。在式(i)的其它实施例中,xaa11不存在或选自由以下组成的组:芳香族氨基酸、经取代的芳香族氨基酸和tic。在式(i)的其它实施例中,xaa1是ac,并且xaa2、xaa3、xaa11、xaa12、xaa13中的三个不存在。在式(i)的其它实施例中,xaa1、xaa2、xaa3、xaa11、xaa12、xaa13中的四个不存在。在其它实施例中,式(i)是十个氨基酸的肽。在包含式(i)的化合物的具体实施例中,所述化合物还包含连接两个单体亚基的接头部分,其中所述接头部分任选地选自由以下组成的组:dig、peg13、peg25、peg1k、peg2k、peg34k、peg4k、peg5k、ida、ida-palm、ida-boc、ida-异戊酸、三嗪、三嗪-boc、间苯二甲酸、1,3-苯二乙酸、1,4-苯二乙酸、环丙基乙酸、4-氟苯甲酸、4-氟苯基乙酸、3-苯基丙酸、琥珀酸、生物素、戊二酸、壬二酸、庚二酸、十二烷二酸、脂肪族氨基酸、芳香族氨基酸、杂芳香族化合物、分子量为约400da至约40,000da的聚乙二醇、双官能接头、n-羟基琥珀酰亚胺(nhs)活化的二酯和双马来酰亚胺。在式(i)的某些实施例中,肽单体化合物或肽二聚体化合物的两个亚基包含以下序列之一:pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)(seqidno:19);pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe-(4-cooh)-(β-homoglu)-(d-lys)(seqidno:20);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-lys)(seqidno:21);pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(d-lys)(seqidno:22);pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)(seqidno:23);pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-glu-(n-me-lys)(seqidno:24);pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(d-lys)(seqidno:25);pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(n-me-lys)(seqidno:26);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(n-me-lys)(seqidno:27);pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(n-me-lys)(seqidno:28);pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)(seqidno:23);pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(n-me-lys)(seqidno:29);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)(seqidno:19);或pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-d-lys)(seqidno:30)。在式(i)的某些实施例中,肽单体化合物或肽二聚体化合物的两个亚基包含以下序列之一:ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)(seqidno:19);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe-(4-cooh)-(β-homoglu)-(d-lys)(seqidno:20);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-lys)(seqidno:21);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(d-lys)(seqidno:22);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)(seqidno:23);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-glu-(n-me-lys)(seqidno:24);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(d-lys)(seqidno:25);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(n-me-lys)(seqidno:26);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(n-me-lys)(seqidno:27);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(n-me-lys)(seqidno:28);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)(seqidno:23);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(n-me-lys)(seqidno:29);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)(seqidno:19);和ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-d-lys)(seqidno:30)。在某些实施例中,两个亚基包含相同的序列。在肽二聚体化合物的具体实施例中,亚基在其c端通过dig连接。在具体实施例中,肽二聚体化合物具有以下结构之一:[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)-nh2]2-dig(seqidno:31);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe-(4-cooh)-(β-homoglu)-(d-lys)-nh2]2-dig(seqidno:32);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-lys)-nh2]2-dig(seqidno:33);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(d-lys)-nh2]2-dig(seqidno:34);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)-nh2]2-dig(seqidno:35);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-glu-(n-me-lys)-nh2]2-dig(seqidno:36);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(d-lys)-nh2]2-dig(seqidno:37);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(n-me-lys)-nh2]2-dig(seqidno:38);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(n-me-lys)-nh2]2-dig(seqidno:39);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(n-me-lys)-nh2]2-dig(seqidno:40);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)-nh2]2-dig(seqidno:35);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(n-me-lys)-nh2]2-dig(seqidno:41);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)-nh2]2-dig(seqidno:31);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-d-lys)-nh2]2-dig(seqidno:42);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)-oh]2-dig(seqidno:31);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe-(4-cooh)-(β-homoglu)-(d-lys)-oh]2-dig(seqidno:32);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-lys)-oh]2-dig(seqidno:33);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(d-lys)-oh]2-dig(seqidno:34);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)-oh]2-dig(seqidno:35);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-glu-(n-me-lys)-oh]2-dig(seqidno:36);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(d-lys)-oh]2-dig(seqidno:37);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(n-me-lys)-oh]2-dig(seqidno:38);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(n-me-lys)-oh]2-dig(seqidno:39);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(n-me-lys)-oh2]2-dig(seqidno:40);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)-oh]2-dig(seqidno:35);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(n-me-lys)-oh]2-dig(seqidno:41);[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)-oh]2-dig(seqidno:31);或[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-d-lys)-oh]2-dig(seqidno:42),其中在某些实施例中,在单体亚基中的两个pen残基之间存在二硫键。在某些实施例中,肽单体化合物或肽二聚体化合物的两个亚基包含以下序列之一:pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe(4-cooh))-(glu)-(d-lys)(seqidno:43);pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe(4-cooh))-(β-homo-glu)-(d-lys)(seqidno:20);pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe(4-tbu))-glu-(d-lys)(seqidno:44);pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe(4-tbu))-(β-homo-glu)-(d-lys)(seqidno:25);pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe(4-tbu))-glu-(n-me-lys)(seqidno:45);pen-(n-me-arg)-ser-asp-thr-leu-pen-bip-glu-(d-lys)(seqidno:46);pen-(n-me-arg)-ser-asp-thr-leu-pen-bip-(β-homo-glu)-(d-lys)(seqidno:47);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)(seqidno:19);pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe-(4-cooh)-(β-homoglu)-(d-lys)(seqidno:20);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-lys)(seqidno:21);pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(d-lys)(seqidno:22);pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)(seqidno:23);pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-glu-(n-me-lys)(seqidno:24);pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(d-lys)(seqidno:25);pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(n-me-lys)(seqidno:26);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(n-me-lys)(seqidno:27);pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(n-me-lys)(seqidno:28);pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)(seqidno:23);pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(n-me-lys)(seqidno:29);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)(seqidno:19);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-d-lys)(seqidno:30);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)-oh(seqidno:19);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe-(4-cooh)-(β-homoglu)-(d-lys)-oh(seqidno:20);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-lys)-oh(seqidno:21);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(d-lys)-oh(seqidno:22);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)-oh(seqidno:23);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-glu-(n-me-lys)-oh(seqidno:24);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(d-lys)-oh(seqidno:25);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(n-me-lys)-oh(seqidno:26);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(n-me-lys)-oh(seqidno:27);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(n-me-lys)-oh(seqidno:28);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)-oh(seqidno:23);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(n-me-lys)-oh(seqidno:29);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)-oh(seqidno:19);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-d-lys)-oh(seqidno:30);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)-nh2(seqidno:19);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe-(4-cooh)-(β-homoglu)-(d-lys)-nh2(seqidno:20);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-lys)-nh2(seqidno:21);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(d-lys)-nh2(seqidno:22);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)-nh2(seqidno:23);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-glu-(n-me-lys)-nh2(seqidno:24);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(d-lys)-nh2(seqidno:25);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-(n-me-lys)-nh2(seqidno:26);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(n-me-lys)-nh2(seqidno:27);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-(n-me-lys)-nh2(seqidno:28);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(d-lys)-nh2(seqidno:23);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-(n-me-lys)-nh2(seqidno:29);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-(d-lys)-nh2(seqidno:19);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-d-lys)-nh2(seqidno:30);或pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe(4-cooh))-(glu)(seqidno:48);pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe(4-cooh))-(β-homo-glu)(seqidno:49);pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe(4-tbu))-glu(seqidno:50);pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe(4-tbu))-(β-homo-glu)(seqidno:51);pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe(4-tbu))-glu(seqidno:52);pen-(n-me-arg)-ser-asp-thr-leu-pen-bip-glu(seqidno:53);pen-(n-me-arg)-ser-asp-thr-leu-pen-bip-(β-homo-glu)(seqidno:54);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)(seqidno:55);pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe-(4-cooh)-(β-homoglu)(seqidno:49);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu(seqidno:56);pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)(seqidno:57);pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)(seqidno:58);pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-glu(seqidno:59);pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)(seqidno:51);pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)(seqidno:51);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)(seqidno:55);pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)(seqidno:57);pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)(seqidno:58);pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)(seqidno:58);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)(seqidno:55);pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu(seqidno:56);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-oh(seqidno:55);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe-(4-cooh)-(β-homoglu)-oh(seqidno:49);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-oh(seqidno:56);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-oh(seqidno:57);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-oh(seqidno:58);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-glu-oh(seqidno:59);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-oh(seqidno:51);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-oh(seqidno:51);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-oh(seqidno:55);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-oh(seqidno:57);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-oh(seqidno:58);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-oh(seqidno:58);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-oh(seqidno:55);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-oh(seqidno:56);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-nh2(seqidno:55);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-(phe-(4-cooh)-(β-homoglu)-nh2(seqidno:49);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-nh2(seqidno:56);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-nh2(seqidno:57);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-nh2(seqidno:58);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-glu-nh2(seqidno:59);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-nh2(seqidno:51);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-(β-homoglu)-nh2(seqidno:51);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-nh2(seqidno:55);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-2-nal-(β-homoglu)-nh2(seqidno:57):ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-nh2(seqidno:58);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-1-nal-(β-homoglu)-nh2(seqidno:58);ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(β-homoglu)-nh2(seqidno:55);或ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-nh2(seqidno:56),其中在某些实施例中,肽或肽单体化合物的两个pen残基之间存在二硫键。本发明的接头部分可包括与本文的教导相容的任何结构、长度和/或大小。在某些实施例中,接头部分选自由以下组成的非限制性组:dig、peg13、peg25、peg1k、peg2k、peg3.4k、peg4k、peg5k、ida、ida-palm、ida-boc、ida-ac、ida-异戊酸、ada三嗪、三嗪-boc、间苯二甲酸、1,3-苯二乙酸、glu、asp、d-glu、d-asp、1,4-苯二乙酸、联苯二乙酸、环丙基乙酸、琥珀酸、戊二酸、十二烷二酸、合适的脂肪族二酸、合适的芳香族二酸、杂芳香族化合物以及分子量为约400da至约40,000da的聚乙二醇。当接头是ida、ada或任何具有游离胺的接头时,它可以用选自由以下组成的组的酰化有机化合物酰化:2-me-三氟丁基、三氟戊基、乙酰基、辛酰基、丁基、戊基、己基、棕榈基、月桂基、油酰基、月桂基、三氟甲基丁酸、环戊烷甲酸、环丙基乙酸、4-氟苯甲酸、4-氟苯基乙酸、3-苯基丙酸、四氢-2h-吡喃-4甲酸、琥珀酸和戊二酸、具有10至20个碳单元的直链脂肪酸、胆酸和其它胆汁酸。在一些情况下,小peg(peg4-peg13)、glu、isoglu或asp在酰化前用作间隔物。在某些实施例中,接头通过连接两个含硫的c端或n端氨基酸连接两个单体亚基。在一些实施例中,两个含硫氨基酸通过包含二卤化物、脂肪族链或peg的接头连接。在某些实施例中,接头通过在每个单体亚基的c端连接含硫的c端氨基酸来连接两个单体亚基。在某些实施例中,接头通过在每个单体亚基的n端连接含硫的n端氨基酸来连接两个单体亚基。在某些实施例中,接头通过将一个单体亚基的含硫c端氨基酸连接到另一个单体亚基的含硫n端氨基酸来连接两个单体亚基。在一些实施例中,两个含硫氨基酸通过包含以下的接头连接:同型双官能马来酰亚胺交联剂、二卤化物、1,2-双(溴单甲基)苯、1,2-双(氯单甲基)苯、1,3-双(溴单甲基)苯、1,3-双(氯单甲基)苯、1,4-双(溴单甲基)苯、1,4-双(氯单甲基)苯、3,3′-双-溴甲基-联苯或2,2′-双-溴甲基-联苯。具体的卤代乙酰基交联剂含有碘乙酰基或溴乙酰基。这些同型双官能接头可含有包含peg或脂肪族链的间隔物。在具体实施例中,接头是双官能接头(例如二酸、二胺、二卤化物、n-羟基琥珀酰亚胺(nhs)活化的二酯、双马来酰亚胺,其可能能够通过胺、酯、硫醚、二硫基或醚键连接两个单体亚基。在具体实施例中,其中单体亚基通过具有含胺侧链的氨基酸的侧链连接,接头是二酸。在具体实施例中,其中单体亚基通过具有含酸侧链的氨基酸的侧链连接,接头是二胺。在某些实施例中,接头选自由以下组成的组:dig、peg4、peg4-生物素、peg13、peg25、peg1k、peg2k、peg3.4k、peg4k、peg5k、ida、ada、boc-ida、戊二酸、间苯二甲酸、1,3-苯二乙酸、1,4-苯二乙酸、1,2-苯二乙酸、三嗪、boe-三嗪、ida-生物素、peg4-生物素、aada、脂肪族化合物、芳香族化合物、杂芳香族化合物以及基于聚乙二醇的分子量为约400da至约40,000da的接头。在具体实施例中,接头是双官能接头(例如二酸、二胺、二卤化物、n-羟基琥珀酰亚胺(nhs)活化的二酯、双马来酰亚胺,其可能能够通过胺、酯、硫醚、二硫基或醚键连接两个单体亚基。表4中提供了合适的接头部分的非限制性实例。表4:说明性接头部分当接头是ida、ada或任何具有游离胺的接头时,它可以用选自由以下组成的组的酰化有机化合物酰化:2-me-三氟丁基、三氟戊基、乙酰基、辛酰基、丁基、戊基、己基、棕榈基、月桂基、油酰基、月桂基、三氟甲基丁酸、环戊烷甲酸、环丙基乙酸、4-氟苯甲酸、4-氟苯基乙酸、3-苯基丙酸、四氢-2h-吡喃-4甲酸、琥珀酸和戊二酸、具有10至20个碳单元的直链脂肪酸、胆酸和其它胆汁酸。在一些情况下,小peg(peg4-peg13)、glu、isoglu或asp在酰化前用作间隔物。应理解,一旦与接头或另一种氨基酸结合,肽化合物的氨基酸残基可以经历结构变化,例如,酸可以变成酰胺。对特定氨基酸残基的提及涵盖在与接头结合或与肽化合物的另一氨基酸形成分子内键时任何改变的结构形式的氨基酸残基。在某些实施例中,化合物是包含式(ii)的单体亚基的肽单体或包含两个连接的式(ii)(seqidno:60)的单体亚基的肽二聚体化合物:xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-xaa7-xaa8-xaa9-xaa10-xaa11-xaa12-xaa13-xaa14-xaa15(式(ii))或其药学上可接受的盐、溶剂合物或水合物,其中:xaa1是不存在的、氢、ac、合适的接头部分,或选自由以下组成的组的氨基酸:gln、asn、asp、pro、gly、his、ala、ile、phe、lys、arg、asn、glu、leu、val、tye、trp、met、thr及其合适的电子等排体和相应的d-氨基酸;xaa2是不存在的、ac、nh2、合适的接头部分,或选自由以下组成的组的氨基酸:gln、asn、asp、pro、gly、his、ala、ile、phe、lys、arg、asn、glu、leu、val、tye、trp、met、thr及其合适的电子等排体和相应的d-氨基酸;xaa3是不存在的、ac、nh2、合适的接头部分,或选自由以下组成的组的氨基酸:gln、asn、asp、pro、gly、his、ala、ile、phe、lys、arg、asn、glu、leu、val、tye、trp、met、thr及其合适的电子等排体和相应的d-氨基酸;xaa4选自由以下组成的组:cys、pen、asp、glu、hglu、b-asp、b-glu、lys、homo-lys、orn、dap、dab及其合适的电子等排体和相应的d-氨基酸;xaa5选自由以下组成的组:gln、asn、asp、pro、gly、his、ala、ile、phe、lys、arg、asn、glu、leu、val、tye、trp、met、thr、homo-arg、dap、dab、n-me-arg、arg-(me)sym、arg-(me)asym、4-guan、cit、cav及其合适的电子等排体;xaa6选自由以下组成的组:ser、gln、asn、asp、pro、gly、his、ala、ile、phe、lys、arg、asn、glu、leu、val、tye、trp、met及其合适的电子等排体;xaa7选自由以下组成的组:asp、n-me-asp和asp的合适的电子等排体替代物;xaa8选自由以下组成的组:thr、gln、ser、asn、asp、pro、gly、his、ala、ile、phe、lys、arg、asn、glu、val、tye、trp、met和n-甲基氨基酸,包括n-me-thr;xaa9选自由以下组成的组:gln、asn、asp、pro、gly、ala、phe、leu、asn、glu、val、homo-leu、正丁基ala、正戊基ala、正己基ala、n-me-leu及其合适的电子等排体;xaa10选自由以下组成的组:cys、asp、pen、lys、homo-lys、orn、glu、b-asp、b-glu、dap和dab;xaa11选自由以下组成的组:gly、gln、asn、asp、ala、ile、leu、val、met、thr、lys、trp、tyr、conh2、cooh、his、glu、ser、arg、pro、phe、sar、1nal、2nal、hphe、phe(4-f)、phe(4-tbu)、o-me-tyr、二氢-trp、dap、dab、dab(ac)、orn、d-orn、n-me-orn、n-me-dap、d-dap、d-dabbip、ala(3,3二苯基)、联苯-ala、芳环取代的phe、芳环取代的trp、芳环取代的his、杂芳香族氨基酸、n-me-lys、n-me-lys(ac)、4-me-phe以及相应的d-氨基酸和合适的电子等排体替代物;xaa12是不存在的、合适的接头部分、酰胺、lys、cooh、conh2,或选自由以下组成的组的氨基酸:glu、lys、gln、pro、gly、his、ala、ile、phe、lys、arg、leu、val、tye、trp、met、gla、ser、asn、dap、dab、orn、d-orn、n-me-orn、n-me-dap、n-me-dab、n-melys、d-dap、d-dab及其合适的电子等排体和相应的d-氨基酸;xaa13是不存在的、ac、合适的接头部分,或选自由以下组成的组的氨基酸:gln、pro、gly、his、ala、ile、phe、lys、arg、leu、val、tye、trp、met、glu、gla、ser、asn、dap、dab、orn、d-orn、n-me-orn、n-me-dap、n-me-dab、n-melys、d-dap、d-dab、cooh、conh2及其合适的电子等排体和相应的d-氨基酸;xaa14是不存在的、合适的接头部分、cooh、conh2,或选自由以下组成的组的氨基酸:天然氨基酸及其合适的电子等排体、相应的d-氨基酸和相应的n-甲基氨基酸;以及xaa15不存在或是合适的接头部分。在某些实施例中,xaa15选自由以下组成的组:dig、dig-oh、peg13、peg25、peg1k、peg2k、peg3.4k、peg4k、peg5k、ida、ida-palm、ida-boc、ida-异戊酸、三嗪、三嗪-boc、三氟丁酸、2-me-三氟丁酸、三氟戊酸、间苯二甲酸、1,3-苯二乙酸、1,4-苯二乙酸、戊二酸、壬二酸、庚二酸和十二烷二酸。在某些实施例中,化合物是由通过合适的c端或n端接头连接的两个式(ii)的亚基形成的二聚体,所述接头选自由以下组成的组:dig、dig-oh、peg13、peg25、peg1k、peg2k、peg3.4k、peg4k、peg5k、ida、ida-palm、ida-boc、ida-异戊酸、三嗪、三嗪-boc、间苯二甲酸、1,3-苯二乙酸、1,4-苯二乙酸、戊二酸、壬二酸、庚二酸、十二烷二酸、合适的脂肪族化合物、合适的芳香族化合物、杂芳香族化合物和分子量为约400da至约40,000da的聚乙二醇。在某些实施例中,其中化合物的一个或两个单体亚基包含xaa4和xaa10之间的键。在一个实施例中,xaa4是cys或pen,xaa10是pen或cys,并且xaa4和xaa10通过二硫键连接。在某些实施例中,xaa4和xaa10都是pen。在其它实施例中,xaa4和xaa10都是l-pen。在其它实施例中,xaa4和xaa10都是d-pen。在式(ii)的其它实施例中,xaa1是ac,xaa2、xaa3、xaa11、xaa12、xaa13中的三个不存在,并且xaa15是接头。在式(ii)的其它实施例中,xaa1是ac,xaa2、xaa3、xaa11、xaa12、xaa13、xaa15中的四个不存在。在式(ii)的其它实施例中,xaa1、xaa2、xaa3、xaa11、xaa12、xaa13、xaa15中的五个不存在。在式(ii)的其它实施例中,xaa1、xaa2、xaa3、xaa11、xaa12、xaa13中的四个不存在,并且xaa15是接头。在其它实施例中,式(ii)是十个氨基酸的肽。在某些实施例中,化合物是包含式(iii)的单体亚基的肽单体或包含两个连接的式(iii)(seqidno:61)的单体亚基的肽二聚体化合物:xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-xaa7-xaa8-xaa9-xaa10-xaa11-xaa12-xaa13-xaa14(式(iii))或其药学上可接受的盐、溶剂合物或水合物,其中每个亚基任选地包含xaa4和xaa10之间的二硫键或内酰胺键,xaa1是不存在的、氢或选自由以下组成的组的氨基酸:gln、asp、pro、gly、his、ala、ile、phe、lys、arg、asn、glu、leu、val、tyr、ser、trp、met、thr、其合适的电子等排体和相应的d-氨基酸;xaa2不存在或是选自由以下组成的组的氨基酸:gln、asp、pro、gly、his、ala、ile、phe、lys、arg、asn、glu、leu、val、tyr、trp、met、thr及其合适的电子等排体和相应的d-氨基酸;xaa3不存在,是选自由以下组成的组的氨基酸:gln、asp、pro、gly、his、ala、ile、phe、lys、arg、asn、glu、leu、val、tyr、trp、met、ser和thr及其合适的电子等排体和相应的d-氨基酸;xaa4选自由以下组成的组:cys、pen、asp、glu、hglu、basp、b-glu、lys、hlys、orn、dap、dab及其合适的电子等排体和相应的d-氨基酸;xaa5选自由以下组成的组:gln、asp、pro、gly、his、ala、ile、phe、lys、arg、asn、glu、leu、val、tyr、trp、met、thr、harg、dap、dab、n(α)me-arg、arg-me-sym、arg-me-asym、4-guan、cit、cav及其合适的电子等排体;xaa6选自由以下组成的组:ser、gln、asn、asp、pro、gly、his、ala、ile、phe、lys、arg、glu、leu、val、tyr、trp、met及其合适的电子等排体;xaa7选自由以下组成的组:asp、n-me-asp和asp的合适的电子等排体替代物;xaa8选自由以下组成的组:thr、gln、ser、asp、pro、gly、his、ala、ile、phe、lys、arg、asn、glu、val、tyr、trp、leu、met和n-甲基氨基酸,包括n-me-thr;xaa9选自由以下组成的组:gln、asn、asp、pro、gly、ala、phe、leu、glu、ile、val、hleu、正丁基ala、正戊基ala、正己基ala、nle、环丁基-ala、hcha、n-me-leu及其合适的电子等排体;xaa10选自由以下组成的组:cys、asp、lys、glu、pen、hasp、hglu、hlys、orn、b-asp、b-glu、dap和dab;xaa11选自由以下组成的组:gly、gln、asn、asp、ala、ile、leu、val、met、thr、lys、trp、tyr、his、glu、ser、arg、pro、phe、sar、l-nal、2-nal、hphe、phe(4-f)、o-me-tyr、二氢-trp、dap、dab、dab(ac)、orn、d-orn、n-me-orn、n-me-dap、d-dap、d-dab、bip、ala(3,3二苯基)、联苯-ala、芳环取代的phe、芳环取代的trp、芳环取代的his、杂芳香族氨基酸、n-me-lys、n-me-lys(ac)、4-me-phe及其相应的d-氨基酸和合适的电子等排体;xaa12不存在,或是选自由以下组成的组的氨基酸:glu、酰胺、lys、cooh、conh2、gln、pro、gly、his、ala、ile、phe、lys、arg、leu、val、tyr、trp、met、gla、ser、asn、d-glu、β-hglu、2-nal、1-nal、d-asp、bip、β-hphe、b-glu、d-tyr、d-lys、dap、dab、orn、d-orn、n-me-orn、n-me-dap、n-me-dab、n-melys、d-dap、d-dab及其合适的电子等排体和相应的d-氨基酸;xaa13可以不存在,或xaa13选自由以下组成的组:gln、pro、gly、his、ala、ile、phe、lys、arg、leu、val、tyr、trp、met、glu、ser、asn、gla、dap、dab、orn、d-orn、d-lys、n-me-orn、n-me-dap、n-me-dab、n-me-lys、d-dap、d-dab、cooh、conh2及其合适的电子等排体和相应的d-氨基酸;以及xaa14不存在或是选自由以下组成的组的氨基酸:天然氨基酸、其合适的电子等排体替代物、相应的d-氨基酸和相应的n-甲基氨基酸。在某些实施例中,化合物是由通过合适的c端或n端接头连接的两个式(iii)的亚基形成的二聚体,所述接头选自由以下组成的组:dig、dig-oh、peg13、peg25、peg1k、peg2k、peg3.4k、peg4k、peg5k、ida、ida-palm、ida-boc、ida-异戊酸、三嗪、三嗪-boc、间苯二甲酸、1,3-苯二乙酸、1,4-苯二乙酸、戊二酸、壬二酸、庚二酸、十二烷二酸、合适的脂肪族化合物、合适的芳香族化合物、杂芳香族化合物和分子量为约400da至约40,000da的聚乙二醇。在某些实施例中,其中化合物的一个或两个单体亚基包含xaa4和xaa10之间的键。在一个实施例中,xaa4是cys或pen,xaa10是pen或cys,并且xaa4和xaa10通过二硫键连接。在某些实施例中,xaa4和xaa10都是pen。在其它实施例中,xaa4和xaa10都是l-pen。在其它实施例中,xaa4和xaa10都是d-pen。在式(iii)的其它实施例中,xaa1是ac,并且xaa2、xaa3、xaa12、xaa13、xaa14中的三个不存在。在式(iii)的其它实施例中,xaa1、xaa2、xaa3、xaa12、xaa13、xaa14中的四个不存在。在其它实施例中,式(iii)是十个氨基酸的肽。在任何式(i)-(iii)的任何化合物的某些实施例中,化合物包含8至20个氨基酸残基,或约9至约15个氨基酸残基,或约9-12个氨基酸残基。在任何式(i)-(iii)的任何化合物的具体实施例中,化合物包含十个氨基酸残基。对于任何式(i)-(iii)的任何化合物的一些实施例,xaa1-xaa5、xaa7-xaa9和xaa11-xaa13经n(α)甲基化。xaa5可以进一步是arg-me-sym或arg-me-asym,并且xaa11可以是o-me-tyr、n-me-lys(ac)或4-me-phe。在一些情况下,xaa1-xaa4和xaa11-xaa14经酰化。例如,在一些情况下,xaa1-xaa4和xaa11-xaa14位的一个或多个残基被酰化有机化合物酰化,所述酰化有机化合物选自由以下组成的组:2-甲基-4,4,4-三氟丁基、三氟戊基、乙酰基、辛酰基、丁基、戊基、己基、棕榈基、三氟甲基丁基、环戊烷甲酸、环丙基乙酸、4-氟苯甲酸、4-氟苯基乙酸和3-苯基丙酸。在一些情况下,xaa1-xaa4和xaa11-xaa14位的一个或多个残基经酰化有机化合物酰化,所述酰化有机化合物选自由以下组成的组:2-甲基-4,4,4-三氟丁基、三氟戊基、乙酰基、辛酰基、丁基、戊基、己基、棕榈基、月桂基、油酰基、三氟甲基丁基、环戊烷甲酸、环丙基乙酸、4-氟苯甲酸、4-氟苯基乙酸、3-苯基丙酸、四氢-2h-吡喃-4羧酸、琥珀酸和戊二酸。在一些情况下,小peg(例如peg4-peg13)在酰化之前用作间隔物。在一些情况下,glu、isoglu或asp用作酰化的间隔物。对于任何式(i)-(iii)的任何化合物的一些实施例,化合物包含在选自由xaa3、xaa5、xaa7-xaa9和xaa11-xaa13组成的组的一个或多个位置的n(α)甲基化。对于任何式(i)-(iii)的任何化合物的一些实施例,xaa5是n-me-arg。对于任何式(i)-(iii)的任何化合物的一些实施例,化合物包含在选自由xaa1-xaa3和xaa11-xaa14组成的组的一个或多个位置的酰化。在某些实施例中,化合物是包含单体亚基的肽单体,或包含两个单体亚基的肽二聚体,每个亚基包含氨基酸序列:pen-n(me)arg-ser-asp-thr-leu-pen-xaa1-xaa2-xaa3(seqidno:62)其中xaa1是任何氨基酸(天然或非天然);在某些实施例中,xaa1是phe(4-tbu)或trp;其中xaa2不存在或是任何氨基酸(天然或非天然);在某些实施例中,xaa2是β-homoglu、glu或d-glu;以及其中xaa3可以是任何氨基酸(天然或非天然);在某些实施例中,xaa3是lys、d-lys、n-me-lys或n-me-d-lys。在具体实施例中,两个pen残基通过分子内二硫键连接。在具体实施例中,一个或多个单体亚基的n端和/或c端经修饰。在具体实施例中,n端包含ac基团。在具体实施例中,c端包含nh2基团。在本文所述任何化合物的具体实施例中,任何化合物的亚基包含以下任何氨基酸序列:pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(d-lys)(seqidno:63)pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-bhomoglu-(d-lys)(seqidno:19)pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-βhomoglu-(d-lys)(seqidno:25)pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-d-lys)(seqidno:30)pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-lys)(seqidno:21)pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(d-glu)-(d-lys)(seqidno:64)pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(d-lys)(seqidno:65)pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(d-glu)-(d-lys)(seqidno:64)pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(d-lys)(seqidno:65)在具体实施例中,两个pen残基通过分子内二硫键连接。在具体实施例中,化合物是二聚体,其包含由dig接头连接的具有两个单体亚基的以下氨基酸序列:[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(d-lys)-nh2]2-dig(seqidno:66)[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-bhomoglu-(d-lys)-nh2]2-dig(seqidno:31)[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-phe(4-tbu)-βhomoglu-(d-lys)-nh2]2-dig(seqidno:37)[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-d-lys)-nh2]2-dig(seqidno:42)[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(n-me-lys)-nh2]2-dig(seqidno:33)[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(d-glu)-(d-lys)-oh]2-dig(seqidno:67)[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(d-lys)-nh2]2-dig(seqidno:68)[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-(d-glu)-(d-lys)-nh2]2-dig(seqidno:67)[ac-pen-(n-me-arg)-ser-asp-thr-leu-pen-trp-glu-(d-lys)-oh]2-dig(seqidno:68)在具体实施例中,每个亚基的两个pen残基通过分子内二硫键连接。固相肽合成在具体实施例中,本发明的方法提供了通过固相方法使用廉价的起始材料、温和的试剂合成商业规模量的含有青霉胺的肽的方法,以产生高纯度肽。在某些实施例中,本发明提供通过固相肽合成来合成化合物b的肽、表2、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558;pct/us2015/053603;美国专利号9,518,091b2中所公开的那些和本文公开的其它肽,包括但不限于式(i)-(iii)的那些,及其药学上可接受的盐、溶剂合物或水合物的方法。在本发明的其它实施例中,固相肽合成在任何合适的树脂上进行,例如但不限于rinkamide(ram)树脂、wang树脂、三环酰胺接头树脂(ramageresin)、二苯基重氮甲烷树脂(pddm-树脂)、dhpp树脂以及4,4′-二烷氧基苯甲酰胺树脂。在本发明的具体实施例中,化合物b的肽、表2、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558;pct/us2015/053603;美国专利号9,518,091b2中所公开的那些和本文公开的其它肽,包括但不限于式(i)-(iii)的那些,是通过固相肽合成在三环酰胺接头树脂(ramageresin)上合成。在本发明的其它实施例中,化合物b的肽和表2是通过固相肽合成由受保护的氨基酸合成,所述氨基酸选自由以下组成的组:fmoc-d-lys(boc)-oh、fmoc-β-homoglu(otbu)-oh、fmoc-l-(4-tbu)phe-oh、fmoc-l-pen(acm)-oh、fmoc-l-pen(trt)-oh、fmoc-pen(ψme,mepro)-oh、bpoc-pen(ψme,mepro)-oh、cbz-pen(ψme,mepro)-oh、fmoc-pen(ψh,hpropro)-oh、bpoc-pen(ψh,hpropro)-oh、cbz-pen(ψh,hpropro)-oh、fmoc-leu-pen(ψme,mepro)-oh、bpoc-leu-pen(ψme,mepro)-oh、cbz-leu-pen(ψme,mepro)-oh、fmoc-leu-pen(ψh,hpropro)-oh、bpoc-leu-pen(ψh,hpropro)-oh或cbz-leu-pen(ψh,hpropro)-oh、fmoc-l-leu-oh、fmoc-l-thr(tbu)oh、fmoc-l-asp(tbu)-oh、fmoc-l-asp(tbu)-thr(ψme,mepro-oh、fmoc-l-ser(tbu)-oh、fmoc-l-nme-arg(pbf)-oh、fmoc-l-trp(boc)-oh、fmoc-l-glu(otbu)-oh、fmoc-d-glu(otbu)-oh、fmoc-n-me-d-lys(boc)-oh和fmoc-n-me-d-lys(boc)-nh2。在本发明的其它实施例中,化合物b的肽通过固相肽合成由以下受保护的氨基酸合成:fmoc-d-lys(boc)-oh、fmoc-β-homoglu(otbu)-oh、fmoc-l-(4-tbu)phe-oh、fmoc-l-pen(acm)-oh、fmoc-l-leu-oh、fmoc-l-thr(tbu)oh、fmoc-l-asp(tbu)-oh、fmoc-l-ser(tbu)-oh和fmoc-l-nme-arg(pbf)-oh。在本发明的其它实施例中,化合物b的肽通过固相肽合成由以下受保护的氨基酸合成:fmoc-d-lys(boc)-oh、fmoc-β-homoglu(otbu)-oh、fmoc-l-(4-tbu)phe-oh、fmoc-l-pen(trt)-oh、fmoc-l-leu-oh、fmoc-l-asp(tbu)-thr(ψme,mepro)-oh、fmoc-l-ser(tbu)-oh和fmoc-l-nme-arg(pbf)-oh。在其它实施例中,本发明的方法提供了用于合成具有以下序列的肽的固相合成方法:ac-pen-n(me)arg-ser-asp-thr-leu-pen-xaa1-xaa2-xaa3(seqidno:62)或ac-pen-n(me)arg-ser-asp-thr-leu-pen-xaa1-xaa2-xaa3-nh2(seqidno:62),其中:xaa1可以是任何天然或非天然氨基酸;xaa2可以不存在或是任何天然或非天然氨基酸;以及xaa3可以是任何天然或非天然氨基酸。在某些实施例中,xaa1是phe(4-tbu)或trp。在具体实施例中,xaa2是β-homoglu、glu或d-glu。在其它实施例中,xaa3是lys、d-lys、n-me-lys或n-me-d-lys。在其它实施例中,xaa1是phe(4-tbu)或trp;xaa2是β-homoglu、glu或d-glu;以及xaa3是lys、d-lys、n-me-lys或n-me-d-lys。在某些实施例中,本发明提供合成化合物a的肽二聚体、表3、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558;pct/us2015/053603;美国专利号9,518,091b2中所公开的那些和本文公开的其它肽,包括但不限于式(i)-(iii)的那些,及其药学上可接受的盐、溶剂合物或水合物的方法,其中适当肽单体通过固相肽合成来合成,然后使pen残基环化并用合适的接头使环化肽二聚化。在本发明的某些实施例中,接头是二乙醇酸。在具体实施例中,本发明提供了通过固相肽合成来合成式i的肽单体和二聚体的方法,如流程ia中所示。流程ia流程ia续在某些实施例中,xaa1至xaa14如式i(seqidno:18)中所定义;r1和r2是h、c1-c6烷基(支链或直链)或c3-c6芳基;n是2至20的任何整数x是cr′r′、nhco、conh、s-s、c=o、choh、s、s=o、n、nh或o;y是接头部分;z是h、c1-c6烷基(支链或直链)、c3-c6芳基、杂芳基、n、s、o、nhac或不存在;以及每个r′独立地是h或c1-c4烷基。在某些实施例中,xaa1至xaa14如式i(seqidno:18)中所定义r1和r2是h、c1-c6烷基(支链或直链)或c1-c6芳基n是2至20的任何整数x是cr′r′、c=o、s、n或o;y是接头部分;z是h、c1-c6烷基(支链或直链)、c3-c6芳基、杂芳基、n、s或o;以及每个r′独立地是h或c1-c4烷基。在其它实施例中,xaa1至xaa14如式i(seqidno:18)中所定义r1和r2是h或men是2至20的任何整数x是ch2、nhco、conh、s-s、c=o、choh、s、s=o、nh或o;y是接头部分;以及z是nhac、不存在或h。在其它实施例中,xaa1至xaa14如式i(seqidno:18)中所定义r1和r2是h或men是2至10的任何整数x是ch2、nhco、conh、s-s、c=o、choh、s、s=o、nh或o;y是接头部分;以及z是nhac、不存在或h。在本发明的某些实施例中,在流程ia的任何上述实施例中,y可以选自由以下组成的组:dig、peg13、peg25、peg1k、peg2k、peg34k、peg4k、peg5k、ida、ida-palm、ida-boc、ida-异戊酸、三嗪、三嗪-boc、间苯二甲酸、1,3-苯二乙酸、1,4-苯二乙酸、环丙基乙酸、4-氟苯甲酸、4-氟苯基乙酸、3-苯基丙酸、琥珀酸、生物素、戊二酸、壬二酸、庚二酸、十二烷二酸、脂肪族氨基酸、芳香族氨基酸、杂芳香族化合物、分子量为约400da至约40,000da的聚乙二醇、双官能接头、n-羟基琥珀酰亚胺(nhs)活化的二酯以及双马来酰亚胺。在本发明的其它实施例中,在流程ia的任何上述实施例中,y可以选自表4的接头。在其它实施例中,xaa1至xaa14如式i(seqidno:18)中所定义r1和r2是h或men是2至20的任何整数x是ch2、nhco、conh、s-s、c=o、choh、s、s=o、nh或o;y是如表c中所示的接头部分;以及z是nhac、不存在或h。在其它实施例中,xaa1至xaa14如式i(seqidno:18)中所定义r1和r2是h或men是2至10的任何整数x是ch2、nhco、conh、s-s、c=o、choh、s、s=o、nh或o;y是如表c中所示的接头部分;以及z是nhac、不存在或h。表c:可能的接头在流程ia的任何上述实施例中,xaa4是cys或pen,xaa10是pen或cys,并且xaa4和xaa10通过二硫键连接。在流程ia的某些实施例中,xaa4和xaa10都是pen。在流程ia的其它实施例中,xaa4和xaa10都是l-pen。在流程ia的其它实施例中,xaa4和xaa10都是d-pen。流程ib说明了本发明的具体实施例,其提供了通过固相肽合成来合成肽二聚体的方法,所述肽二聚体包含具有以下结构ac-pen-n(me)arg-ser-asp-thr-leu-pen-xaa1-xaa2-xaa3-nh2(seqidno:62)的肽,其中:xaa1可以是任何天然或非天然氨基酸;xaa2可以不存在或是任何天然或非天然氨基酸;以及xaa3可以是任何天然或非天然氨基酸。在某些实施例中,xaa1是phe(4-tbu)或trp。在具体实施例中,xaa2是β-homoglu、glu或d-glu。在其它实施例中,xaa3是lys、d-lys、n-me-lys或n-me-d-lys。在其它实施例中,xaa1是phe(4-tbu)或trp;xaa2是β-homoglu、glu或d-glu;以及xaa3是lys、d-lys、n-me-lys或n-me-d-lys。流程ib续其中xaa11可以是任何氨基酸(天然或非天然);在某些实施例中,xaa11是phe(4-tbu)或trp其中xaa12可以不存在或是任何氨基酸(天然或非天然);在某些实施例中,xaa12是β-homoglu、glu或d-glu其中xaa13可以是任何氨基酸(天然或非天然);在某些实施例中,xaa13是lys、d-lys、n-me-lys或n-me-d-lys其中每个r独立地是trt或acm,并且如果r是trt,则在步骤2(用tfa处理)后不存在r在流程ib的具体实施例中,xaa11选自由以下组成的组:芳香族氨基酸、经取代的芳香族氨基酸、glu、d-glu、homoglu、asp、d-asp、d-homoglu、gla、β-homoglu、tic、aic、gln、cit、glu(ome)、asn、d-his、tic、phe(3-cooh)、phe(4-tbu)、d-arg、bip、trp、d-trp、phe、d-phe、d-val、d-thr、d-tyr、d-lys、d-ile、d-his、n-me-glu、n-me-asp、α-homoglu、联苯-gly、联苯-ala、homo-phe、d-1-nal、d-2-nal、thr和val、pro以及相应的d-氨基酸和电子等排体在流程ib的其它实施例中,xaa11是phe(4-tbu)或trp在流程ib的某些实施例中,xaa12不存在或选自由以下组成的组:芳香族氨基酸、经取代的芳香族氨基酸、glu、d-glu、homoglu、asp、d-asp、d-homoglu、gla、β-homoglu、tic、aic、gln、cit、glu(ome)、asn、d-his、tic、phe(3-cooh)、d-arg、bip、d-trp、phe、d-phe、d-val、d-thr、d-tyr、d-lys、d-ile、d-his、n-me-glu、n-me-asp、α-homoglu、联苯-gly、联苯-ala、homo-phe、d-1-nal、d-2-nal、thr和val、pro以及相应的d-氨基酸和电子等排体;在流程ib的具体实施例中,xaa12不存在,在流程ib的其它实施例中,xaa12是β-homoglu、glu或d-glu在流程ib的其它实施例中,xaa13选自由以下组成的组:具有胺侧链的任何氨基酸、lys、d-lys、n-me-lys、d-n-me-lys、n-me-d-lys、orn、dab、dap、homolys、d-dap、d-dab、d-orn、cys、homocys、pen、d-homocys、d-cys、d-pen、asp、glu、d-asp、d-glu和homoser、homoglu、d-homoglu、n-me-glu、n-me-asp、n-me-d-glu和n-me-d-asp。在流程ib的其它实施例中,xaa13是lys、d-lys、n-me-lys或n-me-d-lys在本发明的一些实施例中,肽单体也可以在n端缀合或二聚化,以产生n端二聚体肽。在某些实施例中,缀合是通过pen(xaa4)的游离n端胺或通过下面流程ic中所示的具有游离胺侧链的氨基酸。流程ic在流程ic的某些实施例中,xaa1至xaa14、r1、r2、n、x、y和z如流程ia的各种实施例中所定义。在其它实施例中,xaa1、xaa2和xaa3不存在,xaa4至xaa14如式i中所定义,并且肽单体使用如本文所述的任何合适的接头通过xaa4的游离胺缀合。在其它实施例中,xaa1和xaa2不存在,xaa3是具有能够与任何接头形成键以形成如本文所述的二聚体的侧链的任何氨基酸,并且xaa4至xaa14如式i中所定义。在本发明的其它实施例中,在n端二聚化的肽二聚体可以通过本文公开的任何肽单体或二聚体合成方法制备,包括但不限于固相肽合成和溶液相肽合成,包括本文所述的各种片段方法,特别是流程v、vi、vii、viii和ix。在本发明的具体实施例中,化合物a通过如所讨论的固相肽合成制备化合物b,然后使pen残基环化并使化合物b与二乙醇酸二聚化来合成。合成肽二聚体化合物a的通用流程如下面的流程ii所示。在具体实施例中,本发明提供合成环化肽单体化合物b的方法。在本发明的其它实施例中,使用固相肽合成然后通过pen残基的环化来制备化合物b。在本发明的其它实施例中,使用fmoc固相肽合成制备化合物b。在本发明的具体实施例中,化合物b在合适的树脂上用选自由以下组成的组的氨基酸合成:fmoc-d-lys(boc)-oh、fmoc-β-homoglu(otbu)-oh、fmoc-l-(4-tbu)phe-oh、fmoc-l-pen(acm)-oh、fmoc-l-pen(trt)-oh、fmoc-pen(ψme,mepro)-oh、bpoc-pen(ψme,mepro)-oh、cbz-pen(ψme,mepro)-oh、fmoc-pen(pro)-oh、bpoc-pen(pro)-oh、cbz-pen(pro)-oh、fmoc-leu-pen(ψme,mepro)-oh、bpoc-leu-pen(ψme,mepro)-oh、cbz-leu-pen(ψme,mepro)-oh、fmoc-leu-pen(pro)-oh、bpoc-leu-pen(pro)-oh、cbz-leu-pen(pro)-oh、fmoc-l-leu-oh、fmoc-l-thr(tbu)oh、fmoc-l-asp(tbu)-oh、fmoc-l-asp(tbu)-thr(ψme,mepro)-oh、fmoc-l-ser(tbu)-oh、fmoc-l-nme-arg(pbf)-oh、fmoc-l-trp(boc)-oh、fmoc-l-glu(otbu)-oh、fmoc-d-glu(otbu)-oh和fmoc-n-me-d-lys(boc)-oh。在本发明的其它实施例中,在三环酰胺接头树脂(ramageresin)上用下列受保护的氨基酸制备化合物b:fmoc-d-lys(boc)-oh、fmoc-β-homoglu(otbu)-oh、fmoc-l-(4-tbu)phe-oh、fmoc-l-pen(acm)-oh、fmoc-l-leu-oh、fmoc-l-thr(tbu)oh、fmoc-l-asp(tbu)-oh、fmoc-l-ser(tbu)-oh、fmoc-l-nme-arg(pbf)-oh。在本发明的其它实施例中,在三环酰胺接头树脂(ramageresin)上用下列受保护的氨基酸制备化合物b:fmoc-d-lys(boc)-oh、fmoc-β-homoglu(otbu)-oh、fmoc-l-(4-tbu)phe-oh、fmoc-l-pen(trt)-oh、fmoc-l-leu-oh、fmoc-l-asp(tbu)-thr(ψme,mepro)-oh、fmoc-l-ser(tbu)-oh、fmoc-l-nme-arg(pbf)-oh。在本发明的某些实施例中,末端pen残基在偶联受保护的pen残基之后和脱保护、裂解、环化和纯化之前被酰化。在某些实施例中,脱保护和裂解在同一步骤中发生。在具体实施例中,末端pen残基用乙酸酐酰化。用于制备化合物b的本发明的代表性方法示于流程iiia和iiib中。流程iiia流程iiib用于由化合物b制备化合物a的本发明的代表性方法示于流程iv中。流程iv在本发明的其它实施例中,肽二聚体表3、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558;pct/us2015/053603;美国专利号9,518,091b2中所公开的那些和本文公开的其它肽,包括但不限于式(i)-(iii)的那些,及其药学上可接受的盐、溶剂合物或水合物是通过如上文流程ia和ib中所述的固相肽合成来合成。在本发明的某些实施例中,肽二聚体的两个连接的单体亚基通过其c端通过连接部分连接在一起。在本发明的其它实施例中,肽二聚体的两个连接的单体亚基通过其n端通过连接部分连接在一起。在本发明的某些实施例中,如下合成含有青霉胺的肽,例如(xaaz)n-pen-(xaaz)m或hpen-(xaaz)m,其中每个xaaz独立地选自由天然氨基酸、非天然氨基酸、合适的电子等排体替代物、相应的d-氨基酸和相应的n-甲基氨基酸组成的组,并且n和m各自独立地是1-20的整数:使用本领域技术人员已知的固相肽合成技术制备与合适的固体支撑物连接的肽片段(xaaz)m,并与n端受保护的假脯氨酸青霉胺衍生物缩合,所述n端受保护的假脯氨酸青霉胺衍生物例如但不限于:fmoc-pen(ψme,mepro)-oh、bpoc-pen(ψme,mepro)-oh、cbz-pen(ψme,meψpro)-oh、fmoc-pen(pro)-oh、bpoc-pen(pro)-oh、cbz-pen(pro)-oh、fmoc-leu-pen(ψme,mepro)-oh、bpoc-leu-pen(ψme,mepro)-oh、cbz-leu-pen(ψme,mepro)-oh、fmoc-leu-pen(pro)-oh、bpoc-leu-pen(pro)-oh或cbz-leu-pen(pro)-oh。所得肽的n端在合适的条件下脱保护,得到与固体支撑物连接的肽片段h-pen(ψme,mepro)-(xaaz)m或h-pen(pro)-(xaaz)m。使用本领域技术人员已知的固相肽合成技术将额外残基偶联至h-pen(ψme,mepro)-(xaaz)m或h-pen(pro)-(xaaz)m肽片段,然后用tfa/水/tis(9.0∶0.5∶0.25)溶液处理以去除假脯氨酸(pro或ψme,mepro)基团以及任何侧链保护基团。在某些实施例中,可以使用本领域技术人员已知的技术对肽进行进一步的脱保护以去除任何剩余的侧链保护基团和/或从固体支撑物上切割下来。在本发明的某些实施例中,如下合成含有青霉胺的肽,例如h-pen-(xaaz)m,其中每个xaaz独立地选自由天然氨基酸、非天然氨基酸、合适的电子等排体替代物、相应的d-氨基酸和相应的n-甲基氨基酸组成的组,并且m是1-20的整数:使用本领域技术人员已知的固相肽合成技术制备与合适的固体支撑物连接的肽片段(xaaz)m,并与n端受保护的假脯氨酸青霉胺衍生物缩合,所述n端受保护的假脯氨酸青霉胺衍生物例如但不限于:fmoc-pen(ψme,mepro)-oh、bpoc-pen(ψme,mepro)-oh、cbz-pen(ψme,meepro)-oh、fmoc-pen(pro)-oh、bpoc-pen(pro)-oh、cbz-pen(pro)-oh、fmoc-leu-pen(ψme,mepro)-oh、bpoc-leu-pen(ψme,mepro)-oh、cbz-leu-pen(ψme,mepro)-oh、fmoc-leu-pen(pro)-oh、bpoc-leu-pen(pro)-oh或cbz-leu-pen(pro)-oh。用tfa/水/tis(9.0∶0.5∶0.25)溶液处理所得肽片段,以去除假脯氨酸(pro或(ψme,mepro))基团以及任何侧链保护基团。在某些实施例中,可以使用本领域技术人员已知的技术对肽进行进一步的脱保护以去除任何剩余的侧链保护基团和/或从固体支撑物上切割下来。在本发明的其它实施例中,如下合成含有青霉胺的肽,例如ac-pen-(xaaz)m,其中每个xaaz独立地选自由天然氨基酸、非天然氨基酸、合适的电子等排体替代物、相应的d-氨基酸和相应的n-甲基氨基酸组成的组,并且m是1-20的整数:使用本领域技术人员已知的固相肽合成技术制备与合适的固体支撑物连接的肽片段(xaaz)m,并与n端受保护的假脯氨酸青霉胺衍生物缩合,所述n端受保护的假脯氨酸青霉胺衍生物选自ac-pen(ψme,mepro)-oh和ac-pen(pro)-oh。用tfa/水/tis(9.0∶0.5∶0.25)溶液处理所得肽片段,以去除假脯氨酸(pro或ψme,mepro)基团以及任何侧链保护基团。在某些实施例中,可以使用本领域技术人员已知的技术对肽进行进一步的脱保护以去除任何剩余的侧链保护基和/或从固体支撑物上切割下来。在其它实施例中,上述固相肽合成技术可用于将一个或多个青霉胺残基掺入肽链中,例如(xaaz)p-pen-(xaaz)n-pen-(xaaz)m、hpen-(xaaz)n-pen-(xaaz)m和ac-pen-(xaaz)n-pen-(xaaz)m,其中每个xaaz独立地选自由天然氨基酸、合适的电子等排体替代物、相应的d-氨基酸和相应的n-甲基氨基酸组成的组,并且p、n和m各自独立地是1-20的整数。在某些实施例中,肽的c端包含nh2或oh。在某些实施例中,c端氨基酸中的游离胺例如用乙酰基封端。在其它实施例中,n端氨基酸中的游离胺例如用乙酰基封端。在其它实施例中,n端氨基酸的α-氨基例如用乙酰基封端。溶液相肽合成在具体实施例中,本发明的方法提供了一种有成本效益的方法,用于通过溶液相方法使用廉价的起始原料、温和的试剂合成商业量的含有青霉胺的肽,以产生高纯度肽。在某些实施例中,本发明提供通过溶液相肽合成来合成化合物b的肽、表2、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558;pct/us2015/053603;美国专利号9,518,091b2中所公开的那些和本文公开的其它肽,包括但不限于式(i)-(iii)的那些,及其药学上可接受的盐、溶剂合物或水合物的方法。在具体实施例中,本发明提供通过溶液相肽合成使用cbz和fmoc保护的氨基酸合成化合物b的肽、表2、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558,pct/us2015/053603;美国专利号9,518,091b2中所公开的那些和本文公开的其它肽,包括但不限于式(i)-(iii)的那些,及其药学上可接受的盐、溶剂合物和水合物的方法。在其它实施例中,本发明提供通过溶液相肽合成使用fmoc保护的氨基酸合成化合物b的肽、表2、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558,pct/us2015/053603;美国专利号9,518,091b2中所公开的那些和本文公开的其它肽,包括但不限于式(i)-(iii)的那些,及其药学上可接受的盐、溶剂合物和水合物的方法。在其它实施例中,本发明提供通过溶液相肽合成使用bpoc保护的氨基酸合成化合物b的肽、表2、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558,pct/us2015/053603;美国专利号9,518,091b2中所公开的那些和本文公开的其它肽,包括但不限于式(i)-(iii)的那些,及其药学上可接受的盐、溶剂合物和水合物的方法。在其它实施例中,本发明的方法提供了用于合成具有以下序列的肽的溶液相合成方法:ac-pen-n(me)arg-ser-asp-thr-leu-pen-xaa11-xaa12-xaa13(seqidno:62)或ac-pen-n(me)arg-ser-asp-thr-leu-pen-xaa11-xaa12-xaa13-nh2(seqidno:62),其中:xaa11可以是任何天然或非天然氨基酸;xaa12可以不存在或是任何天然或非天然氨基酸;以及xaa13可以是任何天然或非天然氨基酸。在某些实施例中,xaa11是phe(4-tbu)或trp。在具体实施例中,xaa12是β--homoglu、glu或d-glu。在其它实施例中,xaa13是lys、d-lys、n-me-lys或n-me-d-lys。在其它实施例中,xaa11是phe(4-tbu)或trp;xaa12是β-homoglu、glu或d-glu;以及xaa13是lys、d-lys、n-me-lys或n-me-d-lys。在本发明的具体实施例中,肽序列ac-pen-n(me)arg-ser-asp-thr-leu-pen-xaa11-xaa12-xaa13(seqidno:62)或ac-pen-n(me)arg-ser-asp-thr-leu-pen-xaa11-xaa12-xaa13-nh2(seqidno:62),其中xaa11、xaa12和xaa13如上文所定义,可以通过两个受保护的肽片段的缩合来合成。例如,ac-pen-n(me)arg-ser-asp-thr-leu-pen-xaa11-xaa12-xaa13-oh(seqidno:62)可以通过以下各组肽片段的缩合,然后脱保护来合成(片段显示没有保护基团,但可以使用任何合适的保护基团):ac-pen-oh和hn(me)arg-ser-asp-thr-leu-pen-xaa11-xaa12-xaa13-oh(seqidno:87)ac-penn(me)arg-oh和hser-asp-thr-leu-pen-xaa11-xaa12-xaa13-oh(seqidno:69)ac-pen-n(me)arg-ser-oh和hasp-thr-leu-pen-xaa11-xaa12-xaa13-oh(seqidno:70)ac-pen-n(me)arg-ser-asp-oh和hthr-leu-pen-xaa11-xaa12-xaa13-oh(seqidno:71和72)ac-pen-n(me)arg-ser-asp-thr-oh和hleu-pen-xaa11-xaa12-xaa13-oh(seqidno:73和74)ac-pen-n(me)arg-ser-asp-thr-leu-oh和hpen-xaa11-xaa12-xaa13-oh(seqidno:75和76)ac-penn(me)arg和ser-asp-thr-leu-oh和hpen-xaa11-xaa12-xaa13-oh(seqidno:77和76)ac-penn(me)arg和ser-asp-thr-leu-pen-oh和hxaa11-xaa12-xaa13-oh(seqidno:78)ac-penn(me)arg和ser-asp-thr-leu-pen-xaa11和hxaa12-xaa13-oh(seqidno:79)。作为另一实例,ac-pen-n(me)arg-ser-asp-thr-leu-pen-xaa1-xaa2-xaa3-nh2(seqidno:62)可以通过以下各组肽片段的缩合,然后脱保护来合成(片段显示没有保护基团,但可以使用任何合适的保护基团):ac-pen-oh和hn(me)arg-ser-asp-thr-leu-pen-xaa11-xaa12-xaa13-nh2(seqidno:87).ac-penn(me)arg-oh和hser-asp-thr-leu-pen-xaa11-xaa12-xaa13-nh2(seqidno:69)ac-pen-n(me)arg-ser-oh和hasp-thr-leu-pen-xaa11-xaa12-xaa13-nh2(seqidno:70)ac-pen-n(me)arg-ser-asp-oh和hthr-leu-pen-xaa11-xaa12-xaa13-nh2(seqidno:71和72)ac-pen-n(me)arg-ser-asp-thr-oh和hleu-pen-xaa11-xaa12-xaa13-nh2(seqidno:73和74)ac-pen-n(me)arg-ser-asp-thr-leu-oh和hxaa11-xaa12-xaa13-nh2(seqidno:75和76)ac-penn(me)arg和ser-asp-thr-leu-oh和hpen-xaa11-xaa12-xaa13-nh2(seqidno:77和76)ac-penn(me)arg和ser-asp-thr-leu-pen-oh和hxaa11-xaa12-xaa13-nh2(seqidno:78)ac-penn(me)arg和ser-asp-thr-leu-pen-xaa11-oh和hxaa12-xaa13-nh2(seqidno:79)。在具体实施例中,本发明提供了使用溶液相肽合成技术与受保护的pen氨基酸来合成ac-pen-n(me)arg-ser-asp-thr-leu-pen-xaa11-xaa12-xaa13-oh(seqidno:62)或ac-pen-n(me)arg-ser-asp-thr-leu-pen-xaa11-xaa12-xaa13-nh2(seqidno:62)的方法,其中xaa11、xaa12和xaa13如上文所定义,所述受保护的pen氨基酸选自由以下组成的组:fmoc-pen(trt)、fmoc-pen(acm)、cbz-pen(trt)、cbz-pen(acm)、fmoc-pen(ψme,mepro)-oh、bpoc-pen(ψme,mepro)-oh、cbz-pen(ψme,mepro)-oh、fmoc-pen(pro)-oh、bpoc-pen(pro)-oh、cbz-pen(pro)-oh、fmoc-leu-pen(ψme,mepro)-oh、bpoc-leu-pen(ψme,mepro)-oh、cbz-leu-pen(ψme,mepro)-oh、fmoc-leu-pen(pro)-oh、bpoc-leu-pen(pro)-oh或cbz-leu-pen(pro)-oh。在某些实施例中,本发明提供合成化合物a的肽二聚体、表3、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558;pct/us2015/053603;美国专利号9,518,091b2中所公开的那些和本文公开的其它肽,包括但不限于式(i)-(iii)的那些,及其药学上可接受的盐、溶剂合物或水合物的方法:通过溶液相肽合成来合成适当肽单体,使单体环化并用合适的接头使环化肽二聚化。在本发明的某些实施例中,接头是二乙醇酸。在具体实施例中,肽单体包含两个pen残基。在本发明的某些实施例中,表2的肽二聚体的肽可以通过溶液相肽合成来合成。在具体实施例中,肽通过适当的8聚体和2聚体片段、7聚体和3聚体片段、6聚体和4聚体片段、5聚体和5聚体片段、4聚体和6聚体片段、3聚体和7聚体片段、2聚体和8聚体片段或和9聚体和受保护的和/或乙酰氨基酸的缩合,然后脱保护和环化来合成。如流程v所示,在本发明的某些实施例中,化合物b可以通过适当受保护的8聚体和2聚体片段、7聚体和3聚体片段、6聚体和4聚体片段、5聚体和5聚体片段、4聚体和6聚体片段、3聚体和7聚体片段、2聚体和8聚体片段,或和9聚体和受保护的和/或乙酰氨基酸的缩合,然后脱保护和环化来合成。流程v流程v续流程v续在本发明的其它实施例中,受保护的片段ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使八肽ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-oh(seqidno:80)与二肽hβ-homoglu(otbu)-d-lys(boc)-nh2缩合来制备;其中每个r独立地是trt或acm。在本发明的其它实施例中,受保护的片段ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使七肽ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-oh(seqidno:81)与三肽hphe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2缩合来制备;其中每个r独立地是trt或acm。在本发明的其它实施例中,受保护的片段ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使六肽ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)与四肽h-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合来制备;其中每个r独立地是trt或acm。在本发明的某些实施例中,受保护的片段ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使五肽ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-oh(seqidno:73)与五肽h-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:83)缩合来制备;其中每个r独立地是trt或acm。在本发明的其它实施例中,受保护的片段ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使四肽ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-oh(seqidno:71)与六肽hthr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:84)缩合来制备;其中每个r独立地是trt或acm。在本发明的具体实施例中,受保护的片段ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使三肽ac-pen(r)-n(me)arg(pbf)-ser(tbu)-oh与七肽h-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:85)缩合来制备;其中每个r独立地是trt或acm。在本发明的其它实施例中,受保护的片段ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使二肽ac-pen(r)-n(me)arg(pbf)-oh与八肽h-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:86)缩合来制备:其中每个r独立地是trt或acm。在本发明的其它实施例中,受保护的片段ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使n-保护的氨基酸或n-乙酰化氨基酸y-pen(r)-oh与九肽hn(me)-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:87)缩合来制备;其中每个r独立地是trt或acm。y是fmoc、cbz或ac在本发明的其它实施例中,六肽ac-pen(acm)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)是通过使y-pen(acm)与五肽hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)缩合来制备。y是fmoc、cbz或ac在本发明的其它实施例中,六肽ac-pen(trt)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)是通过使y-pen(trt)-oh与五肽hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)缩合来制备。y是fmoc、cbz或ac在本发明的其它实施例中,四肽h-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)是通过使fmoc-pen(ψme,mepro)、bpoc-pen(ψme,mepro)或cbz-pen(ψme,mepro)与三肽h-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2缩合,然后去除n端保护基团来制备。在本发明的其它实施例中,八肽h-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:86)是通过使四肽fmoc-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:77)与四肽h-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合,然后去除n端保护基团来制备。在本发明的其它实施例中,九肽hn(me)arg-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:87)是通过使五肽hn(me)arg-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:5)与四肽hpen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合来制备。溶液相肽合成中的假脯氨酸青霉胺衍生物假脯氨酸青霉胺衍生物在本发明的某些实施例中,假脯氨酸青霉胺衍生物是:其中每个r1独立地选自由-h和c1-c6烷基组成的组,并且r2是胺保护基团。在本发明的具体实施例中,至少一个r1是-ch3。在本发明的其它实施例中,两个r1都是-ch3。在本发明的其它实施例中,至少一个r1是-h。在本发明的其它实施例中,两个r1都是-h。在本发明的某些实施例中,r2选自由boc、cbz、fmoc、bpoc和ac组成的组。在本发明的某些实施例中,假脯氨酸青霉胺衍生物是(4r)-3-乙酰基-2,2,5,5-四甲基-噻唑烷-4-甲酸(ac-pen(ψme,mepro)-oh,化合物d-1):在本发明的其它实施例中,假脯氨酸青霉胺衍生物是(4r)-3-乙酰基-5,5-二甲基-噻唑烷-4-甲酸(ac-pen(pro)-oh,化合物i-1):在本发明的其它实施例中,假脯氨酸青霉胺衍生物的n端受任何合适的可去除的n端保护基团保护,例如但不限于t-boc(叔丁氧基羰基)、fmoc(9-芴基甲氧基羰基)、bpoc(2-(4-联苯)异丙氧基羰基)、cbz(z,羧基苄基)或本领域已知的任何其它合适的保护基团,例如isidro-llobet,a.等人,“氨基酸保护基团(aminoacidprotectinggroups)”化学评论(chem.rev.)109,2455-2504,2009中所述的那些。在本发明的具体实施例中,假脯氨酸青霉胺衍生物是(4r)-3-(9h-芴-9-基甲氧基羰基)-2,2,5,5-四甲基-噻唑烷-4-甲酸(fmoc-pen(ψme,mepro)-oh,化合物e-1):在本发明的其它实施例中,假脯氨酸青霉胺衍生物是(r)-3-(((2-([1,1′-联苯]-4-基)丙-2-基)氧基)羰基)-2,2,5,5-四甲基噻唑烷-4-甲酸(bpoc-pen(ψme,mepro)-oh化合物f-1)在本发明的其它实施例中,假脯氨酸青霉胺衍生物是(r)-3-((苯甲氧基)羰基)-2,2,5,5-四甲基噻唑烷-4-甲酸(cbz-pen(ψme,mepro)-oh,化合物g-1)。在本发明的其它实施例中,假脯氨酸青霉胺衍生物是(r)-3-(((9h-芴-9-基)甲氧基)羰基)-5,5-二甲基噻唑烷-4-甲酸(fmoc-pen(ψh,hpropro)-oh,化合物j-1):在本发明的其它实施例中,假脯氨酸青霉胺衍生物是(r)-3-(((2-([1,1′-联苯]-4-基)丙-2-基)氧基)羰基)-5,5-二甲基噻唑烷-4-甲酸(bpoc-pen(pro)-oh,化合物k-1)在本发明的其它实施例中,假脯氨酸青霉胺衍生物是(r)-3-((苯甲氧基)羰基)-5,5-二甲基噻唑烷-4-甲酸(cbz-pen(ψh,hpro)-oh,化合物l-1)。除了具有如上所述的r立体化学的pen(ψh,hpro)-oh衍生物之外,本发明还提供了上述化合物的相应s立体异构体以及它们在肽合成中的用途,具体地:·(4s)-3-乙酰基-2,2,5,5-四甲基-噻唑烷-4-甲酸·(4s)-3-乙酰基-5,5-二甲基-噻唑烷-4-甲酸·(4s)-3-(9h-芴-9-基甲氧基羰基)-2,2,5,5-四甲基-噻唑烷-4-甲酸·(s)-3-(((2-([1,1′-联苯]-4-基)丙-2-基)氧基)羰基)-2,2,5,5-四甲基噻唑烷-4-甲酸·(s)-3-((苯甲氧基)羰基)-2,2,5,5-四甲基噻唑烷-4-甲酸·(s)-3-(((9h-芴-9-基)甲氧基)羰基)-5,5-二甲基噻唑烷-4-甲酸·(s)-3-(((2-([1,1′-联苯]-4-基)丙-2-基)氧基)羰基)-5,5-二甲基噻唑烷-4-甲酸·(s)-3-((苯甲氧基)羰基)-5,5-二甲基噻唑烷-4-甲酸在本发明的某些实施例中,青霉胺和另一种氨基酸作为假脯氨酸二肽掺入肽中。已知假脯氨酸二肽在肽合成期间,特别是在固相肽合成期间使聚集最小化。除了保护青霉胺侧链之外,假脯氨酸二肽有助于肽的溶解,从而在肽合成和随后的链组装过程中增加溶剂化和偶联速率。在某些实施例中,本发明涉及式v、式va和式vb的假脯氨酸二肽及其在含有青霉胺的肽的合成中的用途:其中r1是任何合适的氨基酸侧链,每个r2独立地选自由-h和c1-c6烷基组成的组,以及pg是任何合适的保护基团。在某些实施例中,氨基酸侧链进一步被合适的保护基团(pg)保护。在具体实施例中,pg选自由fmoc、boc和cbz组成的组。在本发明的具体实施例中,r1是对应于选自天然氨基酸、非天然氨基酸、合适的电子等排体替代物、相应的d-氨基酸以及相应的n-甲基氨基酸的氨基酸侧链的氨基酸侧链。在本发明的某些实施例中,每个r2独立地是-h或-ch3在某些实施例中,本发明涉及式vi、式via和式vib的假脯氨酸二肽及其在含有青霉胺的肽的合成中的用途:其中r1是任何合适的氨基酸侧链并且pg是任何合适的保护基团。在某些实施例中,氨基酸侧链进一步被合适的保护基团保护。在具体实施例中,pg选自由fmoc、boc和cbz组成的组。在本发明的具体实施例中,r是对应于选自天然氨基酸、非天然氨基酸、合适的电子等排体替代物、相应的d-氨基酸以及相应的n-甲基氨基酸的氨基酸侧链的氨基酸侧链。在本发明的具体实施例中,假脯氨酸二肽是式vii的二肽其中pg是任何合适的保护基团。在具体实施例中,pg选自由fmoc、boc和cbz组成的组。本发明的其它实施例涉及以下假脯氨酸二肽及其在固态和溶液相肽合成中的用途。fmoc-leu-pen(ψme,mepro)-oh(化合物m):bpoc-leu-pen(ψme,mepro)-oh(化合物n):cbz-leu-pen(ψme,mepro)-oh(化合物o):在某些实施例中,本发明涉及式vii、式viia和式viib的假脯氨酸二肽及其在含有青霉胺的肽的合成中的用途:其中r1是任何合适的氨基酸侧链并且pg是任何合适的保护基团。在某些实施例中,氨基酸侧链进一步被合适的保护基团保护。在具体实施例中,pg选自由fmoc、boc和cbz组成的组。在本发明的具体实施例中,r1是对应于选自天然氨基酸、非天然氨基酸、合适的电子等排体替代物、相应的d-氨基酸以及相应的n-甲基氨基酸的氨基酸侧链的氨基酸侧链。在本发明的具体实施例中,假脯氨酸二肽是式viii的二肽:其中pg是任何合适的保护基团。在具体实施例中,pg选自由fmoc、boc和cbz组成的组。本发明的其它实施例涉及以下假脯氨酸二肽及其在固态和溶液相肽合成中的用途。fmoc-leu-pen(ψh,hpro)-oh(化合物p):bpoc-leu-pen(ψh,hpro)-oh(化合物q):cbz-leu-pen(ψh,hpro)-oh(化合物r):在涉及合成包含两个或更多个青霉胺残基的肽单体的本发明的某些实施例中,青霉胺残基作为假脯氨酸青霉胺掺入肽中。在涉及合成包含两个或更多个青霉胺残基的肽单体的本发明的其它实施例中,青霉胺残基作为三苯甲基保护的青霉胺掺入肽中。在涉及合成包含两个或更多个青霉胺残基的肽单体的本发明的其它实施例中,青霉胺残基作为乙酰氨基甲基(acm)保护的青霉胺掺入肽中。在涉及合成包含两个或更多个青霉胺残基的肽单体的本发明的其它实施例中,至少一个青霉胺残基作为假脯氨酸青霉胺掺入肽中,并且至少一个青霉胺残基作为三苯甲基保护的青霉胺掺入肽中。在涉及合成包含两个或更多个青霉胺残基的肽单体的本发明的其它实施例中,至少一个青霉胺残基作为假脯氨酸青霉胺掺入肽中,并且至少一个青霉胺残基作为乙酰氨基甲基保护的青霉胺掺入肽中。在涉及合成包含两个或更多个青霉胺残基的肽单体的本发明的具体实施例中,至少一个青霉胺残基作为三苯甲基保护的青霉胺掺入肽中,并且至少一个青霉胺残基作为乙酰氨基甲基保护的青霉胺掺入肽中。在本发明的具体实施例中,本文描述的方法可用于以商业和/或工业规模制备肽和肽二聚体。在本发明的具体实施例中,本发明的方法可用于合成约10至150kg的肽或肽二聚体。在本发明的某些实施例中,本文所述的方法可用于合成约10至125kg、10至100kg、10至75kg、10至50kg、10至25kg、25至150kg、25至125kg、25至100kg、25至75kg、25至50kg、50至150kg、50至125kg、50至100kg、50至75kg、75至150kg、75至125kg、75至100kg、100至125kg、100至150kg、或125至150kg、100至500kg、500-1,000kg、1,000至10,000kg和它们之间的所有子范围。本文公开的合成方法的实施例可用于合成化合物a和/或化合物b,以及其它单体和二聚体。本发明的某些实施例提供了合成高达多公吨规模的商业数量的可行性。本发明的某些实施例提供了显著的优点;例如操作简单、副反应最小、适合大规模生产。本发明的某些实施例产品化合物a和/或化合物b可以使用廉价的起始物质大量生产。本发明的某些实施例在产物纯度方面提供了显著的优点。本发明的某些实施例提供过程可扩展的成本有效的合成。本发明的某些实施例提供产生医药级化合物a和/或化合物b的方法。在本发明的某些实施例中,青霉胺的巯基在固相肽合成期间被假脯氨酸衍生物保护。在本发明的某些实施例中,青霉胺作为假脯氨酸青霉胺衍生物掺入含有青霉胺的肽中,例如但不限于化合物b、表2的肽二聚体的肽,以及pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/05355;pct/us2015/053603;美国专利号9,518,091b2中所公开的那些,和本文公开的其它肽,包括但不限于式(i)-(iii)的那些,及其药学上可接受的盐、溶剂合物和水合物。在本发明的具体实施例中,假脯氨酸青霉胺衍生物选自由以下组成的组:fmoc-pen(ψme,mepro)-oh、bpoc-pen(ψme,mepro)-oh、cbz-pen(ψme,mepro)-oh、fmoc-pen(pro)-oh、bpoc-pen(pro)-oh、cbz-pen(pro)-oh和式iv的化合物。在其它实施例中,假脯氨酸青霉胺衍生物是选自由以下组成的组的假脯氨酸二肽:fmoc-leu-pen(ψme,mepro)-oh、bpoc-leu-pen(ψme,mepro)-oh、cbz-leu-pen(ψme,mepro)-oh、fmoc-leu-pen(pro)-oh、bpoc-leu-pen(pro)-oh、cbz-leu-pen(pro)-oh以及式v、式va、式vb、式vi、式via、式vib、式vii、式vii、式viia、式viib和式viii的化合物。在本发明的其它实施例中,如下合成含有青霉胺的肽pen-(xaaz)m,其中每个xaaz独立地选自由天然氨基酸、合适的电子等排体替代物、相应的d-氨基酸和相应的n-甲基氨基酸组成的组,并且m是1-20的整数:使用本领域技术人员已知的溶液相肽合成技术制备肽(xaaz)m,并与n端受保护假脯氨酸青霉胺衍生物缩合,所述n端受保护假脯氨酸青霉胺衍生物例如但不限于:fmoc-pen(ψme,mepro)-oh、bpoc-pen(ψme,mepro)-oh、cbz-pen(ψme,mepro)-oh、fmoc-pen(pro)-oh、bpoc-pen(pro)-oh或cbz-pen(pro)-oh。所得肽的n端在合适的条件下脱保护,产生h-pen(ψme,mepro)-(xaaz)m或h-pen(pro)-(xaaz)m。随后用tfa/水/tis(9.0∶0.5∶0.25)混合物去除假脯氨酸基团。在本发明的其它实施例中,如下合成含有青霉胺的肽ac-pen-(xaaz)m,其中每个xaaz独立地选自由天然氨基酸、合适的电子等排体替代物、相应的d-氨基酸和相应的n-甲基氨基酸组成的组,并且m是1-20的整数:使用本领域技术人员已知的溶液相肽合成技术制备肽(xaaz)m,并与ac-pen(ψme,mepro)-oh或ac-pen(pro)-oh缩合,产生ac-pen(ψme,mepro)-(xaaz)m或ac-pen(pro)-(xaaz)m。随后用tfa/水/tis(9.0∶0.5∶0.25)混合物去除假脯氨酸基团。在本发明的其它实施例中,可以如上所述掺入不止一个青霉胺残基,例如(xaaz)p-pen-(xaaz)n-pen-(xaaz)m、(xaaz)p-pen-(xaaz)n-pen-(xaaz)m、hpen-(xaaz)n-pen-(xaaz)m和ac-pen-(xaaz)n-pen-(xaaz)m,其中每个xaaz独立地选自由天然氨基酸、合适的电子等排体替代物、相应的d-氨基酸和相应的n-甲基氨基酸组成的组,并且p、n和m各自独立地是1-20的整数。在本发明的某些实施例中,使用本领域技术人员已知的标准肽合成方案制备与假脯氨酸青霉胺缩合的肽片段。例如,氨基酸的氨基官能团用例如但不限于boc、cbz(z)、fmoc、bpoc、ac的保护基团保护,并且氨基酸的羧基官能团用例如但不限于烷基(例如甲基)、酰胺、n-osu或芳基苯酚(例如,硝基苯酚)的保护基团保护。氨基受保护的氨基酸的羧基缩合通过使用活性酯方法完成。所述酯可以是n-羟基琥珀酰亚胺或其它活化酯。通过将羧基受保护的氨基酸溶解在极性非质子溶剂如二甲基甲酰胺、四氢呋喃、乙腈、二氯甲烷中,在叔胺如三乙胺、二异丙基乙胺、n-甲基吗啉的存在下,在10至40℃的温度下进行反应2-24小时。或者,氨基受保护的氨基酸的羧基的缩合通常通过将适当保护的氨基酸以等摩尔量溶解在溶剂如二甲基甲酰胺、四氢呋喃、二氯甲烷、乙腈中,并在0-10℃的温度下加入等摩尔量的一种或多种活化剂和缩合剂如nhs、hbtu、dic、hobt、oxyma,并在5至40℃下搅拌2至20小时来进行。通过使用本领域已知的适当试剂去除氨基/羧基的保护基团。在本发明的具体实施例中,用tfa/水/tis(9.0∶0.5∶0.25)混合物处理含有假脯氨酸青霉胺衍生物的肽去除假脯氨酸,得到未保护的青霉胺侧链。在本发明的某些实施例中,如下合成含有青霉胺的肽,例如(xaaz)n-pen-(xaaz)m,其中每个xaaz独立地选自由天然氨基酸、非天然氨基酸、合适的电子等排体替代物、相应的d-氨基酸和相应的n-甲基氨基酸组成的组,并且n和m各自独立地是1-20的整数:使用本领域技术人员已知的溶液相肽合成技术制备肽(xaaz)m,并与n端受保护的假脯氨酸青霉胺衍生物缩合,所述n端受保护的假脯氨酸青霉胺衍生物例如但不限于:fmoc-pen(ψme,mepro)-oh、bpoc-pen(ψme,mepro)-oh、cbz-pen(ψme,mepro)-oh、fmoc-pen(pro)-oh、bpoc-pen(pro)-oh、cbz-pen(pro)-oh、fmoc-leu-pen(ψme,mepro)-oh、bpoc-leu-pen(ψme,mepro)-oh、cbz-leu-pen(ψme,mepro)-oh、fmoc-leu-pen(pro)-oh、bpoc-leu-pen(pro)-oh、cbz-leu-pen(pro)-oh或式v、式va、式vb、式vi、式via、式vib、式vii、式viia、式viib或式viii的化合物。所得肽的n端在合适的条件下脱保护,产生h-pen(ψme,mepro)-(xaaz)m或h-pen(pro)-(xaaz)m。使用本领域技术人员已知的溶液相肽合成技术制备肽(xaaz)n。然后通过使(xaaz)n与h-pen(ψme,mepro)-(xaaz)m或h-pen(pro)-(xaaz)m缩合,接着通过用tfa/水/tis(9.0∶0.5∶0.25)溶液处理以去除假脯氨酸(pro或ψme,mepro)基团以及任何侧链保护基团来制备肽(xaaz)n-pen-(xaaz)m。在某些实施例中,肽可以进一步脱保护以去除任何剩余的侧链保护基团。在本发明的某些实施例中,十肽(xaaz)8-pen-xaaz可以通过将n端受保护的假脯氨酸青霉胺衍生物与氨基酸xaaz偶联,去除n端保护基团,使所得h-pen(ψme,mepro)-xaaz或h-pen(pro)-xaaz肽与(xaaz)8缩合并如上所述脱保护以去除假脯氨酸(pro或ψme,mepro)基团以及任何侧链保护基团来合成。在本发明的某些实施例中,十肽(xaaz)7-pen-(xaaz)2可以通过将n端受保护的假脯氨酸青霉胺衍生物与肽(xaaz)2偶联,去除n端保护基团,使所得h-pen(ψme,mepro)-(xaaz)2或h-pen(pro)-(xaaz)2肽与(xaaz)7缩合并如上所述脱保护以去除假脯氨酸(pro或ψme,mepro)基团以及任何侧链保护基团来合成。在本发明的某些实施例中,十肽(xaaz)6-pen-(xaaz)3可以通过将n端受保护的假脯氨酸青霉胺衍生物与肽(xaaz)3偶联,去除n端保护基团,使所得h-pen(ψme,mepro)-(xaaz)3或h-pen(pro)-(xaaz)3肽与(xaaz)6缩合并如上所述脱保护以去除假脯氨酸(pro或ψme,mepro)基团以及任何侧链保护基团来合成。在本发明的某些实施例中,十肽(xaaz)5-pen-(xaaz)4可以通过将n端受保护的假脯氨酸青霉胺衍生物与肽(xaaz)4偶联,去除n端保护基团,使所得h-pen(ψme,mepro)-(xaaz)4或h-pen(pro)-(xaaz)4肽与(xaaz)5缩合并如上所述脱保护以去除假脯氨酸(pro或ψme,mepro)基团以及任何侧链保护基团来合成。在本发明的某些实施例中,十肽(xaaz)4-pen-(xaaz)5可以通过将n端受保护的假脯氨酸青霉胺衍生物与肽(xaaz)5偶联,去除n端保护基团,使所得h-pen(ψme,mepro)-(xaaz)5或h-pen(pro)-(xaaz)5肽与(xaaz)4缩合并如上所述脱保护以去除假脯氨酸(pro或ψme,mepro)基团以及任何侧链保护基团来合成。在本发明的某些实施例中,十肽(xaaz)3-pen-(xaaz)6可以通过将n端受保护的假脯氨酸青霉胺衍生物与肽(xaaz)6偶联,去除n端保护基团,使所得h-pen(ψme,mepro)-(xaaz)6或h-pen(pro)-(xaaz)6肽与(xaaz)4缩合并如上所述脱保护以去除假脯氨酸(pro或ψme,mepro)基团以及任何侧链保护基团来合成。在本发明的某些实施例中,十肽(xaaz)2-pen-(xaaz)7可以通过将n端受保护的假脯氨酸青霉胺衍生物与肽(xaaz)7偶联,去除n端保护基团,使所得h-pen(ψme,mepro)-(xaaz)7或h-pen(pro)-(xaaz)7肽与(xaaz)2缩合并如上所述脱保护以去除假脯氨酸(pro或ψme,mepro)基团以及任何侧链保护基团来合成。在本发明的某些实施例中,十肽xaaz-pen-(xaaz)8可以通过将n端受保护的假脯氨酸青霉胺衍生物与肽(xaaz)8偶联,去除n端保护基团,使所得h-pen(ψme,mepro)-(xaaz)8或h-pen(pro)-(xaaz)8肽与xaaz缩合并如上所述脱保护以去除假脯氨酸(pro或ψme,mepro)基团以及任何侧链保护基团来合成。在某些实施例中,肽的c端包含nh2或oh。在某些实施例中,c端氨基酸中的游离胺例如用乙酰基封端。在其它实施例中,n端氨基酸中的游离胺例如用乙酰基封端。在其它实施例中,n端氨基酸的α-氨基例如用乙酰基封端。如流程vi所示,在本发明的具体实施例中,化合物b可以通过适当受保护的8聚体和2聚体片段、7聚体和3聚体片段、6聚体和4聚体片段、5聚体和5聚体片段、4聚体和6聚体片段、3聚体和7聚体片段、或2聚体和8聚体片段的缩合,然后脱保护和环化来合成。在本发明的具体实施例中,所述方法提供了线性十肽ac-pen-n(me)arg-ser-asp-thr-leu-pen-phe(4-tbu)-β-homoglu-d-lys-nh2(seqidno:25)的合成。在本发明的其它实施例中,ac-pen-n(me)arg-ser-asp-thr-leu-pen-phe(4-tbu)-β-homoglu-d-lys-nh2(seqidno:25)通过两个pen残基之间的分子内二硫桥键氧化形成分子内环肽。在其它实施例中,环状十肽用合适的接头二聚化以产生肽二聚体(化合物a)。在本发明的某些实施例中,受保护的片段ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使六肽ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)与四肽h-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合来制备,其中每个r独立地是acm或trt。在本发明的其它实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使六肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)与四肽h-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合来制备。在本发明的其它实施例中,六肽ac-pen(acm)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)是通过使y-pen(acm)-oh与五肽hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)缩合来制备。其中y=acm、trt或ac在本发明的其它实施例中,六肽ac-pen(trt)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)是通过使y-pen(trt)-oh与五肽hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)缩合来制备。其中y=acm、trt或ac在本发明的其它实施例中,四肽h-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)是通过使fmoc-pen(ψme,mepro)、bpoe-pen(ψme,mepro)或cbz-pen(ψme,mepro)与三肽h-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2缩合,然后去除n端保护基团来制备。在本发明的其它实施例中,四肽h-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)是通过使fmoc-pen(acm)-oh与三肽h-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2缩合,然后去除n端保护基团来制备。在本发明的其它实施例中,四肽h-pen(trt)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)是通过使fmoc-pen(trt)-oh与三肽h-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2缩合,然后去除n端保护基团来制备。在本发明的其它实施例中,十肽ac-pen(trt)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(trt)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(trt)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:87)与fmoc-pen(trt)-oh缩合,然后去除n端保护基团并用乙酸酐进行乙酰化来制备。在本发明的其它实施例中,十肽ac-pen(acm)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:87)与fmoc-pen(acm)-oh缩合,然后去除n端保护基团并用乙酸酐进行乙酰化来制备。在本发明的其它实施例中,十肽ac-pen(trt)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(trt)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使二肽fmoc-pen(trt)-n(me)arg(pbf)-oh与八肽hser(tbu)-asp(otbu)-thr(tbu)-leu-pen(trt)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:86)缩合,然后去除n端保护基团并用乙酸酐进行乙酰化来制备。在本发明的其它实施例中,十肽ac-pen(acm)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使二肽fmoc-pen(acm)-n(me)arg(pbf)-oh与八肽hser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:86)缩合,然后去除n端保护基团并用乙酸酐进行乙酰化来制备。在本发明的其它实施例中,八肽h-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:86)是通过使四肽fmoc-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:77)与四肽hpen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合,然后去除n端保护基团来制备。在本发明的其它实施例中,九肽hn(me)arg-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:87)是通过使五肽hn(me)arg-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:5)与四肽hpen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合来制备。流程vi流程vi续在本发明的其它实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使八肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-oh(seqidno:80)与二肽hβ-homoglu(otbu)-d-lys(boc)-nh2缩合来制备。在本发明的其它实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使七肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-oh(seqidno:81)与三肽phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2缩合来制备。在本发明的其它实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使六肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)与四肽h-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合来制备。在本发明的其它实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使五肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-oh(seqidno:73)与五肽leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:83)缩合来制备。在本发明的某些实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使四肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-oh(seqidno:71)与六肽thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:84)缩合来制备。在本发明的具体实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使三肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-oh与七肽hasp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:85)缩合来制备。在本发明的其它实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使二肽ac-pen(ψme,mepro)-n(me)arg(pbf)-oh与八肽hser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:86)缩合来制备。在本发明的某些实施例中,区段a,即受保护的六肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)是通过使四肽hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)与ac-pen(ψme,mepro)缩合,然后皂化来制备。在本发明的其它实施例中,区段b是通过使cbz-pen(ψme,mepro)、fmoc-pen(ψme,mepro)或bpoc-pen(ψme,mepro)与hphe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2缩合,然后去除cbz、fmoc或bpoc保护基团来制备。在本发明的一个具体实施例中,受保护的片段ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-βhomoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使六肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)与四肽h-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)缩合来制备。用混合液tfa/水/tis(9.0∶0.5∶0.25)处理十肽,一步去除假脯氨酸(ψme,mepro)基团、tbu、otbu、pbf和boc基团,得到化合物b,然后用过氧化氢氧化形成二硫键,得到环化的十肽,并用二乙醇酸酯接头二聚化,得到化合物a。在本发明的其它实施例中,受保护的片段ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(ψme,mepro)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使五肽ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(ψme,mepro)oh(seqidno:73)与五肽hleu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:83)缩合来制备。(r=acm、trt或ψme,mepro)在本发明的其它实施例中,受保护的片段七肽h-asp(otbu)-thr(ψme,mepro)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:85)是通过使二肽cbz-asp(otbu)-thr(ψme,mepro)-oh与五肽h-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:83)缩合来制备。(r=acm、trt或ψme,mepro)。在本发明的其它实施例中,受保护的片段十肽ac-pen(r)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(ψme,mepro)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是由四肽r2-pen(r)-n(me)arg(pbf)-ser(tbu)-oh和六肽h-asp(otbu)-thr(ψme,mepro)-leu-pen(r)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:85)(r=acm、trt或ψme,mepro;r2=乙酰基、fmoc或cbz)制备。在本发明的某些实施例中,可以通过各种片段方法合成化合物b的肽、表2、pct申请pct/us2013/064439;pct/us2014/032391;pct/us2014/032392;pct/us2015/053558;pct/us2015/053603和美国专利号9,518,091b2中所公开的那些和本文公开的其它肽,包括但不限于式(i)-(iii)的那些,及其药学上可接受的盐、溶剂合物和水合物。具体来说,化合物b可以通过各种片段方法合成,如流程vii、viii、ix和x中所示。通过6+4片段合成(流程vii和viii-a)在一个实施例中,十肽可以通过n端六肽的逐步合成和c端四肽的逐步合成,然后最终偶联这两个片段得到十肽单体来合成。在六肽与c端四肽偶联之前,或在与c端四肽偶联之后,n端可被酰化。在其它实施例中,n端肽可在偶联至肽链之前被酰化。在本发明的一个特定实施例中,n端六肽ac-pen(acm)-nmearg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)(ac-p6-oh)与c端四肽h-pen(acm)-phe(4-tbu)-β-hglu(otbu)-(d)-lys(boc)-nh2(seqidno:4)(h-p4-nh2)偶联,得到化合物b的十肽(ac-p10-nh2)。在本发明的一个具体实施例中,n端六肽fmoc-pen(acm)-nmearg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)(fmoc-p6-oh)与c端四肽h-pen(acm)-phe(4-tbu)-β-hglu(otbu)-(d)-lys(boc)-nh2(seqidno:4)(h-p4-nh2)偶联,得到十肽fmoc-p10-nh2,其可脱保护并酰化,得到化合物b(ac-p10-nh2)。在本发明的另一个实施例中,n端六肽ac-pen(trt)-nmearg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)(ac-p6-oh)与c端四肽h-pen(trt)-phe(4-tbu)-β-hglu(otbu)-(d)-lys(boc)-nh2(seqidno:4)(h-p4-nh2)偶联,得到化合物b的十肽(ac-p10-nh2)。在本发明的另一个实施例中,n端六肽fmoc-pen(trt)-nmearg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)(fmoc-p6-oh)与c端四肽h-pen(trt)-phe(4-tbu)-β-hglu(otbu)-(d)-lys(boc)-nh2(seqidno:4)(h-p4-nh2)偶联,得到十肽fmoc-p10-nh2,其可脱保护并酰化,得到化合物b(ac-p10-nh2)。通过2+(4+4)片段合成(流程viii-b)在另一个实施例中,十肽可以通过合成三种中间物,即n端二肽、中间四肽片段以及c端四肽片段来合成。然后可以偶联中间四肽片段和c端四肽片段,得到c端8聚体肽。所得8聚体肽可以与n端二聚体肽偶联,产生十肽单体。在二肽与c端8聚体肽偶联之前,或在与c端8聚体肽偶联之后,n端可被酰化。在其它实施例中,n端肽可在偶联至肽链之前被酰化。在本发明的另一个实施例中,中间四肽片段cbz-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77)(cbz-p4-ome或z-p4-ome)和c端四肽片段h-pen(acm)-phe(4-tbu)-β-hglu(otbu)-(d)-lys(boc)-nh2(seqidno:3)(n-p4-nh2)可以偶联以提供c端8聚体肽,其然后可以与n端二聚体肽fmoc-pen(acm)-nmearg(pbf)-oh(fmoc-p2-oh)偶联,得到十肽。然后可以将这种所得十肽的n端酰化,得到化合物b的十肽(ac-p10-nh2)。在本发明的其它实施例中,c端8聚体肽可以与n端二聚体肽ac-pen(acm)-nmearg(pbf)-oh(fmoc-p2-oh)偶联,得到化合物b的十肽(ac-p10-nh2)。在本发明的另一个实施例中,中间四肽片段cbz-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77)(cbz-p4-ome或z-p4-ome)和c端四肽片段h-pen(trt)-phe(4-tbu)-β-hglu(otbu)-(d)-lys(boc)-nh2(seqidno:4)(n-p4-nh2)可以偶联,得到c端8聚体肽,其然后可以与n端二聚体肽fmoc-pen(trt)-nmearg(pbf)-oh(fmoc-p2-oh)偶联,得到十肽。然后可以将这种所得十肽的n端酰化,得到化合物b的十肽(ac-p10-nh2)。在本发明的其它实施例中,c端8聚体肽可以与n端二聚体肽ac-pen(trt)-nmearg(pbf)-oh(fmoc-p2-oh)偶联,得到化合物b的十肽(ac-p10-nh2)。通过(2+4)+4片段合成(流程viii-c)在另一个实施例中,十肽可以通过上文所论述的三种中间物来合成:n端二肽、中间四肽片段以及c端四肽片段。首先,偶联n端二肽和中间四肽以提供n端六肽。然后所得n端六肽与c端四肽偶联以提供所得十肽。在二肽与中间四肽偶联之前,与中间四肽偶联之后以及与c端四肽偶联之前,或在与c端四肽偶联之后,n端可被酰化。在其它实施例中,n端肽可在偶联至肽链之前被酰化。在本发明的另一个实施例中,n端二聚体肽fmoc-pen(acm)-nmearg(pbf)-oh(fmoc-p2-oh)与中间四肽片段-h-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77)(h-p4-ome)偶联以提供n端六肽,其然后与c端四肽片段h-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-(d)-lys(boc)-nh2(seqidno:3)(n-p4-nh2)偶联,得到十肽。然后可以将这种所得十肽的n端酰化,得到化合物b的十肽(ac-p10-nh2)。在本发明的其它实施例中,n端二聚体ac-pen(acm)-nmearg(pbf)-oh(ac-p2-oh)与中间四肽片段h-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(h-p4-ome)偶联以提供n端六肽,其然后与c端四肽片段h-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-(d)-lys(boc)-nh2(h-p4-nh2)偶联,得到化合物b的十肽(ac-p10-nh2)。在本发明的另一个实施例中,n端二聚体肽fmoc-pen(trt)-nmearg(pbf)-oh(fmoc-p2-oh)与中间四肽片段-h-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77)(h-p4-ome)偶联以提供n端六肽,其然后与c端四肽片段h-pen(trt)-phe(4-tbu)-β-hglu(otbu)-(d)-lys(boc)-nh2(seqidno:4)(n-p4-nh2)偶联,得到十肽。然后可以将这种所得十肽的n端酰化,得到化合物b的十肽(ac-p10-nh2)。在本发明的其它实施例中,n端二聚体ac-pen(trt)-nmearg(pbf)-oh(ac-p2-oh)与中间四肽片段-h-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77)(h-p4-ome)偶联以提供n端六肽,其然后与c端四肽片段h-pen(trt)-phe(4-tbu)-β-homoglu(otbu)-(d)-lys(boc)-nh2(seqidno:4)(h-p4-nh2)偶联,得到化合物b的十肽(ac-p10-nh2)。二、四和六肽片段的合成:流程ix流程ix说明了本发明的另一个实施例,其中十肽(例如化合物b)可以通过溶液相肽合成来合成,其中受保护的五肽(h-p5-nh2)和受保护的四肽(h-p5-oh)是通过溶液相肽合成来合成并在溶液中缩合以提供九肽(h-p9-nh2),然后将其与受保护的氨基酸(r-p1-oh)偶联以提供十肽(r-p10-oh),随后将其脱保护和纯化。实例实例1:具有pen(acm)的化合物a的固相合成肽序列组装如下通过标准固相肽合成技术使用表5中所述的起始物质组装单体肽序列ac-pen-n(me)arg-ser-asp-thr-leu-pen-phe(4-tbu)-β-homoglu-d-lys-nh2(seqidno:25)。在三环酰胺接头树脂(dl形式,200-400目,0.6mmol/g负载,18.0mmol规模)上进行固相合成。将大约2当量的fmoc保护的氨基酸与3.0eqoxyma((羟亚胺基)氰基乙酸乙酯)和2.6eqdic(含n,n′-二异丙基碳化二亚胺的dmf)组合,在搅拌20分钟后,将活化的氨基酸加入树脂中。在20分钟后,再将1.4eqdic加入反应器中的偶联溶液中,并进行偶联反应大约1.3小时至2.0小时。通过从反应器中取出树脂样品,在具有dmf和ipa的微过滤注射器中多次洗涤,并对特定氨基酸进行适当的比色测试来监测偶联反应。使用20/80哌啶/dmf溶液进行fmoc脱保护。pen(acm)如下偶联:在50∶50dcm∶dmf中使2.0eq氨基酸、2.2eqoxyma和2.0eqdic反应20分钟,之后将活化的氨基酸转移至反应器并允许在室温下反应约48小时。通过氯醌测试监测反应。pen(trt)如下偶联:在50∶50dcm∶dmf中使2.0eq氨基酸、2.2eqoxyma和2.0eqdic反应20分钟,之后将活化的氨基酸转移至反应器并允许在室温下反应约72小时。通过氯醌测试监测反应。在最终的pen(acm)偶联(偶联#10)后,进行fmoc脱保护,并用乙酸酐封端pen(acm)的n端。用dmf和异丙醇(ipa)洗涤所得完全保护的树脂,并在真空下干燥。在最终的pen(trt)偶联(偶联#10)后,进行fmoc脱保护,并用乙酸酐封端pen(trt)的n端。用dmf和异丙醇(ipa)洗涤所得完全保护的树脂,并在真空下干燥。表5:用于肽合成的起始物质单体的裂解和分离为了从树脂上裂解单体肽并去除肽上的侧链保护基团,用含有tfa∶水∶edt∶tips(87.5v∶3.5v∶8v∶1v)的裂解溶液处理受保护的肽树脂。将裂解溶液在冰浴中冷却并在使用前解冻至室温。将裂解反应混合物在室温下搅拌约2小时。滤出废树脂并用90∶10的tfa∶水混合物洗涤。然后将合并的滤液和洗涤液沉淀到冷乙醚中并离心以收集肽。倾析乙醚,用冷乙醚洗涤固体沉淀物三次。将未纯化的线性单体在真空下干燥至恒重。这种肽树脂的tfa裂解产生具有acm保护的pen残基的肽。通过rp-hplc方法20-40-20min(phenomenexaerispeptide3.6μxb-c18150x4.6mm柱),mpa:0.1%tfa水溶液和mpb:含0.1%tfa的acn)分析未纯化的单体。进行lc/ms以验证线性单体的预期分子量,并且观察到的主要产物的mw为1524.5±2da。图1中示出未纯化的线性单体的hplc色谱图。二硫键形成pen(acm)将未纯化的线性单体溶解(3.0克规模)在50∶50acn∶水中,然后以2至3mg/ml的浓度稀释于20∶80acn∶水。在用磁性搅拌器搅拌时,添加i2/meoh溶液,直到溶液变成深黄色。当黄色变淡时,再添加i2/meoh溶液,直到反应混合物保持深黄色至琥珀色。使用lcms和hplc监测反应。当反应完成(未环化单体≤5%(面积%),约30至45分钟)时,用抗坏血酸淬灭反应物,直到获得无色溶液。将反应混合物用水稀释(最终溶液~10∶90acn∶水)且如下所述进行纯化。二硫键形成pen(trt)将未纯化的线性单体溶解(3.0克规模)在50∶50acn∶水中,然后以2至3mg/ml的浓度稀释于20∶80acn∶水。在用磁性搅拌器搅拌时,添加i2/meoh溶液,直到溶液变成淡黄色。当黄色变淡时,再添加i2/meoh溶液,直到反应混合物保持黄色至琥珀色。使用lcms和hplc监测反应。当反应完成(未环化单体≤5%(面积%),约30至45分钟)时,用抗坏血酸淬灭反应物,直到获得无色溶液。将反应混合物用水稀释(最终溶液~10∶90acn∶水)且如下所述进行纯化。通过rp-hplc方法20-40-20min(phenomenexluna3.0μxb-c18150x4.6mm柱),mpa:0.1%tfa水溶液和mpb:含0.1%tfa的acn)分析未纯化的环化单体。进行lc/ms以验证线性单体的预期分子量,并且观察到的主要产物的mw为1381.2±2da。图2中示出未纯化的环化单体的hplc色谱图。并且图3中示出粗制未环化和环化的未纯化单体的叠加hplc。环化单体(化合物b)的纯化环化单体(化合物b)在制备型rp-hplc系统上使用以下条件纯化:缓冲液a:0.1%tfa水溶液和缓冲液b:含0.1%tfa的acn,phenomenexluna10μc18250x50mm柱,流速为80ml/min。每次运行使用23∶35∶60min梯度(23%b至35%b,60min)纯化约3.0g环化单体。收集级分(每次纯化约25个级分,每个级分~40ml),并通过分析型hplc方法20-40-20min分析并冻干。将纯度≥90%的级分合并用于二聚化,将纯度在65和90面积%之间的级分合并用于再循环,并丢弃纯度<65面积%的级分。通过rp-hplc方法20-40-20min(phenomenexluna3.0μxb-c18150x4.6mm柱),mpa:0.1%tfa水溶液和mpb:含0.1%tfa的acn)分析经纯化的单体。进行lc/ms以验证线性单体的预期分子量,并且观察到的主要产物的mw为1381.8±2da。图4中示出经纯化的线性单体的hplc色谱图。接头活化二乙醇酸-二-n-羟基琥珀酰亚胺酯(dig-osu2)是通过在0.1m的浓度下使dig(二乙醇酸)(1.0eq)与ho-su(n-羟基琥珀酰亚胺)(2.2eq)和dcc(n,n′-二环己基碳化二亚胺)(2.2eq)在nmp中反应12小时来制备。在12小时反应后,过滤去除沉淀的二环己基脲,用dig-osu2溶液(0.1m)进行二聚化。单体二聚化通过将~2g单体与0.1mdig接头溶液(0.45eq)和diea在dmf溶液(5.0当量)中偶联,将环化的纯单体转化为相应的二聚体。二聚化反应在环境条件下耗时约15至30分钟。使用lcms和hplc监测反应。当反应完成(单体≤5%(面积%))时,通过加入乙酸淬灭反应物,用水稀释并如下所述进行纯化。通过分析型hplc方法2-50-20min(phenomenexluna5μc18150x4.6mm,5微米100a柱),mpa:0.1%tfa水溶液和mpb:含0.1%tfa的acn)分析粗制二聚体(化合物a)。使用lc/ms验证二聚体的预期分子量,并且观察到的mw为2859.3±2da。图5中示出粗制二聚体的hplc色谱图。化合物a的纯化和化合物a乙酸盐的制备粗制二聚体在制备型rp-hplc系统上使用以下条件纯化:缓冲液a:0.1%tfa水溶液和缓冲液b:含0.1%tfa的acn,phenomenexluna10μc18250x50mm柱,流速为80ml/min。每次运行使用33∶40∶60min梯度(33%b至40%b,60min)纯化约2.0g二聚体。收集级分(每次纯化约15个级分,每个级分~20ml),并通过分析型hplc方法2-50-20min分析。将纯度≥95.0面积%的级分合并作为最终产物并转移至盐交换步骤(1.6节),将在70与94面积%之间的级分合并用于再循环,弃去纯度<60面积%的级分。将上述化合物a的合并的纯化溶液用水(1∶1)稀释,并使用以下条件加载到制备型rp-hplc系统中:缓冲液a:0.2%acoh的水溶液和缓冲液b:含0.2%acoh的acn,phenomenexluna10μc18250x50mm柱,流速80ml/min。每次运行加载约2.0g二聚体,在加载后,通过使0.1m乙酸铵溶液流经色谱柱来进行盐交换步骤,并用含0.2%acoh的acn洗脱物质。收集交换的级分并通过分析型hplc方法2-50-20min进行分析。将纯度≥95.0面积%的级分合并作为最终产物,将纯度<95面积%的级分再次纯化。使用仅乙酸盐冻干机冻干级分。通过rp-hplc方法22-42-50min(phenomenexaerispeptide3.6μxb-c18150x4.6mm柱),mpa:0.1%tfa水溶液和mpb:含0.1%tfa的acn)分析最终经纯化的二聚体。进行lc/ms以验证经纯化的二聚体的预期分子量,并且观察到的主要产物的mw为2859.3±2da。图6中示出纯二聚体的hplc色谱图。实例2:具有fmoc-pen(trt)-oh和fmoc-l-asptbu)-thr(ψme,mepro)-oh的化合物b的固相合成肽序列组装如下通过标准固相肽合成技术使用表6中所述的起始物质组装单体肽序列ac-pen-n(me)arg-ser-asp-thr-leu-pen-phe(4-tbu)-β-homoglu-d-lys-nh2(seqidno:25)。在三环酰胺接头树脂(dl形式,200-400目,0.6mmol/g负载,18.0mmol规模)上进行固相合成。将大约2当量的fmoc保护的氨基酸与3.0eqoxyma((羟亚胺基)氰基乙酸乙酯)和2.6eqdic(含n,n′-二异丙基碳化二亚胺的dmf)组合,在搅拌20分钟后,将活化的氨基酸加入树脂中。在20分钟后,再将1.4eqdic加入反应器中的偶联溶液中,并进行偶联反应大约1.3小时至2.0小时。通过从反应器中取出树脂样品,在具有dmf和ipa的微过滤注射器中多次洗涤,并对特定氨基酸进行适当的比色测试来监测偶联反应。使用20/80哌啶/dmf溶液进行fmoc脱保护。fmoc-asp(otbu)-thr(ψme,mepro)-oh二肽用于在上述条件下偶联asp-thr。pen(trt)如下偶联:在50∶50dcm∶dmf中使2.0eq氨基酸、2.2eqoxyma和2.0eqdic反应20分钟,之后将活化的氨基酸转移至反应器并允许在室温下反应约72小时。通过氯醌测试监测反应。在最终的pen(trt)偶联(偶联#9)后,进行fmoc脱保护,并用乙酸酐封端pen(trt)的n端。用dmf和异丙醇(ipa)洗涤所得完全保护的树脂,并在真空下干燥。表6:用于肽合成的起始物质单体的裂解和分离为了从树脂上裂解单体肽并去除肽上的侧链保护基团,用含有tfa∶水∶dodt∶tips(90v∶5v∶2.5v∶2.5v)的裂解溶液处理受保护的肽树脂。在使用前,将裂解溶液在冰浴中冷却并解冻至室温。将裂解反应混合物在室温下搅拌1.5小时。滤出废树脂并用90∶10的tfa∶水混合物洗涤。然后将合并的滤液和洗涤液沉淀到冷乙醚中并离心以收集肽。倾析乙醚,用冷乙醚洗涤固体沉淀物两次。将未纯化的线性单体在真空下干燥至恒重。通过rp-hplc方法20-40-20min(phenomenexaerispeptide3.6μxb-c18150x4.6mm柱),mpa:0.1%tfa水溶液和mpb:含0.1%tfa的acn)分析未纯化的单体。进行lc/ms以验证线性单体的预期分子量,并且观察到的主要产物的mw为1383.2±2da。图7中示出未纯化的线性单体的hplc色谱图。二硫键形成pen(trt)将未纯化的线性单体溶解于50∶50acn∶水中,然后稀释于2∶18∶80acoh∶acn∶水中至浓度为3至5mg/ml。在用磁性搅拌器搅拌时,添加i2/meoh溶液,直到溶液变成淡黄色至黄色。当黄色变淡时,再添加i2/meoh溶液,直到反应混合物保持黄色。使用lcms和hplc监测反应。当反应完成(未环化单体≤5%(面积%),约10至20分钟)时,用抗坏血酸淬灭反应物,直到获得无色溶液。将反应混合物用水稀释(最终溶液~10∶90acn∶水)且如下所述进行纯化。通过rp-hplc梯度方法20-40%acn20min运行时间(phenomenexaerispeptide3.6μxb-c18150x4.6mm柱),mpa:0.1%tfa水溶液和mpb:含0.1%tfa的acn)分析未纯化的环化单体。进行lc/ms以验证线性单体的预期分子量,并且观察到的主要产物的mw为1381.2±2da。图8中示出未纯化的环化单体的hplc色谱图。环化单体的纯化环化单体在制备型rp-hplc系统上使用以下条件纯化:缓冲液a:0.1%tfa水溶液和缓冲液b:含0.1%tfa的acn,phenomenexluna10μc18250x50mm柱,流速为80ml/min。每次运行使用25∶35;60min梯度(25%b至35%b,60min)纯化约1.0g环化单体。收集级分(每次纯化约15个级分,每个级分~20ml),并通过分析型hplc方法2-50;20min运行时间分析并冻干。将纯度>90%的级分合并用于二聚化,将纯度在60和89面积%的级分合并用于再循环,并丢弃纯度<60面积%的级分。通过rp-hplc梯度方法2-50%acn20min运行时间(phenomenexaerispeptide3.6μxb-c18150x4.6mm柱),mpa:0.1%tfa水溶液和mpb:含0.1%tfa的acn)分析经纯化的单体。进行lc/ms以验证线性单体的预期分子量,并且观察到的主要产物的mw为1381.8±2da。实例3:假脯氨酸青霉胺衍生物的合成(4r)-2,2,5,5-四甲基噻唑烷-4-甲酸(化合物c)的合成:在回流下加热25.0g(167mmol)l(-)-青霉胺于400ml丙酮中的悬浮液,直到所有固体已溶解(约24小时)。趁热过滤反应混合物并冷却至室温过夜。过夜形成少量晶体。使反应混合物保持在-20℃下过夜。通过抽吸过滤收集所得固体并用冷丙酮(100ml)洗涤。真空干燥噻唑产物,得到呈灰白色固体状的化合物c。(26.5g,83.5%)(参见n端l(-)-青霉胺肽作为醛螯合剂的制备(preparationofn-terminall(-)-penicillaminepeptidesasaldehydesequestrationagents):作者nagasawa,herbertt.,来自pct国际申请2001058928,2001年8月16日)(4r)-3-乙酰基2,2,5,5-四甲基-噻唑烷-4-甲酸(ac-pen(ψme,mepro)-oh,化合物d-1)的合成:将化合物c(7.56g,40mmol)和乙酰基n-羟基琥珀酰亚胺酯(7.85g,50mmol)溶解于乙腈(50ml)和碳酸氢盐水溶液(50ml)中。在室温下搅拌所得澄清溶液过夜。在真空下去除有机挥发物。将粗产物溶解于水(50ml)中。用甲基叔丁基醚(2×50ml)洗涤有机相。水相用1nhcl溶液酸化,直到ph为~3。将产物萃取到乙酸乙酯(2×100ml)中,干燥合并的有机层,过滤且蒸发,得到呈白色固体状的标题化合物(ac-pen(ψme,mepro)-oh,化合物d-1)(4.30g,50%)。(参见cook,a.h.和i.m.heilbron.“到1943年12月的n-戊基青霉素的化学(thechemistryofn-amylpenicillinuptodecember1943)”.青霉素化学(chemistryofpenicillin).编辑hanst.clarke,johnr.johnson和robertrobinson.普林斯顿大学出版社(princetonuniversitypress),1949.38-51。制备(4r)-3-(9h-芴-9-基甲氧基羰基)-2,2,5,5-四甲基-噻唑烷-4-甲酸(fmoc-pen(ψme,mepro)-oh,化合物e-1)将化合物c(1.89g,10mmol)和fmoc-cl(3.09g,12mmol)溶解于二氯甲烷(50ml)中。将反应混合物冷却到0℃,然后经10分钟的时间缓慢添加dipea于二氯甲烷中的溶液(2ml)。将所得澄清溶液在室温下搅拌18小时。将反应混合物用水(10ml)淬灭并且使用1nhcl酸化,直到水溶液ph为~2。分离有机相,干燥,过滤且蒸发,得到呈粘性固体状的化合物e-1(fmoc-pen(ψme,mepro)-oh)(2.6g,64.5%)。制备(4r)-5,5-二甲基噻唑烷-4-甲酸(化合物h):如关于化合物c所述,用多聚甲醛代替丙酮来制备化合物h。制备(4r)-3-乙酰基-5,5-二甲基-噻唑烷-4-甲酸(ac-pen(pro)-oh,化合物i)如上关于化合物d所述,以化合物h为起始物质来制备化合物i-1。含有青霉胺的肽的合成表7:用于肽合成的起始物质ac-pen(ψme,mepro)-n-me-arg(pbf)-ser(t-bu)-asp(otbu)-thr(tbu)-leu(-oh)(seqidno:3)的合成cbz-thr(tbu)-leu-ome在0℃下,经10分钟向cbz-thr(tbu)-oh(0.05mol)和nhs(0.075mol)于dcm(250ml)中的悬浮液中添加edc.hcl(0.1mol),且搅拌混合物2小时。然后在0℃下添加h-leu(ome)于dcm中的溶液,并将所得混合物在室温下搅拌18小时。用水(100ml)稀释反应混合物并用1nhcl(100ml)、饱和nahco3(100ml)和盐水(100ml)洗涤有机相。将其干燥并且浓缩,产生15g呈粘性油状的标题化合物。h-thr(tbu)-leu-ome向cbz-thr(tbu)-leu-ome(15g)的溶液中添加pd/c(5%)。将混合物在氢气气氛(气球)下搅拌18小时。将混合物通过硅藻土垫过滤并浓缩,产生6.2g(定量)呈粘性油状的标题化合物cbz-asp(otbu)-thr(tbu)-leu-ome在0℃下,向cbz-asp(otbu)-oh(1.2当量)和nhs(1.5当量)于dcm(50ml)中的悬浮液中添加edc.hcl(2.0当量),并搅拌澄清溶液2小时。然后添加h-thr(tbu)-leu-ome(6.2g)于dcm(50ml)中的溶液。然后将混合物在室温下搅拌18小时。用水(100ml)稀释反应混合物并分离出有机层。用1nhcl(100ml)、饱和nahco3(100ml)、盐水(100ml)洗涤有机层,干燥并浓缩,产生呈粘性油状的标题化合物。使用己烷/etoac(1∶1)通过快速色谱法纯化粗产物。纯化合物的产量为10g(80.25%)。h-asp(otbu)-thr(tbu)-leu-ome向cbz-asp(otbu)-thr(tbu)-leu-ome(9.10g)于甲醇(80ml)中的溶液中添加pd/c。将混合物在氢气气氛(气球)下搅拌24小时。然后将其通过硅藻土垫过滤并浓缩,产生4.7g(66.29%)呈粘性油状的标题化合物。cbz-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77)在0℃下,向cbz-ser(tbu)-oh(1.2当量)和nhs(1.5当量)于dcm(50ml)中的溶液中添加edc.hcl(2.0当量),并在0℃下搅拌混合物2小时。然后添加h-asp(otbu)-thr(tbu)-leu-ome(4.7g)于dcm(50ml)中的溶液,并将混合物在室温下搅拌18小时。用水(100ml)稀释混合物并分离有机相。用1nhcl(100ml)、饱和nahco3(100ml)、盐水(100ml)洗涤有机相,干燥并浓缩,产生2.8g(37.33%)呈粘性油状的标题化合物。h-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77)向cbz-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77)(2.8g)于甲醇(50ml)中的溶液中添加pd/c,并将混合物在氢气气氛(气球)下搅拌24小时。然后将其通过硅藻土垫过滤并浓缩,产生2.0g(87.33%)呈粘性油状的标题化合物。cbz-n-me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)在0℃下,向cbz-n-me-arg(pbf)-oh(2.0g)和nhs(1.5当量)于dcm(25ml)中的混合物中添加edc.hcl,并在0℃下搅拌混合物2小时。然后添加h-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(2.0g)于dcm(25ml)中的溶液,并将混合物在室温下搅拌16小时。用水(100ml)稀释混合物,并分离dcm层。用1nhcl、饱和nahco3、盐水洗涤dcm-萃取物,干燥并浓缩,产生1.2g(34.28%)呈粘性固体状的标题化合物。h-n-me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)向cbz-n-me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(1.2g)于甲醇中的溶液中添加pd/c。将混合物在氢气气氛(气球)下搅拌24小时。将混合物通过硅藻土垫过滤并浓缩,产生1.0g(94%)呈粘性油状的标题化合物。ac-pen(ψme,mepro)-n-me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:3)在0℃下,向ac-pen(ψme,mepro)-oh(250mg)和nhs(1.5当量)于dcm中的混合物中添加edc.hcl(2.0当量),并将混合物在室温下搅拌2小时。然后添加h-n-me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(1.0g)于dcm中的溶液,并将混合物在室温下搅拌24小时。用水稀释反应混合物并分离dcm层。用1nhcl、饱和nahco3、盐水洗涤dcm萃取物,干燥并浓缩,产生800mg(66.6%)呈粘性固体状的标题化合物。h-pen(ψme,mepro)-phe(4-t-bu)-β-homoglu(o-t-bu)-(d)-lys(boc)-nh2(seqidno:4)的合成cbz-(d)-lys(boc)-nh2在0℃下,向cbz-(d)-lys(boc)-oh(10.0g,26.288mmol)于无水ch2cl2(70ml)中的澄清溶液中添加nhs(4.54g,39.447mmol,1.5eq),随后添加edc.hcl(10.0g,52.164mmol,2.0eq)。搅拌混合物,同时温热至室温,然后在室温下搅拌2小时。然后再将混合物冷却至0℃,并经10分钟逐滴添加浓nh4oh(9.0ml,4.8eq)。将所得浆液在室温下搅拌过夜。当产生澄清两相混合物时,用ch2cl2/h2o(200ml/30ml)稀释反应混合物。将其转移到分液漏斗中,并收集dcm层。然后用dcm(2×40ml)再萃取水层。用盐水洗涤合并的dcm-萃取物,干燥(mgso4)并浓缩,产生呈无色固体状的标题化合物。h-(d)-lys(boc)-nh2向cbz-(d)-lys(boc)-nh2于甲醇中的澄清溶液中添加20%pd(oh)2/c(5重量%)。然后将反应容器抽空/用氢气冲洗并在氢气气氛(气球)下搅拌过夜。将反应混合物通过硅藻土垫过滤并浓缩至干,产生呈无色粘性固体状的标题化合物。cbz-β-homoglu(o-t-bu)-(d)-lys(boc)-nh2在室温下,向cbz-glu(o-t-bu)-oh(500mg,1.481mmol)于无水dmf(10ml)中的澄清溶液中添加nhs(215mg,1.868mmol,1.30eq),随后添加edc.hcl(405mg,2.107mmol,1.50eq)。将澄清无色溶液在室温下搅拌1.0小时。然后添加h-(d)-lys(boc)-nh2(345mg,1.408mmol,1.0eq),并将澄清无色反应混合物在室温下搅拌过夜。然后将澄清无色反应混合物用水(80ml,8体积)稀释,此时沉淀出呈无色固体的标题化合物。通过抽吸过滤收集产物,用更多水(3×10ml)冲洗并风干。无色固体的重量,0.620g(78%)。h-β-homoglu(o-t-bu)-(d)-lys(boc)-nh2向cbz-β-homoglu(o-t-bu)-(d)-lys(boc)-nh2(600mg)于甲醇(20ml)中的澄清溶液中添加20%pd(oh)2/c(100mg)。将反应容器抽空/用氢气冲洗,然后在氢气气氛(气球)下搅拌过夜。然后将混合物通过硅藻土垫过滤并浓缩,产生呈粘性胶状的标题化合物。产率,定量。cbz-phe(4-t-bu)-β-homoglu(o-t-bu)-(d)-lys(boc)-nh2向cbz-phe(4-t-bu)-oh(390mg,1.097mmol)和nhs(148mg,1.286mmol,1.3eq)于无水ch2cl2(8.0ml)中的浆液中添加edc.hcl(247mg,1.288mmol,1.3eq),并将混合物在室温下搅拌3小时。然后添加h-β-homoglu(o-t-bu)-(d)-lys(boc)-nh2(425mg,0.990mmol)于ch2cl2(10ml)中的澄清溶液,并将混合物在室温下搅拌过夜。然后将混合物用dcm/饱和nahco3(20ml/10ml)稀释,分离各层。将dcm萃取物用0.5mkhso4、盐水洗涤,干燥(mgso4)并浓缩,产生呈无色粘性固体状的标题化合物。h-phe(4-t-bu)-β-homoglu(o-t-bu)-(d)-lys(boc)-nh2向cbz-phe(4-t-bu)-β-homoglu(o-t-bu)-(d)-lys(boc)-nh2于甲醇中的溶液中添加20%pd(oh)2/c。然后将反应容器抽空/用氢气冲洗,并将混合物在氢气气氛(气球)下搅拌过夜。然后将其通过硅藻土垫过滤并浓缩,产生呈粘性固体状的标题化合物。产率,定量。h-pen(ψme,mepro)-phe(4-t-bu)-β-homoglu(o-t-bu)-(d)-lys(boc)-nh2(seqidno:4)在0℃下,向cbz-pen(ψme,mepro)-oh(250mg)和nhs(1.5当量)于dcm中的混合物中添加edc.hcl(2.0当量),并将混合物在室温下搅拌2小时。然后添加h-phe(4-t-bu)-β-homoglu(o-t-bu)-(d)-lys(boc)-nh2(1.0g)于dcm中的溶液,并将混合物在室温下搅拌24小时。用水稀释反应混合物并分离dcm层。将dcm萃取物用1nhcl、饱和nahco3、盐水洗涤,干燥并浓缩,产生标题化合物。实例4:通过二肽、四肽和六肽片段合成化合物bc端4-aa片段的合成:h-pen(acm)-phe(4-tbu)-b-homoglu(otbu)-(d)-lys(boc)-nh2(seqidno:4)cbz-β-homoglu(otbu)-d-lys(boc)-nh2(z-p2-nh2)在0℃和n2下,向cbz-β-homoglu(otbu)-oh(50.25g,143mmol,1.0eq)和h-d-lys(boc)-nh2(45.605g,185.9mmol,1.3eq)于dmf(650ml)中的溶液中添加cl-hobt(24.253g,143mmol,1.0eq)。然后在-5℃下,添加hbtu(59.664g,157.3mmol,1.1eq)。馈入额外的dmf(200ml),同时将内部温度保持在-5℃以下。在hbtu溶解后,逐滴添加dipea以将反应物的ph调节至约6。在dipea添加期间,反应温度保持在-3℃或更低。用tlc监测反应进程。添加总共1.8当量的dipea。在最初添加dipea五小时后,将反应混合物倒入0.5nhcl(水溶液,10l,<10℃)中,收集所得固体并用0.5nhcl(水溶液,3×)、nahco3(饱和水溶液,3×)、h2o(3×)和正己烷(1×)洗涤。真空去除挥发物后,获得z-p2-nh2(79.1g,95.58%),hplc纯度为84.6%。h-β-homoglu(otbu)-d-lys(boc)-nh2(h-p2-nh2)向z-p2-nh2(5.523g,9.545mmol)于meoh(110ml)中的溶液中添加pd/c(1.064g,10重量%负载,用63.1重量%h2o湿润),在用n2冲洗后,施加h2(在气球中)。通过tlc跟踪反应进程。在1小时后,去除pd/c,并用meoh(4×)洗涤反应物。真空浓缩合并的滤液,得到h-p2-nh2(5.252g)。z-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(z-p3-nh2)在0℃和n2下,向h-p2-nh2(5.252g,9.545mmol,1.0eq)和z-phe(4-tbu)-oh(3.291g,9.259mmol,0.97eq)于dmf(70ml)中的溶液中添加cl-hobt(1.619g,9.545mmol,1.0eq)。然后在-5℃下,添加hbtu(3.982g,10.5mmol,1.1eq)。在hbtu溶解后,逐滴添加dipea以将反应物的ph调节至约6。在dipea添加期间,反应温度保持在-2℃或更低。用tlc监测反应进程。添加总共1.8eqdipea。在4.3小时后,将反应混合物用乙酸乙酯(300ml)和0.5nhcl(水溶液,70ml,<10℃)稀释。通过乙酸乙酯(100ml,2×)萃取水层。将合并的乙酸乙酯层用0.5nhcl(水溶液,4×)、h2o(1×)、nahco3(饱和水溶液,3×)、h2o(2×)和盐水(1×)洗涤。在na2so4(无水)上干燥并真空去除挥发物后,获得z-p3-nh2(7.08g,97.58%),hplc纯度为87.5%。h-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(h-p3-nh2)向z-p3-nh2(7.062g)于meoh(140ml)中的溶液中添加pd/c(1.064g,10重量%负载,用63.1重量%h2o湿润),在用n2冲洗后,施加h2(在气球中)。通过tlc跟踪反应进程。在1小时后,去除pd/c,并用meoh(4×)洗涤反应物。真空浓缩合并的滤液,得到h-p3-nh2(5.784g,98.8%),hplc纯度为89.0%。fmoc-pen(acm)-phe(4-tbu)-β-hglu(otbu)-d-lys(boc)-nh2(seqidno:4)(fmoc-p4-nh2)在0℃和n2下,向h-p3-nh2(5.766g,8.9mmol,1.0eq)和fmoc-pen(acm)-oh(3.82g,8.633mmol,0.97eq)于dmf(72ml)中的溶液中添加cl-hobt(1.509g,8.9mmol,1.0eq)。然后在-5℃下,添加hbtu(3.713g,9.79mmol,1.1eq)。在hbtu溶解后,逐滴添加dipea以将反应物的ph调节至约6。在dipea添加期间,反应温度保持在-2℃或更低。通过tlc跟踪反应进程。添加总共1.9eqdipea。在3小时后,将反应混合物用乙酸乙酯(350ml)和0.5nhcl(水溶液,100ml,<10℃)稀释。用乙酸乙酯(100ml,2×)萃取水层。将合并的乙酸乙酯层用0.5nhcl(水溶液,4×)、h2o(1×)、nahco3(饱和水溶液,3×)、h2o(2×)和盐水(1×)洗涤。在经na2so4(无水)干燥并真空去除挥发物后,获得fmoc-p4-nh2(8.39g,90.6%),hplc纯度为95.2%。h-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)(h-p4-nh2)向fmoc-p4-nh2(7.96g,7.417mmol,1.0eq)于dmf(40ml)中的溶液中添加哌啶(3.665ml,37.1mmol,5eq)。通过tlc跟踪反应进程。在0.5小时后,使用石油醚洗涤反应混合物。将所得下层(dmf溶液)缓慢倒入0.5nhcl(水溶液,400ml,<10℃)中,并搅拌10分钟。收集固体并用0.5nhcl(水溶液,3×)、h2o(2×)、nahco3(饱和水溶液)/h2o(1/2体积,3×)的混合物和h2o(3×)洗涤。在去除挥发物后,获得h-p4-nh2(3.564g),hplc纯度为93.3%。向上述固体中添加乙酸乙酯(30ml)并搅拌10分钟。收集固体(固体a),并将滤液浓缩至15ml体积。将浓乙酸乙酯溶液缓慢倒入石油醚(150ml)中,并搅拌10分钟。收集所得固体(固体b)。将固体a和固体b合并,真空干燥,得到h-p4-nh2(3.504g,55.5%),hplc纯度为94.3%。通过4+2偶联合成n端6-aa片段:fmoc-pen(acm)-n(me)-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:3)fmoc-pen(acm)-n-me-arg(pbf)-oh:在n2下,向-15℃下fmoc-pen(acm)-oh(4mmol,1.0eq)和hoat(0.4mmol,0.1eq)于dmf(16ml,无水)中的溶液中添加hatu(4.2mmol,1.05eq)。dipea(4.4mmol,1.1eq)分数份添加。将反应混合物在-10-0℃下搅拌~1小时。(溶液a)使用tlc跟踪反应进程。在另一烧瓶中,在n2下,向h-n-me-arg(pbf)-oh(4.4mmol,1.1eq)于dmf(25ml,无水)中的溶液中添加bsa(14.52mmol,3.3eq)。将混合物温热至45℃并搅拌4-5小时。(溶液b)向冷却的溶液b(-15至-10℃)中添加溶液a,并将合并的混合物在0℃下搅拌19小时。通过hplc监测反应进程。使用冰冷却浴,将反应混合物用乙酸乙酯(50ml)和5%h3po4(水溶液,150ml)稀释,并搅拌~20分钟。将混合物用乙酸乙酯(100ml)再稀释一次。将有机层分离并用5%h3po4(水溶液,150ml,3×)、h2o(150ml,2×)和盐水(100ml,2×)洗涤。在干燥并去除挥发物后,获得3.485g固体产物,hplc纯度为62.5%。用制备型hplc纯化粗产物,得到纯度为97.7%的纯产物(52.37%)。fmoc-pen(acm)-n(me)-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:3):在-5℃下,向fmoc-pen(acm)-n-me-arg(pbf)-oh(3.55g,4.1mmol)、h-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(2.46g,3.9mmol)、hatu(1.56g,4.1mmol)、hoat(0.53g,3.9mmol)于thf(41ml)中的溶液中添加diea(1.26g,9.75mmol)。将混合物在此温度下搅拌5小时。hplc显示反应完全,并向混合物中馈入etoac(120ml),用5%h3po4(120ml×3)、10%na2co3(120ml×3)和盐水(120ml×2)洗涤。然后将所得有机层经mgso4干燥,浓缩,得到纯度为89.8%的粗产物(5.6g,94.6%)。通过5+1偶联合成n端6-aa片段:ac-pen(acm)-n(me)-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:3)(ac-p6-oh)cbz-thr(tbu)-leu-ome在0℃下,经10分钟向cbz-thr(tbu)-oh(13.60g,44.013mmol)和nhs(6.60g,57.391mmol,1.30eq)于dmf(90ml)中的澄清无色溶液中添加edc.hcl(11.30g,58.946mmol,1.34eq),并将混合物在室温下搅拌1小时。然后将澄清的反应混合物冷却至0℃,并添加呈固体状的h-leu(ome).hcl(8.80g,48.431mmol,1.10eq),随后逐滴添加diea(11.50ml,66mmol,1.50eq)。然后将混合物在室温下搅拌过夜。将反应混合物用水(100ml)稀释并用etoac(3×75ml)萃取。将合并的乙酸乙酯萃取物用1nhcl(100ml)、饱和nahco3(100ml)和盐水(100ml)洗涤。将其干燥(mgso4)并浓缩,产生呈粘性油/胶状的标题化合物(17.66g,92%)。h-thr(tbu)-leu-ome:向cbz-thr(tbu)-leu-ome(15.90g)于甲醇(200ml)中的溶液中添加20%pd(oh)2/c(3.0g)。将反应容器抽空/用氢气冲洗(3×),并将混合物在氢气气氛(气球)下搅拌过夜。将混合物通过硅藻土垫过滤并浓缩,产生呈粘性油状的标题化合物(10.47g,95%)。cbz-asp(otbu)-thr(tbu)-leu-ome:在0℃下,向cbz-asp(otbu)-oh.h2o(6.60g,19.337mmol)和nhs(3.34g,29.04mmol,1.50eq)于dmf(35ml)中的悬浮液中添加edc.hcl(9.26g,48.30mmol,2.5eq),并将混合物在室温下搅拌1小时。然后在0℃下,将此混合物添加至h-thr(tbu)-leu-ome(5.48g,18.145mmol)于dmf(30ml)中的悬浮液中。然后将混合物在室温下搅拌过夜。用水(100ml)稀释反应混合物并分离出呈胶/油状的标题化合物。将其用etoac(3×75ml)萃取。将合并的etoac萃取物用1nhcl(100ml)、饱和nahco3(100ml)、盐水(100ml)洗涤,干燥(mgso4)并浓缩,产生呈蓬松固体状的标题化合物(9.80g,89%)。h-asp(otbu)-thr(tbu)-leu-ome:向cbz-asp(otbu)-thr(tbu)-leu-ome(8.80g)于甲醇(200ml)中的溶液中添加20%pd(oh)2/c(1.50g)。将反应容器抽空/用氢气冲洗,并将混合物在氢气气氛(气球)下搅拌过夜。然后将其通过硅藻土垫过滤并浓缩,产生呈无色胶状的标题化合物(6.65g,97%)。cbz-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77):在0℃下,向cbz-ser(tbu)-oh(4.53g,15.34mmol)和nhs(2.47g,21.478mmol,1.40eq)于dmf(25ml)中的溶液中添加edc.hcl(5.90g,30.777mmol,2.0eq),并将混合物在室温下搅拌1小时。然后在0℃下,将此混合物经10分钟添加至h-asp(otbu)-thr(tbu)-leu-ome(6.60g,13.953mmol)于dmf(35ml)中的溶液中。将反应混合物在室温下搅拌过夜。用水(100ml)稀释混合物并分离出呈胶状的标题化合物。将其用etoac(3×75ml)萃取。将合并的etoac-萃取物用1nhcl(100ml)、饱和nahco3(100ml)、盐水(100ml)洗涤,干燥(mgso4)并浓缩,产生呈粘性油状的标题化合物(9.60g,92%)。h-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77):向cbz-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77)(9.50g)于甲醇(250ml)中的澄清溶液中添加20%pd(oh)2/c(1.50g)。将反应容器抽空/用氢气冲洗,并将混合物在氢气气氛(气球)下搅拌过夜。然后将其通过硅藻土垫过滤并浓缩,产生呈粘性油状的标题化合物(7.40g,95%)。cbz-n(me)-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5):在0℃下,向cbz-n-me-arg(pbf)-oh(4.40g,7.665mmol)和nhs(1.33g,11.565mmol,1.5eq)于dmf(15ml)中的混合物中添加edc.hcl(2.94g,15.336mmol,2.0eq),并将混合物在室温下搅拌1小时。然后在0℃下,向此混合物中添加h-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(4.90g,7.954mmol)于dmf(30ml)中的溶液。将反应混合物在室温下搅拌过夜。用水(100ml)稀释反应混合物并分离出呈胶状的标题化合物。将其用etoac(3×75ml)萃取。将合并的etoac-萃取物用饱和nahco3、盐水洗涤,干燥(mgso4)并浓缩,产生呈无色胶状的标题化合物(8.18g,91%)。h-(n)me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)(h-p5-ome)向cbz-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(5.60g,4.778mmol)于甲醇(75ml)中的澄清溶液中添加20%pd(oh)2/c(1.0g)。然后将反应容器抽空/用氢气冲洗,并将混合物在氢气气氛(气球)下搅拌过夜。然后将其通过硅藻土垫过滤并浓缩,产生呈胶状的标题化合物(4.70g,95%)。fmoc-pen(acm)-n(me)-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:3)(fmoc-p6-ome)在100mlrbf中,称取fmoc-pen(acm)-oh(639mg,1.443mmol,1.5eq)、h-p5-ome(1.0g,0.963mmol,1.0eq)和oxyma(220mg,1.548mmol,1.60eq)。然后添加dcm-dmf(1∶1)(5.0ml)。向所得澄清溶液中逐滴添加dic(195mg,1.545mmol,1.6eq)并在室温下搅拌混合物19小时。lc/ms显示约10%未反应的h-p5-ome。再添加dic(90mg,0.713mmol,0.5eq)。在24小时后,不再剩余起始物质(h-p5-ome)。然后通过在etoac和饱和nahco3之间分配来处理反应物。蒸发合并的etoac萃取物产生粗产物,将其通过快速色谱法使用2-5%meoh/etoac纯化,获得纯fmoc-p6-ome(1.183g,84%)。h-pen(acm)-n(me)-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:3)(h-p6-ome):向fmoc-p6-ome(769mg)于dmf(3.0ml)中的溶液中添加4-甲基哌啶(260mg,5.0eq),并将混合物在室温下搅拌1.0小时。用etoac萃取,随后浓缩产生粗产物,将其原样用于下一反应。ac-pen(acm)-n(me)-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:3)(ac-p6-ome)用dcm(10ml)稀释来自先前步骤的h-p6-ome。向澄清溶液中添加封端剂a(thf/ac2o/pyr,80/10/10)(1.0ml,1.06mmol),并将混合物在室温下搅拌1.0小时。然后将混合物浓缩至干并通过快速色谱法使用5-10%meoh/etoac纯化,产生纯化合物ac-p6-ome(614mg,91%)。ac-pen(acm)-n(me)-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)(ac-p6-oh)在15℃下,向ac-p6-ome(500mg,0.390mmol)于乙腈(5.0ml)中的澄清溶液中添加水(75微升)。添加libr(340mg,3.90mmol,10.0eq),随后添加dbu(178mg,1.169mmol,3.0eq)。然后将混合物在15℃下搅拌8.0小时。然后将其冷却至0℃,并用0.5mkhso4酸化至ph3。然后用etoac(3×)萃取反应混合物,用盐水洗涤合并的萃取物,经mgso4干燥并浓缩,获得呈无色固体状的粗产物ac-p6-oh(386mg,78%)。ac-pen(acm)-n(me)-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-(d)-lys(boc)-nh2(seqidno:25)(ac-p10-nh2)在0℃下,向含ac-p6-oh(300mg,0.236mmol)、h-p4-nh2(220mg,0.259mmol,1.1eq)和hoar(32mg,0.235mmol,1.0eq)的dmf(1.5ml)中添加hatu(135mg,0.355mmol,1.5eq),随后添加diea(31mg,0.239mmol,1.0eq)。在0℃下搅拌反应混合物。在4小时后,仍存在一些未反应的起始物质。再添加hatu、hoat和diea(各0.25eq.)并在室温下继续搅拌24小时。将反应混合物冷却至0℃,用水(15ml,10个体积)稀释,并沉淀呈无色固体状的标题化合物。将固体过滤,用水(75ml)冲洗并风干。将粗产物通过快速色谱法使用5-20%meoh/etoac纯化,产生呈无色固体状的标题化合物(422mg,85%)。cbz-n(me)-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)(z-p5-ome):在0℃下,向cbz-n-me-arg(pbf)-oh(4.40g,7.665mmol)和nhs(1.33g,11.565mmol,1.5eq)于dmf(15ml)中的混合物中添加edc.hcl(2.94g,15.336mmol,2.0eq),并将混合物在室温下搅拌1小时。然后在0℃下,将此混合物添加至h-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(4.90g,7.954mmol)于dmf(30ml)中的溶液中。将反应混合物在室温下搅拌过夜。用水(100ml)稀释反应混合物并分离出呈胶状的标题化合物。将其用etoac(3×75ml)萃取。将合并的etoac-萃取物用饱和nahco3、盐水洗涤,干燥(mgso4)并浓缩,产生呈无色胶状的标题化合物(8.18g,91%)。h-n-me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:5)(h-p5-oh)在0℃下,向h-n-me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)(58.43g,56.2mmol)、libr(48.78g,562mmol,10eq)、h2o(15.2g,843mmol)于acn(480ml)中的溶液中添加dbu(25.65g,168.6mmol,3eq)。再搅拌混合物45小时。将浆液用5%h3po4(200ml)酸化以调节ph至6,然后添加水(850ml)沉淀大部分产物。将浆液搅拌2小时,过滤并用acn/h2o(1/3,v/v,120ml)和水(120ml×2)洗涤。在真空下干燥固体,得到h-p5-oh(50.55g),产率为87.7%,hplc纯度为96.3%。h-n-me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:87)(h-p9-nh2)在-15℃~-5℃(内部)下,向h-n-me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:5)(20g,19.5mmol)和h-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(20g,23.5mmol)和hobt(2.64g,19.5mmol)于dmf/dmso(320ml/40ml)中的溶液中添加hbtu(8.13g,21.4mmol)和diea(6.32g,48.9mmol)。将混合物保持20小时。向混合物中添加5%nahco3(水溶液)(1.2l)以沉淀白色固体,将其收集,用水洗涤并在真空下干燥,得到hplc纯度为90%的37.06g产物。fmoc-pen(acm)-n-me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)(fmoc-p10-nh2)在0℃下,向h-p9-nh2(45g,24.23mmol,1.0eq)于acn/dmf(1/1,v/v,200/200ml)中的溶液中添加fmoc-pen(acm)-oh(12.86g,29.07mmol,1.2eq)、oxyma(4.13g,29.07mmol,1.2eq)和dic(3.67g,29.07mol,1.2eq)。72小时后,将diea(3.76g,29.07mol,1.2eq.)添加至混合物中,将混合物冷却至-10℃至-5℃并再搅拌24小时(溶液a)。然后在0℃下,向fmoc-pen(acm)-oh(3.22g,7.27mmol,0.3eq.)、oxyma(1.03g,7.27mmol)于acn/dmf(1/1,v/v,25/25ml)中的溶液中添加dic(0.92g,7.27mmol,0.3eq)持续1.0小时(溶液b)。将溶液b直接馈入a中,然后添加diea(0.94g,7.27mmol,0.3eq.),将混合物在0℃下再搅拌24小时(溶液a′);然后在0℃下,向fmoc-pen(acm)-oh(1.07g,0.1eq.)、oxyma(0.344g,0.1eq.)于acn/dmf(1/1,v/v,10/10ml)中的溶液中添加dic(0.31g,0.3eq)持续1.0小时(溶液c)。将溶液c直接馈入a′中。将混合物再保持24小时。然后再添加一份diea(0.313g,0.1eq)。将反应混合物再搅拌48小时。总反应时间为192小时。然后向混合物中馈入etoac(1.5l)、5%h3po4(1.5l)。分离有机相并用5%h3po4(1.5l×2)、饱和nahco3(水溶液)(1.5l×3)、5%nacl(水溶液)(1.5l)、盐水(1.5l)洗涤,经mgso4(20g)干燥并浓缩,得到65.94g粗产物ac-pen(acm)-n-me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)向fmoc-p10-nh2(65.094g,24.23mmol,根据上文步骤4所用的h-p9-nh2的量)于dcm(700ml)中的溶液中添加dbu(7.37g,48.46mmol)。将混合物在10℃下搅拌2小时,然后用nah2po4/na2hpo4缓冲液(ph6.0)(700ml)、5%nahco3(水溶液)(700ml)洗涤,经mgso4(30g)干燥。在去除mgso4后,向滤液中添加diea(6.26g,48.43mmol)和ac2o(4.95g,48.43mmol)并保持0.5小时。然后将混合物浓缩至约400ml,并馈入己烷(2l)以沉淀淡黄色固体。收集固体,用己烷(50ml×3)洗涤并真空干燥,得到49.35g淡黄色固体,产率为82.3%,hplc纯度为87.2%。(ac-pen(acm)-n-me-arg-ser-asp-thr-leu-pen(acm)-phe(4-tbu)-β-homoglu-d-lys-nh2.2tfa)(seqidno:25)在0℃下,向tfa/tis/h2o(95/2.5/2.5,v/v/v,500ml)的溶液中缓慢添加ac-p10-nh2(45g)。然后将混合物加热到20℃持续2小时。然后将反应混合物缓慢添加至冷却的mtbe中(在-20℃下持续1小时)以沉淀白色固体,将其收集并用mtbe(200ml×4)洗涤,在真空下干燥,得到104%产率和60.3%hplc纯度的40.31g产物和两种acm去除的产物(根据峰面积,7.2%和11.1%)。化合物a的乙酸盐区段a和b如下用适当保护的氨基酸制备区段a,ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:3)和区段b,h-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)。用适当氨基酸制备五肽hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)。区段a是通过使hn(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:5)与ac-pen(ψme,mepro)-oh缩合,随后皂化来制备。用适当氨基酸制备三肽phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2。区段b是通过使fmoc-、bpoc-或cbz-pen(ψme,mepro)-oh与phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2缩合,随后去除fmoc、bpoc或cbz保护基团来制备。通过cbz基团保护n端,并将琥珀酰亚胺基用于羧基活化。cbz基团是通过经10%pd/c氢化来去除,以提供未受保护的肽。十肽十肽ac-pen(ψme,mepro)-n(me)arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(ψme,mepro)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)是通过使区段a和区段b在hbtu存在下在非质子性溶剂(例如dmf、dma、nmp和thf)中偶联来制备。在反应完成后,用10%盐酸溶液处理所得物质并过滤所分离的固体。将所得固体材料溶解于乙酸乙酯中,用正己烷处理并过滤,得到所需十肽,即区段ab。为了去除boc和三苯甲基保护基团,将受保护的线性十肽酰胺(区段ab)溶解于混合液(0-5℃)tfa/h20/tis(9.0∶0.5∶0.25)的冷溶液中并搅拌两小时。过滤反应物质以去除沉淀产物,在减压下将溶液浓缩至3/4体积,并用异丙醚或甲基叔丁基醚湿磨剩余溶液。在反应完成后,浓缩混合物并用醚处理残余物。将分离的产物过滤并悬浮于水中,随后用选自氢氧化钠、氢氧化钾、碳酸氢钠、碳酸钠和碳酸钙的碱调节至ph7-8。将所得溶液用过氧化氢氧化,得到所需十肽,并用乙酸铵进一步处理,获得粗制化合物a乙酸盐。将此粗制肽溶液通过结晶或采用制备型hplc方法进一步纯化,得到大于97.0%的产物纯度。二硫键形成:将未纯化的线性单体(32.0g)溶解(3.0g规模)于50∶50acn∶水中,然后稀释于20∶80acn∶水(浓度2至3mg/ml)并用i2/meoh(甲醇)溶液氧化,直到颜色为深黄色,用搅拌棒搅拌溶液。当黄色变淡时,再添加i2/meoh溶液,直到反应混合物保持深黄色至琥珀色(环化时间需要30至45分钟)。使用lcms和hplc监测反应。当完成(未环化单体≤5%(面积%))时,用抗坏血酸淬灭反应物,直到获得无色溶液。将所得反应物用水稀释(最终溶液~10∶90acn∶水)并如下分析和纯化。通过rp-hplc方法20-40-20min(phenomenexluna3.0μxb-c18150x4.6mm柱),mpa:0.1%tfa水溶液和mpb:含0.1%tfa的acn)分析未纯化的环化单体。进行lc/ms以验证线性单体的预期分子量,并且观察到的主要产物的mw为1381.2±2da。环化单体的纯化环化单体在制备型rp-hplc系统上使用以下条件纯化:缓冲液a:0.1%tfa水溶液和缓冲液b:含0.1%tfa的acn,phenomenexluna10μc18250x50mm柱,流速为80ml/min。每次运行使用23∶35∶60min梯度(23%b至35%b,60min)纯化约3.0g环化单体。收集级分(每次纯化约25个级分,每个级分~40ml),并通过分析型hplc方法20-40-20min分析并冻干。将纯度≥90%的级分合并用于二聚化,将纯度在65和90面积%之间的级分合并用于再循环,并丢弃纯度<65面积%的级分。通过rp-hplc方法20-40-20min(phenomenexluna3.0μxb-c18150x4.6mm柱),mpa:0.1%tfa水溶液和mpb:含0.1%tfa的acn)分析经纯化的单体。进行lc/ms以验证线性单体的预期分子量,并且观察到的主要产物的mw为1381.8±2da。单体二聚化dig-osu2(二乙醇酸-二-n-羟基琥珀酰亚胺酯)是通过在0.1m的浓度下使dig(二乙醇酸)(1.0eq)与ho-su(n-羟基琥珀酰亚胺)(2.2eq)和dcc(n,n′-二环己基碳化二亚胺)(2.2eq)在nmp中反应12小时来制备。通过过滤去除沉淀的二环己基脲,并将dig-osu2溶液(0.1m)用于二聚化。通过与0.45eq0.1mdig接头溶液(dig-osu2)和5.0eqdiea在dmf溶液中偶联(~2.0g单体二聚化并一次纯化)将纯单体(12.0g)转化为相应的二聚体。二聚化反应在环境条件下耗时约15至30分钟。使用lcms和hplc监测反应。当反应完成(单体≤5%(auc))时,通过添加乙酸淬灭反应物,将其用水稀释并纯化。通过分析型hplc方法2-50-20min(phenomenexluna5μc18150x4.6mm,5微米100a柱),mpa:0.1%tfa水溶液和mpb:含0.1%tfa的acn)分析粗制二聚体。使用lc/ms验证二聚体的预期分子量,并且观察到的mw为2859.3±2da。0.1%tfa缓冲液中的二聚体纯化粗制二聚体在制备型rp-hplc系统上使用以下条件纯化:缓冲液a:0.1%tfa水溶液和缓冲液b:含0.1%tfa的acn,phenomenexluna10μc18250x50mm柱,流速为80ml/min。每次运行使用33∶40∶60min梯度(33%b至40%b,60min)纯化约2.0g二聚体。收集级分(每次纯化约15个级分,每个级分~20ml),并通过分析型hplc方法2-50-20min分析。将纯度≥95.0面积%的级分合并作为最终产物并转移至盐交换步骤(1.6节),将在70与94面积%之间的级分合并用于再循环,弃去纯度<60面积%的级分。0.2%乙酸(acoh)缓冲液中的盐交换将1.5节的合并的纯化溶液用水(1∶1)稀释,并使用以下条件加载到制备型rp-hplc系统中:缓冲液a:0.2%acoh的水溶液和缓冲液b:含0.2%acoh的acn,phenomenexluna10μc18250x50mm柱,流速80ml/min。每次运行加载约2.0g二聚体,在加载后,通过使0.1m乙酸铵溶液流经色谱柱来进行盐交换步骤,并用含0.2%acoh的acn洗脱物质。收集交换的级分并通过分析型hplc方法2-50-20min进行分析。将纯度≥95.0面积%的级分合并作为最终产物,将纯度<95面积%的级分再次纯化。使用仅乙酸盐冻干机冻干级分。通过rp-hplc方法22-42-50min(phenomenexaerispeptide3.6μxb-c18150x4.6mm柱),mpa:0.1%tfa水溶液和mpb:含0.1%tfa的acn)分析最终经纯化的二聚体。进行lc/ms以验证经纯化的二聚体的预期分子量,并且观察到的主要产物的mw为2859.3±2da。化合物b(最终二聚体)纯度99.25%(面积%)。通用肽合成方案制备n-cbz保护的氨基酸的通用程序:将氨基酸(10.0g)溶解于h2o(300ml)中并在室温下,在搅拌下添加na2co3(2.0eq)和nahco3(1.0eq),得到澄清溶液。添加丙酮(4.0体积,相对于氨基酸),并将略微混浊的溶液在冰水浴中冷却至15-20℃。在搅拌下缓慢添加cbz-cl(1.25eq),并使反应混合物升温至室温。在室温下再搅拌三小时后,将混合物用甲基叔丁基醚(50ml)萃取。向水相中缓慢添加1nhcl水溶液,得到ph2。将所得油状物萃取至甲基叔丁基醚(2×100ml)中,并将有机相用h2o(100ml)洗涤,干燥,过滤且随后真空浓缩,得到呈具有粘性油的白色固体状的n-cbz保护的氨基酸。缩合的通用程序:将cbz-aa-oh(1.2eq)、n-羟基琥珀酰亚胺(nhs;1.2-1.4eq)悬浮于二氯甲烷中。将所得浆液冷却至5℃以下。然后,将1-乙基-3-(3-二甲氨基丙基)碳化二亚胺盐酸盐(edac)经30分钟的时间分数份添加。将所得澄清溶液在0℃下搅拌4小时。经五分钟的时间添加hrn-aa-op(1-1.2eq)于二氯甲烷中的溶液。将所得棕色溶液在室温下搅拌过夜。用水稀释反应混合物并分离有机相。将有机相用稀hcl溶液、碳酸氢盐溶液(2次)和盐水洗涤。分离有机相,干燥,过滤并浓缩,得到肽。cbz脱保护的通用程序:在适当大小的圆底烧瓶或氢化装置中,将cbz保护的化合物溶解于甲醇中。将所得澄清溶液用氩气净化,并添加催化量的10%pd/c。将混合物在h2(1atm)下在23℃下搅拌,直到通过tlc分析未检测到起始物质。通过在tlc上显影并通过茚三酮染色来确认胺化合物。通过硅藻土垫过滤去除催化剂并用甲醇洗涤。将滤液在减压下浓缩,得到相应的胺,其未经进一步纯化即用于酰胺形成反应。将受保护的线性十肽酰胺(区段ab,10)溶解于混合液(0-5℃)tfa/h20/tis(9.0∶0.5∶0.25)的冷溶液中并搅拌两小时。将反应物质过滤以去除沉淀产物,将溶液在减压下浓缩至3/4体积并用异丙基醚湿磨剩余溶液。使用2(4+4)方法的中等规模:cbz-β-homoglu(otbu)-d-lys(boc)-nh2(z-p2-nh2)在0℃和n2下,向cbz-β-homoglu(otbu)-oh(164.84g,469.089mmol,1.0eq)和h-d-lys(boc)-nh2(149.60g,609.816mmol,1.3eq)于dmf(2750ml)中的溶液中添加cl-hobt(79.54g,469.089mmol,1.0eq)。然后在-5℃下,添加hbtu(195.69g,516mmol,1.1eq)。馈入额外的dmf(200ml),同时将内部温度保持在-5℃以下。在hbtu溶解后,逐滴添加dipea以将反应物的ph调节至约6。在dipea添加期间,将反应温度保持在不高于-3℃。使用tlc跟踪反应。使用总dipea(1.8eq)。从开始添加dipea的4小时后,将反应混合物倒入0.5nhcl(水溶液,30l,0~5℃)中,收集所得固体并用0.5nhcl(水溶液,3×)、h2o(3×)、nahco3(饱和水溶液,3×)、h2o(3×)和正己烷(1×)洗涤。在真空去除挥发物后,获得z-p2-nh2(260.41g),产率为95.9%,hplc纯度为92.6%。h-β-homoglu(otbu)-d-lys(boc)-nh2(h-p2-nh2)向z-p2-nh2(260.4g,449.967mmol)于meoh(3100ml)中的溶液中添加pd/c(47.876g,10重量%负载,用63.1重量%h2o湿润),在用n2冲洗后,施加h2(在气球中)。通过tlc跟踪反应。3小时后,去除pd/c并用meoh(4×)洗涤。将合并的滤液真空浓缩,得到197.18gh-p2-nh2,产率为98.6%,hplc纯度为91.9%。z-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(z-p3-nh2)在0℃和n2下,向h-p2-nh2(197.18g,443.53mmol,1.0eq)和z-phe(4-tbu)-oh(152.91g,430.224mmol,0.97eq)于dmf(2800ml)中的溶液中添加cl-hobt(75.21g,443.53mmol,1.0eq)。然后在-5℃下,添加hbtu(185.02g,487.883mmol,1.1eq)。在hbtu溶解后,逐滴添加dipea以将反应物的ph调节至约6。在dipea添加期间,将反应温度保持在不高于-2℃。使用tlc跟踪反应。添加总dipea(1.8eq)。从开始添加dipea的5小时后,将反应混合物用乙酸乙酯(7500ml)和0.5nhcl(水溶液,8000ml,<10℃)稀释。用乙酸乙酯(1700ml,2×)萃取水层。将合并的乙酸乙酯层用0.5nhcl(水溶液,4×)、h2o(1×)、nahco3(饱和水溶液,3×)、h2o(2×)和盐水(1×)洗涤。在na2so4(无水)上干燥并真空去除挥发物后,获得z-p3-nh2(327.63g),产率为94.5%,hplc纯度为95.8%。h-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(h-p3-nh2)向z-p3-nh2(327.60g)于meoh(3200ml)中的溶液中添加pd/c(44.70g,10重量%负载,用63.1重量%h2o湿润),在用n2冲洗后,施加h2(在气球中)。通过tlc跟踪反应。4小时后,去除pd/c并用meoh(4×)洗涤。将合并的滤液真空浓缩,得到h-p3-nh2(268.65g,99.0%产率,96.6%hplc纯度)。fmoc-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)(fmoc-p4-nh2)在0℃和n2下,向h-p3-nh2(268.21g,414mmol,1.0eq)和fmoc-pen(acm)-oh(177.71g,401.58mmol,0.97eq)于dmf(3000ml)中的溶液中添加ci-hobt(69.37g,409.1mmol,1.0eq)。然后在-5℃下,添加hbtu(172.71g,455.4mmol,1.1eq)。在hbtu溶解后,逐滴添加dipea以将反应物的ph调节至约6。在dipea添加期间,将反应温度保持在不高于-2℃。通过tlc跟踪反应。添加总dipea(1.9eq)。从开始添加dipea的5小时后,将反应混合物用乙酸乙酯(7500ml)和0.5nhcl(水溶液,7500ml,<10℃)稀释。用乙酸乙酯(1000ml,2×)萃取水层。将合并的乙酸乙酯层用0.5nhcl(水溶液,4×)、h2o(1×)、nahco3(饱和水溶液,3×)、h2o(2×)和盐水(1×)洗涤。在na2so4(无水)上干燥并真空去除挥发物后,获得fmoc-p4-nh2(436.5g),产率为98.32%,hplc纯度为93.9%。h-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:4)(h-p4-nh2)向fmoc-p4-nh2(436.40g,406.95mmol,1.0eq)于dmf(2200ml)中的溶液中添加哌啶(100.5ml,1017.37mmol,2.5eq)。通过tlc跟踪反应。1小时后,使用pe(石油醚,60-90℃,24×2000ml)洗涤反应混合物。将0.5nhcl(水溶液,9000ml,0-5℃)缓慢倒入所得下层(dmf溶液)中,在2-8℃下搅拌不少于10分钟,然后在-20℃下储存1小时。研磨固体并在10℃下过滤。将固体用h2o(1×2000ml)、nahco3(饱和水溶液)(2×)、h2o(3×)、pe(1×)、mtbe/pe(1/1体积,1×)洗涤并干燥,得到固体产物。获得总h-p4-nh2(267.3g,96.2%hplc纯度和77.3%产率)。z-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:77)(z-p4-oh)z-thr(tbu)-leu-ome(z-p2-ome)在25℃和n2下,将z-thr(tbu)-oh.dcha(196.27g,400mmol,1.0eq.)和h-leu-ome.hcl(80g,440mmol,1.1eq.)于dmf(1000ml)中的悬浮液搅拌30分钟。然后将所得混合物冷却至0℃,并添加cl-hobt(67.84g,400mmol,1.0eq.)。然后在-15至-10℃下,添加hbtu(166.86g,440mmol,1.1eq.)。在hbtu溶解后,逐滴添加dipea(129.1g,1mol,2.5eq)以将反应物的ph调节至约6。在dipea添加期间,将反应温度保持在不高于-5℃。使用hplc跟踪反应。使用总dipea(2.5eq.)。9.5小时后,将反应混合物用乙酸乙酯(3000ml)和5%h3po4(3000ml)稀释。将有机层用5%h3po4(3000ml×3)、饱和nahco3(3000ml×4)、水(3000ml×3)、盐水(3000ml×3)洗涤并经mgso4(50g)干燥。在真空去除挥发物后,获得z-p2-ome(180g),产率为103%,hplc纯度为97.4%。h-thr(tbu)-leu-ome(h-p2-ome)在25℃下,向z-p2-ome(179.83g,400mmol,1.0eq.)和tsoh.h2o(91.3g,480mmol,1.2eq.)于dmf(800ml)中的溶液中添加pd/c(20g,10wt.5%负载,用63.1重量%h2o湿润)。在用n2冲洗后,施加h2(在气球中)。通过hplc跟踪反应。5小时后,去除pd/c。将h-p2-ome(120.94g,100%产率)于dmf(800ml)中的溶液未经进一步处理即直接用于下一步骤。溶液中的h-p2-ome具有92.9%hplc纯度。z-asp(otbu)-thr(tbu)-leu-ome(z-p3-ome)在0℃下,向h-p2-ome(120.94g,400mmol,1.0eq.)、z-asp(otbu)-oh.h2o(131.9g,408mmol,1.02eq.)于dmf(1000ml)中的溶液中添加cl-hobt(67.69g,400mmol,1.0eq.)。然后在-10℃下,添加hbtu(159.28g,420mrnol,1.05eq.)。在2小时15分钟内逐滴添加dipea(155.52g,1.2mol,3eq)以将反应物的ph调节至约6。3小时15分钟后,再添加dipea(12.96g,0.1mol)。在dipea添加期间,将反应温度保持在不高于-3℃。使用hplc跟踪反应。1小时后,将反应物用乙酸乙酯(3000ml)和5%h3po4(3000ml)稀释。将有机层用5%h3po4(3000ml×3)、饱和nahco3(3000ml×4)、水(2000ml×2)、盐水(2000ml×2)洗涤并经mgso4(50g)干燥。在真空去除挥发物后,获得z-p3-ome(233.3g,油状物),产率为96.6%,hplc纯度为90.9%。h-asp(otbu)-thr(tbu)-leu-ome(h-p3-ome)向z-p3-ome(233.3g,384mmol,1.0eq.)和tsoh.h2o(76.09g,400mmol,1.04eq.)于meoh(1000ml)中的溶液中添加pd/c(25.0g,10wt.10%负载,用63.1重量%h2o湿润),在用n2冲洗后,施加h2(在气球中)。通过hplc跟踪反应。5小时后,去除pd/c,并用meoh(3×50ml)洗涤。将合并的滤液用乙酸乙酯(3000ml)和饱和nahco3(水溶液,2000ml)稀释。将有机层用饱和nahco3/h2o的混合物(2∶1,v/v,3000ml×2)、水(3000ml×2)、盐水(3000ml×2)洗涤并经mgso4干燥。在真空去除挥发物后,获得h-p3-ome(167.5g,油状物),产率为92.1%,hplc纯度为93.2%。z-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77)(z-p4-ome)在0℃和n2下,向h-p3-ome(167.5g,353.8mmol,1.0eq.)和z-ser(tbu)-oh(105.53g,357.34mmol,1.01eq.)于dmf(1000ml)中的溶液中添加cl-hobt(59.88g,353.8mmol,1.0eq.)。然后在-5℃下,添加hbtu(140.94g,371.49mmol,1.05eq.)。在1.5小时内逐滴添加dipea(91.7g,707.6mmol,2.0eq)以将反应物的ph调节至约6。在dipea添加期间,将反应温度保持在不高于-3℃。使用hplc跟踪反应。2小时后,将反应混合物用乙酸乙酯(3000ml)和5%h3po4(3000ml)稀释。将有机层用5%h3po4(3000ml×3)、饱和nahco3(3000ml×4)、水(3000ml×2)、盐水(3000ml×3)洗涤并经mgso4干燥。在真空去除挥发物后,获得z-p4-ome(260g,固体),产率为97.9%,hplc纯度为92.6%。z-ser(tbu)-asp(otbu)-thr(tbu)-leu-ome(seqidno:77)(z-p4-ome)向z-p4-ome(260.0g,346.3mmol)于mtbe(260ml)中的溶液中添加pe(3900ml),然后形成白色固体。将混合物在25℃下搅拌1.5小时。收集所得固体并用pe/mtbe(30∶1,v/v,500ml×3)洗涤。在真空去除挥发物后,获得z-p4-ome(232.3g),产率为89.3%,hplc纯度为99.1%。z-ser(tbu)-asp(otbu)-thr(tbu)-leu-oh(seqidno:77)(z-p4-oh)在0℃下,向libr(200g,2663.4mmol,10.0eq.)于acn(3332.5ml)和h2o(71.91g,3995mmol,15eq.)中的溶液中添加z-p4-ome(200g,266.34mmol,1.0eq.)。将混合物冷却至-5℃并逐滴添加dbu(121.55g,799.02mmol,3.0eq.)。将混合物在0℃下搅拌13小时。hplc显示反应完全。将混合物用30%柠檬酸(2000ml)淬灭至ph=2并用乙酸乙酯(10000ml)稀释。将有机层用水(10l×5)洗涤至ph=7,用盐水(10l×2)洗涤,经mgso4干燥并减压浓缩。获得z-p4-oh(194.8g),产率为99.2%,hplc纯度为91.1%。z-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:86)(z-p8-nh2)在0℃和n2下,向z-p4-oh(189.9g,257.7mmol,1.0eq.)和h-p4-nh2(230g,270.6mmol,1.05eq.)于dmf(2000ml)中的溶液中添加hoat(35.25g,257.7mmol,1.0eq.)。然后在-5℃下,添加hatu(108.06g,283.5mmol,1.1eq.)。在hatu溶解后,在1小时10分钟内逐滴添加dipea(66.8g,515.4mmol,2.0eq)以将反应物的ph调节至约6。在dipea添加期间,将反应温度保持在不高于-3℃。使用hplc跟踪反应。3小时20分钟后,再添加h-p4-nh2(4.6g,0.02eq)和hatu(2.16g)。将反应混合物再搅拌1小时50分钟。然后将反应混合物用乙酸乙酯(6000ml)和5%h3po4(6000ml)稀释。将有机层用5%h3po4(6000ml×3)、饱和nahco3/nacl(饱和水溶液)(3∶1,6000ml×4)、水(6000ml×2)、盐水(6000ml×2)洗涤并经mgso4干燥。在真空去除挥发物后,获得z-p8-nh2(403.12g),产率为99.7%,hplc纯度为89.5%。h-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:86)(h-p8-nh2)在25℃下,向z-p8-nh2(318g,202.69mmol,1.0eq.)于meoh(3180ml)中的溶液中添加pd/c(595.3g,10wt.10%负载,用63.1重量%h2o湿润,1.2eq.),在用n2冲洗后,施加h2(在气球中)。通过hplc跟踪反应。14.5小时后,去除pd/c,并用meoh(6×500ml)洗涤。将合并的滤液用乙酸乙酯(18l)稀释,用水(18l×3)、盐水(18l×2)洗涤并经mgso4干燥。在真空去除挥发物后,获得h-p8-nh2(246g,固体),产率为87%,hplc纯度为82.7%制备预先形成的fmoc-pen(acm)-oat在-10℃和n2(气体)下,向fmoc-pen(acm)-oh(73.58g,166.3mmol,2.0eq)和hoat(2.275g,16.6mmol,0.2eq)于dmf(800ml,无水)中的溶液中添加hatu(62.12g,163mmol,1.96eq)。在-10℃下,逐滴添加dipea(23.668g,183mmol,2.2eq)。将反应混合物在-10-0℃下搅拌~1小时。(溶液a)使用tlc跟踪反应。使用n,o-双(三甲基硅烷基)乙酰胺(bsa)的h-n-me-arg(pbf)-oh在n2(气体)下,向h-n-me-arg(pbf)-oh(36.6g,83.1mmol,1.0eq)于dmf(400ml,无水)中的溶液中添加bsa(50.74g,249.4mmol,3eq)。将混合物温热至45℃并搅拌4小时。(溶液b)。合并溶液a和b;fmoc-pen(acm)-n-me-arg(pbf)-oh(fmoc-p2-oh)将溶液b冷却至-10℃。然后将溶液a添加至溶液b中。并将合并的混合物在0℃下搅拌18.5小时。使用hplc跟踪反应。使用冰冷却浴,将反应混合物用5%h3po4(0.2l稀释。将混合物用5%h3po4(2.5l)和乙酸乙酯(3l)进一步稀释。将有机层分离并用5%h3po4(水溶液,2.5l,3×)、h2o(2l,2×)、盐水(2l,2×)洗涤。在干燥和去除挥发物后,得到118.8g固体产物,hplc纯度为57.4%。粗产物(fmoc-p2-oh)的纯化:用制备型hplc纯化上述粗产物(118.8g),得到57.5gfmoc-p2-oh,总产率为80%,hplc纯度为89.7%。fmoc-pen(acm)-n-me-arg(pbf)-ser(tbu)-asp(otbu)-thr(tbu)-leu-pen(acm)-phe(4-tbu)-β-homoglu(otbu)-d-lys(boc)-nh2(seqidno:25)(fmoc-p10-nh2)在0℃和n2下,向fmoc-p2-oh(157.43g,182.2mmol,1.0eq)(注意:45.601g来自批次1,57.894g来自批次2,53.935g来自批次3,参见关于fmoc-p2-oh制备的报告)和h-p8-nh2(288.00g,200.43mmol,1.1eq)于thf(4l)中的溶液中添加hoat(24.9g,182.2mmol,1.0eq)。然后在-10℃下,添加hatu(72.9g,191.31mmol,1.05eq)。在hatu溶解后,在不少于30分钟内逐滴添加dipea以将反应物的ph调节至约6。在dipea添加期间,将反应温度保持在不高于-5℃。使用总dipea(58.94g,455.5mmol,2.5eq)。使用hplc跟踪反应。将反应混合物在-11--5℃下搅拌约10小时。然后将反应混合物用5%h3po4(4.5l)和ea(10l)稀释,将有机层分离并用5%h3po4(水溶液,4.5l,3×)、nahco3(水溶液,5l,3×)、h2o(5l,2×)和盐水(5l,2×)洗涤。在干燥和去除挥发物后,得到421.12g固体,hplc纯度为73.5%。ac-p10-nh2在室温(16℃)下,向fmoc-p10-nh2(400g,173.845mmol,1.0eq)于dcm(4l)中的溶液中添加dbu(26.45g,173.845mmol,1.0eq)。使用tlc跟踪反应。1小时后,在去除fmoc保护基团后,将ac2o(26.62g,260.77mmol,1.5eq)添加至所得混合物中。再1小时后,将水(100ml)添加至反应混合物中并搅拌30分钟。然后将反应混合物用5%h3po4(5l)和dcm(4l)稀释,将有机层分离并用5%h3po4(水溶液,5l)、nahco3(水溶液,5l)和h2o(5l,2×)洗涤。在干燥并将滤液浓缩至约3l体积后,在搅拌的同时将正庚烷(15l)添加至所得混合物。收集所形成的固体并干燥,得到338.46g产物,产率为92.6%,hplc纯度为77.2%。整体脱保护在0℃下,将ac-p10-nh2(350g)添加至tfa/tis/h2o(95/2.5/2.5,v/v/v,3.5l)的混合物中。在约10分钟内溶解ac-p10-nh2。然后在20分钟内将反应混合物升温到20°,并在20至25℃下搅拌约1.5小时。将所得反应混合物添加至mtbe(35l,-3℃)中。将所得混合物储存0.5小时。收集固体并用mtbe(5l×3)洗涤,真空干燥,得到288g粗制线性肽,hplc纯度为56.2%。制备经纯化的环状单体肽氧化环化将线性粗肽(20g)溶于10000ml10%acn/纯化水中,浓度为2mg粗肽/ml。溶液的ph为约3.2。在搅拌下,将5.2%碘于acn中的溶液逐滴添加至粗肽溶液中,在将肽氧化并形成二硫键的同时去除acm保护基团。通过分析型反相hplc(c18)使用由0.1%三氟乙酸和acn组成的缓冲系统监测反应的完成(参见下表8中的方法)。在消耗全部量的线性肽后,黄色仍然存在。反应持续约2.5小时。在氧化反应完成后,使用0.1m抗坏血酸水溶液淬灭过量的碘。表8:监测氧化环化的hplc方法(hplc方法1)粗制环状单体肽的rp-hplc纯化将环化单体肽(含有20g粗肽)的溶液通过1μm膜过滤,将滤液直接加载到制备型hplc上进行纯化。通过制备型hplc使用反相c18材料作为支撑物进行纯化。初级纯化(去除残留的钯)制备型柱:150*250mmdac柱,填充有silicyclec1810um树脂。mpa:0.1%tfa水溶液mpb:含0.1%tfa的acn流速:400ml/min检测范围:215nm加载量:含有28g粗肽的氧化溶液梯度:时间mpampb0.090%10%60.030%70%通过分析型反相hplc(c18)使用由0.1%三氟乙酸和acn组成的缓冲系统监测作为从柱洗脱的肽所收集的每种不同级分的质量(参见表9中的方法)。收集并合并在25.4分钟至43.5分钟洗脱的级分。使用下面的分析型hplc方法分析合并物。表9:监测环状单体纯化的hplc方法(hplc方法2)总共处理268g线性粗肽,得到96.6l收集的级分,纯度为约59-60%。二级纯化通过以下方法分别进一步纯化总共96.6l的纯度为约60%的收集级分。制备型柱:200*250mmdac柱,填充有silicyclec1810um树脂。mpa:20mmteap(ph6.5)mpb:acn流速:800ml/min,检测范围:215nm加载量:10l/运行三次;7l/运行六次;8l/运行两次;8.8l/运行一次。梯度:时间mpampb0.095%5%5.079%21%85.059%41%通过hplc方法2监测作为从柱洗脱的肽所收集的每种不同级分的质量。合并纯度≥95%且没有单一杂质>1%的级分。总共收集13l级分,纯度为约98%。收集总共26l的纯度为约98%的级分和22.9l的纯度为约85%的级分。三级纯化通过以下方法分别进一步纯化总共22.9l的纯度为约85%的收集级分。制备型柱:150*250mmdac柱,填充有silicyclec1810um树脂。mpa:20mmteap(ph6.5)mpb:acn流速:400ml/min,检测范围:215nm加载量:3l/运行三次;3.5l/运行一次;2.6l/运行一次;3.8l/运行一次;4l/运行一次。梯度:通过hplc方法2监测作为从柱洗脱的肽所收集的每种不同级分的质量。合并纯度≥95%且没有单一杂质>1%的级分。总共收集10l级分,纯度为约99%。使用柱浓缩合并的级分将纯度约97%的合格的合并级分(~36l)加载到填充有c18硅胶的15-cmrp-hplc柱上,并在60分钟内用含有0.1%tfa的10%-70%acn水溶液梯度洗脱三次。使用上述纯化部分中的hplc方法分析收集的级分。总共收集5600ml级分并使用hplc方法2分析。冻干经纯化的环状单体肽将浓缩的合并的级分转移到歧管冷冻干燥器的烧瓶中。继续冻干3天,得到经纯化的环状化合物b的白色粉末。获得总共75.7g经纯化的环状单体,表示总加工产率为28.3%(获得的纯化肽的总重量/加工的粗肽的总重量)。制备粗二聚体肽化合物a经纯化的环状单体肽的二聚化通过经典溶液相肽合成方法合成化合物a。在dipea存在下,将一分子的双-n-琥珀酰亚胺基二乙醇酸(dig(nhs)2)与两个化合物b环状单体在无水dmf中缀合。将75.2g化合物b纯化单体肽tfa盐(46.73mmol)溶解于700ml无水dmf中,随后添加2.0eq(16.0ml)dipea。然后,添加0.49eq(7.52g)dig(nhs)2并将反应物在25℃下在氮气层下搅拌约40分钟,然后取出样品并通过下面的hplc方法3分析。hplc分析显示有3.8%未反应的化合物b。然后在添加第一个0.49eqdig(nhs)2后90分钟,再添加0.015eqdig(nhs)2以迫使化合物b转化。40分钟后,取出样品并用hplc方法3分析。未反应的化合物b单体为约0.4%。再过40分钟后,通过添加6.0ml乙酸淬灭反应物。将所得混合物倒入7.0l预冷的mtbe(3℃)中,过滤分离沉淀物,洗涤并真空干燥nlt12小时,得到80.3g粗制化合物ae。产率为约92.9%。表10:监测二聚化的hplc方法(hplc方法3)化合物a的纯化和冻干粗二聚体的初级纯化将75.1g粗化合物a溶解于5000ml20%acn/纯水中,通过1μm玻璃纤维膜过滤,然后将20%体积的溶液加载到填充有专用于此产品的c18反相树脂的制备型rp-hplc柱上。在纯化过程的第一步中,用含0.1%tfa的纯化水/acn缓冲系统以梯度方式洗脱肽。以定时间隔收集级分,通过分析型rp-hplc方法分析纯度,然后根据下面的标准合并。初级纯化制备型柱:80*250mmdac柱,填充有galaksilupc18h7um树脂。mpa:0.1%tfa水溶液mpb:含0.1%tfa的acn流速:200ml/min检测范围:215nm加载量:含有5.75g粗二聚体肽的肽溶液梯度:时间mpampb0.095%5%5.067%33%65.060%40%通过分析型反相hplc(c18)使用由0.1%三氟乙酸和acn组成的缓冲系统监测作为从柱洗脱的肽所收集的每种不同级分的质量(参见表11中的方法)。表11:监测二聚体纯化的hplc方法(hplc方法4)总共从两次纯化运行中收集2048ml级分,通过hplc方法4的纯度为约98%。盐交换将主要合并物(纯度≥98.0%,总计7200ml,在每次盐交换运行中加载3600ml)加载到制备型rp-hplcc18柱上。加载后,将肽用多个柱体积的含0.2%acoh的纯化水/acn缓冲系统等度洗涤,然后用含0.5m乙酸铵的纯化水缓冲系统等度洗涤,以实现与所需乙酸盐形式的完全盐交换。然后将肽用含0.2%acoh的纯化水/acn缓冲系统等度洗涤,然后用含0.2%acoh的纯化水/acn缓冲系统以梯度方式洗脱。以定时间隔收集级分,通过过程中对照分析型hplc方法4分析纯度,将那些纯度≥97.0%的级分合并(两次盐交换,总计8640ml)并在≤35℃浓缩至5400ml,然后取出至冻干步骤。最终冻干将来自盐交换运行的所得溶液在歧管冻干器上冻干3天,得到46.2g化合物a。本文所述的所有出版物和专利申请均通过引用整体并入本文。本发明可以其它特定形式实施,而不脱离本文广泛描述和下文要求保护的其结构、方法或其它基本特征。所描述的实施例在所有方面都应被视为仅是说明性的而非限制性的。因此,本发明的范围由所附权利要求表示,而不是由前面的描述表示。在权利要求的含义和等同范围内的所有变化都涵盖在其范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1