多功能高分子胶束药物递送系统及其制备方法和应用与流程
本发明设计靶向药物递送技术领域,涉及多功能高分子胶束药物递送系统及其制备方法和应用,具有通过二硫键交联提高药物递送系统的稳定性,逃逸内涵体向肿瘤细胞内实现高效药物递送和响应谷胱甘肽药物释放的新应用,还特别涉及与放疗和/中子俘获治疗/或化疗药物在制备治疗肿瘤或恶性肿瘤中的应用。
背景技术:
药物递送系统是一种载药系统,也是药物制剂的一种方式,主要用药物载体材料(如高分子材料)来构建药物递送系统用于装载生物活性物质/药物,并将其递送至病灶部位发挥药效。药物递送系统具有降低药物的毒副作用,延长血液循环时间和保持具有治疗效果的血药浓度,将药物靶向递送至病灶部位,药物的控制释放和减少药物在正常组织的暴露等重要意义。因此,药物递送系统的研发被视为将来药物治疗的基本技术体系,受到国内外的广泛关注,已经成为医药,化学,生物材料,高分子等多学科交叉领域的研究热点。高分子胶束是药物递送系统的一种,主要由两亲性嵌段共聚物通过自组装形成,将药物装载在核里,完成对药物的包裹或增溶,外层一般由聚乙二醇高分子组成,也可以通过在高分子末端或者侧链接枝疏水性分子或者巯基在核形成交联,来增加高分子胶束的稳定性。高分子胶束具有粒径可控,载药量大,制备方便等优点,是一种新型的药物递送系统。
恶性肿瘤,又即癌症,是导致人类死亡的重要病因之一,在我国,恶性肿瘤排在所有疾病死亡原因的第一位,仅2014年恶性肿瘤的新发病例数超过380万例,平均每天超过1万人被确诊为癌症,每分钟有7个人被确诊为癌症。恶性肿瘤已经成为中国国民健康的重要杀手,我国的肿瘤现状具有,发病率高,死亡率高等特征。恶性肿瘤具有复杂性,目前针对肿瘤的治疗主要采取早期诊断,放疗和化疗等综合手段治疗。采用上述治疗方法,其最大的缺陷在于对肿瘤细胞和正常细胞没有选择性,对正常细胞造成的副作用太大。因此,研发具有肿瘤靶向的药物递送系统具有重要应用价值。
在肿瘤的放射治疗中,硼中子俘获治疗是一种选择性的癌症放射治疗方式,其原理是让肿瘤细胞摄取含硼(10b)的药物,通过热中子束辐射,硼原子(10b)俘获热中子,因为10b具有大的热中子反应截面,能有效的俘获热中子,然后发生核分裂反应,产生高能量的阿尔法粒子(α)和7li核,通过产生的α粒子来摧毁癌细胞,对肿瘤细胞不可逆致死性损伤,彻底破坏其遗传结构,使其不能修复而凋亡,达到肿瘤治疗的目的,而热中子线相对比较安全,对没有摄取硼(10b)的药物的正常细胞等不产生伤害作用。然而,硼中子俘获治疗产生的α粒子的射程极短,约5-9微米,接近细胞的直径,这些粒子产生的电离辐射损伤作用仅限于摄取10b的细胞,因此,为了达到有效杀死癌症细胞的治疗效果,需要将含硼(10b)的药物递送到肿瘤细胞中,才能取得治疗效果。其他的放射性治疗方式使用放射性同位素,而肿瘤硼中子俘获治疗的含硼化合物不具有非放射性,更安全。硼中子俘获治疗已经在国内外,如日本,美国和我国成功治愈多名病人,尤其是针对难以手术切除的肿瘤,如黑色素瘤,乳腺癌,脑瘤等,取得了成功。迄今为止,已经有两种含硼(10b)的药物,巯基十二硼烷二钠盐(sodiumborocaptate,bsh)和对-硼苯丙氨酸(boronophenylalanine,bpa)。巯基十二硼烷二钠盐是硼簇类化合物,其在生物环境下具有良好的水解和代谢稳定性,含硼量高,在相同的剂量水平下与对-硼苯丙氨酸相比,能够载带更多的硼(10b),是目前最有效的硼中子俘获治疗药物之一,但是由于其电负性等性质,缺少肿瘤细胞/组织的靶向功能,很少被肿瘤细胞内吞,在肿瘤细胞内难以达到硼中子俘获治疗的有效10b浓度,影响肿瘤的硼中子俘获治疗,其结构式如下:
因此,增加巯基十二硼烷二钠盐这一药物对肿瘤细胞的靶向性和胞内药物水平,具有重要意义,构建药物递送系统可以将巯基十二硼烷二钠盐递送至肿瘤组织和细胞,增加肿瘤细胞中10b浓度,提高对肿瘤的治疗效果。目前,巯基十二硼烷二钠盐对肿瘤的治疗效果还有待提高,还缺少对巯基十二硼烷二钠盐高效递送的多功能高分子胶束纳米药物递送系统,来提高肿瘤细胞对巯基十二硼烷二钠盐的内吞,药物的靶向递送和硼中子俘获治疗效果。
技术实现要素:
本发明的目的是提供一种多功能高分子胶束药物递送系统及其制备方法和应用,具体的技术方案为:
多功能高分子胶束药物递送系统,为改性的聚乙二醇-聚赖氨酸嵌段共聚物与带巯基的硼中子俘获治疗药物在水溶液中通过自组装和部分自由二硫键交联作用形成的高分子胶束。
所述的改性的聚乙二醇-聚赖氨酸嵌段共聚物,用3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐对聚乙二醇-聚赖氨酸嵌段共聚物部分侧链进行化学修饰获得带巯基的基团。
所述的带巯基的硼中子俘获治疗药物为含有巯基的药物分子或者前药;
所述的带巯基的硼中子俘获治疗药物为巯基十二硼烷二钠盐。
化学反应过程为:
其中巯基十二硼烷二钠盐交联的前段共聚物合成过程为;
其中,m为聚乙二醇的重复单元数,其范围为3-500;
n为聚阳离子的单元数,其范围为3-300;
x为聚赖氨酸的重复单元数,其范围为1-100;
y为3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐对聚乙二醇-聚赖氨酸侧链进行化学修饰后通过二硫键连接有药物分子巯基十二硼烷二钠盐的重复单元数,其范围为1-100;
z为3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐对聚乙二醇-聚赖氨酸侧链进行化学修饰的重复单元数,其范围为1-100。
该多功能高分子胶束药物递送系统以聚乙二醇-聚赖氨酸嵌段共聚物为基本原料,3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐等化合物在侧链产生巯基,形成高分子嵌段共聚物,该高分子嵌段共聚物通过巯基与巯基十二硼烷二钠盐等含有巯基的药物分子或者前药反应,最后通过自组装形成高分子胶束,未反应的自由巯基可以通过二硫键交联,增加高分子胶束的稳定性。
含有巯基的药物通过二硫键与高分子嵌段共聚物结合,高分子胶束中有聚阳离子片段和自由的巯基用于交联高分子胶束的核。最后形成的高分子胶束的粒径大小在10-200纳米之间。
该多功能高分子胶束药物递送系统的制备方法,包括以下步骤:
(1)高分子材料的合成
将聚乙二醇-聚赖氨酸嵌段共聚物溶于硼酸缓冲液中,同时将3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐溶于硼酸缓冲液中,两种溶液在室温下混合反应45分钟,然后将反应产物在ph7.4的磷酸盐中透析三次,然后加入二硫苏糖醇反应,用磷酸缓冲溶液和纯水透析产物三次,最后通过冷冻干燥得到改性的聚乙二醇-聚赖氨酸嵌段共聚物高分子材料;
(2)药物与高分子材料的交联制备高分子胶束
将改性的聚乙二醇-聚赖氨酸嵌段共聚物溶于hepes缓冲溶液,将巯基十二硼烷二钠溶于hepes缓冲溶液,然后将两种溶液混合,搅拌反应,然后将产物分别用hepes缓冲溶液和纯水透析,通过自组装形成载药巯基十二硼烷二钠溶的高分子胶束。
步骤(1)中配料所用的聚乙二醇-聚赖氨酸嵌段共聚物与3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐的摩尔比是1:1,但是不仅限于1:1。步骤(2)中配料所用的3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐侧链改性的聚乙二醇-聚赖氨酸嵌段共聚物与巯基十二硼烷二钠的摩尔比为1:1,但可以将巯基十二硼烷二钠的投料比例增加。
本发明所制备的多功能高分子胶束药物递送系统,通过二硫键与含有巯基的药物或者前药连接,通过响应体内高浓度的谷胱甘肽实现药物的控制释放功能,同时高分子中的氨基阳离子可以在细胞内吞过程中质子化来实现逃逸内涵体或溶酶体的功能,最后部分自由的高分子侧链的部分自由巯基可以通过交联胶束核,增强高分子胶束在正常生理条件下的稳定性,而该二硫键在肿瘤细胞中可以通过响应谷胱甘肽而断开,实现交联高分子的解离。因此,该多功能高分子胶束药物递送系统可以在药物递送中的应用,具体的与放疗和/中子俘获治疗/或化疗药物在制备治疗肿瘤或恶性肿瘤中的应用。该多功能高分子胶束药物递送系统作为一种药物载体,是具有肿瘤靶向性的药物递送系统;该高分子胶束可以递送放疗药物,或化疗药物,或抑癌基因以及核酸等,将药物或基因定向送达到病灶部位,是一种肿瘤靶向的高分子胶束。
本发明具有以下有益效果:
1、增加了高分子胶束药物递送系统的种类,拓宽了高分子胶束的应用领域,有利于药物递送系统和新型药物制剂的研究和发展。
2、本发明所述多功能高分子胶束药物递送系统,具有可以响应肿瘤细胞内高浓度谷胱甘肽响应的二硫键用于交联胶束核和与药物交联,可以实现药物控制释放和胶束解离功能;高分子胶束中的聚阳离子具有在肿瘤细胞内吞过程中破坏溶酶体和内涵体的功能,实现向肿瘤细胞内高效药物递送的目的,解决了现有药物靶向肿瘤细胞困难和向肿瘤细胞内药物递送不足等问题。
3、药物制剂新颖,药物递送效果好,可以靶向肿瘤细胞。
4、制备方法简单,所需设备为常规设备。
附图说明
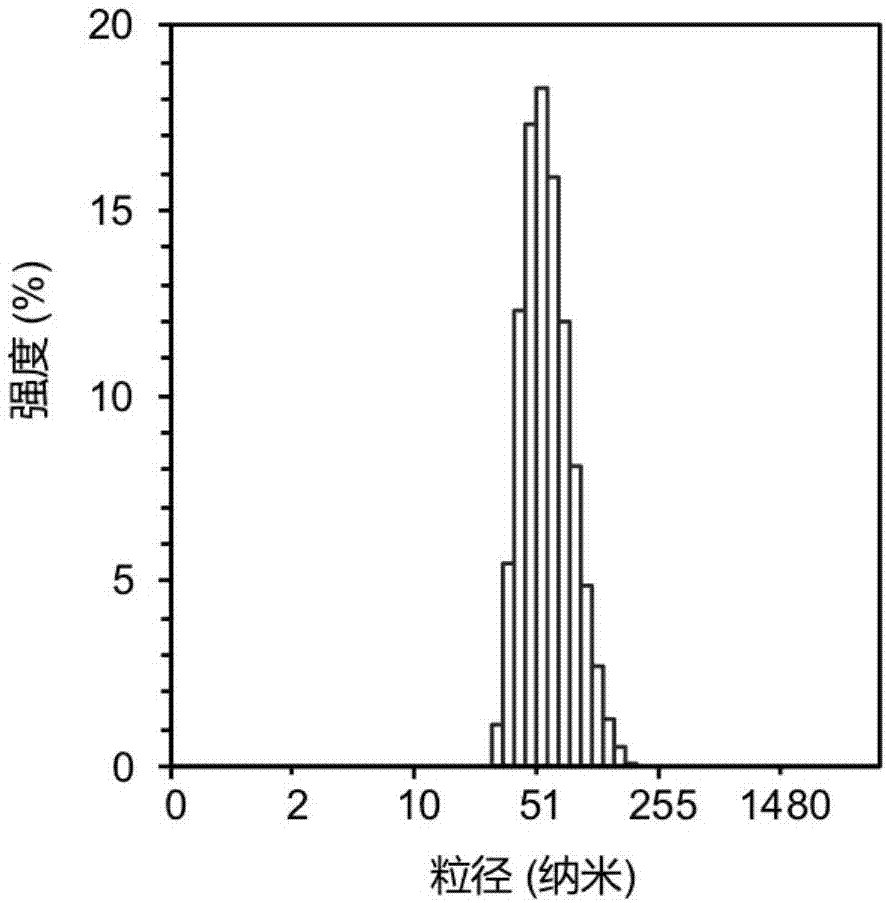
图1是实施例1表征高分子胶束的粒径分布图;
图2是实施例1表征高分子胶束形貌的透射电镜图;
图3是实施例4表征高分子胶束响应谷胱甘肽和二硫苏糖醇的药物释放结果;
图4a是实施例4用等离子体质谱测试的肿瘤细胞对巯基十二硼烷二钠和载药高分子胶束的相对乳腺癌细胞内吞量的比较结果;
图4b是实施例4用等离子体质谱测试的肿瘤细胞对巯基十二硼烷二钠和载药高分子胶束的相对黑色素瘤细胞内吞量的比较结果;
图5a是实施例4用巯基十二硼烷二钠和载药高分子胶束用于对乳腺癌细胞的硼中子俘获治疗结果图;
图5b是实施例4用巯基十二硼烷二钠和载药高分子胶束用于对黑色素瘤细胞的硼中子俘获治疗结果图。
具体实施方式
以下结合几个实施例对本发明做进一步描述。应充分说明的是,下述实施例仅用于说明说明本发明,但不以任何方式限制本发明。
实施例1:
本实施例以聚乙二醇-聚赖氨酸嵌段共聚物和3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐为原料构建高分子胶束药物载体系统,所用药物分子为巯基十二硼烷二钠盐,工艺步骤如下:
(1)高分子材料的合成
将50mg的3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐侧链改性的聚乙二醇-聚赖氨酸嵌段共聚物溶于15ml的hepes缓冲溶液(10mm,ph7.4),将34mg药用巯基十二硼烷二钠溶于4ml的hepes缓冲溶液(10mm,ph7.4),然后将两种溶液混合,搅拌反应6小时,然后将产物分别用hepes缓冲溶液和纯水透析24小时,通过自组装形成载药巯基十二硼烷二钠溶的高分子胶束。
(2)药物与高分子材料的交联和高分子胶束的制备
将100mg的3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐侧链改性的聚乙二醇-聚赖氨酸嵌段共聚物溶于10ml的hepes缓冲溶液(10mm,ph7.4),将75mg药用巯基十二硼烷二钠溶于10ml的hepes缓冲溶液(10mm,ph7.4),然后将两种溶液混合,搅拌反应1小时,然后将产物分别用hepes缓冲溶液和纯水透析24小时,通过自组装形成载药巯基十二硼烷二钠溶的高分子胶束。
其制备的高分子胶束的粒径大小在10-200nm之间,如图1所示,所得的高分子胶束通过投射电镜观察具有粒径分布均匀的特征,如图2所示。
实施例2:
本实施例以聚乙二醇-聚赖氨酸嵌段共聚物和3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐为原料构建高分子胶束药物载体系统,所用药物分子为巯基十二硼烷二钠盐,工艺步骤如下:
(1)高分子材料的合成
在25℃的条件下,将100mg的聚乙二醇-聚赖氨酸嵌段共聚物溶于10ml浓度为100mm,ph值为9.0的硼酸缓冲液中,同时将50mg的3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐溶于12ml浓度为100mm,ph值为9.0的硼酸缓冲液中,两种溶液在室温下混合反应60分钟,然后将反应产物在10mm,ph7.4的磷酸盐中透析三次,然后加入70mg二硫苏糖醇反应50分钟,然后用磷酸缓冲溶液和纯水透析三次,最后通过冷冻干燥得到3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐侧链改性的聚乙二醇-聚赖氨酸嵌段共聚物。
(2)药物与高分子材料的交联和高分子胶束的制备
将5mg的3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐侧链改性的聚乙二醇-聚赖氨酸嵌段共聚物溶于1ml的hepes缓冲溶液(10mm,ph7.4),将巯基改性的dna质粒溶于0.1ml的hepes缓冲溶液(10mm,ph7.4),然后将两种溶液混合,剧烈搅拌反应10分钟,然后加入50μl二甲基亚砜静置3-10小时,然后将产物放于超滤离心管中用纯水或者hepes缓冲溶液洗涤纯化3-5次出去杂质,最后得到包裹dna质粒的高分子胶束。
实施例3:
本实施例以聚乙二醇-聚赖氨酸嵌段共聚物和3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐为原料构建高分子胶束药物载体系统,所用药物分子为巯基十二硼烷二钠盐,工艺步骤如下:
(1)高分子材料的合成
在25℃的条件下,将100mg的聚乙二醇-聚赖氨酸嵌段共聚物溶于10ml浓度为100mm,ph值为9.0的硼酸缓冲液中,同时将150mg的3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐溶于15ml浓度为100mm,ph值为9.0的硼酸缓冲液中,两种溶液在室温下混合反应120分钟,然后将反应产物在10mm,ph7.4的磷酸盐中透析三次,然后加入200mg二硫苏糖醇反应60分钟,然后用磷酸缓冲溶液和纯水透析三次,最后通过冷冻干燥得到3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐侧链改性的聚乙二醇-聚赖氨酸嵌段共聚物。
(2)药物与高分子材料的交联和高分子胶束的制备
将5mg的3,3’-二硫代双丙亚氨酸二甲酯二盐酸盐侧链改性的聚乙二醇-聚赖氨酸嵌段共聚物溶于2ml的hepes缓冲溶液(10mm,ph7.4),将2mg巯基喜树碱溶于200μl的二甲基亚砜中,然后将高分子溶液置于超声中,将巯基喜树碱溶液快速加入,连续超声5分钟,然后将制备的高分子胶束静置3-10小时,然后将产物放于超滤离心管中用纯水或者hepes缓冲溶液洗涤纯化3-5次出去杂质,最后得到包裹dna质粒的高分子胶束。
实施例4:
多功能高分子胶束在肿瘤硼中子俘获治疗中的应用,将实施例1中制备的载有药物巯基十二硼烷二钠的高分子胶束配置成水溶液或者生理盐水溶液,然后通过静脉注射到荷瘤小鼠身上,注射剂量为100mg/kg,注射药物24小时后,用热中子线照射肿瘤部位1小时,热中子线的剂量为(1.6-2.2×1012neutron/cm2),然后每隔两天测量一次肿瘤大小,实现肿瘤的硼中子俘获治疗。
本发明所述载药多功能高分子胶束在肿瘤细胞内部条件下的谷胱甘肽或相同浓度的二硫苏糖醇水平(2-10mm),可以快速的切断药物与高分子之间相连的二硫键,将药物从高分子胶束中释放出来,而在正常生理条件下,谷胱甘肽含量水平较低(0.01mm),药物基本上不释放,如图3所示,通过这种方式,可以实现对药物分子,如巯基十二硼烷二钠的肿瘤细胞靶向的控制释放。本发明所述多功能高分子胶束可以实现对含有巯基的药物或者前药的响应肿瘤细胞内谷胱甘肽浓度的控制释放。
本发明所述载药多功能高分子胶束可以递送巯基十二硼烷二钠到肿瘤细胞,使用高分子胶束跟单独使用巯基十二硼烷二钠作用于肿瘤细胞相比,可以显著提高肿瘤细胞内的药物含量,比如同时用高分子胶束和巯基十二硼烷二钠作用于4t1乳腺癌细胞核b16f10黑色素瘤细胞24小时后,高分子胶束作用的肿瘤细胞内药物的含量是对照组的10倍以上,如图4a和图4b所示。本发明所述的多功能高分子胶束具有被肿瘤细胞内吞后逃逸溶酶体、内涵体的功能设计,可以递送更多的药物到细胞中,实现靶向肿瘤细胞的高效药物递送。
本发明所述载药多功能高分子胶束可以通过硼中子俘获治疗有效杀死癌细胞,其治疗效果远远优于使用巯基十二硼烷二钠,比如将载药高分子胶束和巯基十二硼烷二钠(其中药物的含量都为10μm)分别作用于4t1乳腺癌细胞核b16f10黑色素瘤细胞24小时后,用热中子线照射细胞1小时,然后培养24小时去测试细胞存活率,结果显示载药高分子胶束可以杀死大部分肿瘤细胞,而巯基十二硼烷二钠几乎对细胞没有杀伤作用,如图5a和图5b所示。本发明所述的载药高分子胶束可以有效实现对肿瘤的硼中子俘获治疗。
- 还没有人留言评论。精彩留言会获得点赞!