可吸收的生物医用复合材料及其制备方法与流程
本发明属于生物医用复合材料领域,特别涉及一种可吸收的生物医用复合材料及其制备方法。
背景技术:
人体骨骼中含有水、有机质(骨胶)和无机盐等成分,其中,无机盐的成分以钙磷化合物为主,其以结晶羟基磷灰石和无定形磷酸钙的形式分布于有机质中。因此,包含钙磷化合物的无机盐,尤其是羟基磷灰石、磷酸钙等,与人体骨骼无机盐组分类似,具有优良的生物相容性和生物活性。生物可降解聚酯材料,如聚乳酸、聚己内酯、聚乙交酯等,具有良好的生物降解性、生物相容性和力学性能,是常见的可吸收医用聚合物材料,在医疗领域应用较为广泛。将包含钙磷化合物的无机盐和生物可吸收聚酯材料结合制成复合材料可以结合两种材料的优点,用作骨固定和骨修复材料时具有良好的生物相容性、生物活性和力学性能。
然而,包含钙磷化合物的无机盐大多是亲水性的,其与可吸收聚酯材料简单共混时,两者界面的相容性较差,缺乏一定强度的界面作用力,使无机盐颗粒发生聚集,在聚酯材料基体中分散不均匀,因此易导致应力集中,且界面处因基体与填充物之间的脱落易引发裂纹,严重影响复合材料的力学性能。此外,无机盐颗粒的加入通常会损害聚酯材料的韧性,易导致脆断,限制了复合材料在骨科领域的应用。因此,由普通的聚酯和包含钙磷化合物的无机盐复合材料制成的骨科医疗器械,可能会在实际应用中给病人带来很大的风险。
针对上述问题,在专利文献1中,提出一种羟基磷灰石/聚乳酸复合材料。其中,羟基磷灰石表面通过吸附低分子量聚乳酸进行了改性,然而,尽管改性后的羟基磷灰石与聚乳酸基体材料的结合力有所增强,但是仍然缺乏强的界面作用力,最终复合材料的力学性能仍存在很多改善之处。
另外,专利文献2也提出了一种羟基磷灰石/聚乳酸复合材料。其中,这种材料主要由羟基磷灰石原位聚合聚乳酸制成,即羟基磷灰石与聚乳酸之间存在共价键。尽管这能在很大程度上有助于羟基磷灰石的分散并提高界面作用力,提高材料的力学性能,然而在该羟基磷灰石/聚乳酸复合材料中,由于刚性羟基磷灰石颗粒与聚乳酸之间没有缓冲机制,容易导致复合材料的韧性严重受损,容易发生脆断,不利于其在骨科临床中的应用。
【现有技术文献】
【专利文献】
专利文献1:中国授权专利cn102153058b
专利文献2:中国授权专利cn103319696a
技术实现要素:
本发明有鉴于上述现有技术的状况而完成,其目的在于提供一种既能够提高力学强度且韧性又能得到改善的可吸收的生物医用复合材料。
为此,本发明一方面提供了一种可吸收的生物医用复合材料,其包括:基底颗粒;中间层,其包覆于所述基底颗粒的表面,所述中间层具有第一玻璃态转化温度,并且所述第一玻璃态转化温度不高于人体正常体温;以及聚合物基体,其具有第二玻璃态转化温度,并且所述第二玻璃态转化温度大于所述人体正常体温,所述基底颗粒与所述中间层分散在所述聚合物基体内。
在本发明的一方面中,基底颗粒与聚合物基体之间存在中间层,该中间层的玻璃态转化温度不高于人体正常体温,因此,将本发明的复合材料应用于骨科临床治疗时,该中间层在人体内能够保持为橡胶态(高弹态),该橡胶态的中间层可以释放由基底颗粒引起的应力集中并且缓解其微裂纹,改善复合材料的韧性。另外,该基底颗粒还可以抑制呈橡胶态的中间层在一定应力下的剧烈形变,从而能够抑制橡胶态的中间层材料的加入带来的复合材料强度的下降。
另外,在本发明的一方面所涉及的复合材料中,可选地,所述基底颗粒包含选自羟基磷灰石、聚磷酸钙和磷酸三钙当中的一种以上。在这种情况下,由于基底颗粒的成分与人体骨骼组织的成分近似,因此能够提高复合材料的生物活性和生物相容性。
另外,在本发明的一方面所涉及的复合材料中,可选地,所述中间层为聚合物层,并且所述基底颗粒与所述中间层之间以共价键结合。在这种情况下,在基底颗粒与中间层之间可以形成强界面作用力,从而有效提高二者之间的结合力,有利于力的传导。
另外,在本发明的一方面所涉及的复合材料中,可选地,所述基底颗粒为刚性颗粒。由此,能够提高复合材料的力学强度。
另外,在本发明的一方面所涉及的复合材料中,可选地,在所述中间层上,以原位聚合的方式形成所述聚合物基体。在这种情况下,在中间层与聚合物基体之间可以形成诸如共价键的强界面作用力,从而有效提高二者之间的结合力,有利于力的传导。
另外,在本发明的一方面所涉及的复合材料中,可选地,所述中间层包含选自己内酯、对二氧环己酮当中的一种单体的均聚物,或者选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的二元以上的无规共聚物或嵌段共聚物。在这种情况下,中间层可以形成可吸收的聚合物材料,利于复合材料在骨科领域,尤其是可吸收骨科材料领域的应用。
另外,在本发明的一方面所涉及的复合材料中,可选地,所述中间层与所述聚合物基体以共价键结合。在这种情况下,在中间层与聚合物基体之间可以形成强界面作用力,从而有效提高二者之间的结合力,有利于力的传导。
本发明的另一方面提供了一种可吸收的生物医用复合材料的制备方法,其步骤包括:准备基底颗粒;将所述基底颗粒与第一反应单体充分混合,得到混合溶液;在所述混合溶液中加入催化剂,并进行加热,以使由所述第一反应单体构成的中间层包覆于所述基底颗粒;并且加入第二反应单体,维持加热,从而所述基底颗粒与所述中间层分散在所述聚合物基体内,其中,所述中间层具有第一玻璃态转化温度,并且所述第一玻璃态转化温度不高于人体正常体温,所述聚合物基体具有第二玻璃态转化温度,并且所述第二玻璃态转化温度大于所述人体正常体温。在这种情况下,可以形成包含中间层的复合材料,该复合材料的力学强度和韧性都能得到提高,这在骨科医疗器械应用中有着重要意义。
另外,在本发明的另一方面所涉及的复合材料的制备方法中,可选地,所述第一反应单体选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的一种,或者选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的二种以上;所述第二反应单体选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的至少一种。在这种情况下,可以制备得到可吸收的中间层和聚合物基体,此有利于复合材料在骨科领域,尤其是可吸收骨科材料领域的应用。
另外,在本发明的另一方面所涉及的复合材料的制备方法中,可选地,所述第一反应单体与所述第二反应单体不同。在这种情况下,可以通过调节单体种类、单体质量或单体比例等,控制中间层或聚合物基体的玻璃态转化温度,以利于其在骨科领域的应用。
根据本发明,能够提供一种力学强度高且韧性好的可吸收的生物医用复合材料及其制备方法。
附图说明
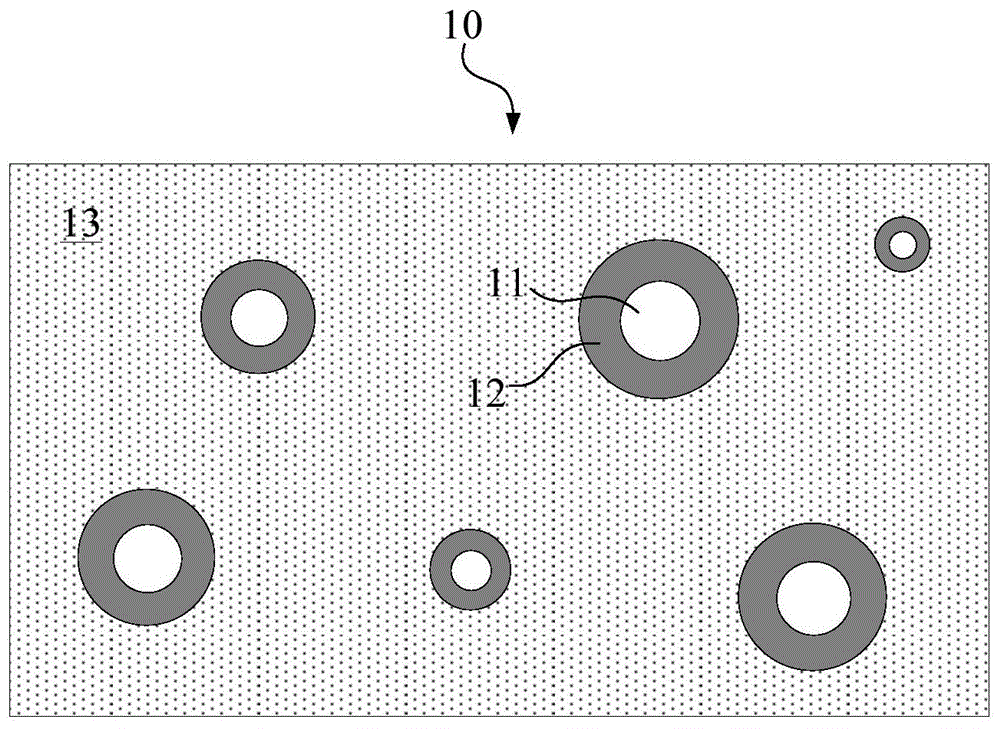
图1是示出了本发明的实施方式所涉及的可吸收的生物医用复合材料的结构示意图。
图2示出了本实施方式所涉及的生物医用复合材料的局部结构示意图。
图3是示出了可吸收的生物医用复合材料的制备步骤示意图。
符号说明:
10…复合材料,11…基底颗粒,12…中间层,13…聚合物基体。
具体实施方式
以下,参考附图,详细地说明本发明的优选实施方式。在下面的说明中,对于相同的部件赋予相同的符号,省略重复的说明。另外,附图只是示意性的图,部件相互之间的尺寸的比例或者部件的形状等可以与实际的不同。
在下面的说明中,为了方便说明使用了小标题的方式进行描述,但是这些小标题仅起到提示作用,并不是为了将小标题下所描述的内容限制于小标题的主题中。
(复合材料)
图1是示出了本实施方式所涉及的可吸收的生物医用复合材料的结构示意图。图2示出了本实施方式所涉及的生物医用复合材料的局部结构示意图。
如图1和图2所示,本实施方式所涉及的复合材料10可以包括基底颗粒11、中间层12和聚合物基体13。具体而言,在基底颗粒11外表面包覆有中间层12,聚合物基体形成在中间层12的外表面。在一些示例中,基底颗粒11和中间层12可以作为整体均匀地分散于聚合物基体13中。
如上所述,在基底颗粒11与聚合物基体13之间形成有中间层12。在这种情况下,在基底颗粒11与聚合物基体13之间引入了缓冲机制,因此能够增强基底颗粒11与聚合物基体13的界面作用力,提高基底颗粒11在聚合物基体13中的分散,从而同时提高复合材料1的力学强度和韧性。
(基底颗粒)
在本实施方式中,基底颗粒11可以包含钙磷化合物。优选地,基底颗粒11可以包含选自羟基磷灰石、聚磷酸钙和磷酸三钙当中的一种以上。在这种情况下,有助于提高复合材料10的生物活性,促进其对人体骨骼组织的修复作用。
众所周知,人体骨骼组织的无机组成成分中,以钙磷的化合物为主。将本实施方式所涉及的复合材料10作为骨科修复材料植入到体内后,中间层12和聚合物基体13(稍后描述)会被人体吸收,因此基底颗粒11所包含的钙、磷等元素会被身体组织吸收,形成新的骨骼组织,因此有助于骨骼的生长与修复。
另外,基底颗粒11也不限于上述的羟基磷灰石、聚磷酸钙、磷酸三钙等。在本实施方式中,基底颗粒11只要包含与人体骨骼组织的成分相近的物质,便能够提高复合材料10对人体骨骼组织的修复作用。
在本实施方式中,优选地,基底颗粒11为刚性颗粒。在一些示例中,基底颗粒11可以为杨氏模量大于2×1011pa的刚性颗粒。在这种情况下,能够有效提高复合材料10的力学强度。
另外,在本实施方式中,基底颗粒11的形状并没有特别限制。例如,在一些示例中,基底颗粒11可以是球体状。但本实施方式不限于此,在另一些示例中,基底颗粒11可以是椭球状、不规则立体状等。
在本实施方式中,基底颗粒11的质量百分数(wt%)没有特别限制。出于复合材料10的力学强度和韧性的考虑,基底颗粒11的质量百分数优选为1wt%~10wt%,例如基底颗粒11的质量百分数可以取1wt%、3wt%、5wt%、8wt%或10wt%。具体而言,在复合材料10中,基底颗粒11起到提高复合材料10的力学强度的作用,一般而言,基底颗粒11的含量越多,复合材料10的力学强度越高。当基底颗粒11的含量较少时,复合材料10的力学强度不足,而当基底颗粒11的含量过多时,则会使复合材料10中聚合物基体13的含量相对减少,由此影响复合材料10的力学强度。因此,将基底颗粒11的质量百分数取为1wt%~10wt%,可以提高复合材料10的力学强度,或保证复合材料10的力学强度不受或受较小影响。
另外,在本实施方式中,基底颗粒11的平均粒径没有特别限制。出于复合材料10的力学强度和韧性的考虑,基底颗粒11的平均粒径优选为5nm~200μm,例如,基底颗粒11的平均粒径可以取5nm、10nm、30nm、50nm、1μm、2μm、5μm、10μm、20μm、30μm、50μm、80μm、100μm、130μm、150μm、180μm或200μm。具体而言,通常基底颗粒11的粒径越小,其刚性越强,因此选用粒径较小的基底颗粒11时,能充分发挥基底颗粒11对复合材料10的力学强度增强的作用;随着基底颗粒11粒径的增大,其表面能减小,可以在一定程度上抑制团聚,但当基底颗粒11的粒径过大则会影响其分散的均匀性,从而影响聚乳酸复合材料1的力学强度。因此,将基底颗粒11的粒径限定在上述范围内,既能起到增强复合材料10力学强度的作用,又能保持基底颗粒11的分散足够均匀。
(中间层)
在本实施方式中,中间层12可以包覆于基底颗粒11的表面。也即,中间层12覆盖在基底颗粒11的表面。另外,中间层12可以具有第一玻璃态转化温度t1。在一些示例中,第一玻璃态转化温度t1可以不高于人体正常体温。一般而言,对于物质的玻璃态转化温度而言,在外界温度高于聚合物的玻璃态转化温度时,物质将呈弹性态或橡胶态;在外界温度小于或等于聚合物的玻璃态转化温度时,物质将呈玻璃态。
当将本实施方式所涉及的复合材料10应用于人体时,由于该中间层12的第一玻璃态转化温度t1不高于人体正常体温(例如37℃),因此,中间层12能够保持为橡胶态。在这种情况下,呈橡胶态的中间层12可以释放(例如原位释放)由基底颗粒11引起的应力集中并缓解由此引起的微裂纹,由此能够改善复合材料10的韧性。另外,该基底颗粒11也可以稳固(例如原位稳固)呈橡胶态的中间层12在一定应力下的剧烈形变,由此能够抑制复合材料10力学强度的下降。
在本实施方式中,中间层12可以由聚合物材料构成,并且中间层12与基底颗粒11之间可以以共价键结合。在这种情况下,基底颗粒11与中间层12之间形成强界面作用力,从而有效提高二者之间的结合力,有利于力的传导。另外,中间层12与基底颗粒11之间还可以以诸如离子键等强界面作用力结合。
在人体骨科修复的临床应用中,当呈橡胶态的中间层12与基底颗粒11之间存在强作用力时,能够有助于中间层12与基底颗粒11之间力的传导并促进二者的联动效应。具体而言,一方面,呈橡胶态的中间层12可以释放(例如原位释放)由基底颗粒11引发的应力集中并且缓解微裂纹,从而改善复合材料10的韧性;另一方面,基底颗粒11可以稳固(例如原位稳固)橡胶态的中间层12在一定应力下的剧烈形变,从而有效抑制由于橡胶态的中间层12的加入而引起的复合材料10力学强度的下降。因此,能够同时提高复合材料10的强度与韧性,这对于本实施方式所涉及的复合材料10在骨科医疗器械应用中有着重要意义。
在本实施方式中,中间层12的质量百分数(wt%)没有特别限制。出于复合材料10的力学强度和韧性的考虑,中间层12的质量百分数优选为1wt%~10wt%,例如中间层12的质量百分数可以取1wt%、3wt%、5wt%、8wt%或10wt%。具体而言,在复合材料10中,中间层12起到增强复合材料10韧性的作用,一般而言,中间层12的含量越多,复合材料10的韧性越好。当中间层12的含量较少时,复合材料10的韧性不足,而当中间层12的含量过多时,则会影响复合材料10的力学强度等性能特点。因此,将中间层12的质量百分数取为1wt%~10wt%,既能提高复合材料10的韧性,又对复合材料10的力学强度等其他性能特点不产生影响或影响较小。
在本实施方式中,中间层12可以包含选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的一种单体的均聚物。另外,中间层12也可以包含选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的二元以上的无规共聚物或嵌段共聚物。在这种情况下,中间层12可以形成可吸收的聚合物材料,有利于复合材料10在骨科领域,尤其是可吸收骨科材料领域的应用。
如上所述,在本实施方式中,中间层12所具有的第一玻璃态转化温度t1可以不高于人体正常体温。另外,该第一玻璃态转化温度t1的具体数值范围没有特别限制,优选地,该第一玻璃态转化温度t1满足-40℃≤t1≤36℃,例如,第一玻璃态转化温度t1可以为-40℃、-37℃、-30℃、-20℃、-10℃、-5℃、0℃、10℃、20℃或36℃;更优选地,第一玻璃态转化温度t1满足-37℃≤t1≤36℃。
另外,在本实施方式中,中间层12的玻璃态转化温度t1的大小可以根据实际需要进行调控。对于均聚物而言,可以通过调控其单体的种类或质量得到不同的玻璃态转化温度t1;对于共聚物而言,可以通过调控混合单体中各单体的比例等来实现玻璃态转化温度t1的改变。
另外,在本实施方式中,中间层12的成型方式没有特别限制。在一些示例中,可以通过在基底颗粒11外表面引发原位聚合而形成。另外,在另一些示例中,也可以通过对基底颗粒11表面改性的方式形成。
(聚合物基体)
在本实施方式中,在中间层12的外表面形成聚合物基体13。另外,聚合物基体13可以具有第二玻璃态转化温度t2。在一些示例中,第二玻璃态转化温度t2可以大于中间层12具有的第一玻璃态转化温度t1,即t2>t1。由此,在同样的温度条件下,聚合物基体13能够保持比中间层12更好的力学强度,从而增强复合材料10的力学性能。
另外,在本实施方式中,聚合物基体13所具有的第二玻璃态转化温度t2可以高于人体正常体温。由此,在将本实施方式所涉及的复合材料10应用于人体时,聚合物基体13可以保持为玻璃态,可以进一步确保复合材料10的力学强度足够高。
在本实施方式中,在中间层12上,可以以原位聚合的方式形成聚合物基体13。在这种情况下,在中间层12与聚合物基体13之间可以形成诸如共价键的强界面作用力,从而有效提高二者之间的结合力,有利于力的传导。
在本实施方式中,中间层12可以与聚合物基体13以共价键结合。在这种情况下,中间层12与聚合物基体13之间形成强界面作用力,从而有效提高二者之间的结合力,有利于力的传导。另外,中间层12与聚合物基体13之间还可以以诸如离子键等强界面作用力结合。
另外,在本实施方式中,聚合物基体13可以包含选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的一种单体的均聚物。另外,聚合物基体13也可以包含选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的二元以上的无规共聚物或嵌段共聚物。在这种情况下,聚合物基体13可以形成可吸收的聚合物材料,有利于复合材料10在骨科领域,尤其是可吸收骨科材料领域的应用。
图3是示出了可吸收的生物医用复合材料的制备步骤示意图。
以下,参考图3,详细地描述本实施方式所涉及的可吸收的生物医用复合材料的制备方法。
如图3所示,本实施方式中所涉及的制备可吸收的生物医用复合材料的方法可以包括如下步骤:准备由钙磷化合物构成的基底颗粒11(步骤s1);将基底颗粒11与第一反应单体充分混合,得到混合溶液(步骤s2);在混合溶液中加入催化剂,并在惰性气体的条件下,加热至80℃~180℃,反应2小时至48小时,以使由所述第一反应单体构成的中间层12包覆于基底颗粒11(步骤s3);加入第二反应单体,维持加热,并继续反应2小时至48小时,从而在所述中间层12之上形成聚合物基体13,最终获得复合材料10(步骤s4)。
在本实施方式中,在步骤s1中,首先准备由钙磷化合物构成的基底颗粒11。在一些示例中,基底颗粒11可以选自羟基磷灰石、聚磷酸钙和磷酸三钙当中的一种以上。众所周知,人体骨骼组织的无机组成成分中,以钙磷的化合物为主。将本实施方式所涉及的复合材料10作为骨科修复材料植入到体内后,中间层12和聚合物基体13(稍后描述)会被人体吸收,因此基底颗粒11所包含的钙、磷等元素会被身体组织吸收,形成新的骨骼组织,因此有助于骨骼的生长与修复。
另外,基底颗粒11也不限于上述的羟基磷灰石、聚磷酸钙、磷酸三钙等。在本实施方式中,基底颗粒11只要包含与人体骨骼组织的成分相近的物质,也能够提高复合材料10对人体骨骼组织的修复作用。
在本实施方式中,在步骤s2中,将步骤s1中的基底颗粒11与第一反应单体充分混合,得到混合溶液。在一些示例中,在步骤s2中,可以同时将基底颗粒11和第一反应单体溶于有机溶剂中,充分混合,形成混合溶液。在另一些示例中,有机溶剂优选为干燥甲苯。
其中,第一反应单体可以选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的一种。另外,第一反应单体也可以选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的二种以上。在这种情况下,所得到的中间层12为包含选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的一种单体的均聚物,或者选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的二元以上的无规共聚物或嵌段共聚物。由此,中间层12可以形成可吸收的聚合物材料,有利于复合材料10在骨科领域尤其是可吸收骨科材料领域的应用。
另外,在本实施方式中,在步骤s2中,添加第一反应单体的过程,可以包含一次以上的添加。在一些示例中,每次添加后均待反应一定时间后再进行下一次添加,由此可以形成嵌段聚合物。
在本实施方式中,在步骤s3中,将催化剂加入到在步骤s2中所得到的混合溶液中,并在惰性气体的条件下,加热至80℃~180℃,反应2小时至48小时,以使由第一反应单体构成的中间层12包覆于基底颗粒11。在一些示例中,基底颗粒11与中间层12之间以诸如共价键之类的强作用力结合,由此可以提高二者的结合力,有利于力的传导并促进了二者的联动效应。
另外,在本实施方式中,在步骤s3中,催化剂优选为辛酸亚锡。由此,可以引发单体的原位聚合,形成诸如共价键的强界面作用力。
另外,在本实施方式中,在步骤s3中,惰性气体可以为氮气或氩气。由此,可以保证反应的顺利发生,有效避免其他杂质的生成。
在本实施方式中,在步骤s4中,在步骤s3的反应体系中,加入第二反应单体,维持加热,并继续反应2小时至48小时,从而在中间层12之上形成聚合物基体13,最终获得复合材料10。
其中,第二反应单体可以为选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的一种。另外,第二反应单体也可以为选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的二种以上。在这种情况下,所得到的聚合物基体13为包含选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的一种单体的均聚物,或者选自丙交酯、己内酯、对二氧环己酮和乙交酯当中的二元以上的无规共聚物或嵌段共聚物。由此,聚合物基体13可以形成可吸收的聚合物材料,有利于复合材料10在骨科领域尤其是可吸收骨科材料领域的应用。
在一些示例中,第二反应单体与第一反应单体可以不同。该不同包括种类不同、含量不同或种类与含量均不同等情形。
另外,在本实施方式中,在步骤s4中,添加第二反应单体的过程,可以包含一次以上的添加。在一些示例中,每次添加后均待反应一定时间后再进行下一次添加,由此可以形成嵌段聚合物。
另外,在本实施方式中,将步骤s3和步骤s4两个阶段的产物分别溶于第一有机溶剂,优选地,该第一有机溶剂为氯仿。接着,经过离心处理,再经第二有机溶剂沉淀并清洗,优选地,该第二有机溶剂为甲醇,最终可以得到中间层12聚合物(中间层12),基底颗粒11与中间层12的组合物(基底颗粒11-中间层12),以及包含基底颗粒11、中间层12和聚合物基体13的复合材料10(基底颗粒11-中间层12-聚合物基体13)。
另外,在本实施方式中,可以通过差式扫描量热法(dsc)测试材料的玻璃态转化温度,也可以通过凝胶渗透色谱(gpc)得到材料的重均分子量(mw),还可以通过热重分析(tga)测定材料的组分含量。
另外,在本实施方式中,将步骤s4得到的复合材料10经注塑成型,再经测试得到其力学性能分析结果。
在本实施方式中,通过步骤s1至步骤s4所制备的可吸收的生物医用复合材料10包括了基底颗粒11和聚合物基体13,以及介于基底颗粒11和聚合物基体13之间的中间层12。如上所述,中间层12的玻璃态转化温度不高于人体正常体温,因此,将本实施方式所涉及的复合材料10应用于骨科临床治疗时,该中间层12在人体内能够保持为橡胶态,该呈橡胶态的中间层12可以缓解由基底颗粒11引起的应力集中和微裂纹,改善复合材料10的韧性。同时,该基底颗粒11也可以稳固呈橡胶态的中间层12在一定应力下的剧烈形变,因此也能够抑制复合材料10力学强度的下降。
为了进一步说明本发明,以下结合实施例对本发明提供的可吸收的生物医用复合材料及其制备方法进行详细描述,并结合对比例对本发明实现的有益效果进行充分说明。
(实施例1)
将0.1g颗粒直径为5nm的羟基磷灰石,0.06g的左旋丙交酯单体和0.06g的己内酯单体混合均匀,加入40ul辛酸亚锡,然后在氮气保护下搅拌加热到180℃,待反应混合物融化均匀后,继续搅拌反应2小时,形成羟基磷灰石-橡胶态层。然后向反应体系中加入10g左旋丙交酯,继续在180℃下反应2小时。
反应结束后,将反应混合物用氯仿溶解,然后在甲醇中沉淀,并用甲醇清洗3次,得到羟基磷灰石-橡胶态层-聚乳酸复合材料。
将所得到的羟基磷灰石-橡胶态层复合材料和羟基磷灰石-橡胶态层-聚乳酸复合材料分别溶解在氯仿中,然后以15000rpm的速率离心,取上层清液在甲醇中沉淀并清洗,得到自由的橡胶态聚合物和橡胶态-聚乳酸聚合物进行材料表征,差示扫描量热法(dsc)和凝胶渗透色谱(gpc)数据见表1。
表1
将羟基磷灰石-橡胶态层-聚乳酸复合材料进行注塑成型,拉伸力学性能测试结果见表2。羟基磷灰石-橡胶态层-聚乳酸复合材料中羟基磷灰石的质量含量由tga测定,为1%。羟基磷灰石-橡胶态层-聚乳酸复合材料中的橡胶态层的质量含量由表1中橡胶态层和橡胶态层-聚乳酸的重均分子量,结合羟基磷灰石的含量计算得到,结果见表1。
表2
(实施例2)
将1g颗粒直径为200um的羟基磷灰石,0.4g左旋丙交酯单体,0.4g对二氧环己酮单体和0.4g乙交酯单体在100ml干燥甲苯中混合均匀,加入160ul辛酸亚锡,然后在氩气保护下搅拌加热至80摄氏度,待反应物混合溶解均匀后,继续搅拌反应48小时,形成羟基磷灰石-橡胶态层。然后向反应体系中加入8.5g乙交酯,继续在80摄氏度下反应48小时。
反应结束后将反应混合物在甲醇中沉淀,并用甲醇清洗3次,得到羟基磷灰石-橡胶态层-聚乙交酯复合材料。
将所得到的羟基磷灰石-橡胶态层复合材料和羟基磷灰石-橡胶态层-聚乙交酯复合材料分别溶解在氯仿中,然后以15000rpm的速率离心,取上层清液在甲醇中沉淀并清洗,得到自由的橡胶态聚合物和橡胶态-聚乙交酯聚合物进行材料表征,差示扫描量热法(dsc)和凝胶渗透色谱(gpc)数据结果见表1。
将羟基磷灰石-橡胶态层-聚乙交酯复合材料进行注塑成型,拉伸力学性能测试结果见表2。羟基磷灰石-橡胶态层-聚乙交酯复合材料中羟基磷灰石的质量含量由tga测定,为10%。羟基磷灰石-橡胶态层-聚乙交酯复合材料中的橡胶态层的质量含量由表1中橡胶态层和橡胶态层-聚乳酸的重均分子量,结合羟基磷灰石的含量计算得到,结果见表1。
(实施例3)
将0.5g颗粒直径为200nm的羟基磷灰石和0.3g己内酯单体在100ml干燥甲苯中混合均匀,加入100ul辛酸亚锡,然后在氩气保护下搅拌加热至120摄氏度,待反应物混合溶解均匀后,继续搅拌反应12小时,然后加入0.3g对二氧环己酮单体,继续在120摄氏度下反应12小时,形成羟基磷灰石-橡胶态层。然后向反应体系中加入4.6g乙交酯,继续在130摄氏度下反应24小时,之后再加入4.6g左旋丙交酯,继续在130摄氏度下反应24小时。
反应结束后将反应混合物在甲醇中沉淀,并用甲醇清洗3次,得到羟基磷灰石-橡胶态层-聚乳酸乙醇酸复合材料。
将所得到的羟基磷灰石-橡胶态层复合材料和羟基磷灰石-橡胶态层-聚乳酸乙醇酸复合材料分别溶解在氯仿中,然后以15000rpm的速率离心,取上层清液在甲醇中沉淀并清洗,得到自由的橡胶态聚合物和橡胶态-聚乳酸乙醇酸聚合物进行材料表征,差示扫描量热法(dsc)和凝胶渗透色谱(gpc)数据结果见表1。
将羟基磷灰石-橡胶态层-聚乳酸乙醇酸复合材料进行注塑成型,拉伸力学性能测试结果见表2。羟基磷灰石-橡胶态层-聚乳酸乙醇酸复合材料中羟基磷灰石的质量含量由tga测定,为5%。羟基磷灰石-橡胶态层-聚乳酸乙醇酸复合材料中的橡胶态层的质量含量由表1中橡胶态层和橡胶态层-聚乳酸的重均分子量,结合羟基磷灰石的含量计算得到,结果见表1。
(对比例1)
将0.1g颗粒直径为5nm的羟基磷灰石和10g左旋丙交酯单体混合均匀,加入40ul辛酸亚锡,然后在氮气保护下搅拌加热到180摄氏度,待反应混合物融化均匀后,继续搅拌反应2小时,形成羟基磷灰石-聚乳酸复合材料。
反应结束后将反应混合物用氯仿溶解,然后在甲醇中沉淀,并用甲醇清洗3次,得到羟基磷灰石-聚乳酸复合材料。
将所得到的羟基磷灰石-聚乳酸复合材料溶解在氯仿中,然后以15000rpm的速率离心,取上层清液在甲醇中沉淀并清洗,得到自由的聚乳酸进行材料表征,差示扫描量热法(dsc)和凝胶渗透色谱(gpc)数据结果见表1。
将羟基磷灰石-聚乳酸复合材料进行注塑成型,拉伸力学性能测试结果见表2。羟基磷灰石-聚乳酸复合材料中羟基磷灰石的质量含量由tga测定,为1%。
(对比例2)
将0.1g颗粒直径为5nm的羟基磷灰石和9.9g左旋聚乳酸在氯仿中分散溶解,搅拌均匀,然后在甲醇中沉淀,得到羟基磷灰石/聚乳酸复合材料。
本对比例采用的左旋聚乳酸的分子量和玻璃态转化温度和对比例1的测试结果接近,差示扫描量热法(dsc)和凝胶渗透色谱(gpc)数据结果见表1。将羟基磷灰石/聚乳酸复合材料进行注塑成型,拉伸力学性能测试结果见表2。羟基磷灰石/聚乳酸复合材料中羟基磷灰石的质量含量由tga测定,为1.2%。
(对比例3)
将对比例2中的左旋聚乳酸进行注塑成型,拉伸力学性能测试结果见表2。
由实施例1和对比例3的比较可以看出,本发明的界面设计方法能够有效同时提高聚酯材料的强度(由杨氏模量和抗拉强度表示)和韧性(由断裂伸长率表示)。
实施例1和对比例1的比较可以看出,橡胶态层在羟基磷灰石和聚乳酸之间形成的缓冲作用对聚乳酸材料的韧性提高很有帮助。
对比例2中羟基磷灰石和聚乳酸基体之间缺乏强有力的界面作用力,故实施例1、对比例1和对比例2的比较可以看出,本发明中可吸收复合材料中界面处的强作用力对于提高复合材料的力学性能有着重要的作用。
虽然以上结合附图和实施方式对本发明进行了具体说明,但是可以理解,上述说明不以任何形式限制本发明。本领域技术人员在不偏离本发明的实质精神和范围的情况下可以根据需要对本发明进行变形和变化,这些变形和变化均落入本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!