利用免疫疗法诱导IL-12的制作方法
本申请是申请日为2012年05月02日、申请号为201280021818.0(pct/us2012/036123)、发明名称为“利用免疫疗法诱导il-12”的分案申请。本申请要求2011年05月03日提交的美国临时申请us61/482,009、2011年08月29日提交的美国临时申请us61/528,484、2011年11月29日提交的美国临时申请us61/564,551和2012年01月04日提交的美国临时申请us61/582,881的权益,所述申请的内容以引用的方式整体并入本文。
本发明涉及利用免疫细胞的疗法,更具体地,本发明涉及在患者中促进il-12产生的免疫细胞疗法。
背景技术:
所知的最精确、最强大和最安全的疾病预防和治疗机制,是在没有医疗介入的情况下,结合先天免疫元素和适应性免疫元素的与生俱来的“灭菌式(sterilizing)”免疫应答以清除身体内种类繁多的外源性病原体。免疫系统被设计为“记忆”清除过的外源性抗原以便对再次感染快速发动免疫应答。即使癌症患者的免疫系统,也可以识别外源性抗原(例如在病毒和细菌中发现的外源性抗原)并对其发动应答,足以从身体中彻底破坏和消除这些外源性抗原。这种灭菌式免疫应答的猛烈性和特异性可以被以下方式证明,未充分抑制的免疫系统可以在保留自身组织的同时完全破坏大的移植器官如肾、肝或心脏。这种针对外源性抗原的免疫力的破坏效果将是有益的,如果这种效果可以被再定向到肿瘤和/或由于通过所述患者不充分的免疫应答而逃脱的其他抗原。
免疫疗法致力于发展针对包括癌症的多种感染性和非感性疾病利用、引导和控制免疫应答的方法。治疗性疫苗是一种旨在用现有癌症训练免疫系统的免疫疗法。在具有现有癌症的患者中,该疫苗被设计为该患者的免疫系统将肿瘤细胞识别为外源性抗原。如果肿瘤被免疫系统识别为外源性病原体,则理论上免疫应答可以被引发,该免疫应答可能导致免疫细胞破坏大的肿瘤、找出并破坏转移性肿瘤细胞,无论它们位于体内何处。成功的免疫治疗后,免疫系统的“记忆”清除过的外源性细胞的能力,使免疫系统在没有任何额外治疗下可以消除任何复发的癌细胞,很像免疫系统防止机会性感染。
个体的免疫系统对疾病或病原体的应答可以是th1应答或th2应答。在th1应答中,cd4+t细胞对于th1细胞成为极化状态,相反地在th2应答中,该cd4+t细胞对于th2细胞成为极化状态。这种日益普及的分类方法被称为th1/th2平衡。th1细胞促进细胞介导的免疫,而th2细胞诱导体液免疫。细胞免疫(th1)引导自然杀伤细胞(nk)、t-细胞和巨噬细胞在感染部位攻击异常细胞和微生物。体液免疫(th2)导致用于中和外源性入侵物的抗体的产生。在一般情况下,cd4+t细胞的th2极化已在大多数人类和动物癌症研究中被证明是与癌症进程相关的,而th1极化与肿瘤消退和抗肿瘤免疫力相关。
所述个体的th1/th2平衡免疫应答可以通过在该个体中细胞因子的平衡而被评估。细胞因子是小细胞信号蛋白分子。术语细胞因子被用作不同群体可溶性蛋白和多肽的通用名称,这些蛋白和多肽通常以纳摩到皮摩浓度在正常或病理条件下作为调节因子调控个体细胞和组织的功能活性。这些蛋白也直接介导细胞间相互作用并调节发生在细胞外微环境中的进程。白介素是涉及免疫调节的一组细胞因子,可以通过免疫系统中的各种细胞被合成。存在多种白介素,例如il-2、il-4、il-10和il-12,并且这些白介素中的每一种在免疫系统中具有特定的作用。
th1细胞产生涉及炎性应答的i型细胞因子。i型细胞因子包括,例如il-2、il-12、il-15、ifn-γ、tnf-α、tnf-β、gm-csf和c-c趋化因子。th2细胞产生涉及体液免疫应答的ii型细胞因子。ii型细胞因子包括,例如il-4、il-5、il-6、il-10、il-13和tgf-β。th1和th2免疫应答是反相调节的,即增强的i型应答下调ii型应答而增强的ii型应答下调i型应答。
il-12是由p53亚单位和p40亚单位组成的异质二聚体。其是主要通过抗原呈递细胞(apc)被产生。il-12也可以通过单核细胞和巨噬细胞、树突细胞和b细胞被产生。il-12在t细胞和天然杀伤细胞上发挥免疫调节作用。内源性il-12被认为与产生优化的th1应答有关,并可以在细胞介导的针对细胞内病原体的免疫发挥重要作用。
il-12由于其可以调节免疫系统中的重要成分并且被证实具有显著的抗肿瘤作用,一直是实验室和动物实验广泛研究的对象。例如,在抑制人肺腺癌生长和急性髓系白血病中il-12都被涉及其中。然而,在治疗方案中采用外源性il-12被其在人体中的高毒性而限制。
附图说明
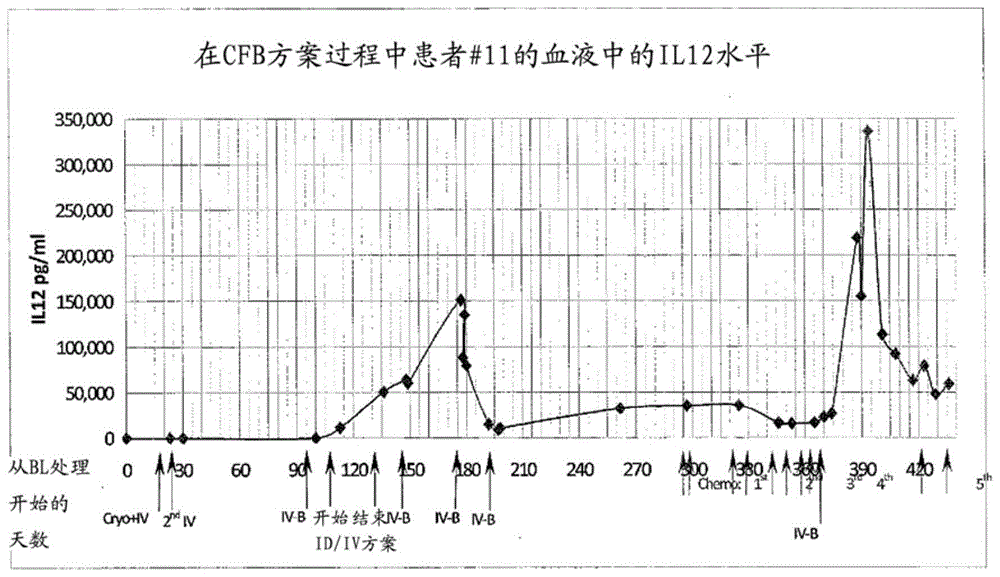
图1是显示了多于一年中在患者的血浆中il-12水平的图表。通过各种给药方式在各个时间点为患者给药同种异体的、激活的th1细胞。
具体实施方式
本发明涉及导致在患者的血浆中il-12的水平可以被检测到的组合物和方法。本发明包括组合物,当为患者给药时,可以导致患者的血浆中内源性il-12产生的水平可以被检测到,而没有任何显著的毒性。该内源性il-12可以在患有癌症的患者中被意外地检测到。所述组合物优选包括同种异体激活的t细胞。t细胞不能够产生il-12,因此为患者给药该t细胞组合物引起通过该患者自身apc产生il-12。
本发明还包括在患者中通过该患者的自身免疫系统诱导产生内源性il-12的方法。该方法包括给药同种异体材料的组合物,优选地为同种异体的被激活的t细胞。该组合物可以以单剂量或多剂量进行给药。优选地,该同种异体的被激活的t细胞以多次、低剂量进行给药。该同种异体细胞可以通过皮肤内的、静脉内的或病灶内的途径给药。优选地,给药频率为不少于每3天一次。给药这些组合物时,患者自身的免疫系统可以被诱导产生可以检测得到水平的血浆il-12,甚至在患有癌症的患者体内。通常地,由于肿瘤可以抑制il-12的表达,在患有癌症的患者体内没有发现il-12。令人惊奇的是,本文所描述的方法可以克服这种抑制作用,并且在建立足够诱导血浆中il-12的长时间表达的环境,例如,表达几个月或甚至一年。进一步地,血浆中内源性il-12的存在在患者中并不引起如作为药物给药外源性il-12时的显著毒性。
内源性il-12是指该il-12是在患者体内通过其自身的免疫系统合成的。具体地,该il-12可以通过患者的抗原呈递细胞(apc)而被合成。apc可以包括单核细胞和巨噬细胞、树突细胞和b细胞。外源性il-12是指该il-12不是通过患者自身的免疫系统合成的。外源性il-12包括从另一个体中分离和/纯化的il-12,或者通过包括il-12基因的dna构建体而表达的il-12。
有利地,在患者体内全身内源il-12的产生对患者引起极小或没有毒性。该患者可能经历瞬时性症状,例如短暂的流感样症状。通常地,当为患者给药外源性il-12时,毒性作用限制了其在治疗方案(setting)中的应用。本文所描述方法促进内源性il-12产生的能力是令人惊讶的,其可以导致在血浆中系统性地可检测到il-12的水平而不具有毒性。这种结果使得能够利用患者自身的免疫系统以获得由于存在il-12对于肿瘤和癌细胞的减少和/或消除所引起的益处。
这些方法的用途也可以应用于对th1环境积极应答的其他疾病的降低和/或消除,尤其是对il-12。这种疾病包括癌症、感染性疾病,包括慢性病毒性和细胞内细菌或分枝杆菌性疾病,如乙型肝炎、丙型肝炎、hiv1、hiv2、htlv1、htlv2、hpv、结核杆菌、牙周病和如变应性哮喘的变态反应性疾病。此外,促进内源性il-12产生的方法可以通过维持细胞免疫而具有抗衰老的作用。在正常个体中,th1细胞相对于th2细胞的平衡作为老龄化进程的一部分而降低,这使得老年人更易患感染性疾病和癌症。促进内源性il-12产生可以增加th1/th2比率,由此防范对疾病的易感性。
本发明的所述组合物一般包括外源性抗原,优选同种异体抗原。所述药物组合物还包括至少一种th1细胞因子和/或至少一种能够引致树突细胞成熟化以产生il-12的树突细胞效应分子。所述治疗组合物一般包括至少一种th1细胞因子,和/或至少一种与所述同种异体抗原结合在一起的树突细胞效应分子。所述组合物优选地包含活的同种异体的被激活的t细胞,这种t细胞能够在单一细胞类型中提供所述组合物中每个组分。在优选的实施方案中,采用活的同种异体th1细胞,所述活的同种异体th1细胞被激活以便产生th1细胞因子,如干扰素-γ、肿瘤坏死因子-α和白介素-2,并在所述细胞表面表达所述树突细胞成熟化效应分子cd40l。或者,所述组合物中的所述三种组分可以来源于多个细胞类型。例如,在组合物中所述th1细胞因子可以来源于一种细胞类型,所述同种异体抗原来自不同的细胞类型,以及所述树突细胞效应分子来自第三种细胞类型。或者,一种细胞类型可以包含所述组分中的任意两种,和第二种细胞类型包含第三种组分。所述细胞类型不需要是活的,只要他们提供所述组合物的所述必要组分的来源。
或者,所述组合物组分可以来源于天然的或者生物工程的蛋白质。例如,重组或纯化的th1细胞因子或树突细胞成熟化分子或同种异体抗原可以一起使用或与活细胞组分组合使用。所述组合物组分可以被结合在“芯片”或生物可降解平台上。所述组分不需要被同时传递给患者,而可以以任何顺序被传递给患者。
在所述治疗组合物中的所述同种异体抗原必须以这样的方式提供,通过该方式该抗原可被吞噬或提呈给免疫系统从而被处理和提呈给t细胞。该抗原可以是活细胞的天然部分,也可以是利用分子生物学技术改变的或生物工程改造的。该抗原可以是可溶性的或者被固定在表面上,活的生物体或细胞的完整部分,或减毒生物体的一部分。在优选的实施方案中,所述同种异体抗原为同种异体的t细胞,在更优选的实施方式中,为同种异体的被激活的t细胞。
在一个示例性的实施例中,所述治疗组合物包括表达于t细胞上的同种异体抗原。所述t细胞优选为cd4+t细胞,更优选地为th1细胞。所述th1细胞可以是由来源于正常血液供体的幼稚cd4+前体细胞经体外分化、扩增和激活而来。优选地,所述细胞在给药时是处于被激活的状态的。优选地所述细胞通过交联针对cd3/cd28表面分子的单克隆抗体而被激活。该交联优选地通过在表面固定化所述cd3/cd28单克隆抗体而实现。优选地,所述表面是微米珠或纳米珠颗粒。这些珠子可以是生物可降解的。这些细胞可以产生大量炎症th1细胞因子,还可以在细胞表面表达效应分子,例如cd40l,其用于通过引起内源性il-12的产生促进th1免疫的发展。
在优选的实施方案中,所述治疗组合物包括被激活的同种异体th1细胞。这些被激活的th1细胞可以作为强有效的抗炎药。这些被激活的同种异体th1细胞和用于制备它们的方法被详细描述于美国专利7,435,592、7,678,572、7,402,431和7,592,431中,通过参照将其并入本文。该被激活的同种异体th1细胞是故意针对患者错配的。
各种各样的th1炎性细胞因子可以被包含在所述治疗组合物中。th1炎性细胞因子的例子包括:il-1、il-2、il-6、il-12、il-15、ifn-γ、tnf-α、tnf-β,gm-csf和c-c趋化因子,并且不包括tgf-β、il-4或il-10。所述细胞因子组分可以为天然的或重组的细胞因子,或者可以为设计为与细胞因子的受体相互作用的生物工程分子。所述细胞因子可以被直接包括在所述治疗组合物中。或者,所述治疗组合物可以包括活的细胞或者其他产生和分泌所述细胞因子的组分。优选地,所述细胞因子通过被激活的细胞源自然地被提供,由于外源性细胞因子对于患者往往是极毒的而内源性细胞因子却不是。在一些示例性的实施方式中,这些治疗组合物包括处于被激活状态而产生和分泌所述th1炎性细胞因子的t细胞,由此,这些治疗组合物可以作为所述这些治疗组合物中细胞因子的来源。
所述治疗组合物可以包括引致所述未成熟树突细胞成熟化的一个因子(afactor)或几个因子(factors),具体地,促进树突细胞1细胞成熟化的成熟化因子和引起干扰素-γ产生和th1适应性免疫的il-12产生。树突细胞对引发免疫应答是所必需的,该树突细胞能够由未成熟的、抗原-捕获细胞进化为成熟的、抗原-呈递的、t细胞-致敏的细胞,从而将抗原转化成为免疫原并表达细胞因子、趋化因子、共刺激分子。t细胞介导的免疫应答的类型(th1vs.th2)引起取决于从周围微环境接收的激活信号的变化。树突细胞调控如抗肿瘤和抗感染性疾病免疫的能力取决于促进th1免疫的树突细胞成熟化。人类树突细胞不是同源性群体。除了引起抗肿瘤免疫,树突细胞可以引起无效或耐受。树突细胞源于cd34+造血干细胞(hsc)。髓样树突细胞(dc1)和类浆细胞树突细胞(dc2)为人类树突细胞的两个主要亚群,他们的表型、迁移和功能特性差异极大。dc1细胞为有效的t细胞刺激因子,引起肿瘤特异性免疫应答。cd11c+dc1细胞首先引起th1分化,而表达il-3(cd123)受体的dc2主要促进th2应答。在患有癌症的患者中两种树突细胞群显著低于在健康供体中的。dc1细胞成熟化后产生il-12,而dc2细胞产生il-10。
在所述树突细胞成熟化进程中,细胞因子如il-10和il-12的产生影响th1或th2免疫应答的dc诱导。除了抗原呈递分子和共刺激因子分子水平的高表达,成熟树突细胞必须释放大量il-12从而刺激th1免疫应答。il-10的释放通过干扰共刺激因子分子的上调和il-12的产生而阻碍所述树突细胞成熟化进程,这限制了树突细胞引发th1应答的能力。
各种各样因子可以在摄入和处理抗原后引起树突细胞的成熟化而成为dc1(il-12产生细胞),包括:完整细菌或细菌源性的抗原(例如,脂多糖,lps),炎性细胞因子如ifn-γ、tnf-α、il-1、gm-csf,,选择细胞表面抗体的配体(例如cd40),病毒性产品(例如双链rna),在未成熟树突细胞上的fas啮合(fasengagement),例如,这种fas啮合引起成熟化以及il-1β和ifn-γ的释放。cd40的连接促进所述共刺激因子分子(例如b7-1/cd80和b7-2/cd86)和il-12分泌以及趋化因子释放的上调(例如,il-8、mip-1α、mip-1β)。
在一些优选的实施方案中,包含cd40l作为用于所述树突细胞成熟化的因子。引起所述树突细胞成熟化的其他因子的内含物也在本发明的保护范围之中。在一些示例性实施方案中,这些治疗组合物包括处于被激活状态的t细胞,该t细胞在表面上表达高密度的dc40l。dc40l是用于树突细胞成熟化而产生il-12的强有效的效应分子。
在一些示例性的实施方案中,所述治疗组合物包括被激活的同种异体t细胞、至少一种i型细胞因子和至少一种引致树突细胞成熟化的效应因子。包含这些组分的这些组合物被描述于,例如,在2010年12月14日提交的、专利申请号为12/967,910、审查中的美国专利申请中,并通过参照将其并入本文。
在消融一些肿瘤细胞后瘤内给药所述治疗组合物从而释放肿瘤相关抗原进入所述微环境可以为树突细胞成熟化为dc1表型提供一个强有效的辅助作用,其中dc1表型产生il-12并促进i型抗肿瘤免疫的发展和肿瘤免疫逃逸机制的下调。给药所述治疗组合物还可以通过其他方法而被完成,例如静脉内的、皮肤内的、鞘内的、腹膜内的、病灶内的、胸膜内的给药和诸如此类。优选地,所述组合物首先被皮内给药,因为皮肤有大量的被成为朗格汉斯细胞的未成熟树突细胞。在th1炎性细胞因子(如干扰素-γ、肿瘤坏死因子-α、il-2和gm-csf)和树突细胞成熟化因子(如cd40l)的存在下,所述朗格汉斯细胞摄入所述同种异体抗原并成熟化为dc1,该dc1为il-12产生细胞。这些成熟细胞迁移到淋巴结并促进th1免疫的发展。
皮内注射所述组合物可以“致敏”患者对所述组合物中的所述同种异体抗原产生免疫力。多次皮内注射可以增强th1记忆细胞的数量,这会反过来改变所述th1/th2平衡,其中所述th1记忆细胞特异性针对所述患者的循环中所述同种异体抗原。优选的皮内注射剂量为1x106个到1x107个同种异体的被激活的th1细胞,每1毫升液体中含有1x107个细胞是最优选的。所述皮内注射剂量优选地被重复多次从而建立循环中th1记忆细胞的数量。所述皮内注射剂量的频率优选为每7天注射约3~4次,更优选地每3~4天。
在优选的实施方案中,继皮内给药后是通过肿瘤内给药所述组合物以建立原位疫苗。优选地将在靶病灶的一些肿瘤细胞进行原位消融后进行所述肿瘤内给药。优选地通过采用极度冷(冷冻消融术)或极度热(辐射)引致所述消融,但也可以利用各种包括酒精消融法、化学疗法和/或单克隆抗体药物的方法进行。肿瘤内给药的优选剂量在约1x107个细胞和1x108个细胞之间,最优选地为约3x107个细胞。优选地第一次肿瘤内给药在所述消融后即刻进行注射并在约7天内节进行第二次,优选地在所述第一次注射的约3~4天内。该在消融后进行肿瘤内注射所述组合物的过程可以根据需要重复。
所述方法还优选地包括通过静脉内给药所述组合物从而引致(先天的和获得的)宿主免疫细胞的激活及其向炎性部位的渗出,包括肿瘤部位。静脉内给药包含同种异体的被激活的th1细胞的组合物的优选剂量包括约1x107个细胞~1x109个细胞,更优选地约5x107个细胞~1x108个细胞。该静脉输注可以被重复若干次,优选的以月计。
所述包含同种异体th1细胞的组合物优选地产生大量i型细胞因子:il-2、ifn-γ、tnf-α和gm-csf。在th1炎性细胞因子的存在的微环境中未成熟树突细胞吞噬和处理抗原可以帮助促进成熟化为dc1,该dc1为il-12产生细胞。il-12可以刺激ifn-γ的水平,这反过来可以引起促进th1免疫。ifn-γ是对促进i型抗肿瘤免疫所必须的一种重要的i型细胞因子。ifn-γ可以通过直接抑制肿瘤细胞生长并诱导t细胞介导的抗肿瘤应答而调节抗肿瘤作用。ifn-γ的分泌可以独立地影响nk细胞应答,还可以增强由il-12激活的nk细胞应答。
包含被激活的同种异体th1细胞的优选药剂可以来源于前体细胞,该前体细胞从正常或筛选过的血液供体纯化而来。所述细胞应以无菌、低内毒素的剂型提供,该剂型被制成适于皮内的或肿瘤内注射或者静脉输注。该细胞还可以制成适于腹膜内的、胸膜内的或硬膜外的输注。优选地供体被测试为hiv1、hiv2、htlv1、htlv2、hbv、hcv和rpr(梅毒)为阴性,并且优选地细胞被测试为支原体、ebv和cmv阴性。在优选的实施方案中,被激活的同种异体细胞为与患者hla不匹配的。
本发明的方法通常涉及在患者的血浆中产生可检测水平的内源性il-12。该方法包括按照这样的方式给药本发明的组合物,通过该方式能够操纵患者的免疫系统以在患者的血浆中以可检测的水平产生内源性il-12。本文中所述的方法可以提高癌症患者中th1免疫细胞的循环数目,改变th2环境与th1环境的平衡。另外,该方法也可包括下列步骤:引发抗肿瘤特异性th1免疫性和/或激活先天的和适应性的免疫反应的组分以产生持续的th1细胞因子环境以便下调肿瘤免疫逃逸。
本发明的该方法可以包括给药一种包含外源性抗原的组合物以促进患者中的th1免疫抵抗外源性抗原。该方法也可包括消融肿瘤的全部或者部分导致至少一些肿瘤坏死。许多方法可用于在该患者中产生肿瘤坏死。该方法也可包括接近于肿瘤坏死位点,即肿瘤损伤的位点,造成炎性的微环境。另外,该方法还可以包括激活患者适应性的和先天的免疫细胞以保持延长的th1环境。在优选实施方案中,该方法的主要组成包括使用包含如上所述激活的同种异体的t细胞的药物或组合物。
因为大多数人类癌症患者通常出现极化的th2免疫性,这个治疗方法的目标通常是用于提高癌症患者中循环th1细胞的量。循环th1细胞的数目在癌症患者中可以被增加,通过为患者给药上述包括外源性抗原的治疗组合物之一。
在一示范性实施方案中,患者被皮内注射给药激活的同种异体的th1细胞。在优选实施方案中,皮内注射是按照周进度表进行的,一周一次持续约3-4周。在其它优选的实施方案中,皮内注射可以是每隔3-4天给药多次。皮内注射可以是每隔一天或相隔至多一年地给药。注射日程表应该设计成能提高th1记忆细胞在循环中的足迹。表达在外源细胞上的同种异体抗原可以刺激有效的免疫排斥响应。另外,th1细胞因子在组合物中的存在或通过同种异体细胞表达th1细胞因子可以提供炎性的辅助环境,这对于控制针对同种异体抗原的免疫反应朝向th1记忆免疫性而言是必要的。这可以造成在患者循环中的提高的th1记忆细胞汇合,所述患者对于同种异体th1细胞中包含的同种异体抗原是特异性的。多重给药可以作为加强注射,提高对于同种异体抗原特异性的循环记忆th1细胞的数目。
在一些实施方案中,给药同种异体的激活的t细胞之后可以进行另外的步骤以提高患者响应。这些步骤可以包括例如消融肿瘤,其造成肿瘤坏死,以及瘤内给药另外的同种异体的激活的t细胞。也可进行另外的静脉内给药同种异体的激活的细胞。这些方法被描述于har-noy的美国专利no.7,972,594中,通过参照引入本文。
使用本文中所述的方法给药该治疗组合物或药物可以促进在患者中通过患者自身的免疫系统系统性产生内源性il-12。患者中的内源性il-12的浓度足以il-12可以在患者血浆中被检测到。可检测水平的il-12是内源的,并且不是任何治疗组合物中所包存在的组分的结果,因为通常该组合物的组分被患者的免疫系统在排斥响应中消除,其中排斥响应通过给药同种异体的材料引起。在优选实施方案中,该组合物包含不能产生il-12的t细胞。因此任何在患者血浆中产生的il-12都是通过患者的自身免疫系统产生il-12的结果。
优选地,il-12是通过患者的免疫细胞产生的,例如患者自身单核细胞、天然杀伤细胞和树突状细胞。这些细胞将在通过给药本文中所述的组合物所产生的炎性的或i型细胞因子的影响下成熟。
患者的血浆中il-12的浓度可以变化但是通常为至少约8000pg/ml。患者的血浆中il-12的浓度优选在约8000pg/ml至200,000pg/ml之间。如这里所述,在患者的血浆中检测的il-12的浓度没有招致毒性问题。然而,给药外源的il-12已经知道对于患者是有毒的。与在血清中没有表达il-12的患者相比,在血浆中血清转化至il-12表达的患者具有提高的存活。il-12的水平可能与存活无关,只是il-12的存在是重要的。
通常在给药组合物后一段时间检测il-12的增加。优选地,在给药治疗组合物约3-4周之后,在血浆中可以检测到il-12。在给药上次组合物之后,在il-12血清转化方面可能会有约90-120天的延迟。
可以通过使用许多方法检测血浆中的il-12。il-12具有两个亚基,称为p40和p35链,优选p40特异性的抗体用于检测。许多方法可以用来检测il-12的存在。il-12的检测可以包括例如elisa和细胞因子珠阵列。
本文中所述的方法可以适于许多患者包括人类。该方法也可对其它哺乳动物使用。
本发明还包括治疗患者中疾病的方法。该疾病可以包括如上所述的癌性的肿瘤、血液恶性肿瘤以及由病原体所引起的疾病。对患者中th1响应敏感的其它疾病也可以使用本文中所述的方法治疗。根据本文中所述的方法为患者给药同种异体的组合物。患者的血浆然后后监控il-12的存在。检测到内源性il-12可以是患者对该疾病免疫反应的表现。可以进行另外的给药治疗组合物用于维持il-12水平并且由此保持患者的免疫反应抵抗疾病抗原。
实施例
进行该研究以监控被同种异体的激活的th1细胞治疗的患者中的il-12水平。这些激活的同种异体th1细胞和用于制备他们的方法被描述于美国专利no.7,435,592。激活的同种异体th1细胞故意与患者错配。
皮内注射-皮内注射给药激活的同种异体th1细胞。细胞悬浮于1ml中,密度为1x107个细胞/ml。
瘤内注射-在消融一小时内,在被消融的肿瘤的坏死中给进行瘤内注射给药。
冷冻消融是利用cryocare-28percutaneousprobesystem(endocare,ca,usa)进行的。该系统使用joule-thomson效应以在封闭系统中冷却冷冻探针的末端。根据气体系数和针头的尺寸,不同的气体元素在接近枕头的区域产生不同的温度交换事件。氩气用于冷却(-187℃),氦气用于加热(67℃)。
在ct成像引导下,鉴定和定位所计划的目标肿瘤损伤。形成无菌区域,并且为计划的插入位点给药局部麻醉药。皮下插入导引探针,并且通过ct确认在目标肿瘤损伤内。进行一两次冻-融循环。根据目标肿瘤的尺寸,使用2-mm或5-mm的单个探针。冷冻的时间为大约5~20分钟,依赖于ct上可见到的“冰球”的出现。融化时通过在开始第二次冷冻处理之前,在与冷冻相同的时间内输入氦气而完成的。该过程需要消融肿瘤损伤样品,而不需要完整地消融肿瘤以及无肿瘤边缘。
在第二冷冻循环之后,在注射同种异体激活的th1细胞之前,对损伤进行冷却。
表1、2和3显示了具体治疗的时机,以及在所指定日期患者血浆中il-12的水平。图1是在该研究过程中患者免疫系统表达il-12的示意图。
表1
pt#11
表2
表3
尽管已经参考优选实施方案对本发明进行了描述,但本领域技术人员能够理解可以在细节和形式上对本发明做出改变,而不离开本发明的主旨和范围。
- 还没有人留言评论。精彩留言会获得点赞!