一种肿瘤免疫治疗复合物及其制备方法和用途与流程
本发明涉及肿瘤药物技术领域,具体涉及一种肿瘤免疫治疗复合物及其制备方法和用途。
背景技术:
含有非甲基化cpg二核苷酸的合成寡核苷酸(cpgodn)能激活脊椎动物的免疫系统。根据其结构和功能特点,cpgodn是分为3种:a型cpgodn,在回文序列中含有cg双核,在5"和/或3"末端用3-6poguanoineses封端,能够活化浆细胞id树突状细胞产生大量干扰素-α(ifn-α),间接激活nk细胞,促进细胞毒性t淋巴细胞的诱导。b型cpgodnps残基并需要至少一个cpg双核和优选两个或更多,这可以刺激b细胞的增殖和活化并直接触发蚂蚁的分化。igen呈示细胞(apcs)。c型cpgodn具有a型和b型cpgodn的性质,需要在5’端共刺激序列中的cpg和palindromic序列。"t"hes的免疫刺激特性一直吸引着开发cpgodns作为治疗多种癌症的单一药物的研究。提高单药cpg的疗效odn,我们已经尝试开发新的cpgodn,并考虑到它们的二级结构。如果在cpgodn中存在回文序列,则可能会出现带茎和环的发夹结构。这个茎,可以提供额外的抗药性,普遍存在的核酸酶,被认为是必需的干扰素-α诱导。回文消失后,cpgodn诱导的干扰素α明显减少。研究表明,5‘端的茎导致干扰素-α诱导丢失,揭示了tlr9识别需要一个可接近的5’端。此外,拉长th树干长度在一定程度上可以提高cpgodn诱导ifn-α的活性。此外,循环内外的cg二核苷酸也影响cpgodn的活性。据报道,cgodn在其循环中具有cg二核苷酸的cpgodn诱导的单核细胞衍生il12水平高于具有cg二核苷酸的cpgodn点突变。位于odns环内的cg双核肽的ns降低了它们il-12产生的能力。
cpg-odn是toll样受体9(tlr9)激动剂,通过tlr9诱导炎性细胞因子和一型干扰素(ifn)激活体液或细胞免疫。在人类中tlr9仅在浆细胞样树突状细胞(pdc)和b细胞中表达,b淋巴细胞和浆细胞样树突状细胞(pdc)能够直接响应cpg的刺激作用。迄今为止开发的cpg是具有20个碱基的单链合成odn。并且他们根据其结构和免疫反应性的差异大致分为四类。
由于cpgodn不仅能够促进thl、促炎性细胞因子的产生以及apc的成熟和活化,还能增强多肽类肿瘤疫苗的免疫原性。它诱导的细胞因子微环境能促进辅助性t细胞应答,这些特性使其可在临床研究中用作抗肿瘤的免疫增强剂。但cpgodn独立用于治疗癌症时,其诱导的免疫应答的强度不足以消除肿瘤(《新型免疫增强剂cpgodn的研究进展》,徐宁等,《安徽农业科学》,2019,47(6):8-10)。当前有一些研究是通过对cpgodn的序列进行筛选,以期提高cpgodn的抗肿瘤效果。例如:中国专利文献cn109022431a公开了一种cpg寡核苷酸,该cpg-b型寡核苷酸的序列为tcgtcgtttgtcgtttgacgtt或tcgtcgtttgacgtttcgtttg或tgctgctttgagctttgctttg,该研究表明,上述3种cpg-b型寡核苷酸可用于抑制肺癌的体积;中国专利文献cn109593765a公开了一种cpg寡脱氧核苷酸,其可用于诱发宿主内tlr9-活化免疫反应、tlr21-活化免疫反应或其组合,包含:一个或多个重复的gtcgtt序列;一个或多个重复的gtt序列;以及一个或多个重复的tttt序列,其中,至少一个重复的gtcgtt序列是编码在gtt序列及tttt序列之间。该cpg寡核苷酸可用于治疗多种肿瘤。虽然上述cpg寡核苷酸可用于治疗肿瘤,但单独的odns的水溶性和稳定性较差,很难透过细胞膜,而且易被血清和细胞质中和核酸酶清除,这大大阻碍了odns的免疫应用。
中国专利文献cn108578694a公开了一种cpg寡脱氧核苷酸修饰的空心金纳米球,该cpg寡脱氧核苷酸修饰的空心金纳米球由包括但不限于空心金纳米球溶液、cpg寡脱氧核苷酸、表面活性剂、缓冲液制备的混合液振荡培养所得。该cpg寡脱氧核苷酸修饰的空心金纳米球可依靠近红外光热效应消融原发肿瘤,在原位生成肿瘤相关抗原,在cpg寡脱氧核苷酸的促进下,激活树突细胞(dc)以增加对肿瘤特异性t细胞的刺激来促进转移肿瘤的消退。该cpg寡脱氧核苷酸修饰的空心金纳米球的制备过程复杂且其用于肿瘤治疗时,还需借助近红外光热效应,造成治疗的不便。
乙肝核心蛋白病毒样颗粒是不含病毒核酸的空壳结构,许多病毒结构蛋白都具有自动组装成vlps的能力,在形态结构上与天然的病毒颗粒相似,具有很强的免疫原性和生物学活性。由于vlps不含有病毒遗传物质,因此不具有感染性,其中有些已经作为疫苗成功应用于临床。vlps在结构上允许外源基因或基因片段的插入而形成嵌合型vlps并将外源性抗原展示在其表面。
乙肝病毒核心抗原(hbcag)在1987年被第一次用作外源抗原病毒样颗粒载体。用于hbcag表达的表达系统具有多样化,包括原核表达系统、哺乳动物细胞表达系统、转基因植物表达系统、酵母表达系统、昆虫细胞表达系统等,并且都能达到较高产量,形成天然颗粒状结构。由大肠杆菌表达系统表达产生的hbcag主要有两种颗粒大小,一种包括180个亚基(t=3,t=triangulationnumber),另外一种包括240个亚基(t=4),部分颗粒中包裹大肠杆菌核酸。每个形成颗粒的亚基都是由hbcag单体形成的二聚体,构成颗粒外部的刺突。两个hbcag单体通过二硫键形成一个亚基,每个hbcag单体有4个cys残基,包括cys48、cys61、cys107、cys183。其中cys107包裹在颗粒内部;cys48部分参与单体间二硫键形成,剩下的残基游离在颗粒表面;而cys61和cys183则全部参与单体间或二聚体之间二硫键形成,和野生型的hbcag具有同样的结合方式。对于全长183个氨基酸的hbcag来说,前144个氨基酸属于颗粒装配区,主要功能和病毒颗粒状形成有关。而第145~183个氨基酸属于核酸结合区富含精氨酸,具有三个重复的sprrr结构,主要作用是结合病毒核酸并将其包裹至病毒颗粒内部对病毒核酸起到保护和提供复制场所的功能。hbcag氨基酸序列中第78~82个氨基酸之间是主要免疫区域(majorimmunodominantregion,mir),这个区域呈现在颗粒表面刺突的顶部;第127~133个氨基酸在主要刺突旁边形成一个小的刺突,这两部分为hbcag表面的主要b细胞识别位点。mir区域由于分布在颗粒表面的刺突顶部,具有易于与受体结合和不影响外源片段自然构象的优点。但对于hbcag单体的n末端和c末端而言,插入片段时需要考虑是否呈现在颗粒表面、是否影响颗粒结构组装和插入片段是够能保持天然构象这三方面问题。c末端在144个氨基酸之后插入小片段序列不会影响颗粒自组装,但是插入片段的大小对插入片段是否能正确折叠和是够能呈现在颗粒表面有很大影响。n末段插入外源序列要保持序列正确构象和颗粒表面呈现比较困难,所以对插入片段大小有严格的限制。用结构比较松散的截短型即前144个氨基酸形成的颗粒,可以提高n末端插入片段呈现在颗粒表面的可能性。
当前,乙肝病毒样颗粒用于治疗肿瘤时,一般将乙肝病毒样颗粒作为抗肿瘤药物的载体或通过将肿瘤的抗原、抗体或相应的核苷酸序列插入到乙肝病毒样颗粒之间,制备病毒样颗粒疫苗来起到治疗肿瘤的目的。例如,中国专利文献cn105497886a公开了一种乙肝核心抗原病毒样颗粒作为肿瘤治疗性疫苗的载体的技术方案,该文献公开了通过将hpv16e749-57ctls表位肽段经基因重组插入到乙肝病毒核心抗原的78-79位氨基酸之间,得到的重组质粒phbcag-e749-57转化入大肠杆菌dh5α,经诱导表达及纯化,得到呈递e749-57的hbcag病毒样颗粒疫苗,经该病毒样颗粒疫苗免疫荷瘤小鼠后能够诱导机体产生较强的hpv16e7特异性的细胞免疫应答,并显著抑制肿瘤的生长。但由于对于hbcag单体的n末端和c末端而言,插入片段时需要考虑是否呈现在颗粒表面、是否影响颗粒结构组装和插入片段是够能保持天然构象这三方面问题,使得在实际应用中,需要结合所要插入的片段具体考虑,应用的难度较大。
技术实现要素:
发明人创造性地通过将截短的乙肝核心抗原hbc-144用作c类cpg的载体制成了肿瘤免疫治疗复合物,该免疫治疗复合物在不采用抗肿瘤药物、肿瘤抗原或抗体的情况下,即可起到治疗肿瘤的目的。
本发明的肿瘤靶向免疫治疗复合物采用如下技术方案:一种肿瘤靶向免疫治疗复合物,所述肿瘤免疫治疗复合物包括纳米载体和包封于所述纳米载体的cpg,所述纳米载体主要由hbc-144组成,所述cpg为c类cpg。
优选的,所述hbc-144的78-82位氨基酸被所述靶向肽取代。
优选的,所述靶向肽的两端分别通过连接肽与所述hbc-144的第77位氨基酸和第83位氨基酸相连,所述靶向肽的氨基酸序列为rgd,所述连接肽的氨基酸序列为gtsgssgsgsggsgsgggg。
优选的,所述纳米载体还包括连接于所述hbc-144的ph敏感多肽,所述ph敏感多肽为聚组氨酸多肽,所述聚组氨酸多肽由5-15个组氨酸组成。
优选的,所述c类cpg包括但不限于下述任意一种或几种的组合:
d-sl03,序列为:tcgcgaacgttcgccgcgttcgaacgcgg;
d-sl02,序列为:tcgcgtcgttcgcccgtcgttcggta;
d-sl01,序列为:tcgcgacgttcgcccgacgttcggta;
gc-odn,序列为tgcccaagcttgccccccttgcaagcgcgg。
优选的,所述cpg为硫代或非硫代cpg。
本发明的第二目的在于提供如上述任意一项所述的肿瘤免疫治疗复合物的制备方法,具体技术方案为:包括如下步骤:(1)通过基因工程的方法表达、纯化所述纳米载体;(2)将所述cpg通过尿素解聚法或热激法装载于经步骤(1)处理得到的所述纳米载体。
优选的,所述尿素解聚法的步骤为:(1)解聚:将纯化得到的所述纳米载体与解离液在4℃孵育;(2)重组:将经步骤(1)处理的得到的混合液移入分子量为8000~14000da的透析袋中先后置于重组缓冲液1和重组缓冲液2中透析;(3)向经步骤(2)处理所得溶液中加入解离液在4℃下孵育2.5h后加入cpg,在震荡条件下继续培养30min,之后转入分子量为8000~14000da的透析袋中;(4)将透析袋先后置于重组缓冲液1和重组缓冲液2中透析,透析结束即得所述肿瘤免疫治疗复合物;所述解离液为ph=8.0的含有50mmtris-hcl、150mmnacl和8.0m的尿素;所述重组缓冲液1为ph=8.0的含有50mmtris-hcl、150mmnacl、10%甘油和1%甘氨酸;所述重组缓冲液2为ph=8.0的含有50mmtris-hcl、150mmnacl和1%甘氨酸。
优选的,所述热激法的具体步骤为:(1)将所述纳米载体与cpg以2:1的比例混合;(2)将步骤(1)所得混合物于60-80℃加热70-100min;(3)使步骤(2)所得混合物自然降温至室温;(4)将步骤(3)所得混合物装入透析袋中,置于透析液中透析去除未包封游离cpg。
优选的,所述步骤(1)中纳米载体与cpg按照2:1的比例混合;所述步骤(2)中加热温度为70℃,加热时间为90min,加热方式为水浴、油浴或沙浴;所述步骤(3)中透析袋为截留量为3.5kda的透析袋,透析液为pbs或生理盐水。
本发明还提供了如上述任意一项所述的肿瘤免疫治疗复合物的用途,具体技术方案为:所述肿瘤免疫治疗复合物在制备治疗乳腺癌药物中的应用。
本发明的有益效果是:本发明的肿瘤免疫治疗复合物可通过激活体内免疫应答的方式,实现抑制肿瘤细胞的生长、减小肿瘤体积的目的。
本发明选用hbc-144作为cpgodn的载体,其本身为蛋白质,易于在体内生物降解,安全性好。hbc-144纳米载体的粒径在30-40nm,该范围内纳米载体颗粒稳定,具有肿瘤富集作用。
本发明通过在纳米载体hbc-144的主要免疫区域插入靶向肽的方式,使hbc-144具有靶向性,有助于提高治疗效果。
本发明选用rgd作为靶向肽,并在rgd两端分别连接连接肽,使两端的连接肽分别与hbc-144的第77位和83位氨基酸相连,使得本发明的肿瘤免疫治疗复合物可靶向高整合素受体表达的肿瘤细胞,进而将cpgodn靶向运输至肿瘤细胞表面。本发明的hbc-144纳米载体可靶向多种高整合素受体表达的肿瘤细胞,例如,黑色素瘤、结肠癌、乳腺癌、肺癌、前列腺癌、脑癌或头颈癌等。
本发明通过采用热激法可将cpgodn包封于纳米载体hbc-144中,制备方法简单。
本发明的肿瘤免疫治疗复合物相对于单纯的c类cpg,抑制肿瘤生长的性能更好。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
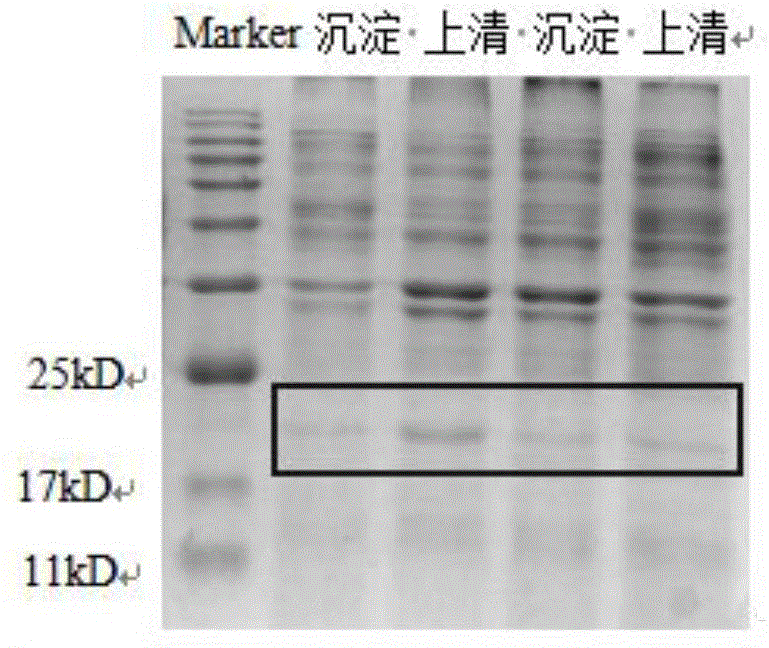
图1为本发明的纳米载体的sds-page凝胶电泳图;
图2为电子显微镜观察到的实施例一纯化得到的纳米载体形态图;
图3为实施例二hbc-vlps/d-sl03与d-sl03cpgodns分别处理人pbmc测得的ifn-α曲线。
图4为实施例三测得的d-sl03cpgodns对不同动物淋巴细胞的免疫刺激活性结果图;
图5为实施例四测得的本发明的肿瘤免疫治疗复合物的靶向性荧光成像照片;
图6为实施例五测得的本发明的肿瘤免疫治疗复合物的抗乳腺癌作用结果图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例一:纳米载体的制备
1.构建纳米载体的氨基酸序列:hbc-144(氨基酸序列为mdidhykefgasvellsflpsdffpsirdlldtasalyrealespehcsphhtalrqailcwgelmnlatwvgsnledpasrelvvgyvnvnmglkirqilwfhiscltfgretvleylvsfgvwirtppayrppnapilstlp)的第78-82位氨基酸(即dpasr)被靶向肽rgd和连接于靶向肽rgd两侧的连接肽(gtsgssgsgsggsgsgggg)取代,即本发明的纳米载体的氨基酸序列为mdidhykefgasvellsflpsdffpsirdlldtasalyrealespehcsphhtalrqailcwgelmnlatwvgsnlegtsgssgsgsggsgsggggrgdggggsgsggsgsgssgstgelvvgyvnvnmglkirqilwfhiscltfgretvleylvsfgvwirtppayrppnapilstlp
2.在上述纳米载体的基础上,还可使hbc-144与ph敏感多肽(聚组氨酸多肽)相连,其氨基酸序列为mdidhykefgasvellsflpsdffpsirdlldtasalyrealespehcsphhtalrqailcwgelmnlatwvgsnlegtsgssgsgsggsgsggggrgdggggsgsggsgsgssgstgelvvgyvnvnmglkirqilwfhiscltfgretvleylvsfgvwirtppayrppnapilstlphhhhhh;其中hhhhhh也可被替换为hhhhh、hhhhhhhhhhhhhhh、hhhhhhhhh(可选自5-15个h相连的任意一种聚组氨酸多肽)等。
3.将上述(1)和(2)设计得到的氨基酸序列提供给上海杰瑞生物技术有限公司,由该公司根据所提供的氨基酸序列合成编码氨基酸序列的核苷酸,并将合成的核苷酸序列通过xhoi/ndei酶切位点构建到表达载体质粒pet43.1(a)中,备用。
4.将上述表达载体质粒pet43.1(a)转化入大肠杆菌bl21(de3)中表达目的蛋白(纳米载体),分离、纯化获取目的蛋白(纳米载体),具体步骤如下:
4.1转化质粒:
4.1.1.取100μl感受态细胞于冰浴上融化。
4.1.2.加入2μl纯质粒或连接产物,(枪头蘸一下即可)轻轻吹打混匀,冰浴30min。
4.1.3.将管放入42℃(温度计测温度)水浴中热激90秒
4.1.4.立即放入冰浴中2min(以上都可以)。
4.1.5.加入800ullb液体培养基(不加抗生素)轻轻混匀,于37℃恒温摇床上200rpm温育45min。照台子,擦涂布棒
4.1.6.将菌液4000rpm/min离心5min,留300μl上清将菌体轻轻打散,拿三个平板分别涂50μl、100μl、150μl菌液于含抗生素(1:1000,amp)的琼脂平板表面,
4.1.7.平板于37℃倒置培养过夜(12~16h)。
4.2目的蛋白(纳米载体)的诱导表达:(1)挑取含表达载体的bl21(de3)单菌落,在lb培养基(含100μg/ml氨苄青霉素)中37℃,255rpm培养至对数期;
(2)菌液与培养基按1:1000的比例稀释,37℃,255rpm培养过夜,使其od600值达到0.5~0.6;按照1︰1将菌种稀释至新鲜培养基,37℃,255rpm培养2h;
(3)37℃温度下诱导,iptg终浓度为1mm;
(4)诱导4h后,取出1ml菌液,12,000rpm离心1min后去上清(收集上清液,作为样品进行sds-page凝胶电泳,做2个,参见图1中标示有“上清”的条带),加入100μlpbs重悬菌体,样品(收集重悬液,作为样品进行sds-page凝胶电泳,做2个,参见图1中标示有“沉淀”的条带)用12%sds-page凝胶电泳分析。
sds-page凝胶电泳分析的具体方法如下(电泳图详见图1):
(1)20μl收集液,加入5×样品缓冲液5μl,在80℃水浴锅中煮5min。按照配方制sds-page凝胶,安装好电泳仪,在槽中加入电泳缓冲液。
(2)按一定顺序在加样孔中加入样品,根据sds-page电泳玻璃板间隙厚度不同,选择加入样品量,一般0.75mm间隙15孔的上样量<10μl/孔,1mm间隙10孔的上样量<20μl/孔。本研究用的上样量为每孔15μl。
(3)打开电源将电压调到80v(一般15min左右),待样品跑过压缩胶后将电压调到120v至样品电泳到胶底部为止。
(4)将凝胶小心取下放入容器中,加入染色液,用摇床摇2-3h
(5)待条带清晰后倒出染色液,加入脱色液过夜
(6)将脱色液倒掉,成像系统拍照、分析、估算蛋白浓度。
备注:(1)收集液即为用于凝胶电泳的样品;
(2)图1中标识有上清的2个条带为相同样品;图1中标识有沉淀的2个条带也为相同样品。由图1可知,实施例一得到的目的蛋白(纳米载体)主要存在于上清液中,蛋白浓度在17-25kd之间。
4.3硫酸铵沉淀初纯目的蛋白(纳米载体):(1)将诱导结束的菌液以4000rpm离心10min后收集菌体,用10mmtris、0.5%tritonph8.0缓冲溶液将菌体吹起;
(2)用超声破碎的方法将菌体破碎,功率300w共超声30min将菌体破碎,此时菌液呈粘稠半透明状,12000rpm离心10min,收集上清(目的蛋白在上清液中,为可溶性蛋白);
(3)将上清液分装在1.5ml离心管中,每管500μl,分别用10%、20%、30%、40%、50%的饱和硫酸铵溶液进行蛋白盐析,在4℃下盐析30min,12,000rpm离心10min,收集沉淀,每个浓度的沉淀取样品进行sds-page检测融合蛋白分布。
4.4deae离子交换色谱纯化
(1)基液平衡柱子:用10倍柱体积含10mmtris-cl(ph8.0)的基液冲洗柱子,至流出液的ph与基液ph一致。
(2)上样:将收集到的样品即硫酸铵沉淀透析后的蛋白粗提取物以3ml/min的流速上样。
(3)上样洗脱:用5个柱体积的基液冲洗层析柱,至紫外检测仪的示数重新回到基线。
(4)洗脱液ⅰ洗脱:用5倍柱体积的洗脱液ⅰ(含10mmtris-cl(ph8.0)、50mmnacl)冲洗柱子,收集洗脱峰。
(5)洗脱液ⅱ洗脱:用5倍柱体积的洗脱液ⅱ(含10mmtris-cl(ph8.0)、100mmnacl)冲洗柱子,收集洗脱峰。
(6)洗脱液ⅲ洗脱:用5倍柱体积的洗脱液ⅲ(含10mmtris-cl(ph8.0)、200mmnacl)冲洗柱子,收集洗脱峰。
(7)洗脱液ⅲ洗脱:用5倍柱体积的洗脱液ⅳ(含10mmtris-cl(ph8.0)、300mmnacl)冲洗柱子,收集洗脱峰。
(8)洗脱液ⅲ洗脱:用5倍柱体积的洗脱液ⅳ(含10mmtris-cl(ph8.0)、400mmnacl)冲洗柱子,收集洗脱峰。
4.5蛋白透析及浓缩
(1)将盛有蛋白溶液的透析袋放入预冷好的透析液中,放在4℃冰箱进行透析;
(2)整个透析过程换4次透析液,直至透析完全;
(3)将透析完全的蛋白溶液放入新的大烧杯中,加聚乙二醇粉末覆盖在透析袋上,袋内溶剂渗出即被聚乙二醇迅速吸去,将烧杯置于4℃冰箱进行浓缩;
(4)在浓缩过程中,少量多次加入干燥的聚乙二醇粉末,以增加浓缩速度,聚乙二醇被水饱和后要更换新的直至达到所需要的浓缩体积;
(5)浓缩结束后,用蒸馏水将透析袋冲洗干净,将浓缩的蛋白溶液取出,即得纯化后的目的蛋白(纳米载体)。根据需要可用bca法定量测定蛋白浓度为0.5mg/ml,用电子显微镜观察所得到的目的蛋白的形态结构(见说明书附图图2)
实施例二药物装载(包括两种方法)
1、尿素解聚法
(1)解聚:取实施例1制备得到的目的蛋白,使目的蛋白与解离液在4℃下孵育3h;
(2)重组:将经步骤(1)处理得到的混合液移入分子量为8000~14000da的透析袋中并置于100ml重组缓冲液1中并在4℃下过夜透析,之后将透析袋置于重组缓冲液2中透析。透析时间总共为48h(在重组缓冲液1和重组缓冲液2中透析的总时间)。经过sds-page电泳验证了制得的蛋白单体分子量。
(3)cpg装载:取1ml经步骤(2)重组后得到的目的蛋白(0.5mg/ml)与预先配制好的解离液在4℃下孵育2.5h,溶液总体积为10ml。此时向上述解离液中加入500mgcpg(c类),伴随轻微震荡,所得混合溶液继续共培养30min。之后,将其移至分子量为8000~14000da的透析袋中,首先置于重组缓冲液1中并在4℃下过夜透析,之后将透析袋置于重组缓冲液2中透析。透析时间总共为48h(在重组缓冲液1和重组缓冲液2中透析的总时间),在重组缓冲液2中透析12h后再更换一次重组缓冲液2,即得本发明的肿瘤靶向免疫治疗复合物,将所得肿瘤靶向免疫治疗复合物保存于-20℃备用。
其中,解离液、重组缓冲液1和重组缓冲液2的具体成分如下:
解离液配制:解离液的ph为8.0,含有50mmtris-hcl,150mmnacl和8.0m的尿素(上述各组分的浓度均为终浓度);
重组缓冲液1︰重组缓冲液1的ph为8.0,含有50mmph8.0tris-hcl,150mmnacl,10%甘油和1%甘氨酸(上述各组分的浓度均为终浓度);
重组缓冲液2︰重组缓冲液1的ph为8.0,含有50mmph8.0tris-hcl,150mmnacl和1%甘氨酸(上述各组分的浓度均为终浓度)。
2、热激法
①混合,将制备得到的纳米载体(0.5mg/ml)与cpg(250μg/ml,c类)以质量比2:1的比例混合;②加热,混合物于70度加热90min;③降温,室温放置10-30min,温度降至室温;④透析,混合物装入截留量为3.5kd的透析袋中,置于pbs中透析,去除未包封游离药物,即得肿瘤靶向免疫治疗复合物;保存于-20℃备用。
实施例二:干扰素-α检测
用d-sl03cpgodns(3μg/ml)与hbc-vlps/d-sl03(3μg/ml,热激法制备得到)分别处理人pbmc(外周血单个核细胞)(每孔6×105/ml)36h,取上清液测定ifn-α。用elisa试剂盒进行免疫组织化学检测,在上清液中进行干扰素-α的检测。图3为检测的ifn-α数值。
实施例三:d-sl03对不同动物淋巴细胞的免疫刺激活性
为验证品种特异性,采用d-sl03与hbc-vlps/d-sl03分别对小鼠(mouse)、大鼠(rat)、兔、猪pbmc的脾细胞增殖能力进行了评价。d-sl03(3μg/ml)和hbc-vlps/d-sl03(3μg/ml)注射剂量相同。实验结果如图4所示,由图4可知,d-sl03和hbc-vlps/d-sl03均可诱导小鼠、大鼠、兔、猪等淋巴细胞剧烈增殖。有趣的是,d-sl03和hbc-vlps/d-sl03可以持续诱导一个强大兔脾细胞和猪pbmc的反应。d-sl03和hbc-vlps/d-sl03对多种动物的淋巴细胞均有影响(图4)。
实施例四:本发明的肿瘤靶向免疫治疗复合物的靶向性
(1)制备标记有cy5的纳米载体
将溶于少量dmso的cy5与要标记的纳米载体按摩尔比为1.5:1进行混合,室温反应30min后,于ph7.4的pbs缓冲液中透析24h以除去过量的cy5,得到标记有cy5的纳米载体。
(2)cpg包封:将实施例一制备得到的纳米载体(0.5mg/ml)与cpg(250μg/ml,c类cpg)以质量比2:1的比例混合;将上述混合物于70℃加热90min,之后自然降温至室温;将混合物装入截留量为3.5kd的透析袋中,置于pbs溶液中透析,去除未包封cpg,得到标记有cy5的肿瘤靶向免疫治疗复合物。
(3)将上述步骤(2)制备好的标记有cy5的肿瘤靶向免疫治疗复合物200μl注射荷瘤小鼠(小鼠乳腺癌肿瘤emt6),用7%水合氯醛麻醉这些小鼠,并于给药后12h和24h通过小动物活体成像仪监测肿瘤及全身的荧光强度。24h后脱颈椎处死小鼠,收集主要脏器、组织和肿瘤,拍摄荧光成像图片,测定荧光强度(图5)。
实施例五:本发明的肿瘤免疫治疗复合物的抗乳腺癌作用
为证实本发明的肿瘤靶向免疫治疗复合物在体内的免疫刺激作用,对小鼠乳腺癌细胞系emt6细胞进行了抗肿瘤活性试验。从肿瘤攻击后第8天起,用hbc-vlps/cpg(实验组)、瘤内注射,隔天注射1次,共注射6次。肿瘤接种后100天监测动物存活情况。其中,hbc-vlps/cpg(实验组)分为两组,其中一组注射hbc-vlps/cpg(d-sl02),另一张注射hbc-vlps/cpg(d-sl03),实验结果详见说明书附图图6。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>河南省生物工程技术研究中心
<120>一种肿瘤免疫治疗复合物及其制备方法和用途
<130>aj192658
<140>2019111209579
<141>2019-11-15
<160>8
<170>siposequencelisting1.0
<210>1
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>1
tcgcgaacgttcgccgcgttcgaacgcgg29
<210>2
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>2
tcgcgtcgttcgcccgtcgttcggta26
<210>3
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>3
tcgcgacgttcgcccgacgttcggta26
<210>4
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>4
tgcccaagcttgccccccttgcaagcgcgg30
<210>5
<211>144
<212>prt
<213>人工序列(artificialsequence)
<400>5
metaspileasphistyrlysglupheglyalaservalgluleuleu
151015
serpheleuproseraspphepheproserileargaspleuleuasp
202530
thralaseralaleutyrargglualaleugluserprogluhiscys
354045
serprohishisthralaleuargglnalaileleucystrpglyglu
505560
leumetasnleualathrtrpvalglyserasnleugluaspproala
65707580
serarggluleuvalvalglytyrvalasnvalasnmetglyleulys
859095
ileargglnileleutrpphehisilesercysleuthrpheglyarg
100105110
gluthrvalleuglutyrleuvalserpheglyvaltrpileargthr
115120125
proproalatyrargproproasnalaproileleuserthrleupro
130135140
<210>6
<211>19
<212>prt
<213>人工序列(artificialsequence)
<400>6
glythrserglyserserglyserglyserglyglyserglysergly
151015
glyglygly
<210>7
<211>180
<212>prt
<213>人工序列(artificialsequence)
<400>7
metaspileasphistyrlysglupheglyalaservalgluleuleu
151015
serpheleuproseraspphepheproserileargaspleuleuasp
202530
thralaseralaleutyrargglualaleugluserprogluhiscys
354045
serprohishisthralaleuargglnalaileleucystrpglyglu
505560
leumetasnleualathrtrpvalglyserasnleugluglythrser
65707580
glyserserglyserglyserglyglyserglyserglyglyglygly
859095
argglyaspglyglyglyglyserglyserglyglyserglysergly
100105110
serserglyserthrglygluleuvalvalglytyrvalasnvalasn
115120125
metglyleulysileargglnileleutrpphehisilesercysleu
130135140
thrpheglyarggluthrvalleuglutyrleuvalserpheglyval
145150155160
trpileargthrproproalatyrargproproasnalaproileleu
165170175
serthrleupro
180
<210>8
<211>186
<212>prt
<213>人工序列(artificialsequence)
<400>8
metaspileasphistyrlysglupheglyalaservalgluleuleu
151015
serpheleuproseraspphepheproserileargaspleuleuasp
202530
thralaseralaleutyrargglualaleugluserprogluhiscys
354045
serprohishisthralaleuargglnalaileleucystrpglyglu
505560
leumetasnleualathrtrpvalglyserasnleugluglythrser
65707580
glyserserglyserglyserglyglyserglyserglyglyglygly
859095
argglyaspglyglyglyglyserglyserglyglyserglysergly
100105110
serserglyserthrglygluleuvalvalglytyrvalasnvalasn
115120125
metglyleulysileargglnileleutrpphehisilesercysleu
130135140
thrpheglyarggluthrvalleuglutyrleuvalserpheglyval
145150155160
trpileargthrproproalatyrargproproasnalaproileleu
165170175
serthrleuprohishishishishishis
180185
- 还没有人留言评论。精彩留言会获得点赞!