在经导管假体瓣膜程序前对主动脉瓣作准备的装置和方法与流程
相关申请的交叉引用
本非临时专利申请要求于2018年3月27日提交的美国临时专利申请序列号第62/648,669号的提交日期的权益,其全部教示内容以参见的方式纳入本文。
背景
主动脉瓣狭窄是一种退行性心脏瓣膜疾病,可通过外科主动脉瓣(sav)和经导管主动脉瓣(tav)置换术进行治疗,生物瓣具有组织瓣,但往往最终将失败。对于失败的生物瓣膜的治疗,重复的置换生物假体植入程序可能出现并发症,包括冠状动脉阻塞的风险和未来经皮冠状动脉介入治疗的困难。
本公开解决了与上述有关的问题和限制。
概述
本公开的方面涉及用于对现有的经植入的经导管假体主动脉瓣进行准备以用于随后的经导管的假体主动脉瓣植入的装置和方法。此类装置和方法减轻了重复瓣膜置换程序引起的冠状动脉阻塞的风险,同时附加地有助于未来经皮冠状动脉介入治疗的进入。替代地,还可以设想本公开的装置和方法可以用于对天然主动脉瓣进行准备以用于递送和植入假体瓣膜。
对主动脉瓣进行准备以用于植入假体主动脉瓣的各种方法包括以下步骤:提供具有包括至少一个瓣叶的主动脉瓣(假体的或天然的)的患者;提供包括切断器械的瓣膜准备装置;以及经由经导管递送将切断器械通过瓣膜准备装置递送至主动脉瓣。然后,将切断器械与至少一个瓣叶接合以切断(一个或多个)瓣叶并且可选地从主动脉瓣的其余部分释放(一个或多个)瓣叶。如果必要,则将瓣膜准备装置移至另一个瓣叶,并且另一个瓣叶脱离或切开。该过程能够可选地继续进行,直到更多或所有瓣叶从支架框架上脱离为止。一旦切断,就可例如经由栓塞保护装置移除瓣叶。瓣膜准备装置从患者体内撤回,并且瓣膜准备好植入假体心脏瓣膜。注意,如果瓣叶移除或明显改变,则患者可能需要临时瓣膜以提供血液动力学稳定性,直到植入新瓣膜为止。应理解的是,所讨论的任何概念都可以与临时瓣膜结合使用(比如在升主动脉或降主动脉内)。在一些实施例中,临时瓣膜还可以结合到(一个或多个)递送导管上。
公开了各种瓣膜准备装置。公开的实施例通常包括用于切断心脏瓣膜瓣叶的瓣膜准备装置,该瓣膜准备装置包括第一导管以及构造成切断钙化的心脏瓣膜瓣叶的切断器械。
一个瓣膜准备装置包括连接于第一导管的第一部分和连接于与第一导管同轴对准的第二导管的第二部分。第一部分和第二部分均由记忆形状的材料制成,该材料偏置以相对于装置的中心轴线向外弯曲。在递送位置中,一个囊状件包含切割系统的第一部分,并且第二囊状件包含切割系统的第二部分。一旦递送并就位,就将第一部分和第二部分脱套,使得第一部分和第二部分扩张至其天然的弓形位置。然后,将第一导管和第二导管布置成使得第一部分和第二部分在瓣膜瓣叶的相对侧上彼此配合或者以其它方式接触瓣膜瓣叶的相对侧。经由第一部分和第二部分的配合或经由电极的接触,第一部分和第二部分共同切断瓣叶。
另一公开的瓣膜准备装置包括导管,该导管具有限定第一内腔和第二内腔的主体。导管还限定从第二内腔延伸穿过主体的轨道。可以致动设置在第一内腔内的铰接器械以使主体铰接,以便将设置在第二内腔中的切断器械递送至瓣叶。切割器械可以包括钩和刀片或电极,所述钩和刀片或电极至少部分地在轨道内延伸,从而一旦定位成与轨道相邻就对瓣叶进行切割。
在另外的实施例中,瓣膜准备装置包括切断器械,该切断器械包括线材和偏置以相对于线材向外弯曲的至少一个臂。每个臂还包括可以致动以切割瓣叶的电极。末端连接于线材的远端,用于刺穿瓣叶以将每个臂电极定位成邻近瓣叶。该装置还包括可从递送位置运动至部署位置的套管,在递送位置中套管覆盖切断器械,并且在部署位置中套管可向近侧缩回以露出切断器械。
在另外的实施例中,一种瓣膜准备装置包括切断器械,该切断器械包括球囊和携带能量以切断瓣叶的至少一根线材。球囊膨胀以优先将激励的线材从瓣叶的根部推到瓣叶的自由边缘。末端连接于装置的远端,用于刺穿瓣叶以将球囊和线材定位在适当的位置。
还囊括了对主动脉瓣进行准备以用于植入假体主动脉瓣的方法。各种方法包括:提供具有包括第一瓣叶的主动脉瓣的患者;以及提供包括切断器械的瓣膜准备装置。切断器械经由经导管递送利用瓣膜准备装置递送至主动脉瓣。然后,切断器械与第一瓣叶接合,并切断第一瓣叶。然后,从患者体内移除瓣膜准备装置。在一些实施例中,还从患者体内移除一个或多个瓣叶。
附图简介
图1a-1b是可以与本公开的装置和方法一起使用的一种合适的假体瓣膜的视图。
图2是瓣膜准备装置的局部截面示意图,该瓣膜准备装置包括互连至相应导管并由相应的远侧囊状件和近侧囊状件压缩的第一部分和第二部分。
图3a是图2所示的瓣膜准备装置的局部剖视示意图,该附图示出了运动以使各个部分脱套并允许这些部分自扩张的囊状件。
图3b是图3a所示的瓣膜准备装置的局部放大示意图。
图4a-4b是设置成致动远侧囊状件的推/拉线材的局部放大剖视图。
图5是可以用于控制图2-4b的装置的导管和/或推/拉线材的运动的手柄组件的立体图。
图6-7示出了定位在图1a-1b所示的假体瓣膜的瓣膜结构的相对侧上的第一部分和第二部分,其中第一部分和第二部分可以变得与瓣膜结构的切断瓣叶接触。
图8a是处于笔直构造的瓣膜准备装置的局部示意图。
图8b是处于铰接构造的图8a所示的瓣膜准备装置的局部示意图。
图9是图8a-8b所示的瓣膜准备装置的剖视图。
图10-11b是图8a-9所示的瓣膜准备装置的局部示意图。
图12a-12g是图8a-11b所示的瓣膜准备装置的局部示意图,其中瓣膜准备装置定位成邻近先前植入的假体瓣膜的一个瓣叶以从假体瓣膜的其余部分移除该瓣叶(其中,为了便于说明,移除了支架框架的一部分)。
图13是图1a-1b所示的假体瓣膜的立体图,该附图经由粗体箭头指示了在如图12c所示的步骤期间装置的远端将定位在何处。
图14a是另一种瓣膜准备装置的局部示意图,该装置包括由套管覆盖的切断系统(为了便于说明,套管示出为透明的)。
图14b是图14a所示的瓣膜准备装置的局部示意图,该附图示出了套管缩回以暴露切断系统。
图14c是图14a-14b所示的瓣膜准备装置的局部示意图,该附图示出了末端缩回到套管中以迫使切断器械的臂向外。
图15是图1a-1b所示的假体瓣膜的立体图,该附图示出了在瓣叶的基部处的目标放置(x),在该目标位置处引导瓣膜准备装置的远侧末端以移除瓣叶。
图16a是图14a-14c所示的瓣膜准备装置的局部示意图,该瓣膜准备装置引导至图15中所示的目标位置(x)(为了便于说明,移除了支架框架的一部分)。
图16b是插入穿过瓣叶的图14a-14c所示的瓣膜准备装置的局部示意图。
图16c是图14a-14c所示的瓣膜准备装置的局部示意图,其中每个臂上的电极激活以切断瓣叶并允许臂扩张。
图17是利用球囊的另一种瓣膜准备装置的局部示意图(为了便于说明,球囊示出为透明的);其中,球囊处于缩瘪或递送布置。
图18a是图17所示的瓣膜准备装置的局部示意图,该球囊(为了便于说明,示出为透明的)处于部署膨胀布置。
图18b是图18a所示的瓣膜准备装置的端视图,该球囊(为了便于说明,示出为透明的)处于部署膨胀布置。
图19a是处于输送装置的图17所示的瓣膜准备装置的示意性侧视图,该瓣膜准备装置定位在瓣叶处以刺穿瓣叶(其中,为了便于说明,移除了支架框架的一部分)。
图19b是处于部署布置的图17所示的瓣膜准备装置的示意性俯视图,该瓣膜准备装置在一个瓣叶中形成狭缝。
详述
现参照附图描述本申请的具体实施例,其中,相似的附图标记指示相同的或功能类似的元件。术语“远侧”和“近侧”在以下的说明中是关于相对于治疗临床医生的位置或方向而使用的。“远侧”或“向远侧”是远离临床医生的位置或沿远离临床医生的方向。“近侧”和“向近侧”是靠近临床医生的位置或沿朝向临床医生的方向。如在本文中关于植入的带支架的假体所使用的,术语“流出”被理解为表示血流方向的下游,而术语“流入”被理解为表示血流方向的上游。
借助
背景技术:
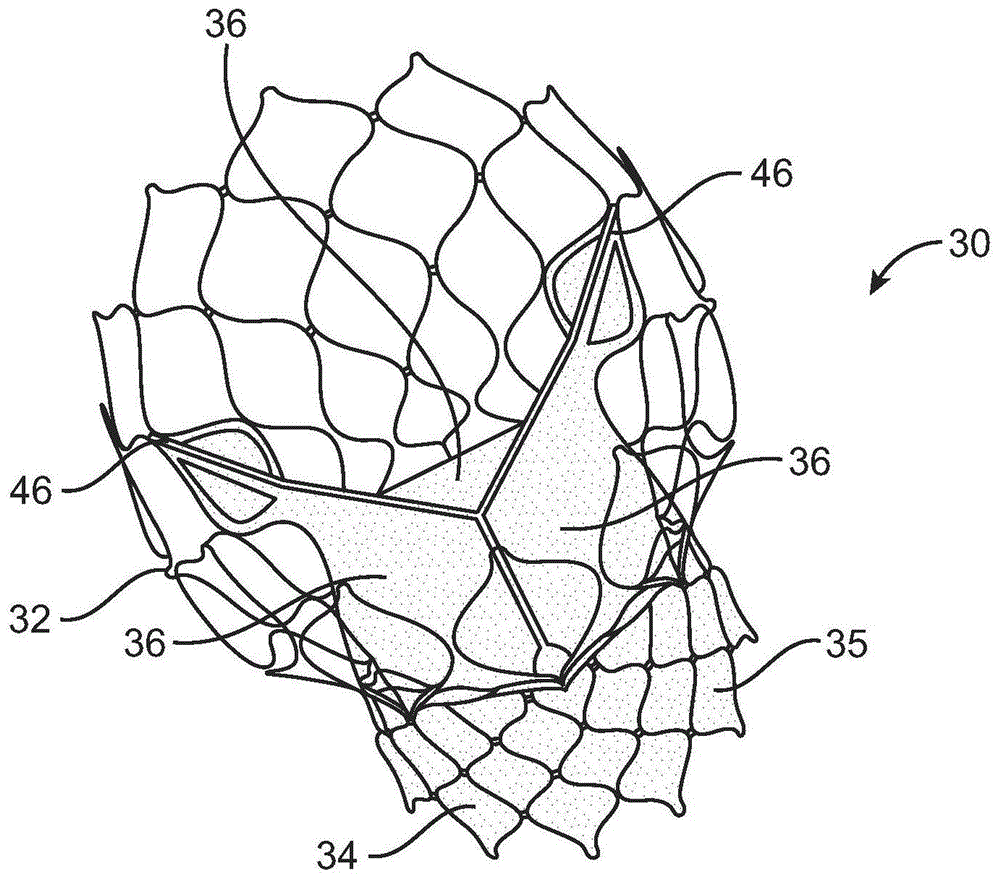
,在图1a-1b中详细地示出了可植入在主动脉瓣处的假体心脏瓣膜30的一非限制性示例。作为参考点,假体心脏瓣膜30在图1a-1b的视图中示出为处于正常或扩张布置。假体心脏瓣膜30包括支架或支架框架32以及瓣膜结构34。支架框架32可以呈现各种形式,并且构造成从压缩布置自扩张至正常扩张布置。例如,可将其它框架构造成经由球囊可扩张或经由手术植入。
带支架的假体30的瓣膜结构34可以呈现多种形式,并且可以由例如一种或多种可生物相容的合成材料、合成聚合物、自体移植组织、同种移植组织、异种移植组织、或一种或多种其它合适的材料形成。在一些实施例中,瓣膜结构34可以由例如牛、猪、马、羊的和/或其它合适的动物组织形成。在一些实施例中,瓣膜结构34由心脏瓣膜组织、心包和/或其它合适的组织形成。瓣膜结构34可以包括或形成有一个或多个瓣叶36。例如,瓣膜结构34可以呈现以下形式:三叶牛心包瓣膜、二叶瓣膜或其它合适的瓣膜。
在一些假体瓣膜的构造中、比如图1a-1b所示的构造中,瓣膜结构34可以包括两个或三个瓣叶36,这些瓣叶在扩大的侧端区域中紧固在一起,以形成连合接头46,而未附连的边缘形成瓣膜结构34的合紧边缘。瓣叶36可以紧固于可选的裙部35,而该裙部又附连于支架框架32。带支架的假体30包括第一端40(流入)、相对的第二端44(流出)以及中间部分或腰部42。如图所示,支架框32可以具有栅格状或单元格状的结构,并且可选地形成或提供有与瓣膜结构34的连合部相对应的柱杆(未示出),以及在第一端40和第二端44中的一个或两者处的特征部48(例如,冠部、孔眼或其它形状)。如果提供,则连合接头46围绕框架32等距间隔开。
随着时间的流逝,瓣叶36可能失效或以其它方式不充分地起作用,因此需要置换。用重复的置换程序治疗失效的人造心脏瓣膜,将置换的人造心脏瓣膜定位在先前植入的假体心脏瓣膜内,可能出现并发症,包括冠状动脉阻塞的风险以及因先前植入的假体心脏瓣膜的瓣叶引起的血流阻塞而导致的未来经皮冠状动脉介入治疗的困难。本发明人已经发现经导管主动脉瓣置换先前植入的经导管主动脉瓣的装置和方法,其降低了上述风险。利用此类装置和此类程序,移除/修改了先前植入的经导管主动脉瓣的瓣叶,使得先前植入的瓣叶不闭塞或阻塞进入冠状动脉的通路。
在图2-7中示意性地示出了瓣膜准备装置50的一种实施例。图2示出了具有切断系统51的瓣膜准备装置50,两者均示出为处于递送构造。瓣膜准备装置50包括延伸装置50的长度的内导管52。切断系统51的第一部分54附连于内导管52。在一些实施例中,内导管52的向近侧/向远侧运动对应地使第一部分54运动。装置50还包括定位在内导管52上并与内导管52同轴对准的中间导管56。切断系统51的第二部分58固定于中间导管56,并且中间导管56的向近侧/向远侧运动可传递以使第二部分58沿着内导管52对应地运动。装置50还包括第一囊状件60和第二囊状件62,每个囊状件在递送构造中覆盖第一部分54和第二部分58中的一个。例如,第一囊状件60可以定位在内导管52上,并且可以在递送构造中压缩地保持和套住第一部分54。如图所示,第二囊状件62连接到与内导管52和中间导管56同轴对准的外轴64,并且可以向远侧和向近侧运动以对应地控制第二囊状件62的运动。
图3a示出了处于扩张布置的瓣膜准备装置50和切断系统51,其中第一部分54和第二部分58已从它们各自的囊状件60、62释放。第一部分54和第二部分58构造成可自扩张,使得从其相应的囊状件60、62中释放导致第一部分54和第二部分58的最大直径的自动扩张。为了实现该效果,第一部分54和第二部分58可以由形状记忆金属网制成。镍钛诺是一种合适的材料。在替代实施例中,第一部分54和第二部分58可以各自包括具有支承杆的塌缩环机构。在又一种实施例中,第一部分54和第二部分58各自包括一系列三角形表面,这些三角形表面在递送位置中在相应的囊状件60、62内克服偏置而塌缩,并且在从相应的囊状件60、62脱套时将扩张。在又一替代实施例中,第一部分54和第二部分58可以各自包括枢转和锁定机构。
为了缩回第二囊状件62,外导管64向近侧缩回。如图4a-4b所示,一根或多根推/拉线材66延伸穿过内导管52中的相应内腔,并连接至第一囊状件60,以致动第一囊状件60的运动,从而套住第一部分54以及使第一部分54脱套。内导管52、中间导管56、外导管64和推/拉线材66的运动能够可选地利用手柄组件70来完成。图5示出了手柄组件70的一非限制性示例。手柄组件70包括连接端72,每个部件52、56、64、66能够可操作地连接在该连接端中。手柄组件70还包括一个或多个相应的致动器74,以单独地或共同地控制部件52、56、64、66的向近侧/向远侧运动。鉴于本公开,应理解的是,仅示出了内导管52、中间导管56、外导管64和推/拉线材66的选择部分,并且这些部件可以根据需要延伸,以使第一部分54和第二部分58能够经导管递送至瓣膜,同时允许手柄组件70保持在患者体外以供临床医生使用。
第一部分54和第二部分58还构造成协配地切断一个或多个瓣叶34。这可通过多种方式来实现。在一个此类实施例中,第一部分54和第二部分58包括共同形成冲头和冲模构造的面或边缘55、59(参见图3a-3b),使得当第一部分54和第二部分58处于扩张布置并在一个或多个瓣叶34的相对侧放在一起时(图6-7),冲头和冲模特征共同切断瓣叶34,以将瓣叶34与假体瓣膜30的其余部分分开。替代实施例可以包括穿孔边缘55。在其它实施例中,第一部分54和第二部分58可以包括位于面55、59上的电极,例如可经由手柄组件70致动的电极,这些电极可以致动以在接触瓣叶组织时切断瓣叶组织。
为了收集和保护患者免受在瓣膜的瓣叶被切断期间产生的碎屑并且还移除切断的(一个或多个)瓣叶,本文公开的实施例可以与任何已知的栓塞保护装置结合使用。此类栓塞保护装置的示例包括但不限于可从加利福尼亚州santarosa的claretmedical公司获得的sentinel脑保护系统(cps)、以及可从加利福尼亚州irvine的edwardslifesciences公司获得的embol-x(r)装置。在各种实施例中,第二部分58还可以构造成用作栓塞保护/移除和瓣叶移除装置。一旦瓣叶被切断并经由栓塞保护装置移除,就可以进行随后的经导管主动脉瓣的递送和植入程序,在该程序中以任何已知的方式在先前植入的支架框架内递送和部署置换瓣膜。在一非限制性的说明性示例中,置换瓣膜是参照图1a-1b公开的类型。
在图8a-12中共同示出了替代的瓣膜准备装置150。瓣膜准备装置150包括导管152,该导管152包括限定多个内腔156a、156b的主体154。沿着主体154的长度延伸的第一内腔156a通向形成在主体154中的轨道158,该轨道158从第一内腔156a径向地延伸。第一内腔156a和轨道158共同维持切断系统160,其包括支承刀片164和钩166的线材162(为了便于说明,仅在一些图中标记了刀片164)。钩166能够可选地对应于第一内腔156a的形状,如图9中最佳所示。可选地,如图8a-8b所示,在瓣膜准备装置150的递送期间,盖176可以固定在主体154的远端172处,以覆盖钩166和刀片164(为了便于说明,在图8a-8b中盖176示出为透明的,并且在后面的图中省略)。线材162向近侧延伸至手柄组件等(例如,参见图5的手柄组件70),手柄组件等可以构造成致动线材162,并由此刀片164和钩166沿着轨道158向远侧和向近侧运动。在第二内腔156b中提供了铰接装置170,该铰接装置170构造成允许导管152铰接。可选地,导管152可以是预成形的、比如j形,以优选地安置在瓣膜瓣叶内。例如,可以通过遵循导丝将导管拉直以进行插入。在其它实施例中,刀片164可用诸如射频(rf)切割元件、超声波切割元件、等离子切割元件、激光切割元件或电极切割元件之类的另一种切割机构代替。铰接装置170可以是任何已知的在导管中提供铰接能力的已知铰接装置(例如,拉线装置)。
在使用期间,瓣膜准备装置150经由经导管程序以图8a中的大致笔直的方式从升主动脉插入。当导管152靠近主动脉瓣a时,导管152经由铰接装置170铰接以形成弯曲形状至图8和12b的位置,并且导管152在升主动脉侧上抵靠一个瓣叶36的基部推动。在上述替代实施例中,导管152用导丝伸直以用于在主动脉瓣a附近递送,然后在移除导丝时转变为弯曲形状。为了维持导管152的位置,临床医生向装置150施加通常恒定且一致的压力,以确保在瓣叶36的基部与装置150的远端172之间形成足够的接触。可选地,远端172可以包括具有带纹理的表面、倒钩或粘合剂的尖端174,以防止装置150从瓣叶36的基部滑落。一旦装置的远端172与瓣叶36的基部接触,钩166就可以接合相邻的连合接头46并在那里找到起钩点(purchase)(由图13中的粗体箭头和c指示)。在提供盖176的实施例中,可能需要用线材162将钩166从盖176中拉出,然后将钩与相邻的连合接头46接合。然后,经由手柄组件70(图5)等将线材162向近侧拉动,使得刀片164将对应地沿着瓣叶36的底部拉动,从而从支架框架32或瓣膜裙部(或瓣膜的组织,如果瓣膜是天然瓣膜)切割瓣叶36。应当注意的是,在图12d-12g中,省略了导管152的近侧部分,以使线材162可见。重复定位装置150并切断一个瓣叶36的过程,直到每个期望的瓣叶36被基本上切除并从支架框架32或裙部分离为止。或者,刀片164可以用于形成一个或多个狭缝而不切断瓣叶36。栓塞保护装置(未示出)可以与装置150结合使用,以解决可能由该过程产生的任何碎屑。此外,一旦分离,栓塞保护装置可以用于捕获和移除瓣叶36。合适的栓塞保护装置的例子包括但不限于以上列出的那些。一旦瓣叶36被切断并经由栓塞保护装置移除,就可以进行随后的经导管主动脉瓣的递送和植入程序,在该程序中以任何已知的方式在先前植入的支架框架内递送和部署置换瓣膜。在一非限制性的说明性示例中,置换瓣膜是参照图1a-1b公开的类型。应理解的是,上述瓣膜准备装置150和相关方法可替代地用于天然瓣膜中,以对假体瓣膜的递送和植入进行准备。
在图14a-14c和16a-16c中示出了又一种瓣膜准备装置250。瓣膜准备装置250包括切断系统254。切断系统254包括线材256和至少一个臂258(例如,两个臂),每个臂具有电极260。臂258可以是具有两个端部的线形式或带形式;其中,至少一端经由盖257等固定于线材256。每个臂258的最远端可以连接至线材256(例如,经由一个盖257)或连接至远侧末端264。带形式的材料是有益的,因为其提供了平坦的外表面,电极260可以在该平坦的外表面上接触瓣叶36。每个臂258由诸如镍钛诺、弹簧钢、聚合物形状记忆材料或缠绕的弹簧构造之类的形状记忆材料制成,并且构造成偏置到图14b的位置。所示实施例包括两个臂258,然而,在替代实施例中可以设想更多或更少的臂。为了使臂258塌缩以用于经导管递送,装置250包括可滑动地定位在臂258上的导管或套管262。在装置250的远侧末端264处包括电极266,该电极266构造成在接触并激励电极266时刺穿瓣叶36。可设想的是,远侧末端264的几何形状可以包括几种形状。远侧末端264构造成提供足够的能量以刺穿瓣叶36,但还必须构造成将装置250引导到位。在所示的实施例中,远侧末端264通常是圆锥形的。其它设想的形状例如包括钝的、圆形的或沙漏形的末端。
在一种示例方法中,瓣膜准备装置250的操作如下进行。在递送构造中,装置250设有覆盖臂258的套管262,使得臂258在套管262内塌缩,使得装置250具有第一宽度或轮廓。装置250在递送位置(图16a)递送至一个瓣叶36的基部,使得远侧末端264接触瓣叶36(该基部在图15中用x表示)。激活电极266以撕裂瓣叶36的基部并形成开口,装置250可以通过该开口定位。一旦将装置250定位在瓣叶36内,使得切断电极260大致邻近瓣叶36,则远侧末端264缩回到套管262中,使得臂258自然地向外弯曲以接触瓣叶36,如图16b中大致所示。可以看出,在此阶段,瓣叶36将收缩并防止臂258完全扩张到其天然位置。在激活电极260时,电极260将切断瓣叶36,并在切断瓣叶36时使臂258更充分地扩张至其天然位置。为了进一步引导电极260进行切割,将线材256向近侧拉出以进一步引导电极260侧向运动以进一步接合瓣叶36。尽管图16c总体上示出了电极260沿水平方向运动,但是当电极260靠近连合接头46时,水平运动可能不足以有效消融瓣叶36组织。因此,各种实施例的电极260构造成经由对套管262和线材256的操纵来水平和垂直地切割。在一实施例中,线材256可以从远侧末端264向近端延伸至装置250的手柄组件(未示出,参见作为一种合适的示例提供的图1a-1b和相关公开),其中手柄组件70(图5)的致动器74控制线材256中的张力,并因此控制线256相对于套管262和手柄组件70的向近侧运动和向远侧运动。
当臂电极260在跟随瓣叶36的曲率到达连合接头46的同时侧向运动时,最有效地完成了瓣叶36的切断。用线材256使臂258塌缩将侧向引导电极260,而手动缩回装置250将供应足够的高度。在此步骤期间,套管262部分地维持在图16c的缩回位置,以将臂258和它们各自的电极260锚定在位。一旦充分地撕裂瓣叶36(即,从支架框架32或裙部分离),臂258就拉回到套管262中进入图16a的递送位置,然后如果期望,装置250可以运动至另一瓣叶36,并且可以重复进行瓣叶切断过程。一旦切断每个期望的瓣叶,就以与递送装置相同的方式使该装置250从患者体内缩回。切断的瓣叶36捕获在上述类型的所提供的栓塞保护装置中,然后与栓塞保护装置一起移除。与先前的实施例一样,一旦瓣叶36被切断并经由栓塞保护装置移除,就可以进行随后的经导管主动脉瓣的递送和植入程序,在该程序中以任何已知的方式在先前植入的支架框架内递送和部署置换瓣膜。在一非限制性的说明性示例中,置换瓣膜是参照图1a-1b公开的类型。
从本公开显而易见的是,瓣膜准备装置250还可以用于从瓣叶与框架相遇的区域(瓣叶的靠近主动脉瓣环中心的瓣叶区域)附近的附连边沿(moa)在瓣叶中切出狭缝。该方法并不移除瓣叶的任何部分,而仅仅是在瓣叶中设置狭槽,以在将第二假体瓣膜植入患者体内时允许瓣叶打开,从而使血液流向冠状动脉,冠状动脉在其它情况下可能由于最初的瓣叶被钉在第一植入物和第二植入物的框架之间而被阻塞。
在一种示例性方法中,装置250包括一个臂258,并且以与以上参照图16a所述相同的方式穿透瓣叶36。在穿透瓣叶36之后,装置250将具有如下的一个臂258:该臂258将从附连的边沿扩张至瓣叶36的自由边缘,并且将射频(rf)能量施加至电极260。形状记忆偏置臂258的偏压力试图扩张,并且来自电极260的rf能量可以切片或切断瓣叶36,从而允许瓣叶36以“v”形狭槽打开,从而允许血液流入冠状动脉。臂258将从图16c中所示的那样对准大约90度。在另一实施例中,一个臂258可以沿着附连的边沿从瓣叶穿透的点延伸到连合部处。结果将是如下的瓣叶:在部署第二瓣膜时将不切断但会被切开并且可以折叠或以其它方式提供冠状动脉通路/灌注。
现在附加地参照图17-19b,这些附图示出了瓣膜准备装置350的另一实施例。瓣膜准备装置350与图14a-14c的瓣膜准备装置大体上相似,不同之处在于臂258由球囊358代替。球囊包括外表面,细长线形电极360定位在该外表面上,并从末端364延伸至递送导管362。与先前公开的实施例一样,末端364可以构造成刺穿瓣叶36,并且可以包括例如电极366。装置350可以进一步包括在支承件356a/末端364内的导丝内腔,该导丝内腔延伸穿过装置350以接纳导丝357。装置350还可以包括膨胀内腔356b,以例如用于经由无对比染料或不含对比染料的盐水来控制球囊358的膨胀。如应理解的,瓣膜准备装置350可以包括手柄,比如图5的手柄。手柄可以例如连接于膨胀源(未示出),并且可以包括用于控制电极360的一个或多个致动器。
在一种示例性方法中,装置350以与以上参照图16a所述相同的方式穿透瓣叶36。在穿透瓣叶36之后,在激励电极360以切割瓣叶36的同时使球囊358膨胀。形状记忆偏置臂358的偏压力试图扩展,并且来自电极360的射频(rf)能量可以切片或切断瓣叶36,从而允许瓣叶36以“v”形狭槽打开,从而允许血液流入冠状动脉(具体地,参见图18a-19b)。电极360可以经由成像对准以引导切口穿过瓣叶36的中心,或者如果期望的话优选地引导至一侧或另一侧。装置350可以替代地被构造成包括多个纵向电极360。每个电极360可以构造成根据期望同时或顺序地激发。
鉴于本公开,应理解的是,瓣叶34的100%可不必从支架框架、裙部或假体瓣膜的其它剩余部分移除。如本文所用,从瓣膜的其余部分移除、切断和切割瓣叶应理解为表示基本上所有的瓣叶都已从支架框架、裙部或假体瓣膜的其它剩余部分中分离,使得在邻近瓣叶的位置植入假体瓣膜后,靠近附连的边沿的任何剩余瓣叶都不出现血流阻塞的风险。应理解的是,当移除瓣叶时,可能需要提供临时瓣膜以提供血液动力学稳定性。
尽管已参照优选实施例描述了本公开,但本领域技术人员应当认识到,可在不脱离本公开的精神和范围内对形式和细节方面进行各种改变。
- 还没有人留言评论。精彩留言会获得点赞!