CD73抗体-药物偶联物的应用的制作方法
本发明涉及医药领域,尤其是涉及cd73抗体-药物偶联物的应用。
背景技术:
近年来,虽然恶性肿瘤的靶向治疗法和免疫治疗法已取得了显著进展,但是肿瘤治疗依然面临药物响应率较低以及继发性耐药频繁的挑战。近期研究表明,肿瘤进展和耐药机制往往涉及到肿瘤与肿瘤免疫微环境的相互作用,而其中的腺苷酶cd73(nt5e)是该领域备受关注的药物靶标。cd73由两个相同的70kd亚基组成,由糖基磷脂酰肌醇(gpi)锚定在细胞膜表面。多种肿瘤如肺癌、乳腺癌、结直肠癌等均发现cd73的高表达与不良预后密切相关。cd73通过催化amp产生大量的腺苷(ado),形成肿瘤免疫抑制的微环境,促进肿瘤发生免疫逃逸。现有靶向cd73的药物研究主要为单克隆抗体,通过结合干预免疫细胞表面的cd73酶活性来改善免疫微环境。
然而在创造本申请的过程中,发明人推测,由于单抗的给药时间间隙较长,组织吸收分布率低,以及酶活性抑制作用的可逆性等限制,当针对cd73表达很高的肿瘤及其肿瘤环境时cd73单抗的抑制效果是有限的。
pct专利申请wo2019170131a1公开了靶向cd73的抗体及抗体-药物偶联物(adc)。其公开的内容表明cd73抗体能够高效、高特异性地结合纯化的cd73蛋白和多种肿瘤细胞表面的cd73,阻断cd73酶的催化活性,其具有很高的亲和力及很低的免疫原性,并且具有显著抗肿瘤作用。并且该专利中表明,cd73人源化单抗与monomethylauristatine(mmae)定点偶联的cd73-adc显示了优异的体外和体内肿瘤杀伤效果。
然而,目前adc研究的主要策略为靶向递送细胞毒物来实现杀伤肿瘤,以上专利公开的内容同样是仅研究了cd73抗体-药物偶联物具备直接杀伤cd73-中高表达的肿瘤细胞的功能。即,目前现有技术中,cd73抗体-药物偶联物已知的功能是直接消除cd73-中高表达的肿瘤细胞。
技术实现要素:
本发明的目的在于提供cd73抗体-药物偶联物(以下简称cd73-adc)的应用,以扩展现阶段cd73抗体-药物偶联物仅具有直接杀伤cd73-中高表达的肿瘤细胞功能的缺陷。
本发明通过理论研究与试验验证发现,cd73抗体-药物偶联物既能直接消除cd73-中高表达的肿瘤细胞,又能降低其它cd73表达异常的肿瘤细胞、基质细胞、免疫细胞的腺苷途径,从而改善肿瘤微环境。
本发明研究发现通过定点偶联技术制备的cd73抗体-药物偶联物能部分保留或全部保留cd73单抗所发挥的腺苷酶抑制活性,同时能直接消除cd73-中高表达的肿瘤细胞,即本发明研究发现cd73抗体-药物偶联物可以实现靶向细胞毒物与腺苷酶抑制剂叠加的双重效果。
本发明的目的可以通过以下技术方案来实现:
本发明提供cd73抗体-药物偶联物的应用,首先,所述cd73抗体-药物偶联物用于制备通过抑制cd73腺苷酶途径激活肿瘤免疫微环境的药物中的应用。
进一步地,所述cd73抗体-药物偶联物用于制备抑制游离cd73或细胞膜cd73酶催化腺苷磷酸(amp)水解生成腺苷(ado)的活性的药物中的应用。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物用于制备以下药物的应用:所述药物为通过抑制cd73腺苷酶途径激活肿瘤免疫微环境,同时对免疫效应t淋巴细胞未显示毒性作用的药物。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物用于制备以下药物的应用:所述药物为通过抑制cd73腺苷酶途径激活肿瘤免疫微环境,同时对免疫效应t淋巴细胞不仅未显示毒性作用,且能有效逆转腺苷磷酸水解生成腺苷过程(简称为amp/ado)对t淋巴细胞增殖及分泌ifn-γ的毒副作用的药物。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物用于制备以下药物的应用:所述药物为通过抑制cd73腺苷酶途径激活肿瘤免疫微环境,同时促进树突状细胞(dendriticcell,dc)成熟,并增强树突状细胞对t淋巴细胞的激活效果的药物。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物用于制备以下药物的应用:所述药物为通过抑制cd73腺苷酶途径激活肿瘤免疫微环境,同时促进免疫效应细胞的浸润,且减少免疫抑制细胞的浸润的药物。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物用于制备杀伤cd73-中高表达的肿瘤细胞,同时通过抑制cd73腺苷酶途径激活肿瘤免疫微环境的药物中的应用。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物用于制备以下药物:所述药物为杀伤cd73-中高表达的肿瘤细胞,同时抑制游离cd73或细胞膜cd73酶催化腺苷磷酸水解生成腺苷的活性的药物。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物用于制备以下药物的应用:所述药物为能够杀伤cd73-中高表达的肿瘤细胞,通过抑制cd73腺苷酶途径激活肿瘤免疫微环境,同时对免疫效应t淋巴细胞未显示毒性作用的药物。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物用于制备以下药物的应用:所述药物为能够杀伤cd73-中高表达的肿瘤细胞,通过抑制cd73腺苷酶途径激活肿瘤免疫微环境,同时对免疫效应t淋巴细胞不仅未显示毒性作用,且能有效逆转腺苷磷酸水解生成腺苷过程(简称为amp/ado)对t淋巴细胞增殖及分泌ifn-γ的毒副作用的药物。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物用于制备以下药物的应用:所述药物为能够杀伤cd73-中高表达的肿瘤细胞,通过抑制cd73腺苷酶途径激活肿瘤免疫微环境,同时促进dc成熟,并增强树突状细胞对t淋巴细胞的激活效果的药物。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物用于制备以下药物的应用:所述药物为能够杀伤cd73-中高表达的肿瘤细胞,通过抑制cd73腺苷酶途径激活肿瘤免疫微环境,同时促进免疫效应细胞的浸润,且减少免疫抑制细胞的浸润的药物。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物用于制备以下药物的应用:所述cd73抗体-药物偶联物用于制备以下药物的应用:所述药物为能够杀伤cd73-中高表达的肿瘤细胞,抑制游离cd73或细胞膜cd73酶催化腺苷磷酸(amp)水解生成腺苷(ado)的活性,对免疫效应t淋巴细胞不仅未显示毒性作用,且能有效逆转腺苷磷酸水解生成腺苷过程对t淋巴细胞增殖及分泌ifn-γ的毒副作用,还同时促进dc成熟,并增强dc对t淋巴细胞的激活效果,且同时促进免疫效应细胞的浸润,且减少免疫抑制细胞的浸润的药物。
即,本发明中所述cd73抗体-药物偶联物可同时具备上述功能。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物选自:pct专利申请wo2019170131a1公开的抗体-药物偶联物(adc)。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物选自pct专利申请wo2019170131a1公开的抗体-药物偶联物(adc)中以下限定的物质:
其中,抗体选自下组:hu001c-14、hu001c-15、hu001c-21、hu001c-22、hu001c-23、hu001c-24、hu001c-25、hu001c-28、hu001c-30、hu001c-31、hu001c-32、hu002c-2、hu002c-3、hu002c-4、hu002c-6、hu002c-7、hu002c-8、hu002c-10、hu002c-11、hu002c-12、hu002c-14、hu002c-15、hu002c-16;
药物选自:
(i)美登素衍生物(dm1、dm4),auristatin和多拉司他汀;
(ii)monomethylauristatine(mmae),monomethylauristatinf(mmaf),monomethyldolastatin10(mmad)类衍生物或其组合;和
(iii)dna损伤药物,较佳地,所述的dna损伤药物包括多卡霉素、吡咯并[2,1-c][1,4]苯二氮卓(pbd)。
在本发明的一个实施方式中,所述cd73抗体-药物偶联物,采用cd73人源化单抗(cd73抗体)hu001c-14(本专利中简写为hu001)制备的cd73-adc优选物hu001c14-bl20-mmae(本专利简写为hu001-mmae)。
在实施例部分针对hu001-mmae开展了针对性研究,验证了该cd73抗体-药物偶联物具有双重抗肿瘤效果及药理机制。
在本发明一个实施方式中,根据对临床肺癌样本中cd73免疫组化染色强度和阳性率的综合评分,将肿瘤分为阴性、低、中和高表达组,然后与肿瘤细胞系来源的肿瘤一起进行定量分析,确定其表达量的高低分组。通过对临床肿瘤样本中cd73蛋白的免疫组化检测和基因表达数据库分析发现,cd73在肿瘤中表达量远高于正常组织,达到类似于或高于cd73-中高表达的肿瘤细胞系。这为开发cd73-adc的临床重要性和可行性提供了良好的基础。
本发明所述cd73-adc药物能够直接杀伤cd73-中高表达的肿瘤细胞,而对表达量低的肿瘤细胞无明显杀伤作用。
通过体外实验意外地发现,本发明所述cd73-adc药物与相应的单抗药物活性一致,依然能够有效抑制游离cd73或细胞膜cd73酶催化腺苷磷酸(amp)水解生成腺苷(ado)的活性。
在本发明一个实施方式中,所述cd73-adc药物对cd73低表达的免疫效应t淋巴细胞未显示毒性作用。通过体外实验意外地发现,所述cd73-adc药物对cd73低表达的t淋巴细胞不仅未显示毒性作用,并能有效逆转amp/ado对t淋巴细胞增殖的毒副作用。
在本发明一个实施方式中,所述cd73-adc能显著促进dc的分化和成熟,进一步增强dc对t淋巴细胞的激活效果。
本发明所述cd73-adc能通过两方面作用来促进dc的活化。首先,通过抑制cd73酶活性逆转ado对dc分化的抑制作用;第二,通过体外实验意外地发现,cd73-adc(mmae偶联物)相比cd73抗体能更强更有效的诱导dc成熟,从而进一步提高dc对t淋巴细胞增殖的激活效果。
在本发明一个实施方式中,所述cd73-adc药物在小鼠体内能够显著促进肿瘤组织中免疫效应细胞的浸润,同时也减少免疫抑制细胞的浸润。通过激活肿瘤免疫微环境,达到抑制肿瘤发展的效果。通过多个肿瘤模型的体内实验发现,经cd73-adc治疗的肿瘤显示了大量成熟dc细胞的浸润和聚集,而cd73抗体治疗后的肿瘤内未见明显成熟dc的浸润。
在本发明一个实施方式中,所述cd73-adc在体内能够显著减少肿瘤微环境中m2型巨噬细胞的浸润。并且,经过cd73-adc治疗的肿瘤内浸润了大量促炎型巨噬细胞,而cd73抗体治疗后的肿瘤内未见大量促炎型巨噬细胞的浸润。
综上,本发明研究的cd73-adc不仅是针对cd73-中高表达肿瘤的靶向细胞毒药物,同时也是活性极强的cd73腺苷酶(nt5e)抑制剂;其一方面通过靶向递送细胞毒药物导致cd73-中高表达的肿瘤消退,同时通过结合阻抑其它cd73异常表达的肿瘤细胞和免疫微环境的腺苷途径来发挥叠加抗肿瘤效果。
与现有技术相比,本发明证实了cd73-adc独特的双重技术效果,一方面直接杀伤cd73-中高表达的肿瘤,另一方面通过抑制cd73腺苷酶途径实现激活免疫微环境;该双重叠加的药理机制具有高效低毒的特点,为难治型肿瘤的治疗提供了新的策略。
以下将结合附图以及具体实施方式、实施例对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
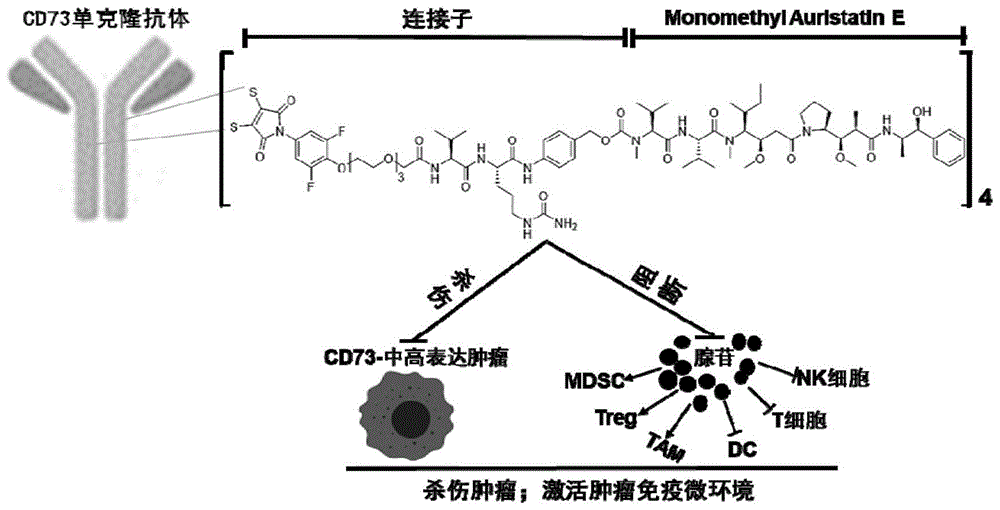
图1为本发明的技术效果。图1展示了本发明的cd73-adc的分子结构及其双重抗肿瘤机制示意图。cd73-adc一方面通过靶向递送细胞毒药物导致cd73-中高表达的肿瘤消退,同时通过结合阻抑其它cd73异常表达的肿瘤环境的腺苷途径来发挥叠加抗肿瘤效果。
图2为cd73蛋白在临床肺癌和癌旁组织芯片样本中的表达。按免疫组化(ihc)综合评分值进行排序,并分为cd73阴性、低阳性、中阳性和高阳性组,计算出两种组织在不同cd73表达组中所占比例(图2a)及代表性样本的染色图片(图2b)。
图3为肿瘤细胞(ccle数据库)或正常人体组织(getx数据库,http://gtexportal.org)中cd73mrna的相对表达量。
图4为cd73在临床肺癌样本和人肺癌细胞株制备的异种移植瘤中的表达。图4a为不同cd73染色强度的临床肺癌样本和细胞系异种移植瘤的染色图片。图4b是对4a中200x视野的image分析的平均灰度值(左)及相对灰度值(右)。
图5为cd73-adc针对cd73低表达肿瘤细胞mda-mb-453,以及针对cd73-中高表达细胞系nci-h441和nci-h292增殖的抑制效果。
图6为cd73抗体和cd73-adc对重组人游离cd73酶催化腺苷磷酸(amp)水解生成腺苷(ado)活性的抑制作用(ic50)。
图7为cd73抗体和cd73-adc对nci-h1299细胞膜cd73酶催化amp水解生成ado活性的抑制作用(ic50)。
图8为流式细胞荧光分选仪(facs)检测乳腺癌mda-mb-453,肺癌nci-h460、nci-h292、nci-h441、nci-h1299、calu-1,人外周血单核细胞(peripheralbloodmononuclearcell,pbmc)和t淋巴细胞的细胞膜cd73蛋白的表达水平。
图9为cd73-adc对t淋巴细胞增殖的影响。图9a是不同浓度adc对t细胞的抑制曲线,图9b是100nmcd73-adc对cd4+/cd8+t淋巴细胞的抑制作用。
图10为cd73-adc和cd73抗体均能有效逆转amp对人t淋巴细胞的增殖抑制作用。试验采用分选获得cd3+人t淋巴细胞,培养5天后统计细胞增殖率。
图11为100nm浓度的cd73-adc能有效逆转amp对人t淋巴细胞ifn-γ分泌的抑制作用。试验采用分选获得cd3+人t淋巴细胞,将其培养5天后检测t淋巴细胞培养上清。
图12为cd73-adc能够促进树突状细胞(dendriticcell,dc)成熟。图12a为dc双染cd11c/cd86的facs散点图,图12b为各组cd11c/cd86双阳性细胞比例。
图13为cd73-adc能有效增强dc对t细胞激活的作用。图13a为经cfse(carboxyfluoresceinsuccinimidylester)标记的t淋巴细胞增殖的facs散点图,图13b为增殖的t淋巴细胞的比例统计。
图14为cd73抗体和cd73-adc能够有效逆转amp/ado对dc分化的抑制作用;并且,相比cd73抗体,cd73-adc能更优异地促进dc的成熟。图14a为双染cd11c/cd86的facs散点图,图14b为各组cd11c/cd86双阳性细胞比例。
图15为在amp/ado环境下,相比cd73抗体,cd73-adc处理后的dc能更显著的促进dc对t淋巴细胞的激活效果。图15a为各组cfse标记的t细胞增殖的facs散点图,图15b为增殖的t细胞的比例统计。
图16为cd73-adc对非小细胞肺癌细胞nci-h441裸鼠移植瘤的治疗效果及对成熟dc、m2型和促炎型巨噬细胞浸润的影响。图16a是药效试验结束取瘤时瘤体积,图16b是经cd73抗体(左)和cd73-adc(右)给药的肿瘤组织中成熟dc标志物cd11c和cd86荧光染色图及双阳性区域信号值,图16c是经cd73抗体(左)和cd73-adc(右)给药的肿瘤组织中巨噬细胞标志物f4/80和m2型巨噬细胞标志物cd206ihc染色结果(左),及各组f4/80阳性区域值与cd206阳性区域值的比值(右)。
图17cd73-adc和多烯紫杉醇对非小细胞肺癌细胞nci-h292裸鼠移植瘤的治疗效果及对成熟dc、m2型和促炎型巨噬细胞浸润的影响。图17a是药效试验结束取瘤时瘤体积,图17b是肿瘤组织中成熟dc标志物cd11c和cd86免疫荧光染色图及双阳性区域信号值,图17c是对cd73、巨噬细胞标志物f4/80和m2型巨噬细胞标志物cd206ihc染色结果(左),及各组f4/80阳性区域值与cd206阳性区域值的比值(右)。
图18为cd73-adc和多烯紫杉醇对非小细胞肺癌细胞nci-h1299裸鼠移植瘤的治疗效果及对成熟dc、m2型和促炎型巨噬细胞浸润的影响。图18a是药效试验结束取瘤时瘤体积,图18b是对成熟dc标志物cd11c和cd86免疫荧光染色图及双阳性区域信号值图,图18c是对cd73、巨噬细胞标志物f4/80和m2型巨噬细胞标志物cd206ihc染色结果(左),及各组f4/80阳性区域值与cd206阳性区域值的比值(右)。
具体实施方式
本发明人通过理论假设,研究设计并大量试验论证,证明了由定点-偶联mmae制备的cd73抗体-药物偶联物hu001c14-bl20-mmae(cd73-adc)具有独特的双重抗肿瘤分子机制。如图1总结的技术效果所展示,本发明研究的cd73-adc能够直接杀伤cd73-中高表达的肿瘤细胞,而对cd73低表达的肿瘤细胞或正常细胞无明显毒副作用;cd73-adc同时也是活性很强的腺苷酶抑制剂,能直接阻断cd73催化腺苷单磷酸(amp)水解生成腺苷(ado)的活性,保护和增强免疫效应细胞的活性及功能;cd73-adc具有优异的体内抗肿瘤治疗效果,减少免疫逃逸的发生。在此基础上完成了本发明。
实施例1cd73在肿瘤中表达水平高于人体正常组织
为研究cd73在肿瘤和正常组织中的表达水平,我们对临床肺癌和癌旁样本组织芯片(outdobiotech,cat#hluga180su07)和采用人肺癌nci-h441,nci-h292和nci-h1299细胞株制备的裸鼠移植瘤切片进行cd73免疫组织化学染色(ihc)。临床肺癌和癌旁的染色结果由病理学家进行分级。ihc综合评分(combinedscore,cs)用染色强度×阳性肿瘤细胞(癌标本)或肺上皮细胞(癌旁标本)的百分比来量化。cs值(合格癌86例,癌旁81例)分为cd73阴性组(cs=0,n=66)和cd73阳性组(cs>0,n=101)。将阳性的cs标本分为低阳性组(</=中位数;n=51),其余50例标本按新的中位数分组,分为中阳性(n=25)和高阳性(n=25)。
选取cd73阴性、低阳性、中阳性和高阳性组具有代表性的临床肿瘤样本以及肺癌细胞移植瘤的染色图片,用imagej软件分析并计算3-4个独立视野(200x)平均灰度值和相对灰度值。
使用ccle数据库中肿瘤细胞或getx数据库(http://gtexportal.org)中正常人体组织的cd73mrna值比内参基因β-actin的mrna值,得到cd73mrna相对表达量。
结果如图2显示,对临床肺癌和癌旁样本的分析发现,cd73在86%的癌和33.3%的癌旁中呈阳性,其中52.35%的癌(n=45)和6.17%的癌旁(n=5)呈中度和高度阳性。说明cd73在蛋白水平上癌组织的表达量远高于癌旁组织。
结果如图3显示,cd73在基因水平上肿瘤细胞系中的表达量远高于人体正常组织。
结果如图4a为代表性临床肺癌样品组和细胞系异种移植瘤的典型染色图像。图4b为图4a的平均灰度定量值。结果显示异种移植瘤模型nci-h441、nci-h292和nci-h1299中cd73表达水平处于临床肺癌样本中或高阳性组范围内。
综上,本实施例结果说明cd73在肿瘤中的表达量远高于人体正常组织,这一结果为进一步的cd73-adc研究提供了依据。
实施例2cd73-adc对cd73-中高表达肿瘤细胞的杀伤作用
为研究cd73-adc对不同cd73表达水平肿瘤细胞的杀伤作用,我们使用cd73低表达细胞系mda-mb-453,cd73-中高表达细胞系nci-h441和nci-h292(购自atcc或中国科学院细胞库)作为体外抑瘤实验模型进行研究。
将处于对数生长期的上述细胞,分别以每孔800-2500个细胞的密度接种至96孔细胞培养板中,150μl/孔,37℃,5%co2培养约5-12h后,分别加入不同浓度的cd73-adchu001-mmae,每个药物浓度设置2-4个复孔,及相应的溶媒对照和空白对照孔,作用5-6天后(根据细胞生长速度,保证细胞分裂足够次数),倾去培养液,加入mts反应液(购自promega,cat#g3581),100μl/孔,于37℃反应至预期颜色深浅,测定每组的细胞活力(od490nm),并按照以下公式计算细胞存活率:存活率=(od给药-od空白)/(od对照-od空白)×100%。通过graphpadprism5软件分析上述数据,并分别计算上述cd73-adc在不同细胞株上的ic50值。
结果如图5所示,在受试浓度区间内,cd73-adc对cd73低表达的肿瘤细胞mda-mb-453无明显毒副作用(ic50>100nm),而对cd73-中高表达的肿瘤细胞nci-h441和nci-h292具有较强的抑制作用(ic50分别为0.023±0.006nm和0.051±0.007nm)。
综上,本实施例结果说明cd73-adc能够针对cd73-中高的肿瘤细胞产生杀伤作用,而对cd73低表达的肿瘤细胞无明显抑制作用。
实施例3cd73-adc对游离cd73及肿瘤细胞膜cd73酶催化amp水解生成ado的活性抑制作用
为研究cd73-adc是否具有与相应单抗药物同样的抑制cd73酶催化腺苷磷酸(amp)水解生成腺苷(ado)的活性的作用,我们使用cd73-adc以及cd73抗体平行进行了研究。
用抗原稀释液将人重组游离cd73酶(cd73胞外区)稀释成0.1μg/ml,均匀铺到96孔低吸附培养板中,25μl/孔。将50μlcd73抗体hu001和cd73-adchu001-mmae按照3倍梯度从2nm稀释到0.0009nm的cd73抗体加入培养板中,混匀(终浓度为1nm~0.00045nm),37℃孵育1h后,入25μl含有1.2mmamp和0.4mmatp的混合液,37℃孵育1h。取出上述反应液50μl加入另一96孔白板中,向每孔加入50μlcelltiter-glo试剂,混匀避光反应3-5min,采用酶标仪检测荧光信号强度。
采用cd73高表达的非小细胞肺癌细胞nci-h1299作为靶细胞。铺2500/孔肿瘤细胞(经预实验确认)于96孔板中,37℃培养16小时之后,用无血清rpmi-1640培养基洗涤细胞3次,将50μlcd73抗体hu001和cd73-adchu001-mmae按照3倍梯度从100nm稀释到0.045nm的受试抗体加入96孔板中,37℃孵育30min后,加入25μl0.9mm的amp,置37℃,5%co2培养3h(终浓度66.6nm~0.03nm)。取出上述培养上清25μl加入另一个96孔白板中,加入25μl0.1mmatp,混匀。向每孔加入50μlcelltiter-glo试剂,混匀避光反应3~5min,使用酶标仪检测荧光信号强度。
检测结果如图6所示,cd73抗体和cd73-adc均具有显著抑制重组游离cd73蛋白酶水解amp生产ado的活性,其ic50分别为0.045nm和0.048nm。
检测结果如图7所示,cd73抗体和cd73-adc均能抑制nci-h1299细胞膜cd73催化水解amp生产ado的活性,ic50分别为0.622nm和0.877nm。
综上,本实施例说明cd73-adc与相应的cd73抗体药物活性一致,能够有效抑制游离cd73及细胞膜cd73酶催化amp生成ado的酶活性。
实施例4体外检测cd73-adc对免疫效应t淋巴细胞的保护作用
通过实施例2和实施例3的研究结果发现,cd73-adc不仅能够靶向杀伤cd73-中高表达的细胞,并且具有抑制cd73酶催化amp生成ado的功能。因此,为研究cd73-adc对免疫效应细胞的作用效果,我们首先检测了人外周血单核细胞(peripheralbloodmononuclearcell,pbmc)和t淋巴细胞中cd73的表达,又进一步研究了cd73-adc对t细胞增殖的作用以及逆转amp/ado对t淋巴细胞的增殖的作用。
采用1x105个细胞与cd73抗体ab001混匀(终浓度10μg/ml),然后于4℃孵育1h,pbs洗涤细胞两次以去除未结合的一抗,再将细胞与pe标记的二抗4℃孵育30min,pbs洗涤细胞两次以去除未结合的二抗,最后将细胞重悬在200μlpbs中,通过流式细胞荧光分选仪(facs)检测平均荧光强度(meanfluorescenceintensity,mfi)。
t细胞的复苏、扩增和分选:pbmc冻存管均由江苏西迪尔生物技术有限公司提供。首先采用含有500ng/mlcd3/cd28抗体和100iu/mlil-2的培养基将pbmc复苏培养3-4天,然后采用分选试剂盒(供应商:stemcell,cat#1795)分选出cd3阳性的t淋巴细胞。
检测对cd73-adc对t细胞增殖的影响,将t细胞铺至96孔板中(20000个细胞/孔),分别加入溶媒(缓冲液)、按照梯度稀释的higg1-mmae和hu001-mmae(终浓度100nm~0.001nm,n=4),混匀,培养4-5天后,使用facs读取并统计固定体积的细胞数,作剂量曲线图,计算ic50值。
另一组实验中,将t细胞铺至96孔板中(20000个细胞/孔),加入溶媒、higg1-mmae和hu001-mmae(100nm),培养后第4-5天将t淋巴细胞取出,经离心后使用cd4+/cd8+荧光抗体双染,使用facs读取固定体积的细胞并统计cd4+/cd8+活细胞数。
另一组实验中,将上述分选得到的t细胞进行荧光标记,将预先配好的cfse(carboxyfluoresceinsuccinimidylester)加入细胞悬液(终浓度2.5μm),使其在37℃标记5min后,pbs洗涤3次。然后将cfse-标记的t细胞铺至96孔板中(2x104个细胞/孔),分别加入溶媒,50μl按照梯度稀释的higg1和hu001(终浓度10nm~0.0001nm,n=4)或higg1-mmae和hu001-mmae(终浓度100nm~0.001nm,n=4),并加入50μl腺苷单磷酸(amp,终浓度为0.25mm),混匀,培养4-5天后收集培养上清,使用facs读取并统计固定体积的细胞。
t细胞ifn-γ的检测:吸取50μl/每孔t细胞培养上清用于检测ifn-γ蛋白浓度,采用elisa试剂盒(联科生物技术有限公司,cat#ek180hs-48),并参照试剂盒所提供的技术操作步骤。
结果如图8所示,采用cd73抗体ab001(与hu001对应的嵌合抗体)特异性识别和结合细胞膜表面的cd73,与cd73-中高表达的肿瘤细胞相比,pbmc和t淋巴细胞表面的cd73表达量较低。
结果如图9所示,与溶媒和higg1-mmae相比,在受试浓度区间cd73-adc未对t淋巴细胞产生毒副作用(ic50>100nm),并且未对cd4+/cd8+t细胞的增殖产生影响。
结果如图10所示,cd73抗体和cd73-adc均能有效逆转amp/ado对t淋巴细胞的增殖抑制,其ec50为分别为0.08±0.01nm和0.09±0.01nm。
结果如图11显示,100nm浓度的cd73-adc能有效逆转amp/ado对t淋巴细胞表达/分泌ifn-γ的抑制作用。
综上,本实施例的结果说明cd73-adc对t淋巴细胞不仅无毒性作用,并且能有效逆转amp/ado对t淋巴细胞的增殖及分泌ifn-γ的毒副作用。
实施例5体外检测cd73-adc对树突状细胞成熟的促进作用
树突状细胞(dendriticcell,dc)是激活t细胞,nk细胞等的关键免疫效应细胞,本实施例研究了cd73-adc对dc的直接作用效果,以及逆转amp/ado对dc成熟的抑制作用。
dc的诱导分化:首先将1x106个pbmc接种在24孔板中,1ml/孔,在细胞培养箱中使细胞恢复12h,然后加入gm-csf(60ng/ml,1000u/ml),il-4(100ng/ml,500u/ml)。培养36小时后,将上清吸掉,换上培养基及含有上述同样浓度的细胞因子,并在此时加入溶媒,higg1-mmae(5μg/ml),hu001-mmae(5μg/ml),并留一空白孔。继续培养4天,在空白孔中加入lps(0.5μg/ml)。24小时后收集细胞,使用cd11c和cd86抗体荧光染色,采用facs读取固定的活细胞数,统计双阳性细胞比例。
另一组实验中,前面步骤与上述相同,在培养36h更换培养基和细胞因子后,在对应孔中加入溶媒,amp(0.25mm),higg1(5μg/ml),hu001(5μg/ml),higg1-mmae(5μg/ml),hu001-mmae(5μg/ml)。继续培养5天,收集细胞,使用cd11c和cd86抗体荧光染色,采用facs读取固定的活细胞数,统计cd11c/cd86双阳性细胞比例。
dc与t细胞共培养:首先将志愿者1来源的2x105个pbmc接种在96孔板中,0.1ml/孔,在细胞培养箱中恢复12小时,然后加入gm-csf(60ng/ml,1000u/ml),il-4(100ng/ml,500u/ml),培养36h,将上清吸掉,换上含有上述同样浓度的细胞因子,并在此时加入溶媒,higg1-mmae(5μg/ml),hu001-mmae(5μg/ml)并留一空白孔。继续培养4天,在空白孔中加入lps(0.5μg/ml)。24小时后将培养板离心(1700rpm,5min),吸掉上清,并使用pbs洗两遍,将cfse-标记的志愿者2来源的t淋巴细胞铺至96孔板中(2x104个细胞/孔),继续培养3-5天后,采用facs读取并统计固定活细胞数,并根据细胞分群圈出增殖的细胞。
另一组实验中,前面步骤与上述相同,在培养36小时更换培养基和细胞因子后,在对应孔中加入溶媒,amp(0.25mm),higg1(5μg/ml),hu001(5μg/ml),higg1-mmae(5μg/ml),hu001-mmae(5μg/ml)。继续培养5天后,将培养板离心(1700rpm,5min),吸掉上清,并使用pbs洗两遍,将cfse-标记的志愿者2来源的t细胞铺至96孔板中(2x104个细胞/孔),继续培养3-5天后,采用facs读取并统计固定活细胞数,并根据细胞分群圈出增殖的细胞。
结果如图12所示,在体外pbmc-dc分化成熟的模型体系中,cd73-adc能够促进未成熟dc成熟。
结果如图13显示,在体外dc-t淋巴细胞共培养的模型体系中,cd73-adc能有效增强dc对t淋巴细胞激活作用。
结果如图14显示,cd73抗体和cd73-adc能够逆转amp/ado对dc分化的抑制作用;与cd73抗体相比,cd73-adc具有更强的促进dc成熟的作用。
结果如图15显示,在体外dc-t淋巴细胞共培养的模型体系中,cd73抗体和cd73-adc能够逆转amp对dc分化-t淋巴细胞的激活的毒副作用;与cd73抗体相比,cd73-adc还能够促进dc成熟并进一步增强dc对t淋巴细胞的激活效果。
综上,本实施例说明,与cd73抗体相比,cd73-adc能够更有效的促进dc成熟,并进一步增强dc对t淋巴细胞的激活效果。
实施例6cd73-adc抑制nci-h441肺癌体内肿瘤生长,提高肿瘤微环境中dc成熟活化,减少m2型并增加促炎巨噬细胞的浸润
为研究cd73-adc体内抑瘤效果及对肿瘤免疫微环境的影响,建立了nci-h441肺癌细胞系裸鼠移植瘤模型。将100μl含有5x106nci-h441混匀在100μl基质胶的细胞悬液,接种到免疫缺陷小鼠(balb/c,nude)背部皮下。待肿瘤体积长至100~300mm3,根据肿瘤体积大小及裸鼠体重随机分组(n=8),采用3mg/kghigg1-mmae和hu001-mmae剂量,每周尾静脉给药一次,共计给药2周;另一组中,在接种h441后第一天开始,即采用10mg/kghigg1和hu001剂量,每3天尾静脉给药一次,直至处死小鼠(n=6)。待肿瘤生长至一定体积后,剥取肿瘤,经4%中性多聚甲醛固定、脱水、石蜡包埋、切片及免疫荧光(cd11c和cd86)或免疫组织化学(f4/80和cd206)染色,观察cd73-adc对成熟dc及m2型和促炎型巨噬细胞浸润的影响。
结果如图16所示,与higg1-mmae相比,cd73-adchu001-mmae治疗后的肿瘤体积更小(图16a),具有良好的抑制体内移植瘤生长的作用;与cd73抗体组相比,cd73-adc能够显著促进nci-h441移植瘤中成熟dc的浸润(图16b);与higg1和higg1-mmae组相比,cd73抗体hu001和cd73-adchu001-mmae能够减少m2型巨噬细胞的浸润(图16c);与cd73抗体hu001组相比,cd73-adchu001-mmae能够显著增加f4/80阳性巨噬细胞的浸润(图16c)。
综上,本实施例结果说明,cd73-adc在nci-h441裸鼠移植瘤模型中具有良好的抑瘤效果;与cd73抗体相比,cd73-adc更能通过促进免疫效应细胞成熟dc和抗炎巨噬细胞在肿瘤微环境中聚集,并减少免疫抑制细胞m2型巨噬细胞浸润,激活免疫微环境,达到更高效抑制肿瘤的作用效果。
实施例7cd73-adc抑制nci-h292、nci-h1299肺癌体内肿瘤生长,相比多烯紫杉醇能提高肿瘤环境的dc成熟活化,减少m2型并增加促炎巨噬细胞的浸润
为研究cd73-adc体内抑瘤效果及对肿瘤免疫微环境的影响,建立了肺癌细胞系裸鼠移植瘤模型。分别将200μl含有5x106nci-h292的细胞悬液,或100μl含有9x106nci-h1299混匀在100μl基质胶的细胞悬液,接种到免疫缺陷小鼠(balb/c,nude)背部皮下。待肿瘤体积长至100~300mm3,根据肿瘤体积大小及裸鼠体重随机分组(n=8),分别采用5mg/kghigg1-mmae和hu001-mmae剂量,每周尾静脉给药一次,共计给药2周;同时设置15mg/kg多烯紫杉醇(docetaxel)作为阳性对照。待肿瘤生长至一定体积后,剥取肿瘤,经4%中性多聚甲醛固定、脱水、石蜡包埋、切片及免疫荧光(cd11c和cd86)或免疫组织化学(f4/80和cd206)染色,观察cd73-adc对成熟dc及m2型和促炎型巨噬细胞浸润的影响。
结果如图17所示,与higg1-mmae相比,cd73-adchu001-mmae处理的nci-h292肿瘤体积更小(图17a),具有良好的抑制体内移植瘤生长的作用;与higg1-mmae和多烯紫杉醇组相比,cd73-adchu001-mmae能够显著促进nci-h292移植瘤中成熟dc的浸润(图17b);与higg1-mmae和多烯紫杉醇组相比,cd73-adchu001-mmae能够显著降低nci-h292移植瘤中cd73的表达量,显著降低m2型巨噬细胞的浸润,并显著增加f4/80阳性巨噬细胞的浸润(图17c)。
结果如图18所示,与higg1-mmae相比,cd73-adchu001-mmae处理的h1299肿瘤体积更小(图18a),具有良好的抑制体内移植瘤生长的作用;与higg1-mmae和多烯紫杉醇组相比,cd73-adchu001-mmae能够显著促进nci-h1299移植瘤中成熟dc的浸润(图18b);与higg1-mmae和多烯紫杉醇组相比,cd73-adchu001-mmae能够显著降低nci-h1299移植瘤中cd73的表达量,并显著降低m2型巨噬细胞的浸润,并显著增加f4/80阳性巨噬细胞的浸润(图18c)。
综上,本实施例结果说明,cd73-adc在肿瘤细胞系裸鼠移植瘤模型中具有良好的抑瘤效果;与多烯紫杉醇相比,cd73-adc能促进免疫效应细胞成熟dc和抗炎巨噬细胞在肿瘤微环境中聚集,并减少免疫抑制细胞m2型巨噬细胞浸润,具有更高效的激活肿瘤免疫微环境,抑制肿瘤的效果。
综合以上结果可知,cd73-adc能够特异性杀伤cd73-中高表达的肿瘤细胞,并能阻断cd73催化amp水解生成ado的活性,降低ado对多种免疫效应细胞的抑制,同时减少免疫抑制细胞的浸润,激活肿瘤微环境,减少肿瘤的免疫逃逸,具有显著的抗肿瘤活性。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!