一种5-硼吡啶羧酸修饰的靶向药物递送系统及其制备方法与流程
本发明涉及分子生物领域,具体涉及一种5-硼吡啶羧酸修饰的靶向药物递送系统及其制备方法。
背景技术:
近年来,基于纳米粒的药物递送系统因其优先在肿瘤部位累积的特性,已经成为一种非常有潜力的肿瘤治疗方法。然而,高效肿瘤特异性的药物递送仍然是目前药物递送治疗肿瘤所面临的主要挑战之一。一般来说,具有合适的粒径、形状和表面电位的纳米粒可以通过高渗透长滞留效应(epr效应),在肿瘤组织富集,从而具备被动的肿瘤靶向功能。但是,这种被动肿瘤靶向是非特异性的,不能为纳米粒提供高效的肿瘤靶向,从而大大限制了药物的递送效率。因此,为了赋予纳米粒对肿瘤细胞主动靶向性,一些肿瘤特异性配体(如小分子、多肽和抗体等)用于修饰纳米粒的表面,通过与肿瘤细胞表面的受体结合,获得肿瘤特异性。但是,为了赋予纳米粒更好地稳定性,常采用聚乙二醇(peg)作为纳米粒的亲水层,这样也会影响其对肿瘤细胞的特异性。此外,尽管这些特异性配体的修饰能够在一定程度上使得纳米粒对肿瘤细胞具有靶向性,但是这种靶向性效率受制于肿瘤细胞表面受体的数目。纳米粒高效的肿瘤特异性除了需要在肿瘤微环境中对肿瘤细胞具有强烈的结合性能,还需要在正常生理条件下具备良好的生物相容性,也就是在体内不能与正常组织、细胞结合。这也是目前靶向载药纳米粒在肿瘤治疗方面效率低的主要原因之一。因此,高效肿瘤特异性的纳米粒的研究仍然面临着很大的挑战。
最近,硼酸衍生物因其与生物分子的特殊结合能力,在肿瘤诊断和治疗中具有很大的发展潜力。硼酸衍生物可以通过可逆的硼酸酯与一些生物分子(糖和核糖)相互作用,得到了广泛的研究。但是,目前对于硼酸衍生物的研究仍然有限,它们在肿瘤治疗领域的应用需要进一步开发。
技术实现要素:
本发明的目的在于克服上述问题,提供一种具有良好生物相容性、高效肿瘤特异性的5-硼吡啶羧酸修饰的靶向药物递送系统,同时提供一种5-硼吡啶羧酸修饰的靶向药物递送系统在制备抗肿瘤药物中的应用。
本发明公开的技术方案如下:
一种5-硼吡啶羧酸修饰的靶向药物递送系统,所述系统包括:
(a)5-硼吡啶羧酸的水溶液;
(b)与药物结合的plga-pei载药纳米粒(以下简称载药纳米粒);
所述5-硼吡啶羧酸带有负电荷,所述载药纳米粒带有正电荷,所述5-硼吡啶羧酸和载药纳米粒通过静电相互作用结合。
本发明还公开了一种5-硼吡啶羧酸修饰的靶向药物递送系统的制备方法,包括如下步骤:
s1,利用丙交酯(la)和乙交酯(ga)两种单体进行开环共聚得到聚合物plga,然后经过功能化后与聚乙烯亚胺(pei)进行酰胺化反应,从而接枝pei,制备得到plga-pei聚合物;
s2,按照质量比为5-10:1的比例,将plga-pei聚合物与药物混合后提纯,得到载药纳米粒;
s3,按照摩尔比为1:1-30的比例向表面带正电荷的载药纳米粒中加入带有负电荷的5-硼吡啶羧酸水溶液,通过静电相互作用,得到5-硼吡啶羧酸修饰的靶向药物递送系统。
作为改进,所述5-硼吡啶羧酸的水溶液浓度为1-15mg/ml。
作为改进,所述药物为抗肿瘤药物,所述系统应用于制备抗肿瘤药物中。
作为改进,所述s1的具体步骤为:
①以1,8-辛二醇为引发剂,辛酸亚锡为催化剂,采用la和ga单体的开环聚合合成plga共聚物;
②将步骤①获得的plga聚合物的端羟基与丁二酸酐进行酯化反应,获得末端基团为羧基的聚合物plga-cooh;
③利用步骤②中获得的plga-cooh聚合物的末端羧基与聚乙烯亚胺上的氨基进行酰胺化反应,从而获得两亲性聚合物plga-pei。
作为改进,s2中所述提纯的具体步骤为:将plga-pei聚合物与药物混合,在搅拌条件下,逐滴加入到水相中,通过450nm的过滤膜,除去过量的药物,采用截留分子量为3500的透析袋透析提纯,得到载药纳米粒。
本发明的优点在于:
1.本发明的5-硼吡啶羧酸修饰的靶向药物递送系统,将5-硼吡啶羧酸修饰到带正电的载药纳米粒表面,在血液循环中抑制其与血细胞相互作用,避免被清除,从而提高其生物相容性和稳定性。
2.5-硼吡啶羧酸修饰的靶向药物递送系统通过简单地在载药纳米粒表面修饰5-硼吡啶羧酸,赋予药物递送系统高效的肿瘤细胞特异性,在肿瘤微环境中,更加高效地与肿瘤细胞表面过表达的唾液酸结合,从而大大提高其药物递送效果。
3.本发明的5-硼吡啶羧酸修饰的靶向药物递送系统同时具有良好生物相容性和高效的肿瘤细胞特异性,有利于显著提高药物递送效果,达到肿瘤治疗的目的。
附图说明
图1为本发明实施例1-5的溶血实验图;
图2为本发明实施例1-5的巨噬细胞摄取图;
图3为本发明实施例1-5的肿瘤细胞摄取图;
图4为本发明实施例1-5的体内抗肿瘤效果图。
具体实施方式
下面结合具体实施例对本发明作进一步的说明。应理解,本发明的实施例仅用于说明本发明而不用于限制本发明的范围。此外,在阅读本发明讲授的内容之后,本领域技术人员可以对本发明做改动或修改,该等价形式同样落于本申请的权利要求所限定的范围。
mcf-7细胞、4t1细胞和raw264.7巨噬细胞购于中国科学院细胞库(上海研发公共服务平台)。
实施例1
本实施例为对照例,本实施例不采用5-硼吡啶羧酸修饰,仅单独使用载药纳米粒。本实施例的制作方法为:
s1,利用丙交酯(la)和乙交酯(ga)两种单体进行开环共聚得到聚合物(plga),然后经过功能化,与聚乙烯亚胺(pei)进行酰胺化反应,从而接枝pei,制备得到plga-pei两亲性共聚物。
s1的具体步骤为:
①以1,8-辛二醇为引发剂,辛酸亚锡为催化剂,采用la和ga单体的开环聚合合成plga共聚物;
②将步骤①获得的plga聚合物的端羟基与丁二酸酐进行酯化反应,获得末端基团为羧基的聚合物plga-cooh;
③利用步骤②中获得的plga-cooh聚合物的末端羧基与聚乙烯亚胺上的氨基进行酰胺化反应,从而获得两亲性聚合物plga-pei;
s2,按质量比为5:1的比例,将plga-pei聚合物与药物混合,在搅拌条件下,逐滴加入到水相中,通过450nm的过滤膜,除去过量的药物,采用截留分子量为3500的透析袋透析提纯,得到载药纳米粒。
实施例2
本实施例公开了一种5-硼吡啶羧酸修饰的靶向药物递送系统及其制备方法。本实施例的系统包括:
(a)5-硼吡啶羧酸的水溶液;
(b)与药物结合的plga-pei载药纳米粒;
5-硼吡啶羧酸带有负电荷,载药纳米粒带有正电荷,5-硼吡啶羧酸和载药纳米粒通过静电相互作用结合。
本实施例的制作和应用方法包含如下步骤:
s1,利用丙交酯(la)和乙交酯(ga)两种单体进行开环共聚得到聚合物(plga),然后经过功能化,与聚乙烯亚胺(pei)进行酰胺化反应,从而接枝pei,制备得到plga-pei两亲性共聚物。
s1的具体步骤为:
①以1,8-辛二醇为引发剂,辛酸亚锡为催化剂,采用la和ga单体的开环聚合合成plga共聚物;
②将步骤①获得的plga聚合物的端羟基与丁二酸酐进行酯化反应,获得末端基团为羧基的聚合物plga-cooh;
③利用步骤②中获得的plga-cooh聚合物的末端羧基与聚乙烯亚胺上的氨基进行酰胺化反应,从而获得两亲性聚合物plga-pei;
s2,按质量比为8:1的比例,将plga-pei聚合物与药物混合,在搅拌条件下,逐滴加入到水相中,通过450nm的过滤膜,除去过量的药物,采用截留分子量为3500的透析袋透析提纯,得到载药纳米粒。
s3,按摩尔比为1:1的比例,向表面带正电荷的载药纳米粒中加入带负电荷的5-硼吡啶羧酸水溶液,通过静电相互作用,得到5-硼吡啶羧酸修饰的靶向药物递送系统;5-硼吡啶羧酸水溶液浓度为5毫克/毫升。
实施例3
本实施例公开了一种5-硼吡啶羧酸修饰的靶向药物递送系统及其制备方法。本实施例的系统包括:
(a)5-硼吡啶羧酸的水溶液;
(b)与药物结合的plga-pei载药纳米粒;
5-硼吡啶羧酸带有负电荷,载药纳米粒带有正电荷,5-硼吡啶羧酸和载药纳米粒通过静电相互作用结合。
本实施例的制作和应用方法包含如下步骤:
s1,利用丙交酯(la)和乙交酯(ga)两种单体进行开环共聚得到聚合物(plga),然后经过功能化,与聚乙烯亚胺(pei)进行酰胺化反应,从而接枝pei,制备得到plga-pei两亲性共聚物。
s1的具体步骤为:
①以1,8-辛二醇为引发剂,辛酸亚锡为催化剂,采用la和ga单体的开环聚合合成plga共聚物;
②将步骤①获得的plga聚合物的端羟基与丁二酸酐进行酯化反应,获得末端基团为羧基的聚合物plga-cooh;
③利用步骤②中获得的plga-cooh聚合物的末端羧基与聚乙烯亚胺上的氨基进行酰胺化反应,从而获得两亲性聚合物plga-pei;
s2,按质量比为10:1的比例,将plga-pei聚合物与药物混合,在搅拌条件下,逐滴加入到水相中,通过450nm的过滤膜,除去过量的药物,采用截留分子量为3500的透析袋透析提纯,得到载药纳米粒。
s3,按摩尔比为1:5的比例,向表面带正电荷的载药纳米粒中加入带负电荷的5-硼吡啶羧酸水溶液,通过静电相互作用,得到5-硼吡啶羧酸修饰的靶向药物递送系统;5-硼吡啶羧酸水溶液浓度为5毫克/毫升。
实施例4
本实施例公开了一种5-硼吡啶羧酸修饰的靶向药物递送系统及其制备方法。本实施例的系统包括:
(a)5-硼吡啶羧酸的水溶液;
(b)与药物结合的plga-pei载药纳米粒;
5-硼吡啶羧酸带有负电荷,载药纳米粒带有正电荷,5-硼吡啶羧酸和载药纳米粒通过静电相互作用结合。
本实施例的制作和应用方法包含如下步骤:
s1,利用丙交酯(la)和乙交酯(ga)两种单体进行开环共聚得到聚合物(plga),然后经过功能化,与聚乙烯亚胺(pei)进行酰胺化反应,从而接枝pei,制备得到plga-pei两亲性共聚物。
s1的具体步骤为:
①以1,8-辛二醇为引发剂,辛酸亚锡为催化剂,采用la和ga单体的开环聚合合成plga共聚物;
②将步骤①获得的plga聚合物的端羟基与丁二酸酐进行酯化反应,获得末端基团为羧基的聚合物plga-cooh;
③利用步骤②中获得的plga-cooh聚合物的末端羧基与聚乙烯亚胺上的氨基进行酰胺化反应,从而获得两亲性聚合物plga-pei;
s2,按质量比为10:1的比例,将plga-pei聚合物与药物混合,在搅拌条件下,逐滴加入到水相中,通过450nm的过滤膜,除去过量的药物,采用截留分子量为3500的透析袋透析提纯,得到载药纳米粒。
s3,按摩尔比为1:10的比例,向表面带正电荷的载药纳米粒中加入带负电荷的5-硼吡啶羧酸水溶液,通过静电相互作用,得到5-硼吡啶羧酸修饰的靶向药物递送系统;5-硼吡啶羧酸水溶液浓度为10毫克/毫升。
实施例5
本实施例公开了一种5-硼吡啶羧酸修饰的靶向药物递送系统及其制备方法。本实施例的系统包括:
(a)5-硼吡啶羧酸的水溶液;
(b)与药物结合的plga-pei载药纳米粒;
5-硼吡啶羧酸带有负电荷,载药纳米粒带有正电荷,5-硼吡啶羧酸和载药纳米粒通过静电相互作用结合。
本实施例的制作和应用方法包含如下步骤:
s1,利用丙交酯(la)和乙交酯(ga)两种单体进行开环共聚得到聚合物(plga),然后经过功能化,与聚乙烯亚胺(pei)进行酰胺化反应,从而接枝pei,制备得到plga-pei两亲性共聚物。
s1的具体步骤为:
①以1,8-辛二醇为引发剂,辛酸亚锡为催化剂,采用la和ga单体的开环聚合合成plga共聚物;
②将步骤①获得的plga聚合物的端羟基与丁二酸酐进行酯化反应,获得末端基团为羧基的聚合物plga-cooh;
③利用步骤②中获得的plga-cooh聚合物的末端羧基与聚乙烯亚胺上的氨基进行酰胺化反应,从而获得两亲性聚合物plga-pei;
s2,按质量比为10:1的比例,将plga-pei聚合物与药物混合,在搅拌条件下,逐滴加入到水相中,通过450nm的过滤膜,除去过量的药物,采用截留分子量为3500的透析袋透析提纯,得到载药纳米粒。
s3,按摩尔比为1:20的比例,向表面带正电荷的载药纳米粒中加入带负电荷的5-硼吡啶羧酸水溶液,通过静电相互作用,得到5-硼吡啶羧酸修饰的靶向药物递送系统;5-硼吡啶羧酸水溶液浓度为10毫克/毫升。
实施例6
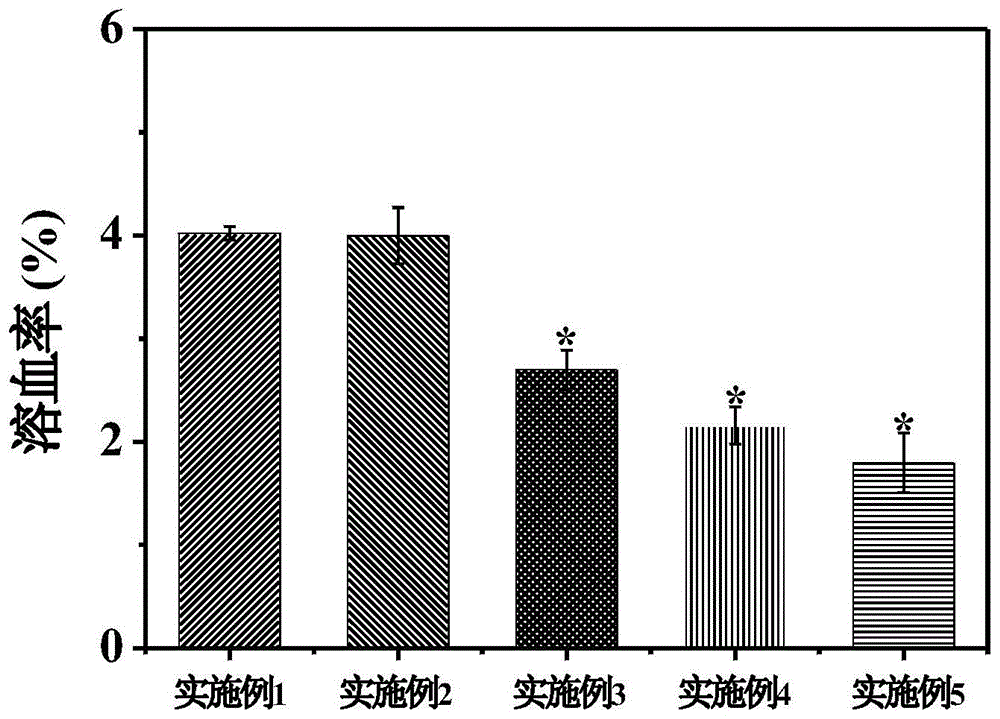
实施例1制备的载药纳米粒和实施例2、实施例3、实施例4及实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统的血液相容性由溶血实验进行评价。
步骤如下:取新鲜小鼠血液1ml,加入2mlpbs缓冲溶液,1500rpm离心10分钟,倒掉上清液,重复5次后,得到红细胞。然后,用pbs缓冲溶液稀释红细胞至2%(v/v)的悬液。取多组红细胞悬液,每组1ml,摇匀,再加入实施例1制备的载药纳米粒和实施例2、实施例3、实施例4及实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统。最后,置于37℃恒温水浴3h后,于1000rpm离心5min,取上清在540nm处测其吸光度(a)。平行操作三次。设置阳性对照组(超纯水)和阴性对照组(pbs缓冲溶液)。
按下面公式计算溶血率:
溶血率(%)=(a540样品–a540阴性对照组)/(a540阳性对照组-a540阴性对照组)×100%
a540样品组为实施例1制备的载药纳米粒和实施例2、实施例3、实施例4及实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统溶液组的吸光度值。
分析结果:图1为血液相容性,分别测定了实施例1制备的载药纳米粒和实施例2、实施例3、实施例4及实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统。溶血率越低代表材料血液相容性越好,且低于5%时被认定为可以用作生物材料的标准。从图中可以看出,所有样品的溶血率均低于5%。并且,与载药纳米粒相比,实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统具有更低的溶血率,更好的血液相容性。
实施例7
利用巨噬细胞摄取实验来评价实施例1制备的载药纳米粒和实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统在巨噬细胞内的摄取效果。
步骤如下:取刺激后的raw264.7巨噬细胞接种于24孔培养板中,细胞密度约为105个/孔,在37℃5%co2条件下培养24h,弃去上清,加入500μl无血清dmem培养基,37℃、5%co2条件下饥饿处理12h,弃去500μl无血清dmem培养基,分别加入300μl的fitc标记的实施例1制备的载药纳米粒和实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统,37℃5%co2孵育4h,弃去上清液,用pbs缓冲溶液洗三次。用200μlpbs缓冲溶液重悬细胞,获得细胞悬液,通过流式细胞仪检测分析。
分析结果:图2为raw264.7巨噬细胞摄取结果,分别测定了实施例1制备的载药纳米粒和实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统。平均荧光强度代表细胞摄取率,摄取率越低说明药物递送系统生物相容性越好。从图中可以看出,实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统的平均荧光强度显著低于实施例1制备的载药纳米粒的平均荧光强度值,说明5-硼吡啶羧酸修饰的靶向药物递送系统的摄取率明显低于载药纳米粒的摄取率,具有更好的生物相容性。
实施例8
利用mcf-7细胞摄取实验来评价实施例1制备的载药纳米粒和实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统在肿瘤细胞内的摄取效果。
步骤如下:将mcf-7细胞接种到6孔板(105细胞/孔),加入实施例1制备的载药纳米粒和实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统,培养4小时。然后,用0.01摩尔/升的pbs缓冲溶液清洗细胞3次。之后,用0.25%的胰蛋白酶酶解1分钟。1500rpm离心5分钟,加入pbs缓冲溶液,获得细胞悬液,采用流式细胞仪进行分析表征。
分析结果:图3为实施例1制备的载药纳米粒和实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统在mcf-7细胞中的摄取结果。从图中可以看出,与实施例1制备的载药纳米粒相比,实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统具有更高的平均荧光强度值,说明其细胞摄取率更高。这一结果说明经过5-硼吡啶羧酸修饰后具有更强的肿瘤特异性,能够选择性高效进入肿瘤细胞。
实施例9
利用体内抗肿瘤实验来评价实施例1制备的载药纳米粒和实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统的抗肿瘤效果。
选用20±3gbalb/c雌性小鼠,4-6周龄,温度25±2℃,12h白昼黑夜循环,充足的食物和饮用水。取对数生长期的4t1细胞用0.25%胰酶消化1分钟,并收集细胞。1500rpm离心5分钟后,弃去胰酶,用无菌生理盐水吹打成单细胞悬液,细胞计数板计数,然后再用无菌生理盐水稀释至细胞浓度5×106/ml。用75%的酒精棉球对小鼠右腋下进行消毒,用无菌注射器在小鼠右腋下皮下接种0.1ml4t1细胞悬液。注射完毕后将注射器缓慢拔出,轻轻按压针孔拔出处20-30秒,最后将小鼠放回笼子,喂养5-7天,得到肿瘤小鼠模型。
取21只肿瘤小鼠称重,随机分为七组(n=3)。模型对照组(注射pbs缓冲溶液的小鼠),和实施例1制备的载药纳米粒及实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统治疗组。当肿瘤体积达到约100mm3,模型对照组给予pbs缓冲溶液(10ml/kg),治疗组向小鼠静脉注射实施例1制备的载药纳米粒和实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统(5mg/kg药物),每2天注射一次,连续注射15天。然后,测量小鼠肿瘤体积。
分析结果:图4为实施例1制备的载药纳米粒和实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统体内抗肿瘤效果。肿瘤体积越小说明抗肿瘤效果越明显。从图中可以看出,与模型对照组相比,实施例1制备的载药纳米粒、实施例2、实施例3、实施例4和实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统具有显著的抗肿瘤效果。另外实施例5制备的5-硼吡啶羧酸修饰的靶向药物递送系统的抗肿瘤效果明显要比其他组更好,进一步证明了其肿瘤特异性,有利于提高药物递送效率,获得更好的抗肿瘤的效果。
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不等同于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,不脱离本发明的精神和范围下所做的均等变换和修改,都应涵盖在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!