一种核‑壳结构的磷酸钙纳米材料、制备方法及其应用与流程
本发明属于纳米生物材料领域,具体涉及一种核-壳结构的磷酸钙纳米材料、制备方法及其应用。
背景技术:
癌症仍是目前死亡的第一杀手,如何提高癌症的治愈率是目前研究的重点热门课题。基因治疗被认为是治疗癌症的有效方法。其中高效特异性基因载体是影响基因治疗的关键技术。羟基磷灰石是一类与脊椎动物骨无机质的主要成分相近的无机材料,具有良好的生物活性和生物相容性良好的,是一种理想的基因载体材料,目前研究者大多将羟基磷灰石制备成纳米球形或空心球结构,但是由于空心球表面的孔洞小,药物难于进入空心球内部,药物携带量低,转染效果不理想,阻碍其临床应用的主要瓶颈是其基因负载率低、转染效率差。
公开号为CN101759169A公开了一种采用微波-水热方法制备单层空心球;将具有良好生物相容性的聚合物、可溶性钙盐和可溶性磷酸盐溶解在水中形成均一的前驱物溶液,然后对该溶液进行微波加热水热处理,从而制备出磷酸钙纳米结构空心微球。所制备的磷酸钙纳米结构空心微球的化学组分包括各种组成的磷酸钙和羟基磷灰石(Ca10(PO4)6(OH)2);空心微球的壳是由厚度为10-50nm磷酸钙纳米片组装形成的多孔结构;空心微球的直径为1-10μm。
技术实现要素:
针对目前基因载体药物携带率低的问题,本发明公开了一种核-壳结构的磷酸钙纳米材料,其具备纳米“蛋壳-蛋黄”结构或双壳层空心结构。
本发明还公开了一种所述磷酸钙纳米材料的制备方法。
此外,本发明还公开了所述核-壳结构的磷酸钙纳米材料在靶向、缓释药物制备中的应用。
一种核-壳结构的磷酸钙纳米材料,包括多孔球型的壳体和内核,所述壳体和内核留有空腔;所述内核呈实心球型,或者,所述内核呈表面多孔或网状的空心球型;所述的壳体和内核的化学组成选自各种组成的磷酸钙或羟基磷灰石。
本发明所提供的核-壳结构的空心球,存在内核,且所述壳体和内核留有空腔;载药量比普通空心球的载药量大一倍。
本发明所述的核-壳结构的磷酸钙纳米材料包含两种核-壳结构形式。一种为具有表面呈多孔、网状的壳体、内部(内核)为实心小球的“蛋壳-蛋黄”结构(结构类似鸡蛋的蛋壳与蛋黄的结构);另一种为包括外壳层(壳体)和内壳层(内核),其内、外壳层均为表面多孔/网状的双层空心球结构(即壳体为表面多孔/网状的空心球结构;其腔室内的内核(内壳体)也为表面多孔/网状的空心球结构)。这两种结构的纳米颗粒,具有较大可调的空腔,较高比表面积,蛋壳壳层厚度可调,壳层(壳体)孔径大小可控,蛋黄(内核)大小可调,尺寸均匀和分散性良好。采用本发明所提供的所述核-壳结构的磷酸钙纳米材料作为载体,不仅生物相容性好,而且药物载荷量大,并且可根据不同形状和大小的药物分子的结构调整表面壳层孔洞的大小,是一个理想的基因、药物载体材料。
本发明所述的壳体、内核的球型为规则或不规则的球体结构。
所述的壳体表面分布有大量的贯穿壳体内外的孔洞,其孔洞孔径的大小会影响本发明所述材料的携带率。
所述壳体的内径为200-400nm,表面孔洞的孔径为5nm-40nm;壳体厚度为5-50nm。在所述优选的壳体参数下,载药量大,且利于载体进入细胞,改善靶向给药效果。
作为优选,实心球型内核的外径为50-150nm。实心球型内核(实心小球)与外壳层之间无连接,小球可在壳体内自由运动。本发明人发现,在所述参数范围的实心球型内核下,并协同配合所述壳体外径、厚度、孔径等参数,蛋黄与蛋壳的空腔体积适合,可进一步协同提高载体的载药量。
表面多孔的空心球型内核的外径为50-150nm,厚度为5-20nm;孔径5-10nm。
作为优选,双层空心球结构的核-壳结构的磷酸钙纳米材料,由大小不等的两个空心球套在一起的结构,其壳体为多孔/网状的球状磷酸钙,内径为150-400nm,表面孔洞的孔径为5nm-40nm,厚度为5-50nm;内核为多孔/网状的球状磷酸钙,外径为50-150nm,厚度为5-20nm;孔径5-10nm。
作为优选,所述壳体的内径和内核的外径的比例为1.5-4。
所述的磷酸钙纳米材料是以聚合物小球为模板,在聚合物小球表面通过反应包裹一层磷酸钙包覆层,在升温速度为1-4℃/min,500-600℃温度下,烧结制得表面多孔的空心球型内核的核-壳结构的磷酸钙纳米材料;或在升温速度为5-10℃/min,500-600℃温度下,烧结制得实心球型内核的核-壳结构的磷酸钙纳米材料。
本发明还提供了一种所述的核-壳结构的磷酸钙纳米材料的制备方法,包括以下步骤:
步骤(1):将酚醛树脂小球超声分散在醇溶液中;随后投加磷源,继续超声分散得分散液;分散液中,磷源的摩尔浓度0.001-0.05mol/L;
步骤(2):向分散液中投加钙盐,搅拌、在酚醛树脂小球表面形成磷酸钙包覆层;其中,Ca/P摩尔比为1-1.67;
步骤(3):包覆后的材料经干燥后再升温煅烧处理,制得所述核-壳结构的磷酸钙纳米材料,其中,在升温速度为1-4℃/min,500-600℃温度下,烧结制得表面多孔的空心球型内核的核-壳结构的磷酸钙纳米材料;或在升温速度为5-10℃/min,500-600℃温度下,烧结制得实心球型内核的核-壳结构的磷酸钙纳米材料。
本发明首先采用纳米酚醛树脂聚合物小球为模板,通过溶胶凝胶法使磷源和钙盐反应并在聚合物小球外面包裹上一层磷酸钙包覆层,然后采用不同烧结机制进行煅烧,最终得到两种不同结构形貌的纳米颗粒。本发明的制备方法中,只需在模板上包覆一层磷酸钙,通过对包覆层厚度结构的控制,及协同配合所述烧结升温速度的控制,可以使包覆的单层磷酸钙涂层在煅烧(烧结)的过程中自动分层收缩,形成核-壳结构磷酸钙。相较于现有核-壳结构或多层空心球在制备过程需要多步模板包覆方法,工艺更简单,且核-壳的空腔、厚度、壳层孔径、蛋黄大小等参数更易可控,使制得的纳米材料的适用于各类药物、基因的携带。
本发明方法的关键在于所述磷酸钙的包覆层的厚度及烧结的温度及升温速率。
所述的包覆层厚度通过所述Ca/P投加摩尔比、包覆过程中磷源的投加摩尔浓度的(或Ca摩尔浓度)、并配合包覆时间来协同调控。
包覆的时间优选为24-48h。
包覆过程的温度例如为室温。
作为优选,在酚醛树脂小球表面形成的磷酸钙包覆层的厚度为50nm-150nm。
所述范围下的包覆层厚度有利于制得所述核-壳的磷酸钙纳米材料。包覆层厚度小于所述范围下限时难以分层形成核-壳结构;厚度大于所述范围的上限容易造成包覆层崩塌。
所述钙盐的投加摩尔以保证所述Ca/P摩尔比在所述范围内。Ca/P摩尔比不同,形成的磷酸钙盐不同(例如磷酸三钙、磷酸氢二钙、磷酸二氢钙或磷酸八钙等)。本发明中,所述反应物的浓度范围下能保证磷酸钙良好地包覆在酚醛树脂表面,避免磷酸钙沉淀形成实心磷酸钙颗粒,从而有利于制得所述核-壳结构的纳米材料的结构。
作为优选,分散液中,磷源的摩尔浓度0.001-0.005mol/L;Ca/P摩尔比为5∶3。
升温速度是形成核-壳结构的关键;且烧结过程中,采用不同的烧结升温速率可制得不同内核结构的核-壳结构的磷酸钙纳米材料。步骤(3)中,所述的升温速度为1-4℃/min;在该升温速率下,分层后的内核部分收缩较慢,内核形成空心球,且在烧结过程中酚醛树脂小球全部脱除;可制得表面多孔的空心球型内核的核-壳结构的磷酸钙纳米材料。在所述升温速度下制得的磷酸钙纳米材料的壳体的内径为200-400nm,表面孔洞的孔径为5nm-40nm;壳体厚度为5-50nm;表面多孔的空心球型内核的外径为50-150nm,厚度为5-20nm;孔径5-10nm;其中,壳体的内径和内核的外径的比例为1.5-4。
步骤(3)中,所述的升温速度为5-10℃/min;在该升温速率下,在烧结过程中酚醛树脂全部脱除,分层后的内核部分收缩迅速,内核形成实心球。制得实心球型内核的核-壳结构的磷酸钙纳米材料。在所述升温速度下制得的磷酸钙纳米材料的壳体的内径为200-400nm,表面孔洞的孔径为5nm-40nm;壳体厚度为5-50nm;实心球型内核的外径为50-150nm,其中,所述壳体的内径和内核的外径的比例为1.5-4。
作为优选,步骤(3)中,干燥的温度为50-100℃。
进一步优选,步骤(3)中,升温至100℃下并保温干燥30min-1.5h。
作为优选,在所述的煅烧温度下煅烧时间为2-5h。
本发明中,现有的酚醛树脂均可作为模板应用至本发明中。
酚醛树脂小球的直径影响核-壳结构外壳直径大小。作为优选,所述酚醛树脂小球的粒径为100-2500nm。
所述的醇优选为乙醇。
所述磷源选自P2O5、磷酸、偏磷酸中的至少一种。
进一步优选,所述磷源为P2O5。
所述的钙盐采用现有水溶性钙盐。作为优选,所述钙盐选自硝酸钙、氯化钙、醋酸钙中的至少一种。
本发明还包括一种所述的核-壳结构的磷酸钙纳米材料的应用,将所述核-壳结构的磷酸钙纳米材料作为药物载体制备靶向和/或缓释药物。
本发明提供的核-壳结构的磷酸钙纳米材料的载药量高于3200mg/g(即每克所述磷酸钙纳米材料载药3200mg),远大于普通空心球的载药量目前报道的1500mg/g的最大载药量。
本发明提供的所述的两种结构的纳米颗粒,具有较大可调的空腔,较高比表面积,蛋壳壳层厚度可调,壳层孔径大小可控,蛋黄大小可调,尺寸均匀和分散性良好,不仅可作为在基因载体、药物缓释方面在纳米反应器,催化,大容量生物分离、吸附方面具有广阔的应用前景。
附图说明
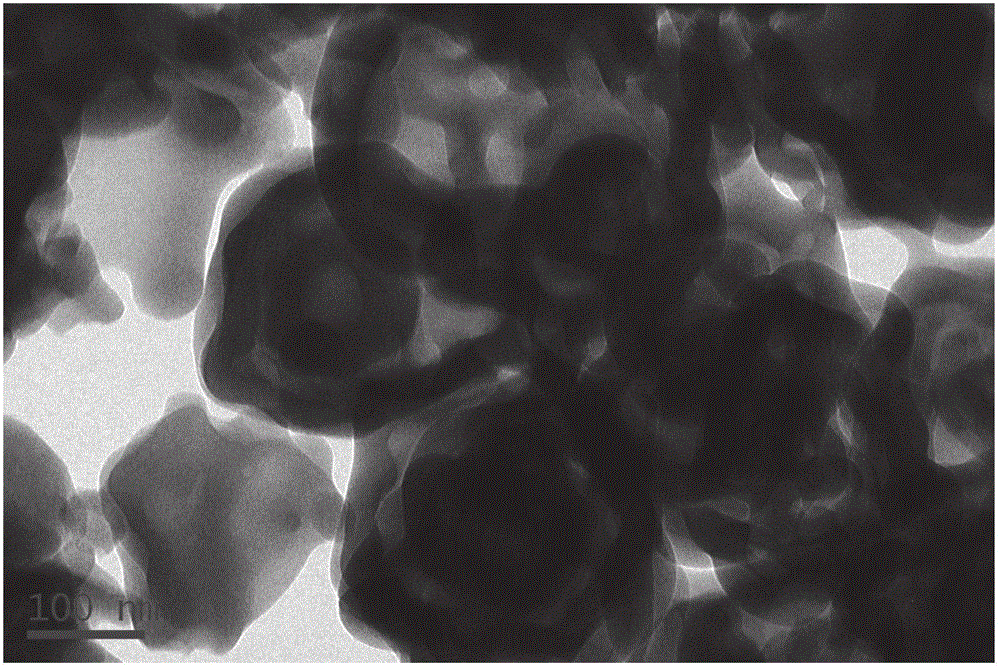
图1:本发明实施例1制得的“蛋壳-蛋黄”结构磷酸钙透射电镜图;
图2:本发明实施例4制得的“双层空心球”结构磷酸钙透射电镜图;
图3:本发明的制备过程工艺流程图。
具体实施方式
以下实施例参照图3所述工艺流程操作、实施:
实施例1
量取50ml乙醇倒入烧杯中,称取0.1g的酚醛树脂小球(粒径550nm)放入乙醇中,超声半小时,再加入P2O5,配成P2O5浓度为0.003mol/L的醇溶液,继续超声半小时得到聚合物小球和P2O5醇溶液,然后缓慢加入硝酸钙醇溶液,使Ca/P摩尔比等于5∶3,继续搅拌24小时,然后进行离心,洗涤,干燥(包覆层的厚度50nm),然后以5℃/min的升温速度升至550℃的,保温煅烧2h后随炉温冷却。制得的“蛋壳-蛋黄”结构磷酸钙透射电镜图见图1。所制得的“蛋黄-蛋壳”结构磷酸钙颗粒外壳内径250nm、厚度20nm、壳层孔径30nm,内核外径120nm对盐酸阿霉素的负载率达4000mg/g。
实施例2
量取50ml乙醇倒入烧杯中,称取0.1g的酚醛树脂小球(粒径550nm)放入乙醇中,超声半小时,再加入P2O5,配成P2O5浓度为0.005mol/L的醇溶液,继续超声半小时得到聚合物小球和P2O5醇溶液,然后缓慢加入硝酸钙醇溶液,使Ca/P摩尔比等于5∶3,继续搅拌24小时,然后进行离心,洗涤,干燥,然后以10℃/min的升温速度升至550℃的,保温煅烧2h后随炉温冷却。得到“蛋黄-蛋壳”结构磷酸钙颗粒。所制得的“蛋黄-蛋壳”结构磷酸钙颗粒的外壳内径350nm、厚度30nm、壳层孔径25nm,内核外径130nm.对盐酸阿霉素的负载率达3500mg/g。
实施例3
量取50ml乙醇倒入烧杯中,称取0.1g的酚醛树脂小球放入乙醇中,超声半小时,再加入P2O5,配成P2O5浓度为0.010mol/L的醇溶液,继续超声半小时得到聚合物小球和P2O5醇溶液,然后缓慢加入硝酸钙醇溶液,使Ca/P摩尔比等于5∶3,继续搅拌24小时,然后进行离心,洗涤,干燥,然后以5℃/min的升温速度升至550℃的,保温煅烧2h后随炉温冷却。得到“蛋黄-蛋壳”结构磷酸钙颗粒。所制得的“蛋黄-蛋壳”结构磷酸钙颗粒的外壳内径400nm、厚度35nm、壳层孔径20nm,内核外径140nm.对盐酸阿霉素的负载率达3200mg/g。
实施例4
量取50ml乙醇倒入烧杯中,称取0.1g的酚醛树脂小球放入乙醇中,超声半小时,再加入P2O5,配成P2O5浓度为0.003mol/L的醇溶液,继续超声半小时得到聚合物小球和P2O5醇溶液,然后缓慢加入硝酸钙醇溶液,使Ca/P摩尔比等于5∶3,继续搅拌48小时后,再次添加等量P2O5和硝酸钙,继续搅拌24h,然后进行离心,洗涤,干燥,然后以2℃/min的升温速度升至550℃的,保温煅烧2h后随炉温冷却。得到“双层空心球”结构磷酸钙纳米颗粒。制得的“双层空心球”结构磷酸钙透射电镜图见图2。所制得的“双层空心球”结构磷酸钙纳米颗粒的外壳内径250nm、厚度30nm、壳层孔径40nm,内空心球外径120nm,壁厚20nm。对盐酸阿霉素的负载率达3800mg/g。
实施例5
量取50ml乙醇倒入烧杯中,称取0.1g的酚醛树脂小球(粒径600nm)放入乙醇中,超声半小时,再加入P2O5,配成P2O5浓度为0.005mol/L的醇溶液,继续超声半小时得到聚合物小球和P2O5醇溶液,然后缓慢加入硝酸钙醇溶液,使℃a/P摩尔比等于5∶3,继续搅拌24小时后,再次添加等量P2O5和硝酸钙,继续搅拌24h,然后进行离心,洗涤,干燥,然后以2℃/min的升温速度升至550℃的,保温煅烧2h后随炉温冷却。得到“双层空心球”结构磷酸钙纳米颗粒。所制得的“双层空心球”结构磷酸钙纳米颗粒的外壳内径350nm、厚度30nm、壳层孔径25nm,内核外径130nm,壁厚20nm。对盐酸阿霉素的负载率达4200mg/g。
实施例6
量取50ml乙醇倒入烧杯中,称取0.1g的酚醛树脂小球(粒径600nm)放入乙醇中,超声半小时,再加入P2O5,配成P2O5浓度为0.010mol/L的醇溶液,继续超声半小时得到聚合物小球和P2O5醇溶液,然后缓慢加入硝酸钙醇溶液,使Ca/P摩尔比等于5∶3,继续搅拌24小时后,再次添加等量P2O5和硝酸钙,继续搅拌24h,然后进行离心,洗涤,干燥,然后以4℃/min的升温速度升至550℃的,保温煅烧2h后随炉温冷却。得到“双层空心球”结构磷酸钙纳米颗粒。所制得的“双层空心球”结构磷酸钙纳米颗粒的外壳内径400nm、厚度35nm、壳层孔径15nm,内核外径150nm,壁厚25nm.对盐酸阿霉素的负载率达3400mg/g。
- 还没有人留言评论。精彩留言会获得点赞!
- 磁性胶体核壳结构γ‑Fe2O3及Fe3O4的制备方法与流程
- 一种核壳结构Au@SiO2负载Pt纳米球的制备方法与流程
- 一种核壳结构Ag@TiO2@Pt纳米复合材料的制造方法与工艺
- 一种基于Ag@In核壳结构的高温钎料及其制备方法与流程
- 一种核壳结构Au@Co(OH)2纳米微球的制备方法与流程
- 一种制备核‑壳结构的高介低损钛酸铜钙基陶瓷的方法与流程
- 一种具有核壳结构的微球复合负极材料及其制备方法和应用与制造工艺
- 一种防潮耐水含橡胶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种耐盐雾含茶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种含锭子油的高流动性核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种核壳结构Au@SiO2负载Pt纳米球的制备方法与流程
- 一种核壳结构Ag@TiO2@Pt纳米复合材料的制造方法与工艺
- 一种基于Ag@In核壳结构的高温钎料及其制备方法与流程
- 一种核壳结构Au@Co(OH)2纳米微球的制备方法与流程
- 一种制备核‑壳结构的高介低损钛酸铜钙基陶瓷的方法与流程
- 一种具有核壳结构的微球复合负极材料及其制备方法和应用与制造工艺
- 一种防潮耐水含橡胶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种耐盐雾含茶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种含锭子油的高流动性核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种含椰子油的抗氧化核壳结构纳米改性变压器油及其制备方法与制造工艺
- 磁性胶体核壳结构γ‑Fe2O3及Fe3O4的制备方法与流程
- 一种核壳结构Au@SiO2负载Pt纳米球的制备方法与流程
- 一种核壳结构Ag@TiO2@Pt纳米复合材料的制造方法与工艺
- 一种基于Ag@In核壳结构的高温钎料及其制备方法与流程
- 一种核壳结构Au@Co(OH)2纳米微球的制备方法与流程
- 一种制备核‑壳结构的高介低损钛酸铜钙基陶瓷的方法与流程
- 一种具有核壳结构的微球复合负极材料及其制备方法和应用与制造工艺
- 一种防潮耐水含橡胶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种耐盐雾含茶籽油的核壳结构纳米改性变压器油及其制备方法与制造工艺
- 一种含锭子油的高流动性核壳结构纳米改性变压器油及其制备方法与制造工艺