一种离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷及其制备方法与流程
本发明属于骨损伤修复医用材料领域,具体涉及一种离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷及其制备方法。
背景技术:
人工合成的多孔磷酸钙陶瓷由于具有与自然骨中无机质相似的成分,不仅表现出优异的生物相容性,而且具有良好的生物活性,同时,它可以和体内的自然骨发生生物化学反应,从而与骨牢固结合,这些优势使得磷酸钙陶瓷成为了骨损伤修复医用材料领域的一个研究热点。虽然多孔磷酸钙陶瓷材料在骨损伤修复方面表现出较多优点,但该类材料仍存在成骨和成血管等生物学性能不足和力学性能较差的缺点,影响了其临床效果。
成骨性能是评价骨修复材料修复效果的重要指标之一,大量研究证明离子掺杂对促进多孔磷酸钙陶瓷的成骨性能具有重要意义。锌是人体重要的微量元素之一,它可以通过抑制破骨细胞分化和提高成骨细胞活性来促进骨生长(kishis,yamaguchim.inhibitoryeffectofzinccompoundsonosteoclast-likecellformationinmousemarrowcultures.biochempharmacol,1994;48;1225–1230)。锶元素与钙元素属同一主族,因此锶离子可以任意比例替代磷酸钙中的钙离子,且可以抑制破骨细胞活性和促进成骨前体细胞增殖(ravind,balur,kumartss.strontium-substitutedcalciumdeficienthydroxyapatitenanoparticles:synthesis,characterization,andantibacterialproperties.jamceramsoc,2012;95;2700–2708)。锰离子掺杂的磷酸钙陶瓷明显增加了成骨细胞的粘附能力,降低了破骨细胞的活性,并促进了成骨物质的生成(paluszkiewiczc,ślósarczyka,pijochad,etal.synthesis,structuralpropertiesandthermalstabilityofmn-dopedhydroxyapatite.journalofmolecularstructure,2010;976;301-309)。骨损伤修复过程中,血管再生在营养供给、氧气输送、细胞前体形成和生长因子传递等方面发挥重要作用。骨组织遭受创伤后,在骨损伤部位首先长入血管然后进一步地形成骨痂,进而形成新骨。因此,当骨修复材料植入骨缺损部位时,首先应当发挥促血管化的能力,血管形成后进而体现材料的成骨性能。研究表明,镁、铜等功能离子的掺入可以提高磷酸钙陶瓷的血管化能力。因此,为同时改善多孔磷酸钙陶瓷的成骨和成血管化性能,已有研究者制备了同时掺杂促成骨和促血管化离子的多孔磷酸钙陶瓷(alessandrab,giuliam,soniaf,etal.novelmultifunctionalstrontium-copperco-substitutedmesoporousbioactiveparticles.materialsletters,2018;223;37-40)。但是,在骨损伤修复过程中,血管化过程发生在成骨之前,而掺杂促血管离子的磷酸钙陶瓷的离子释放较慢,难以实现优先形成血管,故而骨损伤修复效果不佳。
天然骨的成分包含了磷酸钙类的无机质与蛋白类的有机质。其中胶原蛋白是骨中最重要的有机成分,中国专利cn103055352a公开了一种磷酸钙/胶原蛋白复合生物陶瓷材料的制备方法,但其仅介绍了复合材料的力学性能,并未涉及其成骨及成血管能力。相比于胶原蛋白,丝素蛋白同样具有良好的生物活性和生物相容性,而且还具有良好的成血管能力(wangxu,guzhipeng,jiangbo,etal.surfacemodificationofstrontium-dopedporousbioactiveceramicscaffoldsviapoly(dopa)coatingandimmobilizingsilkfibroinforexcellentangiogenicandosteogenicproperties.biomaterialsscience,2016;4;678-688)。现有技术中,同时也公开了磷酸钙/丝素蛋白复合支架(中国专利cn105363074a),将丝素蛋白与磷酸钙粉体直接混合经冷冻干燥制备为复合支架,但是这些复合支架由于不能经过高温烧结,材料内部的结合力较弱,造成了其力学性能较差的现象,影响了其在骨损伤修复医用材料领域的临床应用。
技术实现要素:
本发明的目的在于克服现有技术的缺点,提供了一种离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷及其制备方法。
本发明的目的通过以下技术方案实现。
本发明提供的一种离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷的制备方法,包括以下步骤:
(1)以掺杂促成骨离子的磷酸钙粉为原料制备离子掺杂的多孔磷酸钙陶瓷坯体,经过烧结获得离子掺杂多孔磷酸钙陶瓷;
(2)将步骤(1)得到的离子掺杂多孔磷酸钙陶瓷浸渍在丝素蛋白溶液中,浸渍时间为1-10min,渗透负压为0-0.1mpa;
(3)将步骤(2)浸渍后的离子掺杂多孔磷酸钙陶瓷干燥;
(4)重复步骤(2)和步骤(3)3-7次,得到所述离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷。
进一步地,步骤(1)所述促成骨离子为锌离子、锶离子、锰离子中的至少一种。
进一步地,步骤(1)所述掺杂促成骨离子的磷酸钙粉中,锌离子掺杂含量范围为0.1-1mol.%、锶离子掺杂含量范围为1-50mol.%、锰离子掺杂含量范围为1-10mol.%。
进一步地,步骤(1)所述磷酸钙粉体为α-磷酸三钙、β-磷酸三钙、羟基磷灰石的至少一种。
进一步地,步骤(1)所述多孔磷酸钙陶瓷坯体的制备方法包括挤出成型法、造孔剂法、发泡法、3d打印法。
进一步地,步骤(1)所述烧结为:以2-10°c/min的速率升温至1000-1200°c,然后保温2-4h。
进一步地,步骤(2)所述丝素蛋白溶液的浓度为6-9wt.%。
进一步地,步骤(3)所述干燥的温度为30-60℃,干燥的时间为10-30min。
由上述的方法制得的一种离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷。
一种离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷及其制备方法,所述掺杂的离子为具有促成骨功能的无机离子,所述浸渍的蛋白为具有促血管化能力的丝素蛋白,所述多孔磷酸钙陶瓷为多孔的磷酸钙生物陶瓷。
与现有技术相比,本发明有以下优点和有益效果:
(1)本发明首次将离子掺杂与表面浸渍结合来同时提高多孔磷酸钙陶瓷的成骨和成血管能力及力学性能。首先在磷酸钙粉体合成过程中掺杂能促成骨的离子并制备成多孔磷酸钙陶瓷,然后在真空负压下将其浸渍于丝素蛋白溶液,干燥后在陶瓷表面形成丝素蛋白涂层。
(2)本发明制备出的多孔磷酸钙陶瓷不仅具有促成骨能力,而且还具有良好的促血管化能力。将材料与细胞共培养时,不仅可以提高小鼠骨髓间充质干细胞在陶瓷表面的成骨分化相关基因的表达,而且也能够促进人脐静脉内皮细胞在材料表面的粘附、增殖和no表达。本发明同时提高了多孔磷酸钙陶瓷的成骨和成血管能力。
(3)采用传统混合磷酸钙与丝素蛋白粉末制备得到的复合多孔支架的抗压强度较低,不足以达到骨修复材料所需的力学性能要求,但本发明通过丝素蛋白浸渍的方法制备得到的改性多孔磷酸钙陶瓷,不仅其生物学性能得到改善,而且抗压强度也有大幅度提升。
(4)大气压下,多孔磷酸钙陶瓷表面浸渍的涂覆物会堵塞其内部孔隙,但本发明涉及的多孔磷酸钙陶瓷表面浸渍的处理方法,是支架在负压下浸渍完成的,这种方式避免了因涂覆物堵塞孔道而造成孔隙率大幅度减少的问题,有效地解决了孔隙率与抗压强度之间的矛盾问题,在孔隙率几乎不变的条件下,极大地提高了多孔磷酸钙陶瓷的抗压强度。
(5)本发明可以通过控制多孔磷酸钙陶瓷的渗透时间、渗透真空负压和渗透次数来调控丝素蛋白的渗入量和丝素蛋白涂层的厚度。
附图说明
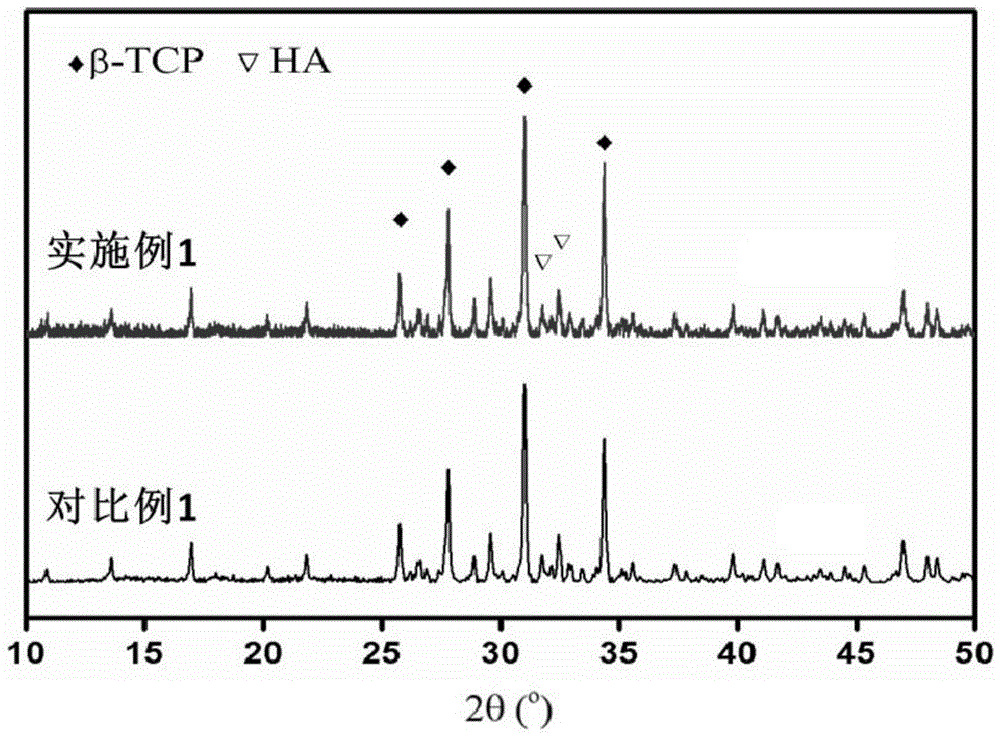
图1为对比例1和实施例1的x射线衍射图。
图2为对比例1多孔磷酸钙陶瓷的表面扫描电子显微镜图。
图3为实施例1制得的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷的表面扫描电子显微镜图。
图4a为小鼠骨髓间充质干细胞在对比例1制得的多孔磷酸钙陶瓷表面的细胞黏附情况的扫描电子镜图。
图4b为小鼠骨髓间充质干细胞在实施例1中制备的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷表面的细胞黏附情况的扫描电子镜图。
图5a为小鼠骨髓间充质干细胞在实施例1中制备的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷与对比例1多孔磷酸钙陶瓷表面的成骨分化alp基因表达柱状图。
图5b为小鼠骨髓间充质干细胞在实施例1中制备的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷与对比例1多孔磷酸钙陶瓷表面的成骨分化bsp基因表达柱状图。
图5c为小鼠骨髓间充质干细胞在实施例1中制备的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷与对比例1多孔磷酸钙陶瓷表面的成骨分化col基因表达柱状图。
图6a为人脐静脉内皮细胞在对比例1中的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷的细胞活性情况的倒置荧光显微镜图。
图6b为人脐静脉内皮细胞在实施例1中的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷的细胞活性情况的倒置荧光显微镜图。
图7为人脐静脉内皮细胞在实施例1中的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷与对比例1多孔磷酸钙陶瓷的细胞增殖柱状图。
图8为人脐静脉内皮细胞在实施例1中的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷与对比例1多孔磷酸钙陶瓷的no表达量柱状图。
图9为实施例1中的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷与对比例1多孔磷酸钙陶瓷的抗压强度柱状图。
图10是实施例1中的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷与对比例1多孔磷酸钙陶瓷孔隙率的柱状图。
图11为实施例2中的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷与对比例2多孔磷酸钙陶瓷的抗压强度柱状图。
具体实施方式
下面结合具体实施例对本发明作进一步的说明,但本发明的实施方式不限于此。
本发明所涉及的丝素蛋白溶液的制备方法为中国专利cn102516777a公开的方法。
本发明所涉及磷酸钙粉体的制备,其中β-磷酸三钙粉体的制备参照文献y.pan,j.l.huang,c.y.shao.preparationofβ-tcpwithhighthermalstabilitybysolidreactionroute.j.mater.sci.2003;38;1049-1056、羟基磷灰石粉体的制备参照文献jimingzhou,zhangx.,chenj.hightemperaturecharacteristicsofsynthetichydroxyapatite.journalofmaterialsscience:materialsinmedicine.1993;4;83-85、α-磷酸三钙粉体的制备参照文献duncanjo,macdonald,jamesf,etal.theroleofthechemicalcompositionofmonetiteonthesynthesisandpropertiesofα-tricalciumphosphate.materialsscienceandengineering:c.2014;34;123-129。
本发明所涉及的多孔磷酸钙陶瓷坯体的制备方法有挤出成型法(中国专利cn106518143a)、造孔剂法(中国专利cn104548213a)、发泡法(叶金凤、韩长菊、陈庆华,有机浆料发泡法制备多孔羟基磷灰石,佛山陶瓷,2006;6;6-9)、3d打印法(中国专利cn107998455a)。
实施例1
本实施例使用掺杂有1mol.%锌离子的β-磷酸三钙粉体和掺杂1mol.%羟基磷灰石粉体为原料,制备所述离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷,具体过程包括:
(1)制备浓度为6wt.%的丝素蛋白溶液;
(2)合成掺杂1mol.%锌离子的β-磷酸三钙粉体和掺杂1mol.%锌离子的羟基磷灰石粉体,形成混合粉体;其中,掺杂1mol.%锌离子的β-磷酸三钙粉体与掺杂1mol.%锌离子的羟基磷灰石粉体质量比为83:17;
(3)将步骤(2)得到的锌离子掺杂磷酸钙粉体通过挤出成型法制备为多孔磷酸钙陶瓷坯体;以2°c/min的速率升温至1200°c,保温2h,进行高温烧结,得到离子掺杂的多孔磷酸钙陶瓷;
(4)将步骤(3)得到的锌离子掺杂多孔磷酸钙陶瓷浸渍在步骤(1)制备的丝素蛋白溶液中,浸渍时间为1min,渗透负压为0.05mpa;
(5)步骤(4)浸渍后的锌离子掺杂多孔磷酸钙陶瓷在30°c干燥30min;
(6)重复步骤(4)和步骤(5)3次,得到离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷。
对比例1
为与本实施例制备得到的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷进行对比,对比例1制备了未掺杂离子且未浸渍蛋白的多孔磷酸钙陶瓷,具体方法如下:
(1)制备β-磷酸三钙粉体和羟基磷灰石粉体,所不同的是原料中不加入锌离子掺杂;
(2)将步骤(1)得到的磷酸钙粉体通过挤出成型法制备为多孔磷酸钙陶瓷坯体;以2°c/min的速率升温至1200°c,保温时间为2h。
图1为对比例1和实施例1陶瓷在浸渍蛋白之前研磨成粉的x射线衍射图,由图1可以看出对比例和实施例的物相均为β-磷酸三钙和羟基磷灰石,对比例1制备的磷酸三钙粉体的(0,2,10)晶面的衍射角为32.44°,而实施例1制备的锌离子掺杂磷酸三钙粉体的(0,2,10)晶面的衍射角为32.45°,实施例1中的衍射峰向高角度偏移,证明锌离子掺杂进入了磷酸钙的晶格内部。
图2为对比例1多孔磷酸钙陶瓷表面的扫描电子显微镜图,由图2中可以清晰地看到陶瓷表面的磷酸钙晶粒和表面微孔。图3是实施例1制备的双重改性多孔磷酸钙陶瓷表面的扫描电子显微镜图,由图3可知,陶瓷表面覆盖有一层丝素蛋白。
图4a为小鼠骨髓间充质干细胞在对比例1制得的多孔磷酸钙陶瓷表面的细胞黏附情况的扫描电子镜图。图4b为小鼠骨髓间充质干细胞在实施例1中制备的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷表面的细胞黏附情况的扫描电子镜图。图5a为鼠骨髓间充质干细胞在实施例1中制备的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷与对比例1多孔磷酸钙陶瓷表面的成骨分化alp基因表达柱状图。图5b为鼠骨髓间充质干细胞在实施例1中制备的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷与对比例1多孔磷酸钙陶瓷表面的成骨分化bsp基因表达柱状图。图5c为鼠骨髓间充质干细胞在实施例1中制备的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷与对比例1多孔磷酸钙陶瓷表面的成骨分化col基因表达柱状图。
细胞在材料表面培养1d后,使用质量百分比为4%多聚甲醛溶液固定细胞2h以上,再利用浓度梯度酒精脱水,最后在扫描电子显微镜下观察细胞黏附情况。细胞在材料表面分别培养10、14d后,使用实时定量pcr检测其成骨分化相关基因的表达情况。细胞黏附检测中,细胞培养板为48孔板,接种密度为2×104cells/孔。成骨分化基因检测中,细胞培养板为48孔板,接种密度为5×104cells/孔。由图4a和图4b扫描电镜结果显示,细胞在对比例1及实施例1的多孔磷酸钙陶瓷表面都可以很好的铺展,这说明双重改性的多孔磷酸钙陶瓷有良好的生物相容性。由图5a、图5b和图5c可知,在成骨相关基因表达检测中,在双重改性多孔磷酸钙陶瓷上,细胞的alkaline(alp)、bonesialoprotein(bsp)、collageni(col-i)三种成骨相关基因的表达量都有一定幅度的上调,说明双重改性多孔磷酸钙陶瓷的成骨性能得到了明显的提高。
图6a为人脐静脉内皮细胞在对比例1中的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷的细胞活性情况的倒置荧光显微镜图。图6b为人脐静脉内皮细胞在实施例1中的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷的细胞活性情况的倒置荧光显微镜图。图7为人脐静脉内皮细胞在对比例1多孔磷酸钙陶瓷与实施例1制备的双重改性多孔磷酸钙陶瓷的增殖情况柱状图。将材料浸泡在完全培养基中,每天收集浸提液,使用浸提液培养细胞。使用细胞活死染色剂和细胞计数试剂盒(cck-8)分别测定细胞活性和增殖情况。由图6a、图6b和图7可知细胞活性和细胞增殖检测中,细胞培养板为96孔板,接种密度为1×103cells/孔。结果显示,在cck-8检测中,实施例1的吸光度明显高于对比例1的吸光度;在1d活死染色检测中,实施例1的活细胞数量明显大于对比例1的数量。
图8是为人脐静脉内皮细胞在对比例1多孔磷酸钙陶瓷与实施例1制备的双重改性多孔磷酸钙陶瓷上的no表达量情况。使用微量no荧光探针daf-fmda表征细胞no表达量,使用浸提液培养细胞,细胞培养板为96孔板,接种密度为1×103cells/孔。由图8可知,实施例1的no表达量高于对比例1,说明实施例的双重改性的颗粒磷酸钙陶瓷更易于血管生成。
图9是对比例1多孔磷酸钙陶瓷与实施例1制备的双重改性多孔磷酸钙陶瓷的抗压强度。由图9可知,对比例1的抗压强度为3.66±0.89mpa,实施例1的为10.58±1.53mpa,抗压强度提高到近3倍。
图10是对比例1多孔磷酸钙陶瓷与实施例1制备的双重改性多孔磷酸钙陶瓷的孔隙率,其中包括总孔隙率和开孔孔隙率。由图10可知,对比例1的总孔隙率和开孔孔隙率分别为76.69±1.46%、60.81±1.84%,实施例1的为73.22±0.93%、60.04±3.78%。相比于对比例1的孔隙率,实施例1的孔隙率只有极小量的减少。
实施例2
本实施例使用掺杂有0.5mol.%锌离子的β-磷酸三钙粉体为原料,制备所述离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷,具体过程包括:
(1)制备得到浓度为7wt.%的丝素蛋白溶液;
(2)合成掺杂0.5mol.%锌离子的β-磷酸三钙粉体;
(3)将步骤(2)得到的锌离子掺杂磷酸钙粉体通过造孔剂法制备为多孔磷酸钙陶瓷坯体,以5°c/min的速率升温至1100°c,保温3h,进行高温烧结,得到离子掺杂的多孔磷酸钙陶瓷;
(4)将步骤(3)得到的锌离子掺杂多孔磷酸钙陶瓷浸渍在步骤(1)制备的丝素蛋白溶液中,浸渍时间为3min,渗透负压为0.1mpa;
(5)步骤(4)浸渍后的锌离子掺杂多孔磷酸钙陶瓷在37°c干燥25min;
(6)重复步骤(4)和步骤(5)5次,得到离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷。
对比例2
为与本实施例制备得到的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷进行对比,对比例2制备了未掺杂离子且未浸渍蛋白的多孔磷酸钙陶瓷,具体方法如下:
(1)制备β-磷酸三钙粉体,所不同的是原料中不加入锌离子掺杂;
(2)将步骤(1)得到的β-磷酸钙粉体通过造孔剂法制备为多孔磷酸钙陶瓷坯体,以5°c/min的速率升温至1100°c,保温时间为3h。
物相分析结果显示,在未浸渍蛋白之前,对比例2和实施例2的物相均为β-磷酸三钙,但实施例中的衍射峰向高角度偏移,证明锌离子掺杂进入了磷酸钙的晶格内部,可参照图1。真空负压浸渍蛋白后,利用扫描电镜观察两者的表面,发现在对比例的陶瓷表面可以清晰地看到陶瓷的磷酸钙晶粒和表面微孔,而实施例的陶瓷表面覆盖有一层丝素蛋白,可参照图2与图3。对比例与实施例陶瓷的孔隙率几乎相同,从图11可知,实施例2抗压强度却明显高于对比例,可参照图10。
将实施例2与对比例2分别与小鼠骨髓间充质干细胞共培养,发现双重改性的实施例2的细胞增殖、粘附和细胞活性均优于对比例2,可参照图4a和图4b;且alp活性表达量均高于对比例2,可参照图5a。在培养10d时,实施例2的alp活性表达量为18.23±2.22u/mg,而对比例2的alp活性表达量为10.15±1.33u/mg。因此双重改性多孔磷酸钙陶瓷提高了骨髓间充质干细胞在磷酸钙陶瓷表面的增殖与成骨分化性能。提取实施例2与对比例2陶瓷的浸提液,使用浸提液培养人脐静脉内皮细胞,结果显示,使用实施例浸提液培养的细胞增殖、活性和no表达量均高于对比例,说明实施例的双重改性多孔磷酸钙陶瓷更易于血管生成,参照图6a、图6b、图7和图8。
实施例3
本实施例使用掺杂有0.1mol.%锌离子的羟基磷灰石粉体为原料,制备所述离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷,具体过程包括:
(1)制备得到浓度为9wt.%的丝素蛋白溶液;
(2)合成掺杂0.1mol.%锌离子的羟基磷灰石粉体;
(3)将步骤(2)得到的锌离子掺杂磷酸钙粉体通过3d打印法制备为多孔磷酸钙陶瓷坯体,以10°c/min的速率升温至1000°c,保温4h,进行高温烧结,得到离子掺杂的多孔磷酸钙陶瓷;
(4)将步骤(3)得到的锌离子掺杂多孔磷酸钙陶瓷浸渍在步骤(1)制备的丝素蛋白溶液中,浸渍时间为10min,渗透负压为0mpa;
(5)步骤(4)浸渍后的锌离子掺杂多孔磷酸钙陶瓷在60°c干燥10min;
(6)重复步骤(4)和步骤(5)7次,得到离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷。
对比例3
为与本实施例制备得到的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷进行对比,对比例3制备了未掺杂离子且未浸渍蛋白的多孔磷酸钙陶瓷,具体方法如下:
(1)制备羟基磷灰石粉体,所不同的是原料中不加入锌离子掺杂;
(2)将步骤(1)得到的磷酸钙粉体通过3d打印法制备为多孔磷酸钙陶瓷坯体,以10°c/min的速率升温至1000°c,保温时间为4h。
物相分析结果显示,在未浸渍蛋白之前,对比例3和实施例3的物相均为羟基磷灰石,但实施例中的衍射峰向高角度偏移,证明锌离子掺杂进入了磷酸钙的晶格内部,可参照图1。真空负压浸渍蛋白后,利用扫描电镜观察两者的表面,发现在对比例的陶瓷表面可以清晰地看到陶瓷的磷酸钙晶粒和表面微孔,而实施例的陶瓷表面覆盖有一层丝素蛋白,可参照图2和图3。对比例与实施例陶瓷的孔隙率几乎相同,但实施例陶瓷的强度却明显高于对比例,可参照图10。
将实施例3与对比例3分别与小鼠骨髓间充质干细胞共培养,发现双重改性的实施例3的细胞增殖、粘附和细胞活性均优于对比例3,可参照图4a和图4b。且alp活性表达量均高于对比例2,在培养10d时,实施例3的alp活性表达量为20.23±2.12u/mg,而对比例3的alp活性表达量为11.25±1.34u/mg,可参照图5a。因此双重改性多孔磷酸钙陶瓷提高了骨髓间充质干细胞在磷酸钙陶瓷表面的增殖与成骨分化性能。提取实施例3与对比例3陶瓷的浸提液,使用浸提液培养人脐静脉内皮细胞,结果显示,使用实施例浸提液培养的细胞增殖、活性和no表达量均高于对比例,说明实施例的双重改性多孔磷酸钙陶瓷更易于血管生成,可参照图6a、图6b、图7和图8。
实施例4
本实施例使用掺杂有1mol.%锶离子的β-磷酸三钙粉体和掺杂有1mol.%羟基磷灰石粉体为原料,制备所述离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷,具体过程包括:
(1)制备得到浓度为6wt.%的丝素蛋白溶液;
(2)合成掺杂1mol.%锶离子的β-磷酸三钙粉体和掺杂1mol.%锶离子羟基磷灰石粉体,然后形成混合粉体;其中掺杂1mol.%锶离子的β-磷酸三钙粉体与掺杂1mol.%锶离子的羟基磷灰石粉体质量比为83:17;
(3)将步骤(2)得到的锶离子掺杂磷酸钙粉体通过挤出成型法制备为多孔磷酸钙陶瓷坯体,以2°c/min的速率升温至1200°c,保温3h,进行高温烧结,得到离子掺杂的多孔磷酸钙陶瓷;
(4)将步骤(3)得到的锶离子掺杂多孔磷酸钙陶瓷浸渍在步骤(1)制备的丝素蛋白溶液中,浸渍时间为1min,渗透负压为0.05mpa;
(5)步骤(4)浸渍后的锶离子掺杂多孔磷酸钙陶瓷在30°c干燥30min;
(6)重复步骤(4)和步骤(5)3次,得到离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷。
对比例4
为与本实施例制备得到的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷进行对比,对比例4制备了未掺杂离子且未浸渍蛋白的多孔磷酸钙陶瓷,具体方法如下:
(1)制备β-磷酸三钙粉体和羟基磷灰石粉体,所不同的是原料中不加入锶离子掺杂;
(2)将步骤(1)得到的磷酸钙粉体通过挤出成型法制备为多孔磷酸钙陶瓷坯体,以2°c/min的速率升温至1200°c,保温时间为2h。
物相分析结果显示,在未浸渍蛋白之前,对比例4和实施例4的物相均为β-磷酸三钙粉体和羟基磷灰石粉体,但实施例中的衍射峰向低角度偏移,证明锶离子掺杂进入了磷酸钙的晶格内部。真空负压浸渍蛋白后,利用扫描电镜观察两者的表面,发现在对比例的陶瓷表面可以清晰地看到陶瓷的磷酸钙晶粒和表面微孔,而实施例的陶瓷表面覆盖有一层丝素蛋白,可参照图2和图3。对比例与实施例陶瓷的孔隙率几乎相同,但实施例陶瓷的强度却明显高于对比例。
将实施例4与对比例4分别与小鼠骨髓间充质干细胞共培养,发现双重改性的实施例4的细胞增殖、粘附和细胞活性均优于对比例4,且alp活性表达量均高于对比例4,可参照图5a。因此双重改性多孔磷酸钙陶瓷提高了骨髓间充质干细胞在磷酸钙陶瓷表面的增殖与成骨分化性能。提取实施例4与对比例4陶瓷的浸提液,使用浸提液培养人脐静脉内皮细胞,结果显示,使用实施例浸提液培养的细胞增殖、活性和no表达量均高于对比例,说明实施例的双重改性多孔磷酸钙陶瓷更易于血管生成,可参照图6a、图6b、图7和图8。
实施例5
本实施例应用掺杂有10mol.%锶离子的β-磷酸三钙粉体为原料,制备所述离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷,具体过程包括:
(1)制备得到浓度为7wt.%的丝素蛋白溶液;
(2)合成掺杂10mol.%锶离子的β-磷酸三钙粉体;
(3)将步骤(2)得到的锶离子掺杂磷酸钙粉体通过造孔剂法制备为多孔磷酸钙陶瓷坯体,以5°c/min的速率升温至1100°c,保温3h,进行高温烧结,得到离子掺杂的多孔磷酸钙陶瓷;
(4)将步骤(3)得到的锶离子掺杂多孔磷酸钙陶瓷浸渍在步骤(1)制备的丝素蛋白溶液中,浸渍时间为3min,渗透负压为0.1mpa;
(5)步骤(4)浸渍后的锶离子掺杂多孔磷酸钙陶瓷在37°c干燥25min;
(6)重复步骤(4)和步骤(5)5次,得到离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷。
对比例5
为与本实施例制备得到的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷进行对比,对比例5制备了未掺杂离子且未浸渍蛋白的多孔磷酸钙陶瓷,具体方法如下:
(1)制备β-磷酸三钙粉体,所不同的是原料中不加入锶离子掺杂;
(2)将步骤(1)得到的磷酸钙粉体通过造孔剂法制备为多孔磷酸钙陶瓷坯体,以5°c/min的速率升温至1100°c,保温时间为3h。
物相分析结果显示,在未浸渍蛋白之前,对比例5和实施例5的物相均为β-磷酸三钙,但实施例中的衍射峰向低角度偏移,证明锶离子掺杂进入了磷酸钙的晶格内部。真空负压浸渍蛋白后,利用扫描电镜观察两者的表面,发现在对比例的陶瓷表面可以清晰地看到陶瓷的磷酸钙晶粒和表面微孔,而实施例的陶瓷表面覆盖有一层丝素蛋白,可参照图2和图3。对比例与实施例陶瓷的孔隙率几乎相同,但实施例陶瓷的强度却明显高于对比例,可参照图10。
将实施例5与对比例5分别与小鼠骨髓间充质干细胞共培养,发现双重改性的实施例5的细胞增殖、粘附和细胞活性均优于对比例5,且alp活性表达量均高于对比例5,可参照图5a。因此双重改性多孔磷酸钙陶瓷提高了骨髓间充质干细胞在磷酸钙陶瓷表面的增殖与成骨分化性能。提取实施例5与对比例5陶瓷的浸提液,使用浸提液培养人脐静脉内皮细胞,结果显示,使用实施例浸提液培养的细胞增殖、活性和no表达量均高于对比例,说明实施例的双重改性多孔磷酸钙陶瓷更易于血管生成,可参照图6a、图6b、图7和图8。
实施例6
本实施例应用掺杂有50mol.%锶离子的羟基磷灰石粉体为原料,制备所述离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷,具体过程包括:
(1)制备得到浓度为9wt.%的丝素蛋白溶液;
(2)合成掺杂50mol.%锶离子的羟基磷灰石粉体;
(3)将步骤(2)得到的锶离子掺杂磷酸钙粉体通过3d打印法制备为多孔磷酸钙陶瓷坯体,以10°c/min的速率升温至1000°c,保温4h,进行高温烧结,得到离子掺杂的多孔磷酸钙陶瓷;
(4)将步骤(3)得到的锶离子掺杂多孔磷酸钙陶瓷浸渍在步骤(1)制备的丝素蛋白溶液中,浸渍时间为10min,渗透负压为0mpa;
(5)步骤(4)浸渍后的锶离子掺杂多孔磷酸钙陶瓷在60°c干燥10min;
(6)重复步骤(4)和步骤(5)7次,得到离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷。
对比例6
为与本实施例制备得到的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷进行对比,对比例6制备了未掺杂离子且未浸渍蛋白的多孔磷酸钙陶瓷,具体方法如下:
(1)制备羟基磷灰石粉体,所不同的是原料中不加入锶离子掺杂;
(2)将步骤(1)得到的磷酸钙粉体通过3d打印法制备为多孔磷酸钙陶瓷坯体,以10°c/min的速率升温至1000°c,保温时间为4h。
物相分析结果显示,在未浸渍蛋白之前,对比例6和实施例6的物相均为羟基磷灰石,但实施例中的衍射峰向低角度偏移,证明锶离子掺杂进入了磷酸钙的晶格内部。真空负压浸渍蛋白后,利用扫描电镜观察两者的表面,发现在对比例的陶瓷表面可以清晰地看到陶瓷的磷酸钙晶粒和表面微孔,而实施例的陶瓷表面覆盖有一层丝素蛋白,可参照图2和图3。对比例与实施例陶瓷的孔隙率几乎相同,但实施例陶瓷的强度却明显高于对比例,可参照图10。
将实施例6与对比例6分别与小鼠骨髓间充质干细胞共培养,发现双重改性的实施例6的细胞增殖、粘附和细胞活性均优于对比例6,且alp活性表达量均高于对比例6,可参照图5a。因此双重改性多孔磷酸钙陶瓷提高了骨髓间充质干细胞在磷酸钙陶瓷表面的增殖与成骨分化性能。提取实施例6与对比例6陶瓷的浸提液,使用浸提液培养人脐静脉内皮细胞,结果显示,使用实施例浸提液培养的细胞增殖、活性和no表达量均高于对比例,说明实施例的双重改性多孔磷酸钙陶瓷更易于血管生成,可参照图6a、图6b、图7和图8。
实施例7
本实施例应用掺杂有1mol.%锰离子的α-磷酸三钙粉体为原料,制备所述离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷,具体过程包括:
(1)制备得到浓度为6wt.%的丝素蛋白溶液;
(2)合成掺杂1mol.%锰离子的α-磷酸三钙粉体;
(3)将步骤(2)得到的锰离子掺杂磷酸钙粉体通过挤出成型法制备为多孔磷酸钙陶瓷坯体,以2°c/min的速率升温至1200°c,保温2h,进行高温烧结,得到离子掺杂的多孔磷酸钙陶瓷;
(4)将步骤(3)得到的锰离子掺杂多孔磷酸钙陶瓷浸渍在步骤(1)制备的丝素蛋白溶液中,浸渍时间为1min,渗透负压为0.05mpa;
(5)步骤(4)浸渍后的锰离子掺杂多孔磷酸钙陶瓷在30°c干燥30min;
(6)重复步骤(4)和步骤(5)3次,得到离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷。
对比例7
为与本实施例制备得到的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷进行对比,对比例7制备了未掺杂离子且未浸渍蛋白的多孔磷酸钙陶瓷,具体方法如下:
(1)制备α-磷酸三钙粉体,所不同的是原料中不加入锰离子掺杂;
(2)将步骤(1)得到的磷酸钙粉体通过挤出成型法制备为多孔磷酸钙陶瓷坯体,以2°c/min的速率升温至1200°c,保温时间为2h。
物相分析结果显示,在未浸渍蛋白之前,对比例7和实施例7的物相均为α-磷酸三钙粉体,但实施例中的衍射峰向低角度偏移,证明锰离子掺杂进入了磷酸钙的晶格内部。真空负压浸渍蛋白后,利用扫描电镜观察两者的表面,发现在对比例的陶瓷表面可以清晰地看到陶瓷的磷酸钙晶粒和表面微孔,而实施例的陶瓷表面覆盖有一层丝素蛋白,可参照图2和图3。对比例与实施例陶瓷的孔隙率几乎相同,但实施例陶瓷的强度却明显高于对比例,可参照图10。
将实施例7与对比例7分别与小鼠骨髓间充质干细胞共培养,发现双重改性的实施例7的细胞增殖、粘附和细胞活性均优于对比例7,且alp活性表达量均高于对比例7,可参照图5a。因此双重改性多孔磷酸钙陶瓷提高了骨髓间充质干细胞在磷酸钙陶瓷表面的增殖与成骨分化性能。提取实施例7与对比例7陶瓷的浸提液,使用浸提液培养人脐静脉内皮细胞,结果显示,使用实施例浸提液培养的细胞增殖、活性和no表达量均高于对比例,说明实施例的双重改性多孔磷酸钙陶瓷更易于血管生成,可参照图6a、图6b、图7和图8。
实施例8
本实施例应用掺杂有5mol.%锰离子的β-磷酸三钙粉体为原料,制备所述离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷,具体过程包括:
(1)制备得到浓度为7wt.%的丝素蛋白溶液;
(2)合成掺杂10mol.%锰离子的β-磷酸三钙粉体;
(3)将步骤(2)得到的锰离子掺杂磷酸钙粉体通过发泡法制备为多孔磷酸钙陶瓷坯体,在1100°c高温烧结,升温速率为5°c/min,保温时间为3h,得到离子掺杂的多孔磷酸钙陶瓷;
(4)将步骤(3)得到的锰离子掺杂多孔磷酸钙陶瓷浸渍在步骤(1)制备的丝素蛋白溶液中,浸渍时间为3min,渗透负压为0.1mpa;
(5)步骤(4)浸渍后的锰离子掺杂多孔磷酸钙陶瓷在37°c干燥25min;
(6)重复步骤(4)和步骤(5)5次,得到离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷。
对比例8
为与本实施例制备得到的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷进行对比,对比例8制备了未掺杂离子且未浸渍蛋白的多孔磷酸钙陶瓷,具体方法如下:
(1)制备β-磷酸三钙粉体,所不同的是原料中不加入锰离子掺杂;
(2)将步骤(1)得到的磷酸钙粉体通过发泡法制备为多孔磷酸钙陶瓷坯体,在1100°c高温烧结,升温速率为5°c/min,保温时间为3h。
物相分析结果显示,在未浸渍蛋白之前,对比例8和实施例8的物相均为β-磷酸三钙,但实施例中的衍射峰向低角度偏移,证明锰离子掺杂进入了磷酸钙的晶格内部。真空负压浸渍蛋白后,利用扫描电镜观察两者的表面,发现在对比例的陶瓷表面可以清晰地看到陶瓷的磷酸钙晶粒和表面微孔,而实施例的陶瓷表面覆盖有一层丝素蛋白,可参照图2和图3。对比例与实施例陶瓷的孔隙率几乎相同,但实施例陶瓷的强度却明显高于对比例,可参照图10。
将实施例8与对比例8分别与小鼠骨髓间充质干细胞共培养,发现双重改性的实施例8的细胞增殖、粘附和细胞活性均优于对比例8,且alp活性表达量均高于对比例8,可参照图5a。因此双重改性多孔磷酸钙陶瓷提高了骨髓间充质干细胞在磷酸钙陶瓷表面的增殖与成骨分化性能。提取实施例8与对比例8陶瓷的浸提液,使用浸提液培养人脐静脉内皮细胞,结果显示,使用实施例浸提液培养的细胞增殖、活性和no表达量均高于对比例,说明实施例的双重改性多孔磷酸钙陶瓷更易于血管生成,可参照图6a、图6b、图7和图8。
实施例9
本实施例应用掺杂有10mol.%锰离子的羟基磷灰石粉体为原料,制备所述离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷,具体过程包括:
(1)制备得到浓度为9wt.%的丝素蛋白溶液;
(2)合成掺杂10mol.%锰离子的羟基磷灰石粉体;
(3)将步骤(2)得到的锰离子掺杂磷酸钙粉体通过挤出成型法与造孔剂法结合的方法制备为多孔磷酸钙陶瓷坯体,在1000°c高温烧结,升温速率为10°c/min,保温时间为4h,得到离子掺杂的多孔磷酸钙陶瓷;
(4)将步骤(3)得到的锰离子掺杂多孔磷酸钙陶瓷浸渍在步骤(1)制备的丝素蛋白溶液中,浸渍时间为10min,渗透负压为0mpa;
(5)步骤(4)浸渍后的锰离子掺杂多孔磷酸钙陶瓷在60°c干燥10min;
(6)重复步骤(4)和步骤(5)7次,得到离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷。
对比例9
为与本实施例制备得到的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷进行对比,对比例9制备了未掺杂离子且未浸渍蛋白的多孔磷酸钙陶瓷,具体方法如下:
(1)制备羟基磷灰石粉体,所不同的是原料中不加入锰离子掺杂;
(2)将步骤(1)得到的磷酸钙粉体通过挤出成型法与造孔剂法结合的方法制备为多孔磷酸钙陶瓷坯体,在1000°c高温烧结,升温速率为10°c/min,保温时间为4h。
物相分析结果显示,在未浸渍蛋白之前,对比例9和实施例9的物相均为羟基磷灰石,但实施例中的衍射峰向低角度偏移,证明锰离子掺杂进入了磷酸钙的晶格内部。真空负压浸渍蛋白后,利用扫描电镜观察两者的表面,发现在对比例的陶瓷表面可以清晰地看到陶瓷的磷酸钙晶粒和表面微孔,而实施例的陶瓷表面覆盖有一层丝素蛋白,可参照图2和图3。对比例与实施例陶瓷的孔隙率几乎相同,但实施例陶瓷的强度却明显高于对比例,可参照图10。
将实施例9与对比例9分别与小鼠骨髓间充质干细胞共培养,发现双重改性的实施例9的细胞增殖、粘附和细胞活性均优于对比例9,且alp活性表达量均高于对比例9,可参照图5a。因此双重改性多孔磷酸钙陶瓷提高了骨髓间充质干细胞在磷酸钙陶瓷表面的增殖与成骨分化性能。提取实施例9与对比例9陶瓷的浸提液,使用浸提液培养人脐静脉内皮细胞,结果显示,使用实施例浸提液培养的细胞增殖、活性和no表达量均高于对比例,说明实施例的双重改性多孔磷酸钙陶瓷更易于血管生成,可参照图6a、图6b、图7和图8。
实施例10
本实施例应用掺杂有5mol.%锰离子和10mol.%锶离子的β-磷酸三钙粉体为原料,制备所述离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷,具体过程包括:
(1)制备得到浓度为7wt.%的丝素蛋白溶液;
(2)合成掺杂5mol.%锰离子和10mol.%锶离子的β-磷酸三钙粉体;
(3)将步骤(2)得到的锰锶离子掺杂磷酸钙粉体通过发泡法制备为多孔磷酸钙陶瓷坯体,在1100°c高温烧结,升温速率为5°c/min,保温时间为3h,得到离子掺杂的多孔磷酸钙陶瓷;
(4)将步骤(3)得到的锰锶离子掺杂多孔磷酸钙陶瓷浸渍在步骤(1)制备的丝素蛋白溶液中,浸渍时间为3min,渗透负压为0.1mpa;
(5)步骤(4)浸渍后的锰锶离子掺杂多孔磷酸钙陶瓷在37°c干燥25min;
(6)重复步骤(4)和步骤(5)5次,得到离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷。
对比例10
为与本实施例制备得到的离子掺杂和蛋白浸渍双重改性多孔磷酸钙陶瓷进行对比,对比例10制备了未掺杂离子且未浸渍蛋白的多孔磷酸钙陶瓷,具体方法如下:
(1)制备β-磷酸三钙粉体,所不同的是原料中不加入锰锶离子掺杂;
(2)将步骤(1)得到的磷酸钙粉体通过发泡法制备为多孔磷酸钙陶瓷坯体,在1100°c高温烧结,升温速率为5°c/min,保温时间为3h。
物相分析结果显示,在未浸渍蛋白之前,对比例10和实施例10的物相均为β-磷酸三钙,但实施例中的衍射峰向低角度偏移,证明锰锶离子掺杂进入了磷酸钙的晶格内部。真空负压浸渍蛋白后,利用扫描电镜观察两者的表面,发现在对比例的陶瓷表面可以清晰地看到陶瓷的磷酸钙晶粒和表面微孔,而实施例的陶瓷表面覆盖有一层丝素蛋白,可参照图2和图3。对比例与实施例陶瓷的孔隙率几乎相同,但实施例陶瓷的强度却明显高于对比例,可参照图10。
将实施例10与对比例10分别与小鼠骨髓间充质干细胞共培养,发现双重改性的实施例10的细胞增殖、粘附和细胞活性均优于对比例10,且alp活性表达量均高于对比例10,可参照图5a。因此双重改性多孔磷酸钙陶瓷提高了骨髓间充质干细胞在磷酸钙陶瓷表面的增殖与成骨分化性能。提取实施例10与对比例10陶瓷的浸提液,使用浸提液培养人脐静脉内皮细胞,结果显示,使用实施例浸提液培养的细胞增殖、活性和no表达量均高于对比例,说明实施例的双重改性多孔磷酸钙陶瓷更易于血管生成,可参照图6a、图6b、图7和图8。
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种稀土掺杂陶瓷基金刚石基板材料及其制备方法
- 通过稀土化合物共掺杂可控析出ML-Ag团簇和Ag纳米晶的发光玻璃及其制备方法
- 丝网印刷用稀土上转换发光油墨及其制备方法及防伪应用
- 提高稀土离子掺杂无机氟化物上转换发光强度的方法
- 一种稀土离子掺杂的铌酸锆荧光粉及其制备方法
- 一种稀土离子掺杂的红色荧光粉及其制备方法
- 多壁碳纳米管/ Ce<sup>3+</sup>掺杂TiO<sub>2</sub>纳米纤维在对苯酚催化降解中的应用
- 一种Er<sup>3+</sup>/Nd<sup>3+</sup>共掺杂Na<sub>5</sub>Lu<sub>9</sub>F<sub>32</sub>单晶体及其生长方法
- 一种具有红光定向发射性能的镱/铥离子共掺六方相氟钇化钠微米晶体的制作方法
- 一种具有红光定向发射性能的β-NaYF4