HBV表型耐药检测试剂盒及其制备方法与流程
本发明涉及一种耐药检测试剂盒,具体地说,涉及一种用于HBV(乙肝病毒)、针对现有各种NAs药物的表型耐药检测试剂盒。同时,本发明也涉及该HBV表型耐药检测试剂盒的制备方法。
背景技术:
慢性乙型肝炎(CHB)是全球范围内重要的医学和公共卫生问题,目前全世界约有4亿人受其影响。高达40%的CHB可能发生肝硬化、失代偿性肝病和肝细胞肝癌(HCC)等并发症。目前,可用于治疗慢性乙型肝炎(CHB)的药物包括免疫调节剂(如干扰素-α)和口服核苷/核苷酸类似物(NAs),包括拉米夫定、拉米夫定、替比夫定、恩替卡韦和替诺福韦。由于口服NAs具有强大的病毒抑制效果和每日单剂量用药比较容易并且没有明显的副作用,现已成为慢性乙型肝炎治疗的主要方法。但是,NAs治疗的一个主要的缺点是长期治疗产生耐药性突变。NAs耐药的患者会出现病毒学突破以致病情恶化。因此,如何早期准确地检测HBV耐药变异具有重要的意义,对于HBV耐药检测试剂盒的研发也是十分必要的。基因型耐药是指通过测序等手段检测已通过表型分析证实的与NAs耐药相关的基因变异;而表型耐药是指通过体外病毒复制系统证实变异HBV对NAs敏感性降低,其是判定体内病毒是否耐药的最直接证据。目前,绝大多数HBV表型耐药检测方法的主要瓶颈有:1.将HBV基因组克隆进入表达载体过程较慢;2.HBV病毒载体体外转染缺乏有效、准确的校准系统,虽然大都采用外在的带有标签蛋白的示踪载体与HBV载体共转染细胞的方法来校准转染效率,然而这种方法很不稳定。
技术实现要素:
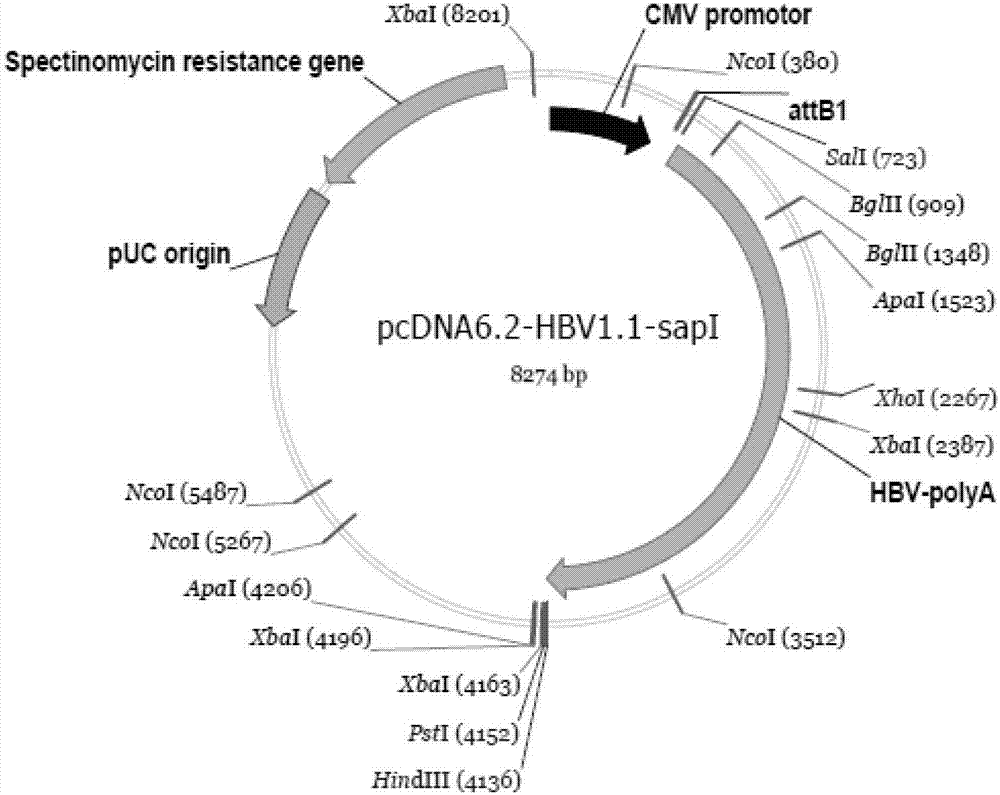
本发明所要解决的第一个技术问题是提供一种用于HBV、针对现有各种NAs药物的表型耐药检测试剂盒。本发明所要解决的第二个技术问题是提供上述用于HBV、针对现有各种NAs药物的表型耐药检测试剂盒的制备方法。为了解决上述第一个技术问题,本发明提供了一种HBV表型耐药检测试剂盒,所述试剂盒包括可以置换HBV1.0片段的重组入门载体和带有分泌性碱性磷酸酶的双表达载体。作为一个优选方案,所述可以置换HBV1.0片段的重组入门载体为pcDNA6.2-HBV1.1-sapI载体,其碱基序列如SEQIDNo.4所示;所述带有分泌性碱性磷酸酶的双表达载体为pcDNA5AP-attR载体,其碱基序列如SEQIDNo.6所示。为了解决上述第二个技术问题,本发明提供所述HBV表型耐药检测试剂盒的制备方法,其特征在于,所述pcDNA6.2-HBV1.1-sapI载体和pcDNA5AP-attR载体的构建包括以下步骤:(1)pcDNA6.2-HBV1.1-sapI载体构建(1.1)扩增pMD18T自连载体多克隆位点区,引物如下;6.2-salI-s:5’-ACGCGTCGACCGAAAGGGGGATGTG-3’(SEQIDNo.8所示);6.2-salI-as:5’-ACGCTCGAGGAGCTCGGTACCCGG-3’(SEQIDNo.9所示);以pMD18T自连载体为模板扩增,扩增序列如SEQIDNo.1所示;(1.2)把pcDNA6.2miR/GW载体用salI和xhoI双酶切,与上述扩增产物连接形成pcDNA6.2-msc载体,序列如SEQIDNo.2所示;(1.3)扩增HBV1.1片段,引物如下:HBV-salI-s:ATAGCGTCGACCACCAGCACCATGC(SEQIDNo.10所示);HBV-hindIII-as:AAGGGAACAAAAGCTGGTACCGGGC(SEQIDNo.11所示);以HBV1.1质粒为模板扩增,扩增片段中不含常用的限制性酶切位点,扩增序列如SEQIDNo.3所示;(1.4)SalI和hindIII双酶切步骤(1.2)扩增的HBV1.1后,插入到pcDNA6.2-msc载体中;(1.5)设计突变引物HBV-QuickChange-S:5'-CACCAGCACCATGCAACGCTCTTCTTTTTCACCTCTGCC-3'(SEQIDNo.12所示);HBV-QuickChange-AS:5'-GGCAGAGGTGAAAAAGAAGAGCGTTGCATGGTGCTGGTG-3'(SEQIDNo.13所示);把HBV1.0基因3’末端引入sapI酶切位点GCTCTTC,经DpnI消化突变后形成pcDNA6.2-HBV1.1-sapI载体,序列如SEQIDNo.4所示;(2)pcDNA5AP-attR载体构建(2.1)以plenti6-dest载体为模板,扩增片段如SEQIDNo.5所示,引物为:attR-aflII-s:5’-gggcttaagataagcagagctcgtt-3’(SEQIDNo.14所示);attR-apaI-as:5’-taccgggcccattactaaccggtacgc-3’(SEQIDNo.15所示);(2.2)aflII和apaI双酶切上述扩增片段,定向连接到pcDNA5AP-TA载体上,形成pcDNA5AP-attR载体,如SEQIDNo.6所示。本发明的技术思路基于下述三方面的考虑。第一,在乙型肝炎临床治疗工作中,表型耐药检测能够为患者的治疗方案的制定提供重要依据;第二,目前绝大多数表型耐药检测在HBV基因组克隆进入载体时多采用的传统的酶切连接克隆手段,该方法受到载体和目的基因上酶切位点的限制,因而载体的选择范围窄,HBV作为目的基因由于亚型很多一旦某个亚型的限制酶切位点不合适则不能进行克隆,导致目的基因检测范围也窄,另外由于HBV1.0基因片段较大该方法效率也受到限制。我们所利用的GatewayTM重组是克隆和亚克隆DNA序列的一项新颖的通用系统,这项强大的体外技术大大提高了克隆效率(高达95%或更高),并且可以将目的基因通过平行反应转移到一个或更多个目的载体;第三,目前大多数HBV表型耐药检测方法只能依靠外在的示踪载体与HBV载体共转染的方法来校准转染效率,该方法不够稳定、准确,我们将分泌性碱性磷酸酶作为示踪基因和HBV目的基因放在同一个表达载体上,有利于实现更稳定、更准确地校准HBV的转染、转录复制。为实现这一目标,我们将利用GatewayTM重组技术将HBV基因组克隆到带有分泌性碱性磷酸酶的示踪的表达载体,构成HBV1.1拷贝基因和分泌性碱性磷酸酶基因双表达载体,转染HepG2细胞后以碱性磷酸酶为校准系统进行表型耐药检测。本发明的优点在于:(1)本发明提供的耐药检测试剂盒主要包括一套基于GatewayTM重组的表达载体系统,该系统包含带有分泌性碱性磷酸酶的双表达载体、可以置换HBV1.0片段的重组入门载体;(2)该重组系统避免了限制性内切酶位点对克隆地限制,可以快速、正确地将目的片段引入表达载体;(3)该耐药检测载体系统可利用培养基上清进行化学发光定量检测,不仅灵敏度高而且可以根据标准碱性磷酸酶的对照进行定量和校准,操作简便,稳定。附图说明图1为pcDNA6.2-msc载体结构图;图2为pcDNA6.2-HBV1.1-sapI载体结构图;图3为pcDNA5AP-attR载体结构图;图4为pcDNA5AP-HBV1.1载体结构图;图5为HBsAg、SEAP-表达水平及相关性;图6为HBVDNA、SEAP-表达水平;图7为HBV野生株拉米夫定耐药IC50曲线图;图8为该HBV表型耐药检测系统主要技术路线图。具体实施方式下面结合具体实施例,进一步阐述本发明。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(NewYork:ColdSpringHarborLaboratoryPress,1989)中所述的条件,或按照制造厂商所建议的条件。实施例1HBV表型耐药载体的构建HBV表型耐药载体的构建步骤包括产生一套基于GatewayTM重组的表达载体系统。该系统包含带有分泌性碱性磷酸酶的双表达载体、可以置换HBV1.0片段的重组入门载体,主要技术路线如图8所示。具体步骤如下:1.可以置换HBV1.0片段的pcDNA6.2-HBV1.1-sapI载体构建所述步骤具体为:1.1首先扩增pMD18T自连载体多克隆位点区,引物如下;6.2-salI-s:5’-ACGCGTCGACCGAAAGGGGGATGTG-3’(SEQIDNo.8所示);6.2-salI-as:5’-ACGCTCGAGGAGCTCGGTACCCGG-3’(SEQIDNo.9所示);以本实验室保存pMD18T自连载体为模板扩增,扩增序列如SEQIDNo.1所示;反应条件:94度2分钟;94度15秒,55度30秒,72度20秒扩增30个循环;72度10分钟。把pcDNA6.2miR/GW载体salI和xhoI双酶切,与上述扩增产物连接形成图1所示的pcDNA6.2-msc载体;序列如SEQIDNo.1所示;1.2把pcDNA6.2miR/GW载体用salI和xhoI双酶切,与上述扩增产物连接形成pcDNA6.2-msc载体;序列如SEQIDNo.2所示;1.3扩增HBV1.1片段引物:HBV-salI-s:ATAGCGTCGACCACCAGCACCATGC(SEQIDNo.10所示);HBV-hindIII-as:AAGGGAACAAAAGCTGGTACCGGGC(SEQIDNo.11所示);以本实验室保存HBV1.1质粒为模板扩增,扩增片段中不含常用的限制性酶切位点,扩增序列如SEQIDNo.3所示;反应条件:94度2分钟;94度15秒,58度30秒,72度3分40秒扩增30个循环;72度10分钟;1.4SalI和hindIII双酶切步骤1.2扩增的HBV1.1后,插入到pcDNA6.2-msc载体中;1.5设计突变引物HBV-QuickChange-S:5'-CACCAGCACCATGCAACGCTCTTCTTTTTCACCTCTGCC-3'(SEQIDNo.12所示);HBV-QuickChange-AS:5'-GGCAGAGGTGAAAAAGAAGAGCGTTGCATGGTGCTGGTG-3'(SEQIDNo.13所示);把HBV1.0基因3’末端引入sapI酶切位点GCTCTTC,以上述1.4步骤形成载体为模板,反应条件:94度2分钟;94度15秒,68度30秒,72度9分钟扩增30个循环;72度10分钟;扩增产物经DpnI消化突变后形成图2所示的pcDNA6.2-HBV1.1-sapI载体,序列如SEQIDNo.4所示。2.带有分泌性碱性磷酸酶标记的pcDNA5AP-attR载体构建所述步骤具体为:2.1以plenti6-dest载体为模板,扩增片段如SEQIDNo.5所示,引物为:attR-aflII-s:5’-gggcttaagataagcagagctcgtt-3’(SEQIDNo.14所示);attR-apaI-as:5’-taccgggcccattactaaccggtacgc-3’(SEQIDNo.15所示);以plenti6-dest载体为模板,反应条件:94度2分钟;94度15秒,55度30秒,72度2分钟扩增30个循环;72度10分钟;2.2aflII和apaI双酶切上述扩增片段,定向连接到pcDNA5AP-TA载体上(本实验室保存载体,具体可参考中国发明专利ZL201110073304.7中的介绍),形成图3所示的pcDNA5AP-attR载体,如SEQIDNo.6所示。实施例2HBV耐药载体系统耐药检测应用验证1.待测HBV1.0片段置换引入应用实施例1构建的pcDNA6.2-HBV1.1-sapI载体形成入门克隆pcDNA6.2-HBV1.1(p);1.1扩增标准HBVC1亚型HBV1.0片段所用引物:HBV1.0-as:TAGTGGAAGCTTGACCATGGTGAGCAAGGGCGAG(SEQIDNo.16所示);HBV1.0-s:GCTTGGGATCCAATTCTTACTTGTACAGCTCG(SEQIDNo.17所示);以实验室保存HBVC2亚型质粒模板,反应条件:94度2分钟;94度15秒,55度30秒,72度3分钟20秒扩增30个循环;72度10分钟;1.2扩增所得产物和pcDNA6.2-HBV1.1-sapI载体经sapI和SalI双酶切后连接,形成pcDNA6.2-HBV1.1(p)。2.重组:门克隆pcDNA6.2-HBV1.1(p)、pDONR221、应用实施例1构建的pcDNA5AP-attR载体实现重组,经快速BP/LR反应得到图4所示的pcDNA5AP-HBV1.1载体,如SEQIDNo.7所示。3.转染HepG2细胞;3.1转染HepG2细胞,收集上清,检测HBsAg(可见光分析仪检测或者ELISA检测)和分泌性碱性磷酸酶分泌水平(可见光分析仪检测),发现两者水平呈正相关关系,相关系数R2=0.999;3.2转染HepG2细胞,收集上清,检测HBVDNA和分泌性碱性磷酸酶分泌水平,发现两者水平呈正相关关系;3.3转染HepG2细胞,拉米夫定药物不同浓度处理三天,收集上清,检测HBsAg(可见光分析仪检测或者ELISA检测)、HBVDNA和分泌性碱性磷酸酶分泌水平(可见光分析仪检测),经分泌性碱性磷酸酶校准后,计算耐药IC50,发现结果与现有其它检测方法检测结果一致。4.结果:如图5所示,其为HBsAg水平与SEAP-表达水平的比较。从结果看出上清的SEAP化学发光水平与HBsAg水平呈显著正相关,对任意两个标本分别比较它们的SEAP值和HBsAg,可以看到两者的增加倍数成近似一致,两者呈现直线相关,相关系数R2=0.999;图6为HBVDNA、SEAP-表达水平。从结果上清的SEAP化学发光水平与HBVDNA水平也呈现出正相关关系,各个标本间两者增加倍数成近似一致;图7为HBV野生株拉米夫定耐药IC50曲线图,经分泌性碱性磷酸酶校准后,计算耐药IC50,发现结果与现有其它检测方法检测结果一致。实施例3关于试剂盒的说明在本发明所提供的试剂盒中,还包含其他组份或结构如引物、探针、显色剂等。具体说明如下:pcDNA6.2-HBV1.1-sapI载体1μgpcDNA5AP-attR载体1μg引物HBV1.0-asTAGTGGAAGCTTGACCATGGTGAGCAAGGGCGAG(SEQIDNo.16所示)引物HBV1.0-sGCTTGGGATCCAATTCTTACTTGTACAGCTCG(SEQIDNo.17所示)该试剂盒的其他组份如扩增PCR的试剂等均可以自行合成和购买,在此就不详细说明了。以上所述仅是本发明的优选实施方式。应当指出,对于本技术领域的普通技术人员,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1