丙型肝炎药物的晶型及其制备方法、其药物组合物和用途与流程
本申请属于药物化学结晶技术领域。具体而言,涉及丙型肝炎药物TMC435的新晶型,还涉及所述新晶型的制备方法、其药物组合物和用途。
背景技术:
TMC435(英文名称Simeprevir)是新一代丙型肝炎病毒(HCV)NS3/4A蛋白酶抑制剂,由Medivir公司和杨森(Janssen)公司开发。TMC435与聚乙二醇化干扰素和利巴韦林联合用药,用于治疗慢性丙型肝炎成年患者并可伴有代偿性肝病(包括各个阶段的肝纤维化)。其作用原理是抑制HCV的NS3/4A蛋白酶,从而抑制HCV在肝脏细胞中的复制。2013年9月,TMC435(在日本商品名Sovriad)获日本劳动卫生福利部批准,用于基因型-1慢性丙型肝炎病毒感染的治疗,这是TMC435获得的全球首个监管批准。2013年11月获FDA批准,商品名OLYSIO。OLYSIO是每日一次的口服胶囊(含150mg活性成分),给药方式为:OLYSIO联合聚乙二醇化干扰素和利巴韦林联合治疗12周,随后进行聚乙二醇干扰素和利巴韦林的联合治疗12周或36周。TMC435的化学名称为:(2R,3aR,10Z,11aS,12aR,14aR)-N-(环丙基磺酰基)-2,3,3a,4,5,6,7,8,9,11a,12,13,14,14a-十四氢-2-[[7-甲氧基-8-甲基-2-[4-(1-甲基乙基)-2-噻唑基]-4-喹啉基]氧基]-5-甲基-4,14-二氧代环戊并[c]环丙并[g][1,6]二氮杂环十四烯-12a(1H)-甲酰胺,分子式C38H47N5O7S2,分子量749.94,化学结构式如下所示:专利文献WO2007/014926A1公开了TMC435化合物及其制备方法。专利文献WO2008/092954A2公开了TMC435的六种晶型(晶型I、晶型II、晶型III、晶型IV、晶型V和晶型VI)及其制备方法,公开了其溶解度、XRPD、FT-IR和DSC数据,并述及晶型I为无水物和最稳定晶型。本发明人研究发现已知的TMC435化合物及其六种晶型存在以下缺陷:溶解度差,在室温水中的溶解度均小于1μg/mL,不适合用于有较高溶解度要求的药物剂型。鉴于现有技术尚存不足,有必要开发具有更多优势性能的TMC435的新晶型。
技术实现要素:
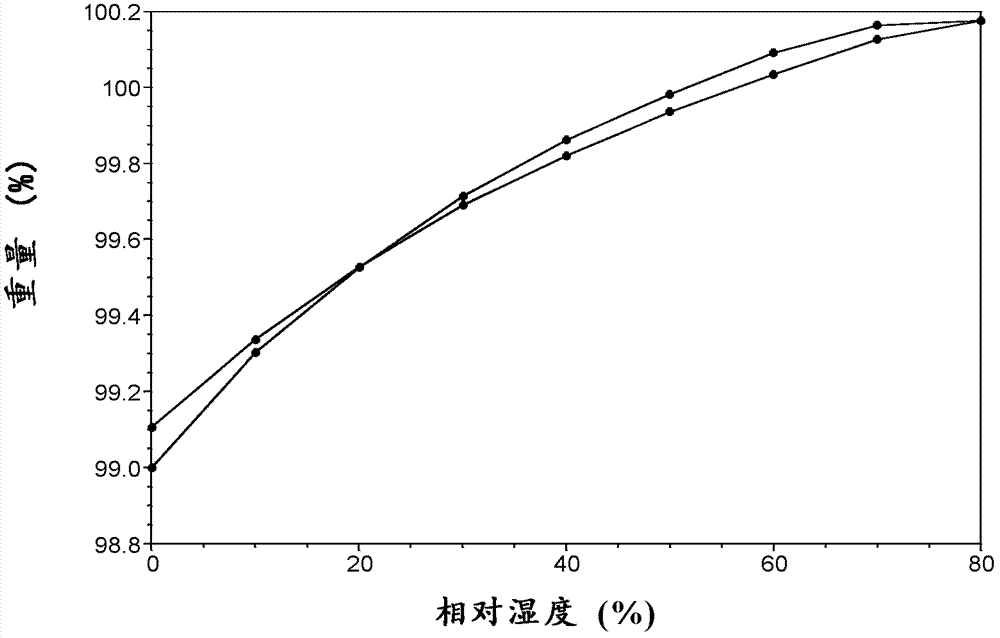
本发明的目的是提供TMC435的新晶型,并提供其制备方法、其药物组合物和用途。与已知的TMC435的晶型相比,本发明的TMC435的新晶型应具有一种或多种更优越的性能,例如:稳定性好例如晶型稳定性、热学稳定性、化学稳定性、机械稳定性、贮存稳定性等;溶解性好;溶出速度快;结晶度高;不易吸湿;易于纯化和处理;化学纯度高;低残留溶剂;低毒性;颗粒形貌佳;适宜的制剂可加工性例如流动性好、有利的粉体粘度、紧密度和可压实性;改善生物利用度和药效;延长保存期;适合制剂新剂型应用等方面,特别是在溶解度、稳定性等方面具有优势性能。根据本发明的目的,本发明提供TMC435的晶型A(在本发明中简称作“晶型A”)及其制备方法。使用Cu-Kα辐射,所述晶型A以2θ角度表示的X-射线粉末衍射图具有以下特征峰:10.2±0.2°、11.7±0.2°、12.9±0.2°、14.5±0.2°、18.0±0.2°和20.5±0.2°。在本发明优选的一个实施方案中,所述晶型A以2θ角度表示的X-射线粉末衍射图具有以下特征峰:4.6±0.2°、5.1±0.2°、6.4±0.2°、8.3±0.2°、9.1±0.2°、9.6±0.2°、10.2±0.2°、11.7±0.2°、12.9±0.2°、14.5±0.2°、18.0±0.2°和20.5±0.2°。在本发明进一步优选的一个实施方案中,所述晶型A以2θ角度表示的X-射线粉末衍射图具有以下特征峰及其相对强度:非限制性地,在本发明的一个具体实施方案中,所述晶型A具有如图4所示的X-射线粉末衍射图。所述晶型A具有至少一种如下的特性:所述晶型A的傅立叶红外光谱(FT-IR)图在波数为1714、1631、1613、1598、1506、1433、1351、1264、1165、1123、1112、1037、845和821cm-1处具有特征峰。非限制性地,在本发明的一个具体实施方案中,所述晶型A具有如图6所示的FT-IR图。非限制性地,在本发明的一个具体实施方案中,所述晶型A具有如图5所示的差式扫描量热图(DSC)和热重分析(TGA)图。显示:晶型A在约188℃熔融,之后在约223℃转晶,转晶得到的样品熔点约为258℃;150℃之前基本无失重,为无水物,分解温度约为272℃。TMC435晶型A的制备方法,采用下述方法(1)和(2)中的任意一种:(1)将TMC435的甲醇溶液在~10℃~40℃下挥发析晶,将析出的晶体分离、干燥,得到所述TMC435的晶型A。优选地,所述TMC435的甲醇溶液中TMC435的用量为室温下其在甲醇中的溶解度的0.1~1倍,更优选为0.5~1倍。优选地,所述析晶的温度为室温。优选地,所述析晶的时间为1~7天,更优选为1~3天。挥发析晶的具体操作是:将样品的澄清溶液放在敞口玻璃小瓶中,敞口或加盖打孔,挥发除去溶剂,获得晶体。(2)将TMC435的甲醇溶液冷却,在冷却后的温度下搅拌析晶,将析出的晶体分离、干燥,得到所述TMC435的晶型A。优选地,所述TMC435的甲醇溶液在冷却前的温度为45℃~60℃。优选地,所述TMC435的甲醇溶液中TMC435的用量为冷却前的温度下其在甲醇中的溶解度0.1~1倍,更优选为0.5~1倍。优选地,所述冷却后的温度为室温。优选地,所述析晶的时间为0.5~72小时,更优选为0.5~10小时。上述TMC435晶型A的制备方法(1)和(2)中,所述TMC435的甲醇溶液中,起始原料TMC435可以是TMC435的已知的化合物、晶型、无定型物或其混合物,例如根据专利文献WO2007/014926A1实施例5制备的TMC435化合物、根据专利文献WO2008/092954A2制备的TMC435的无定型物、晶型I、晶型II、晶型III、晶型IV、晶型V或晶型VI,起始原料TMC435也可以是本发明的TMC435的晶型D、晶型H、晶型G或晶型F。与已知的TMC435晶型相比,本发明的TMC435晶型A具有以下有益性质:(1)在25℃水中添加表面活性剂十二烷基硫酸钠的条件下,TMC435晶型A比已知的TMC435晶型具有更好的增溶效果和更高的溶解度;(2)在处方一致的情况下,本发明的TMC435晶型A的胶囊剂比已知晶型I的胶囊剂的溶出速率快;(3)TMC435晶型A在20%~80%相对湿度范围内的重量变化为0.10%,而相同条件下已知TMC435晶型I的重量变化为0.65%,说明TMC435晶型A更不易吸湿;(4)TMC435晶型A在室温、相对湿度小于10%RH的干燥器中放置6个月,晶型和熔点都不变。上述有益性质表明,与已知的TMC435晶型相比,本发明的TMC435晶型A具有多种优势性能,应用效果更好,更适合作为药物制剂的活性成分。活性成分具有更高的溶解性以及胶囊具有更好的溶出度,有利于提高药物的生物利用度,进而对药效产生积极影响;活性成分不易吸湿,可具有更好的颗粒流动性、更优良的制剂加工特性,有利于药物制造中的准确定量,提高制剂均一性;活性成分具有更低的吸湿性和长期贮存稳定性,能够更好地对抗药物制造和/或存储等过程中由环境温度、湿度等因素引起的活性成分含量不均匀、纯度降低和杂质增加等问题,降低由此带来的疗效下降风险和安全风险,并方便后期的储存和运输。根据本发明的目的,本发明提供TMC435的晶型D(在本发明中简称作“晶型D”)及其制备方法。使用Cu-Kα辐射,所述晶型D以2θ角度表示的X-射线粉末衍射图具有以下特征峰:7.8±0.2°、9.0±0.2°、10.4±0.2°、15.6±0.2°、18.1±0.2°和18.7±0.2°。在本发明优选的一个实施方案中,所述晶型D以2θ角度表示的X-射线粉末衍射图具有以下特征峰:6.9±0.2°、7.8±0.2°、9.0±0.2°、10.4±0.2°、11.6±0.2°、13.8±0.2°、15.6±0.2°、17.5±0.2°、18.1±0.2°、18.7±0.2°、21.4±0.2°和25.1±0.2°。在本发明进一步优选的一个实施方案中,所述晶型D以2θ角度表示的X-射线粉末衍射图具有以下特征峰及其相对强度:非限制性地,在本发明的一个具体实施方案中,所述晶型D具有如图8所示的X-射线粉末衍射图。所述晶型D具有至少一种如下的特性:所述晶型D的FT-IR图在波数为1712、1666、1630、1612、1598、1515、1436、1351、1265、1123、1074、1040、889和753cm-1处具有特征峰。非限制性地,在本发明的一个具体实施方案中,所述晶型D具有如图10所示的FT-IR图。非限制性地,在本发明的一个具体实施方案中,所述晶型D具有如图9所示的差式扫描量热图(DSC)和热重分析(TGA)图谱。显示:晶型D在约169℃熔融,之后在约212℃转晶,转晶得到的样品熔点约为259℃;150℃之前基本无失重,为无水物,分解温度约为271℃。TMC435晶型D的制备方法,包括以下步骤:形成TMC435在乙醇和硝基甲烷的混合溶剂中的溶液,将所得溶液在~10℃~60℃下挥发析晶,将析出的晶体分离、干燥,得到所述TMC435晶型D。优选地,所述混合溶剂中乙醇与硝基甲烷的体积比为0.1∶1~10∶1,更优选为0.25∶1~4∶1。优选地,所述TMC435的溶液中TMC435的用量为室温下其在乙醇和硝基甲烷混合溶剂中的溶解度的0.1~1倍,更优选为0.5~1倍。优选地,所述析晶的温度为室温。优选地,所述析晶的时间为3~14天,更优选为3~7天。挥发析晶的具体操作是:将样品的澄清溶液放在敞口玻璃小瓶中,敞口或加盖打孔,挥发除去溶剂,获得晶体。上述TMC435晶型D的制备方法中,起始原料TMC435可以是TMC435的已知的化合物、晶型、无定型物或其混合物,例如根据专利文献WO2007/014926A1实施例5制备的TMC435化合物、根据专利文献WO2008/092954A2制备的TMC435的无定型物、晶型I、晶型II、晶型III、晶型IV、晶型V或晶型VI,起始原料TMC435也可以是本发明的TMC435的晶型A、晶型H、晶型G或晶型F。与已知的TMC435晶型相比,本发明的TMC435晶型D具有以下有益性质:(1)在25℃水中添加表面活性剂十二烷基硫酸钠的条件下,TMC435晶型D比已知的TMC435晶型具有更好的增溶效果和更高的溶解度;(2)在处方一致的情况下,本发明的TMC435晶型D的胶囊剂比已知晶型I的胶囊剂的溶出速率快;(3)TMC435晶型D在室温、相对湿度小于10%RH的干燥器中放置6个月,晶型和熔点都不变。上述有益性质表明,与已知的TMC435晶型相比,本发明的TMC435晶型D具有多种优势性能,应用效果更好,更适合作为药物制剂的活性成分。活性成分具有更高的溶解性以及胶囊具有更好的溶出度,有利于提高药物的生物利用度,进而对药效产生积极影响;活性成分在室温下具有较好的贮存稳定性,能够更好地对抗药物制造和/或存储等过程中由环境因素引起的活性成分含量不均匀、纯度降低和杂质增加等问题,降低由此带来的疗效下降风险和安全风险,并方便后期的储存和运输。根据本发明的目的,本发明提供TMC435的晶型H(在本发明中简称作“晶型H”)及其制备方法。使用Cu-Kα辐射,所述晶型H以2θ角度表示的X-射线粉末衍射图具有以下特征峰:4.1±0.2°、8.2±0.2°、10.2±0.2°、11.4±0.2°、14.8±0.2°和17.6±0.2°。在本发明优选的一个实施方案中,所述晶型H以2θ角度表示的X-射线粉末衍射图具有以下特征峰:4.1±0.2°、5.0±0.2°、5.6±0.2°、8.2±0.2°、10.2±0.2°、10.7±0.2°、11.4±0.2°、14.8±0.2°、16.0±0.2°、17.2±0.2°、17.6±0.2°和18.6±0.2°。在本发明进一步优选的一个实施方案中,所述晶型H以2θ角度表示的X-射线粉末衍射图具有以下特征峰及其相对强度:非限制性地,在本发明的一个具体实施方案中,所述晶型H具有如图12所示的X-射线粉末衍射图。所述晶型H具有至少一种如下的特性:所述晶型H的FT-IR图在波数为1715、1663、1632、1610、1596、1509、1435、1414、1351、1268、1124、1019、882和781cm-1处具有特征峰。非限制性地,在本发明的一个具体实施方案中,所述晶型H具有如图14所示的FT-IR图。非限制性的,在本发明的一个具体实施方案中,所述晶型H具有如图13所示的差式扫描量热图(DSC)和热重分析(TGA)图谱。显示:晶型H在约172℃熔融,之后在约219℃转晶,转晶得到的样品熔点约为259℃;150℃之前基本无失重,为无水物,分解温度约为269℃。TMC435晶型H的制备方法,包括以下步骤:将TMC435无定型物在水和1,4-二氧六环的混合溶剂中形成混悬液,于~10℃~60℃下搅拌析晶,将析出的晶体分离、干燥,得到所述TMC435晶型H。优选地,所述混合溶剂中水和1,4-二氧六环的体积比为0.1∶1~10∶1,更优选为0.25∶1~4∶1。优选地,所述混悬液中TMC435无定型物的量为室温下其在水和1,4-二氧六环混合溶剂中的溶解度的1.5~20倍,更优选为1.5~10倍。优选地,所述析晶的温度为室温。优选地,所述析晶的时间为3~14天,更优选为3~7天。上述晶型H的制备方法中,起始原料TMC435无定型物可以是已知的,例如根据专利文献WO2008/092954A2实施例4制备的TMC435无定型物。与TMC435的已知晶型相比,本发明的TMC435晶型H具有以下有益性质:(1)在25℃水中添加表面活性剂十二烷基硫酸钠的条件下,TMC435晶型H比已知的TMC435晶型具有更好的增溶效果和更高的溶解度;(2)在处方一致的情况下,本发明的TMC435晶型H的胶囊剂比已知晶型I的胶囊剂的溶出速率快;(3)TMC435晶型H在室温、相对湿度小于10%RH的干燥器中放置6个月,晶型和熔点都不变。上述有益性质表明,与已知的TMC435晶型相比,本发明的TMC435晶型H具有多种优势性能,应用效果更好,更适合作为药物制剂的活性成分。活性成分具有更高的溶解性以及胶囊具有更好的溶出度,有利于提高药物的生物利用度,进而对药效产生积极影响;活性成分在室温下具有较好的贮存稳定性,能够更好地对抗药物制造和/或存储等过程中由环境因素引起的活性成分含量不均匀、纯度降低和杂质增加等问题,降低由此带来的疗效下降风险和安全风险,并方便后期的储存和运输。根据本发明的目的,本发明提供TMC435的晶型G(在本发明中简称作“晶型G”)及其制备方法。使用Cu-Kα辐射,所述晶型G以2θ角度表示的X-射线粉末衍射图具有以下特征峰:7.2±0.2°、9.8±0.2°、11.1±0.2°、13.1±0.2°、17.9±0.2°和19.2±0.2°。非限制性地,在本发明的一个具体实施方案中,所述晶型G具有如图11所示的X-射线粉末衍射图。TMC435晶型G的制备方法,包括以下步骤:将TMC435无定型物在水和1,4-二氧六环的混合溶剂中形成混悬液,于~10℃~60℃下搅拌析晶,将析出的晶体分离,得到所述TMC435晶型G。优选地,所述混合溶剂中水和1,4-二氧六环的体积比为0.1∶1~10∶1,更优选为0.25∶1~4∶1。优选地,所述混悬液中TMC435无定型物的用量为室温下其在水和1,4-二氧六环混合溶剂中的溶解度的1.5~20倍,更优选为1.5~10倍。优选地,所述析晶的温度为室温。优选地,所述析晶的时间为3~14天,更优选为3~7天。根据本发明的目的,本发明提供TMC435的晶型F(在本发明中简称作“晶型F”)及其制备方法。使用Cu-Kα辐射,所述晶型F以2θ角度表示的X-射线粉末衍射图具有以下特征峰:3.9±0.2°、7.5±0.2°、11.2±0.2°、12.3±0.2°、12.6±0.2°和16.3±0.2°。非限制性的,在本发明的一个具体实施方案中,所述晶型F具有如图15所示的X-射线粉末衍射图。TMC435晶型F的制备方法,包括以下步骤:将TMC435的无定型物在正丁醇中形成混悬液,于~10℃~60℃下搅拌析晶,将析出的晶体分离,得到所述TMC435晶型F。优选地,所述混悬液中TMC435的无定型物的用量为室温下其在正丁醇中的溶解度的1.5~20倍,更优选为1.5~10倍。优选地,所述析晶的温度为室温。优选地,所述析晶的时间为3~14天,更优选为3~7天。本发明TMC435的晶型A、晶型D、晶型H、晶型G和晶型F的上述制备方法中,所述“搅拌”可以采用本领域的常规方法进行,例如磁力搅拌、机械搅拌等。搅拌速率为50~1800转/分,优选300~900转/分。本发明TMC435的晶型A、晶型D、晶型H、晶型G和晶型F的上述制备方法中,采用本领域常规方法将析出的晶体进行分离,例如过滤、离心。过滤的具体操作为:将欲分离的样品置于滤纸上,减压抽滤;离心的具体操作为:将欲分离的样品置于离心管中,之后高速旋转直至固体全部沉至离心管底部,离心速率例如6000转/分。可选地,对分离出的晶体进行洗涤,洗涤溶剂的种类优选与该晶型制备方法中所用的溶剂相同,洗涤溶剂的用量为该晶型制备方法中结晶溶剂用量的2~10倍。本发明TMC435的晶型A、晶型D和晶型H的上述制备方法中,所述干燥,采用本领域的常规方法例如自然干燥、鼓风干燥或减压干燥;干燥设备为通风橱、鼓风烘箱或真空烘箱;干燥在减压或不减压下进行,优选为减压下进行;干燥温度约室温至60℃,优选为室温至40℃;干燥时间为1~72小时,优选为1~24小时。本发明中,所述“室温”指约10~30℃。本发明中,“晶体”、“晶型”或“无定型物”指的是被所示的X射线衍射图表征所证实的。本领域技术人员能够理解,其中的实验误差取决于仪器的条件、样品的准备和样品的纯度。特别是,本领域技术人员公知,X射线衍射图通常会随着仪器的条件而有所改变。特别需要指出的是,X射线衍射图的相对强度也可能随着实验条件的变化而变化,所以峰强度的顺序不能作为唯一或决定性因素。另外,峰角度的实验误差通常在5%或更少,这些角度的误差也应该被考虑进去,通常允许有±0.2°的误差。另外,由于样品高度等实验因素的影响,会造成峰角度的整体偏移,通常允许一定的偏移。因而,本领域技术人员可以理解的是,任何具有与本发明图谱特征峰相同或相似的晶型均属于本发明范畴内。所述“单一晶型”是指经X-射线粉末衍射检测是单一晶型。本发明的TMC435的晶型A、晶型D、晶型H、晶型G和晶型F是纯的、单一的,基本没有混合任何其他晶型或无定型物。本发明中,“基本没有”当用来指新晶型时,指这个新晶型中含有的其他晶型或无定型物少于20%(重量),更指少于10%(重量),尤其指少于5%(重量),特别是指少于1%(重量)。本发明中,所述“无水物”是指样品经TGA测量含有不多于1.5%(重量比)或不多于1.0%(重量比)的水。根据本发明的目的,本发明提供一种药物组合物,所述药物组合物包含治疗和/或预防有效量的一种或多种的本发明TMC435的新晶型或者由本发明方法制备得到的TMC435的新晶型,以及至少一种药学上可接受的载体或助剂;其中,所述TMC435的新晶型包括TMC435的晶型A、晶型D、晶型H、晶型G和晶型F。此外,所述药物组合物还可以包含TMC435的其它可药用的晶型或无定型物、或者TMC435可药用的盐及其晶型或无定型物。任选地,所述药物组合物还可以包含一种或多种其他的药物活性成分,例如其他的抗病毒化合物,尤其是抗HCV化合物。上述药物组合物可制成一定的剂型,优选经口服给药、肠胃外给药(包括皮下、肌肉内和静脉内)、直肠给药、透皮给药、含服给药、经鼻给药等形式的剂型,包括但不限于固体剂型、液体剂型、半液体剂型、气雾剂或栓剂等。例如,适合经口给药的剂型包括片剂、胶囊剂、颗粒剂、散剂、丸剂、粉剂、锭剂、糖浆剂或混悬剂;适合肠胃外给药的剂型包括水性或非水性的溶液或乳液;适合直肠给药的剂型包括使用亲水性或疏水性载体的栓剂;适合透皮给药的剂型包括膏剂、霜剂;适合经鼻给药的剂型包括气雾剂、喷剂。根据需要,上述剂型可适于活性成分的快速释放、延迟释放或调节释放。优选地,所述药物组合物为片剂、胶囊剂和颗粒剂。本发明所述药学上可接受的载体或助剂包括固态的载体或助剂,例如包括但不限于:稀释剂,例如淀粉、预胶化淀粉、乳糖、粉状纤维素、微晶纤维素、磷酸氢钙、磷酸三钙、甘露醇、山梨醇、糖等;粘合剂,例如阿拉伯胶、瓜尔胶、明胶、聚乙烯吡咯烷酮、羟丙基纤维素、羟丙基甲基纤维素、聚乙二醇等;崩解剂,例如淀粉、羟基乙酸淀粉钠、预胶化淀粉、交联聚维酮、交联羧甲基纤维素钠、胶体二氧化硅等;润滑剂,例如硬脂酸、硬脂酸镁、硬脂酸锌、苯甲酸钠、乙酸钠等;助流剂,例如胶体二氧化硅等;复合物形成剂,例如各种级别的环糊精和树脂;释放速度控制剂,例如羟丙基纤维素、羟甲基纤维素、羟丙基甲基纤维素、乙基纤维素、甲基纤维素、甲基丙烯酸甲酯、蜡等。本发明所述药学上可接受的载体或助剂还包括液态的载体或助剂,例如包括但不限于:水性、油性或醇类溶液的溶剂例如无菌水、生理盐水溶液、葡萄糖溶液、甘露糖醇溶液、植物油、鱼肝油、乙醇、丙醇、甘油等。此外,还可以使用聚乙二醇、聚丙二醇等载体。根据剂型的不同还可选择使用其他药学上可接受的载体或助剂,例如包括但不限于成膜剂、增塑剂、着色剂、调味剂、粘度调节剂、防腐剂、抗氧化剂、渗透剂、缓冲剂等。每一种载体或助剂必须是可接受的,能与配方中的其他成分兼容并且对于病患无害。所述药物组合物可以使用本领域技术人员公知的方法来制备。制备药物组合物时,本发明TMC435的晶型A、晶型D、晶型H、晶型G、晶型F或其组合与一种或多种药学上可接受的载体或助剂相混合,任选地,与一种或多种其他的药物活性成分相混合。固体制剂可以通过混合、制粒等工艺来制备,液体或半液体剂型可以通过混合、溶解、分散、乳化等工艺来制备。进一步地,本发明提供本发明TMC435的新晶型或者由本发明制备方法得到的TMC435的新晶型在制备用于治疗和/或预防丙型肝炎病毒(HCV)感染或与丙型肝炎病毒(HCV)感染相关的肝脏疾病的药物中的用途,其中所述TMC435的新晶型包括TMC435的晶型A、晶型D、晶型H、晶型G和晶型F;所述与HCV感染相关的肝脏疾病包括由HCV引起的病症,包括渐进式肝纤维化、造成肝硬化的炎症或坏死、末期肝病和肝细胞癌瘤(HCC)。根据本发明的目的,本发明提供一种治疗和/或预防丙型肝炎病毒(HCV)感染或与丙型肝炎病毒(HCV)感染相关的肝脏疾病的方法,所述方法包括给予需要的患者治疗和/或预防有效量的选自本发明的TMC435的新晶型或其组合或其药物组合物,其中所述TMC435的新晶型包括TMC435的晶型A、晶型D、晶型H、晶型G和晶型F。所述与HCV感染相关的肝脏疾病包括由HCV引起的病症,包括渐进式肝纤维化、造成肝硬化的炎症或坏死、末期肝病和肝细胞癌瘤(HCC)。所述患者包括但不限于哺乳动物,例如人。给予的量是指能有效抑制或降低HCV感染或者有效抑制或降低HCV感染相关疾病的量。通常有效的日剂量为0.01~500毫克/公斤体重,优选为0.1~50毫克/公斤体重。日剂量可以以单位剂量形式单次给予或以合适的间隔多次给予,每单位剂量形式含有1~1000毫克,尤其是5~200毫克,例如约25毫克、或约50毫克、或约75毫克、或约100毫克、或约150毫克、或约200毫克的TMC435活性成分。此外,先前已知的抗HCV化合物,例如干扰素-α(IFN-α)、聚乙二醇化干扰素-α和/或三唑核苷以及任选的其他抗HCV化合物,可以联合本发明TMC435的晶型A、晶型D、晶型H、晶型G、晶型F或其组合,用作联合治疗中的药物;所述其他抗HCV化合物选自HCV聚合物抑制剂、HCV蛋白酶抑制剂、在HCV生命周期中的其他目标的抑制剂、免疫调节药物、其他抗病毒药物或它们的联合。优选所述联合治疗包括聚乙二醇化干扰素-α、利巴韦林和本发明TMC435的晶型A、晶型D、晶型H、晶型G、晶型F或其组合。附图说明图1参照WO2008/092954A2制备的TMC435晶型I的XRPD图谱。图2参照WO2008/092954A2制备的TMC435晶型I的DVS等温吸附图。图3参照WO2008/092954A2制备的TMC435无定型物的XRPD图谱。图4本发明TMC435晶型A的XRPD图谱。图5本发明TMC435晶型A的TGA/DSC图谱。图6本发明TMC435晶型A的FT-IR图谱。图7本发明TMC435晶型A的DVS等温吸附图。图8本发明TMC435晶型D的XRPD图谱。图9本发明TMC435晶型D的TGA/DSC图谱。图10本发明TMC435晶型D的FT-IR图谱。图11本发明TMC435晶型G的XRPD图谱。图12本发明TMC435晶型H的XRPD图谱。图13本发明TMC435晶型H的TGA/DSC图谱。图14本发明TMC435晶型H的FT-IR图谱。图15本发明TMC435晶型F的XRPD图谱。具体实施方式本发明进一步参考以下实施例限定,所述实施例详细描述本发明的晶型、其制备方法和应用。通过这些实施例将有助于进一步理解本发明,但是不用于限制本发明。对本领域技术人员显而易见的是,对于材料和方法两者的许多改变可在不脱离本发明范围的情况下实施。检测仪器及方法:X-射线粉末衍射(XPRD):所使用的仪器为BrukerD8Advancediffractometer,采用铜靶波长为1.54nm的KaX-射线,在40kV和40mA的操作条件下、θ~2θ测角仪、Mo单色仪、Lynxeye探测器。仪器在使用前用金刚砂校准。采集软件是DiffracPlusXRDCommander。样品在室温条件下测试,把需要检测的样品放在无反射板上。详细检测条件如下:角度范围:3-40°2θ,步长:0.02°2θ,速度:0.2秒/步。差热分析(DSC):数据采自于TAInstrumentsQ200MDSC,仪器控制软件是ThermalAdvantage,分析软件是UniversalAnalysis。通常取1~10毫克样品放置于铝盘内,以10℃/min的升温速度在40mL/min干燥N2保护下将样品从0℃升至300℃。热重分析(TGA):数据采自于TAInstrumentsQ500TGA,仪器控制软件是ThermalAdvantage,分析软件是UniversalAnalysis。通常取1~15毫克样品放置于白金坩埚内,采用分段高分辨检测的方式,以10℃/min的升温速度在40mL/min干燥N2的保护下将样品从室温升至350℃。等温吸附曲线(DVS):数据采自于TAInstrumentsQ5000TGA,仪器控制软件是ThermalAdvantage,分析软件是UniversalAnalysis。通常取1~10毫克的样品放置于白金坩埚内,TA软件记录样品在相对湿度从0%到80%到0%变化过程中的重量变化。根据样品的具体情况,也会对样品采用不同的吸附和脱吸附步骤。核磁共振氢谱(1H-NMR)采自于BrukerAvanceIIDMX400MHZ核磁共振波谱仪。称量1~5mg样品,用0.5mL氘代氯仿(CDCl3)溶解,配成2~10mg/mL的溶液。傅里叶红外光谱分析(FT-IR)数据采自于BrukerTensor27,仪器控制软件和数据分析软件都是OPUS。通常采用ATR设备,在600~4000cm-1范围内,采集红外吸收光谱,样品和空白背景的扫描时间均为32秒,仪器分辨率4cm-1。高效液相色谱(HPLC)分析数据采自于Agilent1260,化学工作站是B.04。相应参数如下:色谱柱WelchXtimateC18,5μm,150x4.6mm,流速1.0mL/min,溶样溶剂为乙腈和水体积比3∶1的混合溶剂(添加2滴四氢呋喃),流动相为水(0.05%三氟乙酸)和乙腈体积比为20∶80的混合溶剂,波长224nm,进样量5ul和运行时间30分钟。实施例中所用的各种试剂如无特别说明均为商购获得。实施例中的超声操作可以促进样品溶解,设备为超声波清洗器,40kHz功率下进行15分钟。制备例1TMC435可参照专利文献WO2007014926A1实施例5的制备方法制得。具体为:将17-[2-(4-异丙基噻唑-2-基)-7-甲氧基-8-甲基喹啉-4-基氧基]-13-甲基-2,14-二氧代-3,13-二氮杂三环[13.3.0.04,6]十八碳-7-烯-4-羧酸(2.80g,4.335mmol)和羰基联咪唑(1.54g,9.5mmol)在无水四氢呋喃(50mL)中的溶液在氮气中回流搅拌2小时。将反应混合物冷却至室温,加入环丙基磺酰胺(2.00g,16.505mmol)和DBU(1.43g,9.405mmol)。溶液在50℃加热15小时,随后将反应混合物冷却至室温,减压浓缩。残余物在二氯甲烷和1当量(1N)盐酸间分配,有机层用盐水洗涤,用无水硫酸钠干燥,蒸发。用快速色谱法(梯度:在二氯甲烷中的乙酸乙酯(0~25%))纯化得到1.60g(40%)灰白色粉末,进一步用水和异丙基醚洗涤,真空干燥得到1.48g白色固体。1H-NMR(CDCl3):0.99~1.52(m,14H),1.64~2.05(m,4H),2.77(m,1H),2.41(m,2H),2.59(m,2H),2.69(s,3H),2.92(m,2H),3.04(s,3H),3.19(m,1H),3.40(m,2H),3.98(s,3H),4.60(t,J=13Hz,1H),5.04(t,J=11Hz,1H),5.37(m,1H),5.66(m,1H),6.21(s,1H),7.02(s,1H),7.22(d,J=10Hz,1H),7.45(s,1H),7.99(d,J=10Hz,1H),10.82(bs,1H)。制备例2TMC435晶型I可参照专利文献WO2008/092954A2实施例3的制备方法制得。具体为:取2.1gTMC435于5mL正丁醇中回流,在煮沸的混悬液中加入45mL正丁醇至得到澄清溶液。回流条件下搅拌溶液48小时,自然冷却至室温。过滤,滤饼用正丁醇洗涤,40℃真空干燥过夜,得到TMC435晶型I。其XRPD图谱如图1所示,与WO2008/092954A2公开的TMC435晶型I一致。其DVS等温吸附图如图2所示,显示相对湿度20%~80%内的重量变化为0.65%。制备例3TMC435无定型物可参照专利文献WO2008/092954A2实施例4的制备方法制得。具体为:取1.0gTMC435晶型I溶于120mL二氯甲烷中,用0.45μm有机过滤膜过滤,滤液40℃减压旋蒸析晶,将得到的固体40℃真空干燥24小时,得到TMC435无定型物。其XRPD图谱如图3所示,为TMC435无定型物。实施例1室温下,于20mL玻璃小瓶内加入35.1mgTMC435晶型I和11.0mL甲醇,超声15分钟得到无色澄清溶液(该溶液中TMC435晶型I的用量为室温下其在甲醇中溶解度的1倍),用0.45μm有机过滤膜过滤,将滤液置于20mL玻璃小瓶中室温敞口挥发3天析晶,过滤,滤饼40℃真空干燥24小时,得到本发明的TMC435晶型A。产量为30.7mg;产率为87%。其XRPD图谱如图4所示,为TMC435晶型A。其DSC和TGA图谱如图5所示。其FT-IR图谱如图6所示。其DVS等温吸附图如图7所示,显示相对湿度20%~80%内的重量变化为0.10%。实施例2室温下,于20mL玻璃小瓶内加入12.3mgTMC435无定型物和7.7mL甲醇,超声15分钟得到无色澄清溶液(该溶液中TMC435无定型物的用量为室温下其在甲醇中溶解度的0.5倍),用0.45μm有机过滤膜过滤,滤液置于20mL玻璃小瓶中40℃敞口挥发1天析晶,过滤,滤饼室温真空干燥72小时,得到本发明的TMC435晶型A。产量为9.7mg;产率为79%。XRPD检测得到与图4基本相同的X射线粉末衍射图谱。实施例3室温下,于20mL玻璃小瓶内加入6.4mgTMC435晶型I和20.0mL甲醇,超声15分钟得到无色澄清溶液(该溶液中TMC435无定型物的用量为室温下其在甲醇中溶解度的0.1倍),用0.45μm有机过滤膜过滤,将滤液置于20mL玻璃小瓶中-10℃敞口挥发7天析晶,过滤,滤饼60℃真空干燥1小时,得到本发明的TMC435晶型A。产量为3.0mg;产率为47%。XRPD检测得到与图4基本相同的X射线粉末衍射图谱。实施例4于5mL玻璃小瓶内加入32.0mgTMC435晶型I和1mL甲醇,水浴加热至60℃,搅拌至样品完全溶解(TMC435晶型I的量为60℃下其在甲醇中的溶解度的1倍),关闭水浴自然冷却至室温后继续搅拌0.5小时析晶,过滤,滤饼室温真空干燥72小时,得到本发明的TMC435晶型A。产量为28.6mg;产率为89%。XRPD检测得到与图4基本相同的X射线粉末衍射图谱。实施例5于5mL玻璃小瓶内加入24.1mgTMC435无定型和1.5mL甲醇,水浴加热至50℃,搅拌至样品完全溶解(TMC435晶型I的量为50℃下其在甲醇中的溶解度的0.5倍),关闭水浴自然冷却至室温后继续搅拌10小时析晶,过滤,滤饼40℃真空干燥24小时,得到本发明的TMC435晶型A。产量为19.2mg;产率为80%。XRPD检测得到与图4基本相同的X射线粉末衍射图谱。实施例6于5mL玻璃小瓶内加入5.8mgTMC435无定型物和1.2mL甲醇,水浴加热至45℃,搅拌至样品完全溶解(TMC435晶型I的量为45℃下其在甲醇中的溶解度的0.1倍),关闭水浴自然冷却至室温后继续搅拌72小时析晶,过滤,滤饼室温真空干燥1小时,得到本发明的TMC435晶型A。产量为3.2mg;产率为55%。XRPD检测得到与图4基本相同的X射线粉末衍射图谱。实施例7室温下,于5mL玻璃小瓶内加入38.0mgTMC435晶型I、0.25mL乙醇和1.0mL硝基甲烷,超声15分钟得到无色澄清溶液(该溶液中TMC435晶型I的用量为室温下其在乙醇和硝基甲烷的体积比为0.25∶1的混合溶剂中溶解度的1倍),用0.45μm有机过滤膜过滤,将滤液置于5mL玻璃小瓶中室温敞口挥发7天析晶,过滤,滤饼40℃真空干燥24小时,得到本发明的TMC435晶型D。产量为30.1mg;产率为79%。其XRPD图谱如图8所示,为TMC435晶型D。其DSC和TGA图谱如图9所示。其FT-IR图谱如图10所示。实施例8室温下,于5mL玻璃小瓶内加入24.8mgTMC435无定型物、0.1mL乙醇和1.0mL硝基甲烷,超声15分钟得到无色澄清溶液(该溶液中TMC435无定型物的用量为室温下其在乙醇和硝基甲烷的体积比为0.1∶1的混合溶剂中溶解度的0.5倍),用0.45μm有机过滤膜过滤,将滤液置于5mL玻璃小瓶中-10℃敞口挥发14天析晶,过滤,滤饼室温真空干燥72小时,得到本发明的TMC435晶型D。产量15.6mg;产率63%。XRPD检测得到与图8基本相同的X射线粉末衍射图谱。实施例9室温下,于20mL玻璃小瓶内加入10.2mgTMC435无定型物、10.0mL乙醇和2.5mL硝基甲烷,超声15分钟得到无色澄清溶液(该溶液中TMC435无定型物的用量为室温下其在乙醇和硝基甲烷的体积比为4∶1的混合溶剂中溶解度的0.1倍),用0.45μm有机过滤膜过滤,将滤液置于5mL玻璃小瓶中室温敞口挥发14天析晶,过滤,滤饼60℃真空干燥1小时,得到本发明的TMC435晶型D。产量3.6mg;产率35%。XRPD检测得到与图8基本相同的X射线粉末衍射图谱。实施例10室温下,于5mL玻璃小瓶内加入3.7mgTMC435晶型I、1.0mL乙醇和0.1mL硝基甲烷,超声15分钟得到无色澄清溶液(该溶液中TMC435晶型I的用量为室温下其在乙醇和硝基甲烷的体积比为10∶1的混合溶剂中溶解度的1倍),用0.45μm有机过滤膜过滤,将滤液置于5mL玻璃小瓶中60℃敞口挥发3天析晶,过滤,滤饼40℃真空干燥1小时,得到本发明的TMC435晶型D。产量为1.2mg;产率为32%。XRPD检测得到与图8基本相同的X射线粉末衍射图谱。实施例11室温下,于5mL玻璃小瓶内加入87.2mgTMC435无定型物、0.1mL1,4-二氧六环和1.0mL水,超声15分钟得到白色混悬液(该混悬液中TMC435无定型物的用量为室温下其在水和1,4-二氧六环的体积比为10∶1的混合溶剂中溶解度的20倍),室温下搅拌7天,离心,得到的晶体即为本发明的TMC435晶型G。TMC435晶型G的XRPD图谱如图11所示。将上述TMC435晶型G直接40℃真空干燥72小时,得到本发明的TMC435晶型H。产量为78.5mg;产率为90%。TMC435晶型H的XRPD图谱如图12所示。TMC435晶型H的DSC和TGA图谱如图13所示。TMC435晶型H的FT-IR图谱如图14所示。实施例12室温下,于5mL玻璃小瓶内加入124.8mgTMC435无定型物、0.25mL1,4-二氧六环和1.0mL水,超声15分钟得到白色混悬液(该混悬液中TMC435无定型物的用量为室温下其在水和1,4-二氧六环的体积比为4∶1的混合溶剂中溶解度的10倍),-10℃下搅拌14天,过滤,得到的晶体即为本发明的TMC435晶型G。XRPD检测得到与图11基本相同的X射线粉末衍射图谱。将上述TMC435晶型G直接60℃真空干燥24小时,得到本发明的TMC435晶型H。产量为112.5mg;产率为90%。XRPD检测得到与图12基本相同的X射线粉末衍射图谱。实施例13室温下,于5mL玻璃小瓶内加入82.5mgTMC435无定型物、1.0mL1,4-二氧六环和0.1mL水,超声15分钟得到白色混悬液(该混悬液中TMC435无定型物的用量为室温下其在水和1,4-二氧六环的体积比为0.1∶1的混合溶剂中溶解度的1.5倍),60℃下搅拌3天,过滤,得到的晶体即为本发明的TMC435晶型G。XRPD检测得到与图11基本相同的X射线粉末衍射图谱。将上述TMC435晶型G直接室温真空干燥72小时,得到本发明的TMC435晶型H。产量为30.0mg;产率为36%。XRPD检测得到与图12基本相同的X射线粉末衍射图谱。实施例14室温下,于5mL玻璃小瓶内加入37.6mgTMC435无定型物、1.0mL1,4-二氧六环和0.25mL水,超声15分钟得到白色混悬液(该混悬液中TMC435无定型物的用量为室温下其在水和1,4-二氧六环的体积比为0.25∶1的混合溶剂中溶解度的1.5倍),室温下搅拌3天,过滤,得到的晶体即为本发明的TMC435晶型G。XRPD检测得到与图11基本相同的X射线粉末衍射图谱。将上述TMC435晶型G直接60℃真空干燥1小时,得到本发明的TMC435晶型H。产量为17.0mg;产率为45%。XRPD检测得到与图12基本相同的X射线粉末衍射图谱。实施例15室温下,于5mL玻璃小瓶内加入25.1mgTMC435无定型物和1.0mL正丁醇,超声15分钟得到白色混悬液(该混悬液中TMC435无定型物的用量为室温下其在正丁醇中溶解度的10倍),室温搅拌7天,离心,得到的晶体即为本发明的TMC435晶型F。产量为17.3mg;产率为69%。其XRPD图谱如图15所示,为TMC435晶型F。实施例16室温下,于5mL玻璃小瓶内加入49.8mgTMC435无定型物和1.0mL正丁醇,超声15分钟得到白色混悬液(该混悬液中TMC435无定型物的用量为室温下其在正丁醇中溶解度的20倍),60℃搅拌3天,过滤,得到的晶体即为本发明的TMC435晶型F。产量为40.2mg;产率为81%。实施例17室温下,于5mL玻璃小瓶内加入4.5mgTMC435无定型物和1.2mL正丁醇,超声15分钟得到白色混悬液(该混悬液中TMC435无定型物的用量为室温下其在正丁醇中溶解度的1.5倍),-10℃搅拌14天,过滤,得到的晶体即为本发明的TMC435晶型F。产量为2.2mg;产率为49%。实施例18制备含本发明TMC435晶型A的胶囊剂。将72.0g本发明的TMC435晶型A、1.2g月桂基硫酸钠、1.2g无水胶体二氧化硅和159.0g一水乳糖过筛,通过三维混合机混合10分钟。将1.2g过筛的硬脂酸镁加入该混合物中并混合5分钟。将所得混合物填充到硬质明胶胶囊中,制备得到450粒含本发明TMC435晶型A的胶囊剂,规格为150毫克/粒。实施例19制备含本发明TMC435晶型D的胶囊剂。将实施例18中的“TMC435晶型A”替换为“TMC435晶型D”,其他操作同实施例18,制备得到含本发明TMC435晶型D的胶囊剂。实施例20制备含本发明TMC435晶型H的胶囊剂。将实施例18中的“TMC435晶型A”替换为“TMC435晶型H”,其他操作同实施例18,制备得到含本发明TMC435晶型H的胶囊剂。实施例21制备含本发明TMC435晶型G的胶囊剂。将实施例18中的“TMC435晶型A”替换为“TMC435晶型G”,其他操作同实施例18,制备得到含本发明TMC435晶型G的胶囊剂。实施例22制备含本发明TMC435晶型F的胶囊剂。将实施例18中的“TMC435晶型A”替换“为TMC435晶型F”,其他操作同实施例18,制备得到含本发明TMC435晶型F的胶囊剂。对比例1对本发明的TMC435的晶型A、晶型D和晶型H,以及制备例2制备的已知的TMC435晶型I,进行溶解度对比试验。具体操作如下:25℃水浴中,将10mg晶型样品、25mg十二烷基硫酸钠和25mL纯水搅拌成悬浊液,2小时后,各取约3mL悬浊液过滤,取滤液直接测HPLC。结果见表1。表1晶型的溶解度对比试验结果表1的结果显示:在25℃水中添加表面活性剂十二烷基硫酸钠的条件下,与已知的TMC435晶型I相比,本发明TMC435的晶型A、晶型D和晶型H都具有更高的溶解度和更好的增溶效果。对比例2对本发明实施例18制备的TMC435晶型A的胶囊剂、实施例19制备的TMC435晶型D的胶囊剂和实施例20制备的TMC435晶型H的胶囊剂,以及已知的TMC435晶型I的胶囊剂(取制备例2制备的已知的TMC435晶型I,按实施例18的配方和方法制备得到胶囊剂),进行胶囊剂(去胶囊壳)的溶出性能对比试验。参考《中国药典》2010版中“贝诺酯片”的溶出条件测定溶出度,采用桨法,以900mL的0.1%十二烷基硫酸钠水溶液作为溶出介质,温度37℃,搅拌桨转速为50转/分钟,分别于5分钟、15分钟、1小时、2小时和24小时各取样3mL,每次取样后用0.1%十二烷基硫酸钠水溶液补足,HPLC测定各取样点样品的浓度。结果见表2。表2胶囊剂的溶出性能对比试验结果表2的结果显示:本发明的TMC435晶型A、晶型D和晶型H的胶囊剂在15分钟时的溶出百分比均已达85%以上,而已知的TMC435晶型I的胶囊剂在15min时的溶出百分比小于85%,故本发明的TMC435晶型A、晶型D和晶型H的胶囊剂的溶出速率比已知的TMC435晶型I的胶囊剂的溶出速率快。说明在制备速释制剂时,本发明的TMC435晶型A、晶型D和晶型H的制剂更易达到产品的要求。以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本领域的技术人员在本发明所揭露的技术范围内,不经创造性劳动想到的变化或替换都应涵盖在本发明的保护范围之内。本说明书中所引用的所有专利文献,均通过引用以其全文的方式并入本申请中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1