水稻抗病相关基因OsDR11及其在水稻抗病中的应用的制作方法
本发明涉及基因工程技术领域。具体涉及一个水稻抗病相关基因OsDR11的分离克隆、功能验证和应用研究。OsDR11是参与水稻抗病反应。由于选择性剪接模式不同,可产生OsDR11S和OsDR11L两个转录本。超量表达OsDR11S的转基因植株以及抑制OsDR11L表达的转基因植株抵抗白叶枯病的能力均显著提高。
背景技术:
植物在生长的过程中会受到多种病原物的侵害,使植物致病的病原菌包括病毒、细菌、真菌和线虫等。当病原物侵入植物后有可能会导致两种结果:(1)寄主植物杀死病原物或阻止其生长,产生抗病反应;(2)寄主植物不能抵御病原体入侵和繁殖,产生相关的病症。所以利用抗性基因资源改良植物的抗病性,是预防病害同时又保护环境的根本出路。
植物的抗病反应是多基因参于调控的复杂过程。参于植物抗病反应的基因分为两类:(1)主效抗病基因,又称MR(major resistance)基因和(2)抗病相关基因(Kou and Wang,2010;Zhang and Wang,2013)。
根据目前人们对抗病基因功能的认识,MR基因的产物主要是作为受体,直接或间接与病原蛋白相互作用,启动植物体内的抗病信号传导路径(Zhang and Wang,2013)。MR基因介导的抗病反应抗性强,是很好的基因资源。但由于下述原因,使利用抗病基因改良植物抗性受到限制:(1)MR基因的资源有限,如目前知道的抵抗水稻重要病害白叶枯病的主效抗病基因大约只有三十几个;(2)MR基因通常具有病原种类和病原生理小种特异性,即一个MR基因通常只对某一病原的部分生理小种具有抗性,抗病范围有限;(3)因为病原的快速突变,一个MR基因的作用往往几年或者十几年后就丧失了。
抗病相关基因是指除MR基因外所有参于抗病反应的基因,它们的编码产物参于合成植物体内抗病信号分子、参于信号传导、阻止信号传导或参于防卫反应等。这类基因的共同特点是病原诱导后它们的表达量升高或减少,因此人们可以根据病原诱导前后基因的表达量的差异大规模地鉴定植物抗病相关基因(Schenk等,2000;Zhou等,2002;Chu等,2004)。目前,人们对抗病相关基因的认识有限。根据已有报道,绝大多数抗病相关基因单独作用时的抗性能力可能比主效抗病基因小。但根据下述原因,它们是值得大力开发的基因资源:(1)由于绝大多数抗病相关基因的产物不需要直接与病原物相互作用,这类基因是具有持久抗性的基因资源(Kou and Wang,2010);(2)大多数抗病相关基因参于的抗病反应没有病原特异性,因此它们是具有广谱抗性的基因资源;(3)这类基因的资源丰富。但是,水稻中虽然鉴 定了很多抗病相关基因(Zhou等,2002;Chu等,2004),这些基因在水稻抗病反应中的作用机理、以及单个抗病相关基因是否会引起水稻抗病表型的改变都不清楚。
水稻是人类重要的粮食作物,在亚洲国家、美洲的南部和中部、非洲的中部和东部都有广泛的种植,虽然我国的环境适合种植水稻,但是水稻仍然会受到许多环境的影响从而造成减产。白叶枯病对水稻的危害严重,根据水稻生长阶段、地理位置和季节条件,造成的水稻减产(Kou and Wang,2013)。雨水多,湿度大,或者深水灌溉均容易引发大规模的白叶枯病,造成严重的减产,所以抗白叶枯病品种的选育是极为关键。
为了控制病害的发生,人们往往采取化学制剂、轮作等方式来提高水稻抗病的水平,但是化学制剂往往提高了额外的经济成本,造成环境污染;而轮作在现代化的农业种植模式下对于植物抗病效率也不高(Helliwell and Yang,2013)。相比较而言,赋予植株寄主抗性是最为经济有效并且环境友好的防治病虫害的方式,所以培育出能够抗病的水稻,种植抗病品种具有极高的应用价值。
与MR基因的应用相比,抗病相关基因的应用能提供植物更为广谱及长效的抗性。通过超量表达抗病反应的正调控因子基因或者抑制表达抗病反应的负调控因子序列进行水稻品种的改良,将进一步增强水稻的抗病性,拓宽水稻的抗谱。这些方面是采用常规水稻育种和改良技术所不能达到的。
技术实现要素:
本发明的目的是分离克隆水稻中携带的一个抗病相关基因完整DNA片段,并利用超量表达技术,以及RNA干扰技术(RNA interference,RNAi)通过使目标基因在转基因受体中超量表达或者沉默从而鉴定其在抗病反应过程中所起的作用,为利用这个基因改良水稻品种或其它植物抵御病害的能力奠定基础。这个基因被命名为OsDR11。
本发明涉及分离一种包含OsDR11基因的DNA片段并鉴定其功能,该片段能赋予水稻对由白叶枯病菌所引起的病害产生的抗病反应。对其序列进行分析,表明它是一个编码LAMMER蛋白激酶的水稻基因,并发现该基因能够通过不同的选择性剪接方式产生OsDR11S以及OsDR11L两个转录本。超量表达OsDR11S(SEQ ID NO:1)或者抑制表达OsDR11L(SEQ ID NO:2)均可以增强水稻对白叶枯病的抗性。所以,所述OsDR11片段如序列表SEQ ID NO:1以及SEQ ID NO:2所示,或者基本上相当于SEQ ID NO:1和SEQ ID NO:2所示的DNA序列,或者其功能相当于SEQ ID NO:1和SEQ ID NO:2所示序列的亚片段。
可以采用已经克隆的OsDR11基因作探针,从cDNA和基因组文库中筛选到本发明的基因或同源基因。同样,采用PCR(polymerase chain reaction)技术,也可以从基因组、mRNA和cDNA中扩增得到本发明的OsDR11基因以及任何感兴趣的一段DNA或与其同源的一段DNA。采用以上技术,可以分离得到包含OsDR11基因的序列或者包含一段OsDR11基因的序列,将这一序列与合适的载体连接,可以转入植物细胞超量表达OsDR11S转录本或抑制OsDR11L转录本的表达,产生抗病转基因植物。采用这种转基因技术创造抗病植物是传统育 种技术所不能达到的。
本发明为增强水稻对白叶枯病菌的抗性提供了新的方法。包括将OsDR11S基因完整编码区的CDS片段与能够超量表达目标基因的载体连接、转入水稻,通过超量表达OsDR11S改良水稻对白叶枯病的抗性;还包括将OsDR11L转录本的部分片段和与能够表达双链RNA的载体连接、转入水稻,通过抑制其自身OsDR11L转录本的表达改良水稻对白叶枯病的抗性。
在本发明的实施例部分,发明人阐述了OsDR11基因的分离、功能验证和应用研究过程以及该基因的特点。
附图说明
序列表SEQ ID NO:1本发明分离克隆的OsDR11基因的基因组序列。序列长度为3206bp。
序列表SEQ ID NO:2本发明分离克隆的OsDR11基因由于选择性剪接方式不同产生的OsDR11S转录本的cDNA序列,序列长度为1435bp,其中1-531位碱基所示的序列是编码阅读框(即CDS),编码170个氨基酸序列。
序列表SEQ ID NO:3本发明分离克隆的OsDR11基因由于选择性剪接方式不同产生的OsDR11S转录本序列编码的蛋白质序列。
序列表SEQ ID NO:4本发明分离克隆的OsDR11基因由于选择性剪接方式不同产生的OsDR11L转录本的cDNA序列,序列长度为1404bp,其中1-1113位碱基所示的序列是编码阅读框(即CDS),编码370个氨基酸序列。
序列表SEQ ID NO:5本发明分离克隆的OsDR11基因由于选择性剪接方式不同产生的OsDR11L转录本序列编码的蛋白质序列。
图1:本发明鉴定和分离克隆水稻抗病相关基因OsDR11以及验证OsDR11基因功能的流程图。
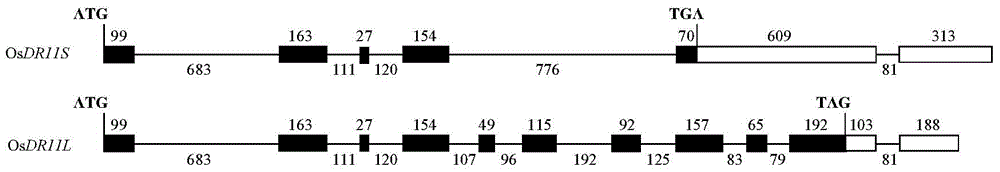
图2:OsDR11S和OsDR11L转录本的结构。图中显示为水稻品种明恢63中获得的包含OsDR11基因、长3206bp的DNA片段。横线表示内含子,横柱条表示外显子,其中黑色部分代表编码序列,白色部分代表非翻译区;数字表示各个结构的碱基数或位置。“ATG”和“TAG”分别是翻译起始密码和终止密码。
图3:是本发明分离克隆的OsDR11基因的两个转录本OsDR11S和OsDR11L在水稻原生质体中的亚细胞定位和转录本编码的蛋白质的蛋白激酶的活性图。图3中的A图是OsDR11S和OsDR11L在水稻原生质体中的亚细胞定位图。图3中的B图是OsDR11L转录本编码的蛋白 质具有蛋白激酶的活性。OsDR11L蛋白在加入γ-32P-ATP后能使自身蛋白磷酸化。
图4:是水稻不同组织中OsDR11S和OsDR11L的表达量检测。图4中的A图是利用实时定量RT-PCR技术检测水稻不同组织中OsDR11S和OsDR11L的表达量。图4中的B图是用实时定量RT-PCR技术检测水稻接种白叶枯病菌PXO61后不同水稻品种或品系中OsDR11S和OsDR11L基因的表达量。图中标记:ck表示没有任何处理的样品(对照),1、4、8、24、48、84、144为明恢63/珍汕97接种1小时、4小时、8小时、24小时、48小时、84小时、144小时后的样品。2、4、8、12、24、48、72为牡丹江8/Rb49接种2小时、4小时、8小时、12小时、24小时、48小时、72小时后的样品。
图5:是OsDR11S转录本在对照材料和T0代遗传转化植株中的表达量及它们与植株病斑面积大小的关系检测。图5中的A图是用实时定量RT-PCR技术检测OsDR11S转录本在对照材料(牡丹江8)和T0代遗传转化植株(D35UM8)中的表达量以及它们与植株病斑面积大小的关系。图5中的B图是用实时定量RT-PCR技术检测OsDR11L转录本在对照材料(明恢63)和T0代遗传转化植株(D229RM)中的表达量以及它们与植株病斑面积大小的关系。
图6:是T1代遗传转化家系接种白叶枯病菌两周后的表型。图6中的A图是T1代遗传转化家系D35UM8-33和D35UM8-54植株接种白叶枯病菌PXO99两周后的表型。图中标记:“+”符号示阳性遗传转化植株,“-”符号示阴性遗传转化植株,牡丹江8是遗传转化的受体(对照)。图6中的B图是T1代遗传转化家系D229RM7和D229RM7植株接种白叶枯病菌PXO99两周后的表型。图中标记:“+”符号示阳性遗传转化植株,“-”符号示阴性遗传转化植株,明恢63是遗传转化的受体(对照)。
具体实施方式
以下实施例中进一步定义本发明,图1描叙了鉴定和分离克隆OsDR11基因以及验证OsDR11基因功能的流程。根据以上的描述和这些实施例,本领域技术人员可以确定本发明的基本特征,并且在不偏离本发明精神和范围的情况下,可以对本发明做出各种改变和修改,以使其适用各种用途和条件。
实施例1:分离克隆OsDR11基因和基因结构分析
1.OsDR11两个不同转录本的确定
在本发明的前期研究工作中,本发明人所在的作物遗传改良国家重点实验室采用cDNA芯片技术分析发现来源于水稻品种明恢63的cDNA克隆EI39C8在水稻品种明恢63接种白叶枯菌后表达量被诱导上升2.4-2.6倍(Zhou等,2002)。本发明的发明人对EI39C8克隆的插入片段测序后,以EI39C8的序列作为模板通过BLASTN方法,分析EI39C08插入序列, 发现其编码产物与拟南芥LAMMER蛋白激酶同源。而根据GenScan、FGENESH(http://www.softberry.com)以及ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)等软件的预测结果,EI39C08包含完整的的cDNA片段。EI39C8与水稻品种日本晴12号染色体AP008218的一段序列(第16244777至16241534bp)的同源性为98%,与MSU Rice Genome Annotation Project(http://rice.plantbiology.msu.edu/)中注册号为LOC-Os12g27520的基因同源性为96%,这些结果提示cDNA克隆EI39C8对应的水稻明恢63基因组序列位于水稻第十二染色体,是LOC-Os12g27520的等位基因,我们将其命名为OsDR11(Orazy sativa defense response gene 11)。
我们还发现Os12g27520基因具有选择性剪接的现象。发明人检索明恢63全生育期平衡化cDNA文库(Chu et al.,2003)中发现OsDR11的另外一个cDNA克隆EI114F3也包含完整cDNA序列信息。通过Southern杂交的手段证明OsDR11在水稻基因组中是以单拷贝形式存在的,所以确认这两个不同的全长cDNA是由OsDR11通过不同的剪切方式产生的两个不同的转录本,按照编码产物的长短分别命名为OsDR11S和OsDR11L。
2.OsDR11基因结构的确定
分别对EI39C8和EI114F3进行测序,得到OsDR11S和OsDR11L的cDNA序列,然后根据cDNA的序列以及OsDR11等位基因Os12g27520的序列设计引物,对水稻品种明恢63中的OsDR11基因进行PCR扩增并测序,使用到的引物为:39C8-GSP3(5′-AGCCGAGAGAGAGAGAAAGA-3′)、39C8-GSP2(5′-CTTTCCTTTCCCTATCCCAAC-3′)、39C8-8F(5′-GTCCCAGGAAATCCCTCGTT-3′)、83J4-2R(5′-CAGGCACTTTAATGTACTCCG-3′)、83J4-2F(5′-CGGAACTGGTTTGACTATCG-3′)、39C8-6R(5′-CTGCGGTAGCTTTGGTAACTC-3′)、39C8-3F(5′-TTGGATGGAGTTACCCCTGTG-3′)、39C8-1R(5′-CTGGATCCTCTTCTTCGCTCGGACTGCT-3′),确定了OsDR11的基因组序列,共3206bp。
分析来源于籼稻明恢63的OsDR11的基因组序列(序列表SEQ ID NO:1)以及同样来源于明恢63的OsDR11S的cDNA序列(序列表SEQ ID NO:2),确定OsDR11S转录本由1435个核苷酸组成,编码区包含5个外显子及4个内含子,3’非翻译区(UTR)包含2个外显子和1个外内含子(图2)。第一个外显子由99个核苷酸组成(位于序列表SEQ ID NO:1的1-99bp处),第一个内含子由683个核苷酸组成(位于序列表SEQ ID NO:1的100-782bp处),第二个外显子由163个核苷酸组成(位于序列表SEQ ID NO:1的783-945bp处),第二个内含子由111个核苷酸组成(位于序列表SEQ ID NO:1的946-1056bp处),第三个外显子由27个核苷酸组成(位于序列表SEQ ID NO:1的1057-1083bp处),第三个内含子由120个核苷酸组成(位于序列表SEQ ID NO:1的1084-1203bp处),第四个外显子由154个核苷酸组成(位于序列表SEQ ID NO:1的1204-1357bp处),第四个内含子由776个核苷酸组成(位于序列表SEQ ID NO:1的1358-2133bp处),第五个外显子由70个核苷酸组 成(位于序列表SEQ ID NO:1的2134-2203bp处),第一段3’UTR由609个核苷酸组成(位于序列表SEQ ID NO:1的2204-2812bp处),第五个外内含子由81个核苷酸组成(位于序列表SEQ ID NO:1的2813-2893bp处),第二段3’UTR由313个核苷酸组成(位于序列表SEQ ID NO:1的2894-3206bp处)。
分析来源于籼稻明恢63的OsDR11的基因组序列(序列表SEQ ID NO:1)以及同样来源于明恢63的OsDR11L的cDNA序列(序列表SEQ ID NO:3),确定OsDR11L转录本由1404个核苷酸组成,编码区包含10个外显子及9个内含子,3’UTR包含2个外显子和1个外内含子(图2)。第一个外显子由99个核苷酸组成(位于序列表SEQ ID NO:1的1-99bp处),第一个内含子由683个核苷酸组成(位于序列表SEQ ID NO:1的100-782bp处),第二个外显子由163个核苷酸组成(位于序列表SEQ ID NO:1的783-945bp处),第二个内含子由111个核苷酸组成(位于序列表SEQ ID NO:1的946-1056bp处),第三个外显子由27个核苷酸组成(位于序列表SEQ ID NO:1的1057-1083bp处),第三个内含子由120个核苷酸组成(位于序列表SEQ ID NO:1的1084-1203bp处),第四个外显子由154个核苷酸组成(位于序列表SEQ ID NO:1的1204-1357bp处),第四个内含子由107个核苷酸组成(位于序列表SEQ ID NO:1的1358-1464bp处),第五个外显子由49个核苷酸组成(位于序列表SEQ ID NO:1的1465-1513bp处),第五个内含子由96个核苷酸组成(位于序列表SEQ ID NO:1的1514-1609bp处),第六个外显子由115个核苷酸组成(位于序列表SEQ ID NO:1的1610-1724bp处),第六个内含子由192个核苷酸组成(位于序列表SEQ ID NO:1的1725-1916bp处),第七个外显子由92个核苷酸组成(位于序列表SEQ ID NO:1的1917-2008bp处),第七个内含子由125个核苷酸组成(位于序列表SEQ ID NO:1的2009-2133bp处),第八个外显子由157个核苷酸组成(位于序列表SEQ ID NO:1的2134-2290bp处),第八个内含子由83个核苷酸组成(位于序列表SEQ ID NO:1的2291-2373bp处),第九个外显子由65个核苷酸组成(位于序列表SEQ ID NO:1的2374-2438bp处),第九个内含子由79个核苷酸组成(位于序列表SEQ ID NO:1的2439-2517bp处),第十个外显子由192个核苷酸组成(位于序列表SEQ ID NO:1的2518-2709bp处),第一段3’UTR由103个核苷酸组成(位于序列表SEQ ID NO:1的2710-2812bp处),第十个外内含子由81个核苷酸组成(位于序列表SEQ ID NO:1的2813-2893bp处),第二段3’UTR由188个核苷酸组成(位于序列表SEQ ID NO:1的2894-3081bp处)。
实施例2:OsDR11基因编码产物的分析
1.OsDR11基因编码产物亚细胞定位分析
在OsDR11的氨基端与其他家族成员一样具有核定位序列,预示着OsDR11S和OsDR11L可能都是定位于细胞核内发挥作用。以cDNA克隆EI39C8,用39C8-4F4(5′-ATTCTAGAATGGAGTGCTTGGCCGAGAT-3′)和39R-XBA1(5′-CTTCTAGACCTTAATAGCACTGGACTTG-3′)扩增OsDR11S全长cDNA,通过XbaⅠ单酶切 后连接到pM999-YFP载体上,挑取阳性单克隆测序验证,构建OsDR11S亚细胞定位载体。以cDNA克隆EI114F3为模板,用39C8-4F4(5′-ATTCTAGAATGGAGTGCTTGGCCGAGAT-3′)和F3R-XBA1(5′-CTTCTAGACATACAAGCAACAAATGAGC-3′)通过PCR扩增出外源片段,通过XbaⅠ单酶切后连接到pM999-YFP载体上,挑取阳性单克隆测序验证,构建OsDR11L亚细胞定位载体。
将水稻种子进行表面消毒后放于MS培养基上,生长至2叶期时切取水稻小苗的叶鞘段,用锋利的刀片将其切成0.5厘米的小段置于0.6M的甘露醇中,将组织转入酶解液中(0.6M甘露醇,10mM pH值为5.7的MES,1.5%的纤维素酶RS,0.75%果胶酶,0.1%BSA,1mM CaCl2,50μg/mL的羧苄青霉素)避光于28℃摇床40转/分钟慢速摇晃4-5小时。然后80转/分钟的转速摇30分钟使原生质体释放。慢慢加入W5溶液(154mM NaCl,125mM CaCl2,5mM KCl,2mM pH值为5.7的MES)20mL,液体过35μm孔径的尼龙膜布。室温100g离心5分钟,用枪小心吸出上清,再加入30mL W5小心洗涤沉淀,100g离心5分钟收集。加入预冷的MMG溶液(0.6M甘露醇,15mM MgCl2,4mM pH值为5.7的MES)悬浮原生质体,在冰上放置30分钟。将10μg的质粒DNA加入一个2mL的圆底离心管,再加入100μL上述制备的原生质体中,加入110μL PEG-CaCl2,轻轻混匀在室温孵育20分钟。加入440μL W5溶液停止转化。100g离心3分钟后弃上清,加入1mL WI溶液(0.6M甘露醇,4mM KCl,4mM pH5.7的MES)重悬原生质体,转入平板黑暗培养12-24小时后用共聚焦荧光显微镜(Leica,德国)进行观察照相。
本研究发明人将将融合了YFP的LAMMER蛋白和融合了CFP的GHD7蛋白用水稻原生质体瞬时转化的方法(Cheng et al.,2015)共转化到水稻原生质体中,对其进行亚细胞的定位。GHD7是一个已经证实定位在细胞核内的基因(Xue等,2008),所以我们将Ghd7-PM999-CFP作为核定位的标记。实验结果显示PM999-YFP空载体单独转化水稻原生质体,其黄色荧光可以在在细胞中的分布没有特异性,而转化OsDR11S-PM999-YFP和OsDR11L-PM999-YFP的原生质体中,产生的黄色荧光与融合CFP的GHD7蛋白产生的青色荧光完全重叠,非常特异的分布在细胞核中。这说明OsDR11S和OsDR11L都是分布在细胞核内的(见图3中的A图)。由此证实OsDR11S和OsDR11L是细胞核蛋白质,它们都在细胞核中发挥功能。
2.OsDR11基因编码产物蛋白激酶活性分析
序列分析显示OsDR11属于LAMMER蛋白激酶,而LAMMER家族的特征就是蛋白的激酶区有一个非常保守的“LAMMER”结构域,OsDR11S编码一个由170个氨基酸组成的蛋白质(序列表SEQ ID NO:1),而OsDR11L编码一个由370个氨基酸组成的蛋白质(序列表SEQ ID NO:2)。通过PROSITE(ScanProsite Results Viewer,http://prosite.expasy.org/prosite.html)预测OsDR11蛋白的结构域,发现OsDR11第88-370位氨基酸为蛋白激酶区,94-102位同样为核苷酸磷酸酯结合区域(NP_BIND),117位氨基酸赖 氨酸为ATP结合位点,同时OsDR11在213位氨基酸天冬氨酸是质子接受位点(proton acceptor)。这些结构预示了OsDR11有可能具有蛋白激酶活性。
为了验证这一推测,本发明采用Shen等(2010)方法,在大肠杆菌中表达OsDR11S和OsDR11L蛋白,分离纯化OsDR11蛋白用于酶活性分析。具体操作如下:以cDNA克隆EI39C8,用39C8-4F2(5’-CTGGATCCATGGAGTGCTTGGCCGAGAT-3’)和39C8pmalR-BamH1(5′-CTGGATCCTCACCTTAATAGCACTGGAC-3′)扩增OsDR11S全长CDS,通过BamHⅠ单酶切后连接到pMAL-C2X载体上,挑取阳性单克隆测序验证。构建OsDR11S原核表达载体。以cDNA克隆EI114F03为模板,用39C8-4F2和expF3-2R(5’-ATGTCGACCTACATACAAGCAACAAAT-3’)扩增OsDR11L全长CDS。将PCR产物用限制性内切酶BamHⅠ和PstⅠ消化后与经BamHⅠ和PstⅠ酶切后纯化的载体pGBKT7(美国Clontech公司)做连接反应。通过酶切筛选阳性克隆,再经测序验证有无核苷酸突变。用限制性内切酶BamHⅠ和PstⅠ消化带有OsDR11基因的编码区段的阳性克隆和pMAL-C2X载体(德国Novagen公司),通过酶切及测序验证阳性克隆,构建OsDR11L原核表达载体。将获得的重组质粒电转化(电转化仪为eppendorf公司产品,本实施例所用电压为1800V,具体操作参考该仪器的使用说明书)进入大肠杆菌表达用宿主菌株BL21(DE3)(德国Novagen公司)进行原核表达。将pMAL-C2X空载体也导入BL21(DE3)作为对照。挑取单克隆培养12h,1:100扩大培养2-3h,待其OD值达到0.5,加入异丙基硫代-β-D-半乳糖苷(IPTG)到终浓度1mM/L,诱导5h,收集菌体,表达蛋白的纯化用麦芽糖亲和树脂Amylose Resin(New England Biolabs,北京),操作参照说明书。OsDR11蛋白激酶反应程序参照前人的方法(Shen等,2010)。具体操作如下:带有MBP标签的OsDR11L和OsDR11S重组蛋白被用于自磷酸化活性的检测,以空载体表达出的MBP蛋白作为对照。反应缓冲液为20μL体系,包括50mM Tris-HCl,pH 7.5的10mM MgCl2,10mM MnCl2和0.3μCiγ-32P-ATP。纯化后的重组蛋白在此缓冲液中室温反应30分钟后加入蛋白质上样缓冲液与95℃变性10分钟,在10-12%的SDS-聚丙烯酰胺凝胶电泳,电泳完成后取胶块压X光片自显影检测自磷酸化活性。结果显示:OsDR11L融合蛋白具有自磷酸化活性,因为磷酸化而偶联上了带有放射性的32P,因此在自身蛋白大小的地方通过放射自显影能出现条带(见图3中的B图)。
实施例3:OsDR11基因的表达模式分析
1.OsDR11两个不同转录本的在水稻组织中的表达模式分析
用籼稻品种明恢63在不同时期不同组织中的RNA样品,包括愈伤组织,两分蘖期的根和叶,孕穗期的叶、叶鞘和幼穗、抽穗期的剑叶和穗、扬花期的雄蕊和雌蕊,通过反转录后进行实时定量PCR的方法检测其表达情况(见图4中的A图)。实验结果证实两个转录本在水稻的各个生育期的不同组织中都有表达,在孕穗期的叶片、叶鞘以及扬花期的配子中表达较高,OsDR11S在成熟的营养器官比如叶片以及叶鞘中表达量较高,而OsDR11L则在幼嫩的营养器官比如愈伤组织以及生殖器官中表达量较OsDR11S更为丰富。地上部分的表达量差异 说明它们可能有着不同的生物学功能。
2.OsDR11两个不同转录本的在不同水稻品种中的表达模式分析
为了证实OsDR11基因是否参于抗病反应的调控,本发明采用定量RT-PCR(quantitative reverse transcription-PCR,qRT-PCR)技术(Qiu等,2007)分析了OsDR11基因在不同水稻品种中接种白叶枯病菌株PXO61(菲律宾生理小种1)(Sun等,2004)后的表达模式。白叶枯病菌接种采用剪叶法对成株期的水稻进行接种(Sun等,2004)。白叶枯病菌菌株PXO61由菲律宾国际水稻研究所惠赠(Sun等,2004)。白叶枯病菌的培养遵循已经公开发表的方法(Sun等,2004)。接种后分不同时间点取接种叶片抽提总RNA(Zhou等,2002)。取5μg总RNA用DNaseI(美国Invitrogen公司)处理15分钟以去除基因组DNA污染,然后参照Zhou等(2002)的方法,使用oligo(dT)15寡聚引物和M-MLV反转录酶(美国Promega公司)进行反转录。采用实时定量PCR分析试剂盒Green PCR Master Mix(大连Tokara公司)、并根据试剂盒使用说明书,在ABI 7500Real-Time PCR system(美国Applied Biosystems公司)仪器上进行实时定量PCR反应。用水稻内源肌动蛋白(actin)基因的表达量衡量、并均一化样品RNA含量(Qiu等,2007)。qRT-PCR分析中的OsDR11S特异PCR引物是39C8-6F(5′-GAATGTTGGGATAGGGAAAGG-3′)和39C8-7R(5′-ACGGGATGAAACCTGGATCTAC-3′),OsDR11L特异PCR引物是83J4-2F(5′-CGGAACTGGTTTGACTATCG-3′)和83J4-2R(5′-CAGGCACTTTAATGTACTCCG-3′),肌动蛋白基因PCR引物是actinF(5′-TGCTATGTACGTCGCCATCCAG-3′)和actinR(5′-AATGAGTAACCACGCTCCGTCA-3′)。
利用明恢63/珍汕97和牡丹江8/Rb49接种PXO61后时间点的两套材料来系统的检测了OsDR11S和OsDR11L在受到病原诱导以后的表达情况。明恢63是携带抗白叶枯病主效基因Xa25(t)和Xa26的抗病水稻品种(Chen等,2003;Sun等,2004),RB11是携带抗白叶枯病主效基因Xa3/Xa26的抗病水稻品种(Cao等,2007),珍汕97和牡丹江8是不携带任何抗病基因的感病水稻品种。实验结果显示OsDR11S在感病材料和抗病材料中都受到了病原菌的诱导上升表达,并且在抗病品种中较感病品种中的表达量高。而OsDR11L则仅在感病材料中诱导上升,在抗病品种中有所下降,并且在感病品种中的表达量高于抗病品种。这些结果说明OsDR11S和OsDR11L可能都参与到水稻-白叶枯病的互作中,调控这两个转录本的表达可能可以提高水稻的抗病性(见图4中的B图)。
实施例4:OsDR11基因的功能验证
1.遗传转化载体的构建
将实施例1所述的包含OsDR11S完整编码序列的cDNA克隆EI39C8,利用限制性内切酶BamHI和KpnI消化,然后用BamHI和KpnI消化超量表达转化载体pU1301。pU1301是常用的水稻遗传转化载体(Cao等,2007;Qiu等,2007;Ding等,2008),它是携带具有组成型和超量表达特征的玉米泛素基因启动子的农杆菌介导的遗传转化载体。酶切完毕,用氯仿: 异戊醇(体积比24:1)抽提,纯化酶切产物。用包含OsDR11S的酶切回收片段和纯化好的载体做连接反应。构建了OsDR11S的超表达载体,通过测序验证阳性克隆,获得的重组质粒载体被命名为D35U。
将实施例一所述的包含完整OsDR11L编码序列的cDNA的文库质粒EI114F3中,用引物F3DSF1732(5′-AGACTAGTGGTACCTTGTGTTCAAATTCGGAACTGG-3′)和F3DSF2253(5′-CGGAGCTCGGATCCTTTGTAATCAGGCACTTTAATG-3′)通过PCR扩增出抑制片段,将该片段通过BamHⅠ和KpnⅠ双酶切后连入载体pDS1301。pDS1301是常用的水稻遗传转化RNAi载体(Cao等,2007),该载体携带具有组成型表达的花椰菜花叶病毒启动子,能够组成性抑制目标基因的表达。再用SacⅠ和SpeⅠ分别双酶切外源片段和连入第一链的pDS1301载体,回收后将上述两个酶切产物用T4-DNA连接酶连接。筛选阳性克隆测序验证并命名为D229R。
2.分析T0代遗传转化植株
采用农杆菌介导的遗传转化方法(Lin和Zhang,2005)将D35U导入水稻品种牡丹江8。获得的遗传转化植株被命名为D35UM8(其中D35U为遗传转化载体名称,M8代表水稻品种牡丹江8)。本发明共获得独立转化植株43株,用遗传转化载体pU1301上的特异PCR引物GUS-2F(5′-CCAGGCAGTTTTAACGATCAGTTCGC-3′)和GUS-2R(5′-GAGTGAAGATCCCTTTCTTGTTACCG-3′)检测阳性植株。对转化植株在成株期阶段接种白叶枯病菌株PXO99(菌株PXO99由菲律宾国际水稻研究所惠赠,Sun等,2004),在鉴定的21株D35UM8基因植株中有10株显著提高了对白叶枯菌PXO99抗性(P<0.05),病斑面积范围从14%-39%,而野生型转化受体牡丹江8植株病斑面积是60%(表1)。为进一步验证遗传转化植株的抗病能力增强是否与OsDR11S基因表达量相关,本发明采用Northern分析OsDR11S基因表达量,实验结果显示转化植株中OsDR11S基因的表达量变化与植株的病斑面积呈极显著相关(见图5中的A图)。该结果说明OsDR11S的编码产物可能在水稻抗白叶枯病反应中发挥正调控因子的作用,超量水稻中OsDR11S基因的表达,可能增强水稻对白叶枯病的抗性。
表1.T0代遗传转化植株(D35UM8)对白叶枯病菌株PXO99的反应
采用农杆菌介导的遗传转化方法将D229R导入水稻品种明恢63。获得的遗传转化植株被命名为D229RM(其中D229R为遗传转化载体名称,M代表水稻品种明恢63)。本发明共获得独立转化植株12株,用遗传转化载体pDS1301上的特异PCR引物pMCG-f(5′-GGCTCACCAAACCTTAAACAA-3′)和pMCG-r(5′-CTGAGCTACACATGCTCAGGTT-3′)检测阳性植株。对全部转化植株在成株期阶段接种白叶枯病菌株PXO99,与对照明恢63相比及遗传转化阴性植株相比10株阳性遗传转化植株中的7株的抗性显著增强(表2)。为进一步验证遗传转化植株的抗病能力增强是否与OsDR11L表达量相关,本发明采用上述实时定量RT-PCR方法检测了其中12株T0代遗传转化植株中OsDR11L基因的表达量。实验结果显示转化植株中OsDR11L的表达量变化与植株的病斑面积呈极显著负相关(图5中的B图)。该结果说明OsDR11L的编码产物可能在水稻抗白叶枯病反应中发挥负调控因子的作用;抑制水稻中OsDR11基因的表达,可能增强水稻对白叶枯病的抗性。
表2.T0代遗传转化植株(D229RM)对白叶枯病菌株PXO99的反应
3.遗传转化植株的共分离分析
为了进一步验证上述推测,对OsDR11S超量的T1代遗传转化植株(D35UM8-33和D35UM8-54)的进行分析。接种调查和Realtime-PCR的结果表明,所有T1家系单株的抗性 增强与OsDR11S的超量表达水平变化表现共分离(见图6中的A图和表3)。说明遗传转化植株抗病表型与转入的超表达的OsDR11S共分离,进一步证明超表达OsDR11S可增强水稻抗病性。
表3.T1代遗传转化植株(D35UM8)对白叶枯病菌株PXO99的反应
另外,本研究发明人对OsDR11L抑制的T1代遗传转化植株(D229RM-7和D229RM-8)的T1代家系进行分析。接种调查和Realtime-PCR的结果表明,所有T1家系单株的抗性增强与OsDR11L的抑制表达水平变化表现共分离(图6中的B图,表4)。说明遗传转化植株抗 病表型与转入的抑制表达的OsDR11L共分离,进一步证明抑制表达OsDR11L可增强水稻抗病性。
表4.T1代遗传转化植株(D229RM)对白叶枯病菌株PXO99的反应
参考文献
Cao Y,Ding X,Cai M,Zhao J,Lin Y,Li X,Xu C,Wang S(2007)The expression pattern of a rice disease resistance gene Xa3/Xa26 is differentially regulated by the genetic backgrounds and developmental stages that influence its function.Genetics 177:523-533.
Chen H,Wang S,Xing Y,Xu C,Hayes PM,Zhang Q(2003)Comparative analyses of genomic locations and race specificities of loci for quantitative resistance to Pyricularia grisea in rice and barley.Proc.Natl.Acad.Sci.USA 100:2544-2549.
Cheng H,Liu H,Deng Y,Xiao J,Li X,Wang S(2015)The WRKY45-2 WRKY13 WRKY42transcriptional regulatory cascade is required for rice resistance to fungal pathogen.Plant Physiol.167:1087-1099.
Chu Z,Ouyang Y,Zhang J,Yang H,Wang S(2004)Genome-wide analysis of defense-responsive genes in bacterial blight resistance of rice mediated by the recessive R gene xa13.Mol.Genet.Genomics 271:111-120.
Chu Z,Peng K,Zhang L,Zhou B,Wei J,Wang S(2003)Construction and characterization of a normalized whole-life-cycle cDNA library of rice.Chinese Science Bulletin 48:229-235.
Ding X,Cao Y,Huang L,Zhao J,Xu C,Li X,Wang S(2008)Activation of the indole-3-acetic acid-amido synthetase GH3-8 suppresses expansin expression and promotes salicylate-and jasmonate-independent basal immunity in rice.Plant Cell 20:228-240.
Helliwell E,Yang Y(2013)Molecular Strategies to Improve Rice Disease Resistance.In Rice Protocols,ed.Y Yang,956:285-309
Kou Y,Wang S(2010)Broad-spectrum and durability:understanding of quantitative disease resistance.Curr.Opin.Plant Biol.13:181-185
Kou Y,Wang S(2013)Bacterial blight resistance in rice.In:Translational Genomics for Crop Breeding:Volume 1-Biotic Stress(Rajeev K.Varshney,Roberto Tuberosa eds.),Wiley-Blackwell/John Wiley&Sons,Inc.,p.11-30
Lin YJ,Zhang Q(2005)Optimising the tissue culture conditions for high efficiency transformation of indica rice.Plant Cell Rep.23:540-547.
Qiu D,Xiao J,Ding X,Xiong M,Cai M,Cao Y,Li X,Xu C,Wang S(2007)OsWRKY13 mediates rice disease resistance by regulating defense-related genes in salicylate-and jasmonate-dependent signaling.Mol.Plant-Microbe Interact.20:492-499.
Schenk PM,Kazan K,Wilson I,Anderson JP,Richmond T,Somerville SC,Manners JM(2000) Coordinated plant defense responses in Arabidopsis revealed by microarray analysis.Proc.Natl.Acad.Sci.USA 97:11655-11660.
Shen X,Yuan B,Liu H,Li X,Xu C,Wang S(2010)Opposite functions of a rice mitogen-activated protein kinase during the process of resistance against Xanthomonas oryzae.Plant J.64:86-99.
Sun X,Cao Y,Yang Z,Xu C,Li X,Wang S,Zhang Q(2004)Xa26,a gene conferring resistance to Xanthomonas oryzae pv.oryzae in rice,encoding a LRR receptor kinase-like protein.Plant J.37:517-527.
Xue W,Xing Y,Weng X,Zhao Y,Tang W,Wang L,Zhou H,Yu S,Xu C,Li X,Zhang Q.Natural variation in Ghd7 is an important regulator of heading date and yield potential in rice.Nat Genet,2008,40:761-767
Zhang H,Wang S(2013)Rice versus Xanthomonas oryzae pv.oryzae:a unique pathosystem.Curr.Opin.Plant Biol.16:188-195
Zhou B,Peng KM,Chu ZH,Wang SP,Zhang QF(2002)The defense-responsive genes showing enhanced and repressed expression after pathogen infection in rice(Oryza sativa L.).Science in China Series C-Life Sciences 45:449-467。
- 还没有人留言评论。精彩留言会获得点赞!