一种重组谷氨酰胺转氨酶的生产方法与流程
本发明涉及生物
技术领域:
,具体涉及一种重组谷氨酰胺转氨酶的生产方法,属于重组蛋白分离纯化
技术领域:
。
背景技术:
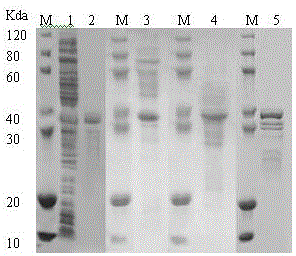
:谷氨酰胺转氨酶(Transglutaminase,TG.2.3.2.13)通过酰基转移反应而引起蛋白质内部、蛋白质之间的相互交联、蛋白质和氨基酸之间的连接作用以及蛋白质分子内部谷氨酰胺基的转移和水解作用,形成ε-(γ-谷胺酰)赖氨酸共价异肽键,从而改善蛋白质的结构和功能特性,由于其卓越的交联特性,TG被认为是生产各种新型蛋白质加工产品的重要酶源,在食品的加工、储藏、保鲜等方面、化妆品、纺织、生物医药等领域具有重要的潜在应用价值。TGase最初从动、植物组织中提取,动物来源的谷氨酰胺转氨酶已经商业化,但是由于来源稀少,工艺复杂、产品得率低、分离成本高,不利于大规模工业化应用。自1989年Ando等从5000株菌株中筛选到几株产谷氨酰胺转氨酶的茂源链霉菌(Streptomycesmobaraensis),在后期研究中将其分离得到微生物来源的TGase,由于其活性不依赖Ca2+、底物特异性低、稳定性高等特点,且其生产周期短,分离纯化工艺简单而受到广大科学爱好者的青睐。目前,MTG已在大肠杆菌(E.coli)、谷氨酸棒杆菌、酵母、枯草芽孢杆菌和链霉菌等宿主中成功表达,但普遍存在酶活低、产量少等问题。日本的味之素公司已经成功利用微生物发酵生产谷氨酰胺转氨酶,并应用于商业化中,已经取得了巨大经济效益,微生物谷氨酰胺转氨酶基本被其所垄断,国内研究谷氨酰胺转氨酶主要集中于发酵条件优化以及酶的应用等方面。大肠杆菌遗传背景清楚,生长周期短,生产成本低,转化率高并且可以大规模表达目的蛋白,其表达水平明显高于其他表达系统。而实现产品的工业化生产与成熟的重组菌纯化工艺是息息相关,不可逾越的,因此实现基因工程技术和工程菌的纯化工艺的有机结合,无疑会为重组产品实现大规模生产奠定基础。尽管许多微生物在自然状态下都能产TGase,但绝大多数酶的产量极低,而通过常规育种技术耗时费力,难以筛选到TGase的高产菌株,这就造成了生产成本居高不下,限制了其工业化生产。技术实现要素:本发明要解决的技术问题是提供一种重组谷氨酰胺转氨酶的生产方法,以克服现有技术的不足,提供一种新的谷氨酰胺转氨酶生产技术,可大幅提高重组谷氨酰胺转氨酶的表达量和酶活性。为了达到上述目的,本发明采用的技术方案为:一种重组谷氨酰胺转氨酶的生产方法,包括如下步骤:1)重组谷氨酰胺转氨酶的发酵:将含有谷氨酰胺转氨酶的重组大肠杆菌于10L发酵罐37℃培养至OD600=2-3时加入IPTG诱导培养;2)细胞的收集及裂解:将步骤1)的发酵液以管式离心机离心收集菌体,按1:10-15(m:v)的比例(单位为g/ml),加入裂解缓冲液,利用高压均质机在4℃下将细胞裂解,裂解结束后将匀浆液于12500rpm,15℃离心20分钟,保留沉淀;3)包涵体的纯化:将步骤2)的沉淀按1:10-15(m:v)的比例加入包涵体洗涤缓冲液I,以步骤2)相同方法裂解,于6000rpm,15℃离心20分钟,保留沉淀,然后再将沉淀按1:10-15(m:v)的比例加入包涵体洗涤缓冲液I,以步骤2)相同方法裂解,于6000rpm,15℃离心20分钟,保留沉淀,然后再将沉淀按1:10-15(m:v)的比例加入包涵体洗涤缓冲液II,以步骤2)相同方法裂解,于6000rpm,15℃离心20分钟,保留沉淀,最后将沉淀加入包涵体溶解液中以步骤2)相同方法裂解,于12500rpm,15℃离心20分钟,保留上清,即可得纯化的谷氨酰胺转氨酶包涵体;4)包涵体的复性:将步骤3)的上清透析于复性缓冲液中复性,复性结束将样品透析与最终储存缓冲液中。步骤1)所述的10L发酵罐中为TB培养基,装液量为6L,培养基组分及各组分含量为:50ug/ml的卡那霉素,蛋白胨12g/L,酵母膏24g/L,甘油5g/L,K2HPO4·3H2O15.2g/L,KH2PO42.33g/L,培养条件:转速200-300rpm,罐压为0.03-0.05Mpa,初始通气量为1.5m3/h,通过调节通气量维持DO大于25%,IPTG终浓度为0.2-0.5mM。步骤2)所述的裂解缓冲液为20-50mmol/LTris-HCl(pH7.0-8.5)、0.1-0.5mol/LNaCl,0.5%-2%TritonX-100,1-2mMDTT(二硫苏糖醇),0.2-1mMPMSF(苯甲基磺酰氟),1-2mMEDTA;加入低浓度DTT为了保护蛋白质的二硫键不被破环,加入PMSF和EDTA(乙二胺四乙酸)是为了防止蛋白再裂解后被蛋白酶降解。步骤2)所述的均质压力为700-900Mpa,以菌液不再粘稠为结束标志。步骤3)所述的洗涤缓冲液I为20-50mmol/LTris-HCl(pH7.0-8.5)、0.1-0.5mol/LNaCl,0.5%-2%TritonX-100,1-2mMDTT,2mol/L尿素。步骤3)所述的洗涤缓冲液II为20-50mmol/LTris-HCl(pH7.0-8.5)、0.1-0.5mol/LNaCl,1-2mMDTT,4mol/L尿素。洗涤缓冲液中分别加入2mol/L和4mol/L尿素是为了将包裹在包涵体外部的杂质溶解,提高包涵体纯度。步骤3)所述的包涵体溶解液为20-50mmol/LTris-HCl(pH7.0-8.5)、0.1-0.5mol/LNaCl,1-2mMDTT,8mol/L尿素。步骤4)所述的复性缓冲液为20-50mmol/LTris-HCl(pH7.0-8.5)、0.1-0.5mol/LNaCl,0.2-0.4mMGSSG(氧化型谷胱甘肽),1-4mMGSH(还原型谷胱甘肽),1-2mMDTT,0.2-0.5ML-Arginine(L-精氨酸),复性温度为4℃,复性时间为20-26h。利用GSH/GSSG氧化还原系统模拟蛋白质的体内折叠进行蛋白质的复性,并且在其中加入促溶剂L-Arginine或月桂酸肌氨酸钠,提高了复性的成功率。步骤4)所述的储存缓冲液为20-50mmol/LTris-HCl(pH7.0-8.5)、0.1-0.5mol/LNaCl,10-20%甘油,温度为-80℃。本发明中所述谷氨酰胺转氨酶重组大肠杆菌是将谷氨酰胺转氨酶基因通过表达载体转入大肠杆菌中获得的重组菌。例如构建方法可以为:根据Fu,R.Y.报道的MTG基因(GenBank:DQ132977),以Streptomycesmobaraensis基因组DNA为模板,PCR扩增目的基因片段,反应条件为:95℃,5min;(95℃30s,60℃60s,72℃45s,30个循环);72℃,10min。纯化扩增出的mtg基因,将mtg基因和表达质粒分别用EcoRI和bamHI双酶切、连接转化至BL21(DE3)感受态细胞,使用EcoRI和bamHI双酶切鉴定重组质粒pET30a-mtg,得到大小为1000bp左右的条带,酶切结果表明,重组质粒pET30a-mtg构建成功,获得重组质粒pET30a-mtg,参考《分子克隆》将重组质粒pET30a-mtg通过热击导入大肠杆菌BL21(DE3)得到重组的谷氨酰胺转氨酶大肠杆菌BL21(DE3)/mtg。有益效果本发明将重组谷氨酰胺转氨酶大肠杆菌经过高温培养和诱导,得到以包涵体形式的目的蛋白,可以大幅提高发酵过程中谷氨酰胺转氨酶的的含量;相对于其他受体菌,大肠杆菌遗传背景清楚,生长周期短,生产成本低,转化率高并且可以大规模表达目的蛋白。在破碎过程选择高压均质破碎,由于其可以低温控制,保持蛋白稳定结构,并且破碎率良好,处理量大,管式离心机处理量大,操作简单,转速高,离心效果好,特别适合工业化生产中大批量样品的处理。在蛋白纯化阶段通过包涵体洗液清洗后的包涵体纯度较高,易于后续复性操作,复性缓冲液中加入GSH/GSSG氧化对,以及促溶剂L-Arginine和月桂酸肌氨酸钠,提高了复性成功率,蛋白回收率高,因此整个生产工艺简单、高效快速,生产成本低,对以包涵体形式存在的谷氨酰胺转氨酶生产提供了基础。本发明解决了传统方法中蛋白表达量低,复性回收率低的问题,适合规模化生产,得到的谷氨酰胺转氨酶纯度好,质量稳定。附图说明图1:琼脂糖凝胶电泳分析mtg基因(其中M为DNAMark,1为mtg基因);图2:SDS-PAGE分析包涵体纯化结果(其中M为蛋白Mark,1为包涵体纯化前,2为本发明纯化结果,3、4、5为对照实验纯化结果);图3:SDS-PAGE分析包涵体复性结果(其中M为蛋白Mark,1为标准牛血清蛋白(BSA),2为本发明纯化结果,3、4、5为对照实验复性结果)。具体实施方式下面结合具体实施实例对本发明做进一步描述,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的具体的物料配比、工艺条件及其结果仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。本发明缓冲液中所述的百分比是体积比。实施例1本实施例说明谷氨酰胺转氨酶重组大肠杆菌的构建1、设计合成带有EcoRI酶切位点的上游引物和带有BamHI酶切位点的下游引物(下划线部分为相应的酶切位点),Primer1上游引物:5’-GGTCGTCAACAACTACATAC-3’;Primer2下游引物:5’-GTTCGCCAGTTCCTTCTT-3’。2、根据Fu,R.Y.报道的MTG基因(GenBank:DQ132977),以Streptomycesmobaraensis基因组DNA为模板,PCR扩增目的基因片段,反应条件为:95℃,5min;(95℃30s,60℃60s,72℃45s,30个循环);72℃,10min。纯化扩增出的mtg基因(参照TakaraDNA片段纯化试剂盒说明书)和表达质粒pET30a(购自Takara公司)分别用EcoRI和bamHI双酶切、连接转化至BL21(DE3)感受态细胞(购自德泰生物公司),使用EcoRI和bamHI双酶切鉴定重组质粒pET30a-mtg,得到大小为1000bp左右的条带,酶切结果表明(图1),重组质粒pET30a-mtg构建成功,获得重组质粒pET30a-mtg,参考《分子克隆》将重组质粒pET30a-mtg通过热击导入大肠杆菌BL21(DE3)得到重组的谷氨酰胺转氨酶大肠杆菌BL21(DE3)/mtg。3、将步骤2)的表达载体热击导入大肠杆菌,热击条件:42℃90s,后冰浴3min,然后加入200ulLB培养基,于37℃恒温培养1h,取已培养好的大肠杆菌BL21用无菌水制成浓度大约为1×106个/mL孢子悬浮液,吸取50μL在无菌条件下均匀涂布到加入50ug/ml的卡那霉素平板培养基上,在37℃下培养12-24小时,即可获得重组大肠杆菌。实施例2本实施例说明重组谷氨酰胺转氨酶大肠杆菌的发酵控制过程将实施例1得到的重组的谷氨酰胺转氨酶大肠杆菌BL21(DE3)/mtg的平板上挑取单克隆接种在含4mlLB培养液试管37℃,200rpm培养16h,再将培养好的一级种液按2%的接种量接种于含200mlLB培养液的三角烧瓶中37℃培养16h,作为发酵用种子液,种子液以2%接种量接种于含有6LTB培养液(含50ug/ml的卡那霉素,蛋白胨12g/L,酵母膏24g/L,甘油5g/L,K2HPO4·3H2O15.2g/l,KH2PO42.33g/l)10L发酵罐中37℃培养,转速设为300rpm,罐压维持在0.03-0.05Mpa,初始通气量为1.5m3/h,通过调节通气量维持DO大于25%,培养至OD600在2-3之间加入终浓度为0.375mMIPTG诱导培养,当OD600增至2稳定两小时后停止发酵,将发酵液缓慢加入管式离心机离心后收集菌体,最终获得湿菌体为26.7g/L。在目前的文献中通常在高温37℃培养后在低温下(15℃或者28℃)诱导,这样可以让蛋白表达在上清,但是这样表达的蛋白量少,本发明采用37℃培养和诱导,蛋白以包涵体形式大量表达,表达量高。实施例3本实施例说明重组谷氨酰胺转氨酶蛋白的纯化将收集的细胞取26.7g加入10倍体积(260ml)的50mmol/LTris-HCl(pH8.0)、0.15mol/LNaCl,0.5%TritonX-100,1mMDTT,0.2mMPMSF,1mMEDTA搅匀后,缓慢流加到高压均质机中,压力控制在800Mpa,循环两次后将匀浆液在6000rpm,4℃离心,将沉淀加入10倍体积的50mmol/LTris-HCl(pH8.0)、0.15mol/LNaCl,0.5%TritonX-100,1mMDTT,2mol/L尿素搅匀后,缓慢流加到高压均质机中,压力控制在800Mpa,循环两次后将匀浆液在6000rpm,4℃离心,再将得到的沉淀加入10倍体积的50mmol/LTris-HCl(pH8.0)、0.15mol/LNaCl,0.5%TritonX-100,1mMDTT,4mol/L尿素搅匀后,缓慢流加到高压均质机中,压力控制在800Mpa,循环两次后将匀浆液在6000rpm,4℃离心,将最后的到的沉淀加入10倍体积的50mmol/LTris-HCl(pH8.0)、0.15mol/LNaCl,1mMDTT,8mol/L尿素中溶解,并以高压均质辅助,最后在12500rpm,4℃离心15min,即可得到纯化的谷氨酰胺转氨酶包涵体,同时在纯化过程中分别将不加入DTT、PMSF、和尿素作为对照实验,最终得到的纯化包涵体质量和纯度见表1以及SDS-PSGE见图2。表1本发明无DTT无PMSF无尿素纯度>90%<70%<70%<70%包涵体重量3.96g3.752.854.23实施例4本实施例说明重组谷氨酰胺转氨酶蛋白的复性将纯化好的包涵体蛋白0.502g透析到10倍体积的50mmol/LTris-HCl(pH8.0)、0.15mol/LNaCl,0.4mMGSSG,4mMGSH,1mMDTT,0.4ML-Arginine中4℃复性22h后将蛋白再透析至5倍体积的50mmol/LTris-HCl(pH8.0)、0.15mol/LNaCl,10%甘油中8h,其中换液4次,最终得到可溶的活性蛋白0.224g,因此每升发酵液可以得到1.78g谷氨酰胺转氨酶,复性回收率为44.6%,显然高于相关文献报道的36.3%,分装于-80℃保存后取样品于冰浴冻融,并且进行SDS-PAGE比对,SDS-PAGE图显示蛋白未发生降解,说明蛋白稳定性良好,蛋白纯度大于90%。同时在复性过程中分别将不加入DTT、GSSG/GSH、和L-Arginine作为对照实验,其余按本发明操作,结果如下表2和图3。表2本发明无DTT无GSSG/GSH无L-Arginine纯度>90%<70%<70%0回收率44.6%10.1%6.05%0稳定性澄清部分浑浊部分浑浊浑浊<110>南京工业大学<120>一种重组谷氨酰胺转氨酶的生产方法<130><160>2<170>PatentInversion3.3<210>1<211>20<212>DNA<213>人工序列<400>1ggtcgtcaacaactacatac20<210>2<211>18<212>DNA<213>人工序列<400>2gttcgccagttccttctt18当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1