帕比司他乳酸盐晶型II及其制备方法和用途与流程
本发明涉及一种帕比司他乳酸盐的新晶型及其制备方法,更具体地说,本发明涉及帕比司他乳酸盐晶型II及其制备方法。
背景技术:
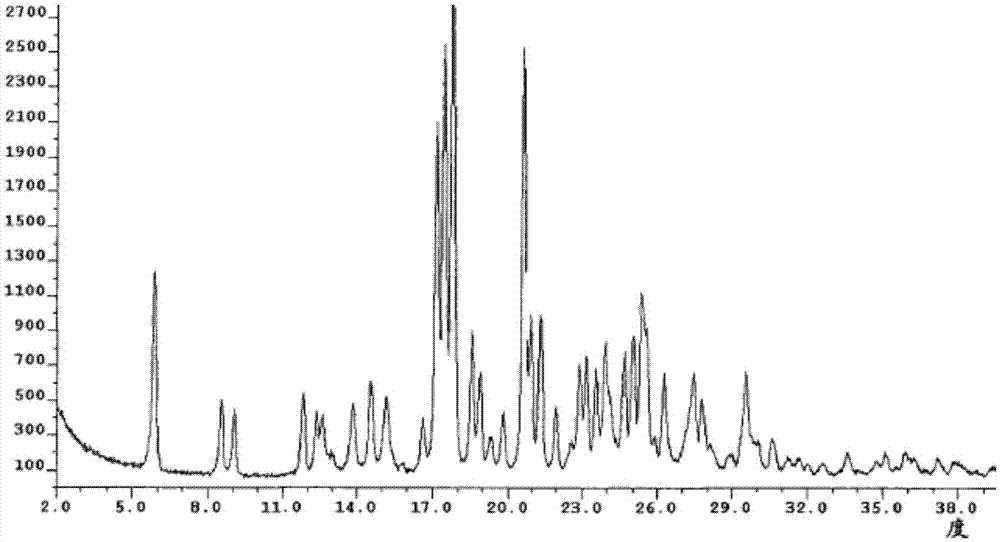
:帕比司他乳酸盐(Panobinostatlactate,商品名为Farydak),其化学名为:N-羟基-3-[4-[[[2-(2-甲基-1H-吲哚-3-基)乙基]氨基]甲基]苯基]-(2E)-2-丙烯酰胺乳酸盐,由诺华公司开发。2015年2月23日,美国食品和药品监管局(FDA)批准Farydak作为用于治疗多发性骨髓瘤(MM)的药物。其化学结构式如式(1)所示:MM是浆细胞恶性增殖性疾病,其特征为骨髓中克隆性浆细胞异常增生,分泌单克隆免疫球蛋白或其片段(M蛋白),并导致相关器官或组织损伤。常见临床表现为骨痛、贫血、肾功能不全和感染等。随着人口老龄化,MM的发病率正逐年增加,据统计,它占恶性肿瘤1%,血液肿瘤10%。欧美国家年发生率是2~5/10万,我国发病率约1/10万,主要集中在老年人,发病年龄50~70岁,中位年龄55岁, 40岁以下者少见,男女比例为3:1,近20年来发病率有上升趋势,MM至今仍被认为是不能治愈的恶性血液病。帕比司他乳酸盐是一种新型、广谱组蛋白脱乙酰酶(HDAC)抑制剂,组蛋白去乙酰化酶与肿瘤的发生密切相关,通过催化组蛋白N-端赖氨酸残基的去乙酰化进而调控基因转录和染色体重组,此外组蛋白去乙酰化酶也可以催化非组蛋白去乙酰化。抑制HDAC可以诱导肿瘤细胞周期停止、分化及凋亡。该药能够对癌细胞施以严重的应激直至其死亡。诺华公司在专利WO2007146716中公开了帕比司他乳酸盐的晶型A、晶型HA和晶型SA等三种晶型。其中晶型A是无水晶型,其XRPD图谱中的特征峰包括:9.9、11.4、13.8、15.7、18.2、19.7、20.3、21.5、25.3、27.4和30.0(2θ角),熔点为183-186℃,此晶型具有略微的引湿性,在120℃下失重0.2%,晶型A的XRPD图谱如图1所示;晶型HA为含水晶型,其XRPD图谱的特征峰包括5.8、8.5、9.0、11.7、13.7、14.5、15.1、17.1、17.4、17.7、18.5、20.8和21.2(2θ角),此晶型具有略微的引湿性,在110℃下失重为0.4%,在130℃下失重为3.0%,在155℃下失重为4.4%,晶型HA的XRPD图谱如图2所示;晶型SA为甲醇溶剂化物,其XRPD图谱的特征峰包括9.9、17.2、17.7、18.1、19.5、20.5、21.4、21.7、22.5、23.6、24.6和26.1(2θ角),此晶型在123℃下熔化并分解。技术实现要素:本发明的目的在于提供了一种帕比司他乳酸盐的新晶型,将其命 名为晶型II,以及该晶型的制备方法。本发明帕比司他乳酸盐晶型II具有稳定性好、溶解度高的优点。一方面,本发明提供的帕比司他乳酸盐晶型II,其粉末X-射线衍射图谱(XRPD)在2θ±0.2°为6.2、12.4、14.9、20.1、21.9、23.7和26.5处具有特征衍射峰。优选地,本发明提供的帕比司他乳酸盐晶型II,其粉末X-射线衍射图谱在2θ±0.2°为6.2、12.4、14.9、16.7、20.1、21.9、23.7、25.7和26.5处具有特征的衍射峰。优选地,本发明提供的帕比司他乳酸盐晶型II,其粉末X-射线衍射数据基本如表1。表12θ(°)D值相对强度(%)6.214.2100.012.47.119.014.95.926.216.75.337.420.14.450.621.94.124.223.73.77.025.73.530.826.53.454.3优选地,本发明提供的帕比司他乳酸盐晶型I,其粉末X-射线衍射图谱基本如图4所示。进一步地,本发明提供的帕比司他乳酸盐晶型II为水合物晶型,通过热重分析(TGA)测定含有约3.8%的水,优选其TGA图谱基本如图5所示。另一方面,本发明提供了帕比司他乳酸盐晶型II的晶种的制备工艺,包括:在丙酮与水(体积比2:1)的混合溶剂中,搅拌使帕比司他丙烯酸盐与乳酸反应,至反应体系中析出含帕比司他乳酸盐的固体,过滤得到所述晶型II的晶种。优选地,所述搅拌在室温下进行。优选地,所述帕比司他丙烯酸盐通过将帕比司他与丙烯酸在丙酮中成盐制得。又一方面,本发明提供了帕比司他乳酸盐晶型II的制备工艺,包括:步骤1),将帕比司他置于水和酮类溶剂的混合溶剂中,加入乳酸水溶液,加热至固体溶解;步骤2),将步骤1)所得溶液降温,加入晶种,搅拌析晶得到晶型II。优选地,步骤1)中所述酮类溶剂为丙酮、丁酮、戊酮,更优选丙酮。优选地,步骤1)中所述混合溶剂中水的含量为20%~60%(体积含量比),更优选20%~40%。优选地,步骤1)中所述帕比司他与乳酸的质量比为1:0.1~1,更优选1:0.3~0.5,最优选1:0.45。优选地,步骤1)中所述加热温度为40℃~60℃,更优选50℃~55℃。优选地,步骤2)中所述降温温度为-20℃~0℃,更优选-15℃~-10℃。优选地,加入晶种的量为帕比司他投料量的1‰~10%。作为本发明帕比司他乳酸盐晶型II的制备工艺的示例,所述制备工艺包括如下步骤:步骤1):将帕比司他置于水和丙酮的混合溶剂中,缓慢滴加乳酸水溶液,加热至50℃,保温搅拌1小时,形成溶液;步骤2):将溶液降温至-15℃~-10℃,加入晶种,保温搅拌12小时后过滤,真空干燥12小时得到晶型II。本发明的帕比司他乳酸盐晶型II具有良好的稳定性,通过影响因素试验发现晶型I样品在高温(60℃)、高湿(25℃/RH92.5%)和强光(5000Lx)条件下放置30天,未发生晶型转变和化学降解。本发明的帕比司他乳酸盐晶型II不仅具有良好的溶解度,而且在水中的溶解度受pH值影响很小,这对于制剂处方筛选非常有利。再一方面,本发明提供了帕比司他乳酸盐晶型II,在制备治疗多发性骨髓瘤的药物中的应用。帕比司他乳酸盐晶型II可制成药物组合物,同时该药物组合物可通过口服或注射液途径给药,优选口服给药途径,包括片剂、胶囊、微丸等,优选片剂。附图说明图1:专利WO2007146716中公开的帕比司他乳酸盐无水晶型A的XRPD图谱;图2:专利WO2007146716中公开的帕比司他乳酸盐水合物晶型HA的XRPD图谱;图3:专利WO2007146716中公开的帕比司他乳酸盐甲醇溶剂化物晶型SA的XRPD图谱;图4:本发明中的帕比司他乳酸盐晶型II的XRPD图谱;图5:本发明中的帕比司他乳酸盐晶型II的TGA图谱。具体实施方式实施例1:晶种制备称取帕比司他0.5g置于丙酮中,加入丙烯酸0.2g,室温下搅拌24小时,过滤,得到帕比司他丙烯酸盐。将上述得到的帕比司他丙烯酸盐置于丙酮/水(体积比为2:1)的混合溶剂中,加入0.3g乳酸,室温下搅拌3天,过滤得到帕比司他乳酸盐晶种。实施例2:制备帕比司他乳酸盐晶型II称取帕比司他50g置于含水量为30%的丙酮1000ml中搅拌,缓慢滴加125g乳酸水溶液(质量百分比18%),加热至50℃,保温搅拌1小时,形成溶液,将溶液降温至-10℃,加入实施例1中得到的晶种100mg,保温搅拌18小时过滤,室温下真空干燥12小时得到58.2g晶型II。经检测,晶型II的XRPD图谱基本如图4所示,TGA图谱 基本如图5所示。实施例3:制备帕比司他乳酸盐晶型II称取帕比司他10g置于含水量为20%的丙酮200ml中搅拌,缓慢滴加25g乳酸水溶液(质量百分比18%),加热至50℃,保温搅拌1小时,形成溶液,将溶液降温至-15℃,加入实施例1得到的晶种50mg,保温搅拌14小时过滤,室温真空干燥12小时得到11.6g晶型II。经检测,晶型II的XRPD图谱基本如图4所示,TGA图谱基本如图5所示。实施例4:溶解度研究将本发明帕比司他乳酸盐晶型II和根据专利WO2007146716实施例18制备得到的帕比司他乳酸盐晶型A样品,分别研磨后过80目药筛,在25℃±2℃条件下测定样品在不同pH值水溶液中的溶解性。检测结果如下:实验结果表明,本发明帕比司他乳酸盐晶型II不仅具有较高的溶解度,而且在不同pH值水溶液中的溶解度变化范围小,这对制剂处方筛选非常有益。实施例5:稳定性研究将本发明的帕比司他乳酸盐晶型II样品进行影响因素试验和加速试验,实验内容和结果如下:(1)影响因素试验内容和结果(2)加速试验内容和结果实验结果表明,帕比司他乳酸盐晶型II样品在高温(60℃)、高湿(RH92.5%)和光照(5000勒克斯)的条件下能够至少稳定存储30天。在温度25℃,湿度RH60%的加速实验条件下至少可以稳定存储6个月,说明本发明帕比司他乳酸盐晶型II稳定可控,方便存储与运输,符合药用要求。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1