使用SOMAmer通过基于荧光的检测方法检测样品中微生物的方法与流程
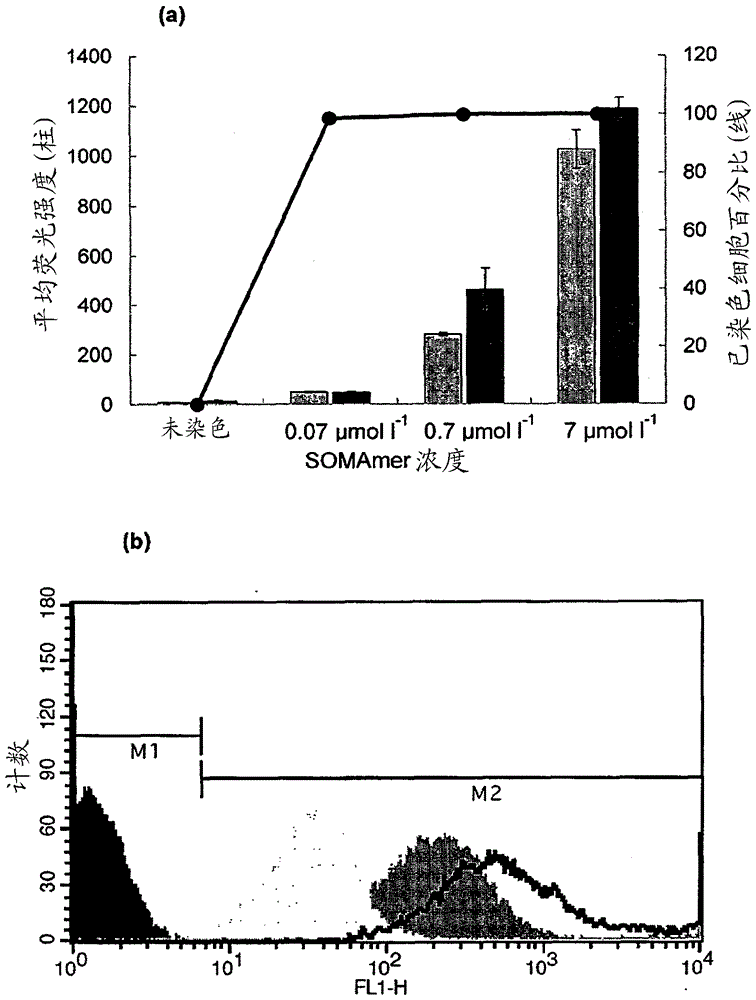
本发明还涉及包含荧光标记的SOMAmer,其中所述SOMAmer包含对金黄色葡萄球菌特异的核苷酸序列,其用于检测样品中的金黄色葡萄球菌细胞,并且涉及包括至少一种此类包含荧光标记的SOMAmer的微阵列或生物传感器以及试剂盒。对于食物、水、非无菌产品或环境的微生物污染的监测通常基于传统的微生物学方法,如培养方法。对于检测特定的微生物,可以使用选择性或鉴别性培养基,其分别允许仅选定的微生物生长或将一种微生物类型与生长在相同培养基上的另一种微生物区分开来。这些方法需要若干天以得到结果,因为其依赖于微生物生长以产生可见菌落的能力。即使其耗时,但其一直是标准的检测方法。在过去的二十多年里,在快速微生物学领域兴起了许多技术和检测系统,如基于核酸扩增的技术(NAAT)和免疫测定法。相比传统的基于培养的方法,这些替代技术减少了检测时间。已知NAAT可以在数小时内得出污染结果。然而,此技术有若干缺点,如方案的复杂性(需要很高专业技术)或假阳性问题,并且依然受限于样品的制备方法。免疫测定法依赖于使用特定的单克隆或多克隆抗体以捕获和/或检测靶微生物。免疫测定法的效率和成功依赖于测试中所使用的抗体的质量。由于其生产方式(在动物体内或通过细胞培养),使用抗体的一个缺点是各批次间的再现性问题。为了克服抗体的某些缺点并提高测定质量,已经开发了新的亲和力结合剂,如适体。适体是合成的、短的DNA或RNA链,其可以折叠成多种结构并可以(如抗体般)特异性结合至其靶标。DNA适体已经被用于检测微生物(包括金黄色葡萄球菌)。此外,也已经报道了经荧光标记的DNA适体用于使用基于荧光的方法检测全细菌细胞:US2012/0071639A1公开了用于结合多种食源性和水源性病原体及生物毒素的特定DNA序列。WO2013/064818A1公开了用于检测样品中病原细菌的经荧光标记的适体。Cao等人(2009,NucleicAcidsRes37,4621-4628)公开了通过全细菌SELEX程序获得的对金黄色葡萄球菌特异的一组ssDNA适体。这些适体中的五种的组合在识别不同的金黄色葡萄球菌菌株中取得了良好的效果。Dwivedi等人(2013,ApplMicrobiolBiotechnol97,3677-3686)描述了对塞洛瓦鼠伤寒沙门氏菌(SalmonellaentericaserovaTyphimurium)特异的DNA适体及其在通过流式细胞术检测沙门氏菌上的用途。Gold等人(2010,PLoSOne5,e15004)和Vaught等人(2010,JAmChemSoc132,4141-4151)描述了被称为SOMAmer(经修饰的慢解离率的适体)的新的基于适体的试剂的开发。SOMAmer由单链DNA(ssDNA)制成,含有在其5’位置用氨基酸侧链模拟物修饰过的嘧啶残基并且具有相当长的(>30min)解离速率。这些特征导致了SOMAmer相比标准的RNA或DNA适体更好的亲和力和更好的动力学特性。US7947447B2公开了用于生产SOMAmer的经过改进的SELEX方法,所述SOMAmer能够以较使用以前的SELEX方法获得的更慢的解离速率常数结合至靶分子。Ochsner等人(2013,DiagnMicrobiolInfectDis.76,278-285)描述了对艰难梭状芽孢杆菌(Clostridiumdifficile)毒素(即,微生物蛋白质)特异的SOMAmer的表征。在现有技术中尚未描述SOMAmer在检测全细菌细胞上的用途。本发明的目的是为检测复杂样品中的微生物提供合适的试剂。令人惊奇的是,据发现,高度特异的经荧光标记的SOMAmer是用于通过基于荧光的方法检测复杂样品中微生物的非常有效的工具。因此,本发明涉及检测样品中微生物的方法,包括步骤:a)将所述样品与包含荧光标记的经修饰的慢解离率的适体(SOMAmer)温育;b)任选地洗涤所述样品;c)通过基于荧光的检测方法分析所述样品。SOMAmer(经修饰的慢解离率的适体)由单链DNA(ssDNA)制成,含有在其5’位置用氨基酸侧链模拟物修饰过的嘧啶残基并且具有相当长的(>30min)解离速率。这些特征导致了SOMAmer相比标准的RNA或DNA适体更好的亲和力和更好的动力学特性(Gold等人,2010,PLoSOne5,e15004;Vaught等人,2010,JAmChemSoc132,4141-4151)。如本文所用,“慢解离率”指代适体/靶标复合物开始解离所花费的时间。这可以表示为半衰期或50%的适体/靶标复合物已经解离的(时间)点。SOMAmer的解离率或解离速率,表示为半衰期(t1/2)值,可以大于30min、大于60min、大于90min或大于120min。解离时间可以通过本领域熟知的监测复合物的结合与解离的动态系统(例如,表面等离子体共振)来测量。可以使用天然或经纯化的重组蛋白用多个经修饰的DNA文库通过SELEX方法对微生物的细胞表面结合蛋白质生成SOMAmer试剂。用于生成此类SOMAmer的合适的SELEX方法公开于US7947447B2中,其以引用方式并入本专利申请的公开内容中。实施本发明所需的常规的化学、微生物学和分子生物学方法是本领域技术人员已知的,并且也可见于标准文献中。根据本发明,术语微生物涉及细菌、酵母或真菌。在优选的实施方案中,微生物为细菌,优选病原细菌。其可以,例如,选自沙门氏菌属(如鼠伤寒沙门氏菌、肠炎沙门氏菌)、大肠杆菌(Escherichiacoli)、李斯特氏菌属(Listeriaspp)、单核细胞增多性李斯特菌(Listeriamonocytogenes)、金黄色葡萄球菌、假单胞菌(Pseudomonas)、弯曲菌(Campylobacter)、志贺氏杆菌(Shigella)、链球菌(Streptococcus)、分枝杆菌(Mycobacterium)、伯克氏菌(Burkholderia)、军团菌(Legionella)、耶尔森氏菌(Yersinia)、梭状芽孢杆菌(Clostridium)、棒状杆菌(Corynebacterium)和弧菌(Vibrio)。在本发明的优选实施方案中,微生物为金黄色葡萄球菌。金黄色葡萄球菌的表面结合蛋白质(可以针对其制备例如SOMAmer)的实例包括:SpA、ClfA、ClfB、FnbA、FnbB、SasD、IsdA、IsdB、IsdC和IsdH。通过转肽酶介导的LPXTG转肽酶基序的苏氨酸与甘氨酸之间的裂解,所有这些蛋白质均连接到细胞壁上,并且变成酰胺连接至肽聚糖的五甘氨酸交联桥(Marraffini等人,2006,MicrobiolMolBiolRev70:192-221)。金黄色葡萄球菌蛋白质A(SpA)存在于细菌表面并且分泌到细胞外环境中。ClfA和ClfB是结构上相关的纤维蛋白原结合蛋白(McDevitt等人,1997,EurJBiochem247:416-424;NiEidhin等人,1998,MolMicrobiol30:245-257)。ClfB是负责粘附至脱落的前鼻孔上皮细胞的关键因素之一,并且通常产生于早期指数生长期(NiEidhin等人,1998,参见上文)。FnbA和FnbB附着到细胞外基质的组分(既有纤粘蛋白又有弹性蛋白),并且对于感染期间宿主组织的定殖很重要(Roche等人,2004,JBiolChem279:38433-38440)。SasD是假定的具有未知生理作用的粘附蛋白(Roche等人,2003,Microbiology149:643-654;Ythier等人,2012,MolCellProteomics11:1123-1139)。这些蛋白质中的四种属于铁响应表面决定因子(Isd)系统,该系统在金黄色葡萄球菌中于限铁条件下被诱导并且对于捕获来自血红蛋白(IsdB、IsdH)及其跨细胞壁转运子(IsdA、IsdC)的血红素很重要(Grigg等人,2010,JInorgBiochem104:341-348;Mazmanian等人,2003,Science299:906-909)。通常,待分析的样品是复杂样品,如临床样品、食物或饲料样品、饮料样品、药物样品(包括注射用水)、个人护理和/或化妆品样品。样品可以是原料、成品,或者可以取自生产或储存环境。优选地,样品为临床样品、食物样品、药物样品和/或个人护理产品。“复杂样品”意指包含不止一种组分的样品。例如,当其为食物或饲料时-其可以是肉类或肉制品(例如,生或熟肉制品)、乳制品或用于乳制品生产的组合物(如奶酪或酸奶)、基于植物的食物产品、即食食物或食物成分、沙拉产品、婴儿配方奶粉。在一个实施方案中,样品可以是个人护理或化妆产品如眼部护理产品,如隐形眼镜护理液。如果样品为饮料,则其可以是例如啤酒或取自啤酒酿制期间的样品、饮用水。药物样品涵盖了人用以及动物用(即兽医应用)药品。临床样品可以例如是体液(特别是血液、血浆或血清)或组织样品。示例性样品包括但不限于:食物(例如牛奶、羊奶、山羊奶、马奶、驴奶、骆驼奶、牦牛奶、水牛奶和驯鹿奶、奶制品、牛肉、山羊肉、羔羊肉、羊肉、猪肉、蛙腿肉、小牛肉、啮齿类动物肉、马肉、袋鼠肉、禽类肉(包括鸡肉、火鸡肉、鸭肉、鹅肉、野鸽肉或鸽子肉、鸵鸟肉、鸸鹋肉)、海鲜(包括有鳍鱼如鲑鱼和罗非鱼,以及贝类如软体动物和甲壳类以及蜗牛)、肉制品、植物制品、种子、来自草本植物的谷类(包括玉蜀黍、小麦、水稻、大麦、高粱和小米)、来自非草本植物的谷类(包括菜豆、花生、豌豆和小扁豆)、坚果(包括杏仁、核桃和松子)、含油种子(包括葵花、油菜和芝麻)、蔬菜如食根类蔬菜(包括马铃薯、木薯和芜青)、食叶类蔬菜(包括苋菜、菠菜和甘蓝)、海生蔬菜(包括掌状红皮藻、昆布和翅菜)、食茎类蔬菜(包括竹笋、仙人掌和芦笋)、食花类蔬菜(包括洋蓟、花椰菜和黄花菜)以及食果实类蔬菜(包括南瓜、秋葵和茄子)、水果、香草和香料)、全血、尿液、痰液、唾液、羊水、血浆、血清、肺灌洗液和组织(包括但不限于肝、脾、肾、肺、肠、脑、心脏、肌肉、胰腺等)。技术人员将认识到,得自任何以上示例性样品或所述示例性样品的混合物或包括一种或多种所述示例性样品的组合物的细胞裂解物、提取物或(均质化)材料也是在本发明的范围之内的样品。在本发明的一个实施方案中,SOMAmer包含对金黄色葡萄球菌特异的核苷酸序列。如本文所用的术语“核苷酸序列”指代寡核苷酸序列或多核苷酸序列及其变体、同系物、片段和衍生物(如其部分)。核苷酸序列可以源于合成或重组,其可以是单链的,代表有义或反义链。与本发明有关的术语“核苷酸序列”包括合成的DNA和RNA。优选地,可以使用本领域熟知的化学方法整体地或部分地合成根据本发明的SOMAmer的核苷酸序列。如本文所用的术语“特异的”意指,相比其它微生物,SOMAmer选择性地与金黄色葡萄球菌反应。根据本发明的SOMAmer可以类似抗体的方式使用。与抗体类似,SOMAmer提供靶标结合特异性。在本发明的一个方面,SOMAmer包含选自下列的核苷酸序列:SEQIDNO:15和SEQIDNO:16或其片段或与其具有至少80%同一性的序列,或在严格条件下与其杂交的序列。优选地,SOMAmer包含选自下列的核苷酸序列:SEQIDNO:1、SEQIDNO:2、SEQIDNO:3、SEQIDNO:4、SEQIDNO:5、SEQIDNO:6、SEQIDNO:7、SEQIDNO:8、SEQIDNO:9、SEQIDNO:10、SEQIDNO:11和SEQIDNO:12或其片段或与其具有至少80%同一性的序列,或在严格条件下与其杂交的序列。更优选地,SOMAmer包含选自下列的核苷酸序列:SEQIDNO:1、SEQIDNO:2、SEQIDNO:3、SEQIDNO:4、SEQIDNO:5、SEQIDNO:6、SEQIDNO:7、SEQIDNO:8、SEQIDNO:9、SEQIDNO:10、SEQIDNO:11和SEQIDNO:12。在本发明的非常优选的实施方案中,SOMAmer包含根据SEQIDNO:1或SEQIDNO:3的核苷酸序列。如本文所用的术语“片段”意指本文教导的适体序列的一部分,相比完整序列,其对目的靶标具有相同或更好的亲和力、特异性或功能活性。片段可以由约35个核苷酸(例如33-37个核苷酸)构成。优选地,片段具有与原始全长适体在该片段所代表的区域上相似的二级结构。本发明也涵盖了与本发明的核酸序列具有至少80%的序列同一性的序列的通途。在本上下文中,所采取的相似序列包括可能与目标序列(subjectsequence)具有至少80%、优选至少90%、更优选至少95或98%的同一性的核苷酸序列。通常,相似序列将包含与目标SOMAmer相同或相似的二级结构。在一个实施方案中,所采取的相似序列包括相比目标序列具有一个或若干个添加、缺失和/或置换的核苷酸序列。序列同一性比较可以通过肉眼,或更常用地,借助容易得到的序列比较程序进行。这些市售的计算机程序可以计算两个或更多个序列之间的%同一性。本发明也涵盖了与本发明的核酸序列互补的序列或能够杂交至本发明的序列或与其互补的序列的序列。如本文所用的术语“杂交”应当包括“核酸链与互补链通过碱基配对连接的方法”。杂交在严格条件下(例如,50℃和0.2xSSC{1xSSC=0.15MNaCl、0.015M柠檬酸钠pH7.0})进行。根据本发明,SOMAmer包含荧光标记。所述标记可连接到SOMAmer的5’或3’端。在优选的实施方案中,所述标记连接到SOMAmer的5’端。技术人员很清楚用于将荧光标记连接到核酸链的技术。这些方法中的任一种均可用于本发明以将荧光标记连接到SOMAmer,例如,如Schubert等人,1990,NucleicAcidsResearch18,3427所述。理论上,可以在寡核苷酸合成期间或之后连接荧光标记。荧光标记可以直接或间接连接到SOMAmer。对于间接连接而言,可以使用本领域技术人员已知的任何机制,如使用生物素和链霉亲和素或地高辛(DIG)和抗地高辛。合适的荧光标记由本领域技术人员根据不同的参数选择,如标记的大小和/或光学特性(如颜色、荧光激发波长、荧光发射波长和强度)。大量各种各样的荧光标记在市场上有售。合适的荧光标记的实例有:荧光素染料(如荧光素、6-FAM(6-羧基荧光素)、JOE、TET、HEX)、若丹明染料(如5’-四甲基若丹明、ROX、TRITC、X-若丹明、丽丝胺若丹明B)、花青染料(如Cy2、Cy3、Cy3B、Cy3.5、Cy5、Cy5.5、Cy7、IRD700、IRD800、别藻蓝蛋白(APC))、甲藻叶绿素(PerCP)、R-藻红蛋白(R-PE)、香豆素染料(如羟基香豆素、氨基香豆素、甲氧基香豆素)和量子点。另外的实例有:AlexaFluor®350、AlexaFluor®405、AlexaFluor®430、AlexaFluor®488、AlexaFluor®500、AlexaFluor®514、AlexaFluor®532、AlexaFluor®546、AlexaFluor®555、AlexaFluor®568、AlexaFluor®594、AlexaFluor®610、AlexaFluor®633、AlexaFluor®647、AlexaFluor®660、AlexaFluor®680、AlexaFluor®700、AlexaFluor®750、AlexaFluor®790、DyLight350、DyLight408、DyLight488、DyLight549、DyLight594、DyLight633、DyLight649、DyLight680、DyLight759、DyLight800、eFluor®660、CascadeBlue、PacificBlue、PacificOrange、LuciferYellow、NBD、Red613、TruRed、FluorX、BODIPY-FL、TexasRed。优选地,使用荧光素。根据本发明的方法涉及步骤a)将样品与包含荧光标记的经修饰的慢解离率的适体(SOMAmer)温育。这意味着将包含荧光标记的SOMAmer与样品混合并温育一段时间。通常,在使用SOMAmer通过基于荧光的检测方法进一步分析之前,将样品直接接种到缓冲液或生长培养液中(任选温育)。如果样品是固体样品,则可能有必要在加入缓冲液或生长培养液之后或期间进行均化(stomaching)。在另外的可选的实施方案中,用液体冲洗固体样品,并随后收集所述液体用于另外任选的在生长培养液中温育并用SOMAmer进一步分析。可选地,将SOMAmer与合适的缓冲液或与生长培养液混合,随后与样品混合。如果样品是固体样品,则可能有必要在加入包含SOMAmer的缓冲液/生长培养液之后或期间进行均质化。合适的缓冲液可以由本领域技术人员选择。其通常具有大于5而小于9的pH值,优选大于6而小于8,更优选在6.5到7.5之间。可用于本发明的方法中的缓冲液优选自磷酸缓冲液、磷酸盐缓冲生理盐水缓冲液(PBS)、2-氨基-2-羟甲基-1,3-丙二醇(TRIS)缓冲液、TRIS缓冲生理盐水缓冲液(TBS)和TRIS/EDTA(TE)。在本发明的一个实施方案中,所述缓冲液还包含MgCl2。MgCl2–如果存在-通常以0.005至3M之间、优选0.01至1M之间、更优选0.01至0.5M之间,例如25mM,的浓度存在。通常,大约0.07µmol/L的SOMAmer将足以检测样品中107个靶微生物的细胞。在优选的实施方案中,使用0.01至10µmol/l缓冲液的SOMAmer浓度。温育通常在16℃至30℃的温度、优选18℃至28℃的温度、更优选室温下进行。通常,温育时间周期在1至60分钟、优选5至30分钟。根据本发明所用的SOMAmer的浓度可以由本领域技术人员确定。任选地,根据本发明的方法可涉及洗涤样品的步骤。在此步骤期间,可以在检测结合态SOMAmer的存在之前,洗脱任何未结合的SOMAmer。通常,洗涤意指将样品离心并将团块重悬浮于缓冲液中。所述洗涤步骤可以进行一次或重复若干次,例如两次、3次或4次。在根据本发明的步骤c)中,通过基于荧光的检测方法分析样品。基于荧光的检测方法优选自:流式细胞术、固相式细胞术、基于荧光的分析方法和荧光成像系统(如荧光显微术)。流式细胞术是一种分析方法,其允许测量由发光的单个细胞所散射的光和所产生的荧光发射。通常,将待分析的细胞或颗粒悬浮于液体中并单独通过激光束。通过检测器收集每个颗粒的散射光(与颗粒大小和复杂性有关)和荧光发射(由于对靶颗粒/细胞的荧光标记)并发送至计算机。由于每个颗粒或细胞是分别调查的,所以结果代表了累积的个体细胞特征(Álvarez-Barrientos等人2000,ClinMicrobiolRev,13(2):167–195)。将可含有靶分析物的样品与用合适的荧光分子标记的对该靶分析物特异的试剂(例如,根据本发明的SOMAmer)混合。在施加恰当的结合条件及任选的洗涤步骤之后,然后通过流式细胞仪处理经标记的样品:细胞单独地通过激光束并分析所得散射光和荧光信号以收集与该靶分析物(例如细胞)有关的信息。荧光成像系统提供了被观察对象(例如单个细胞、微菌落)的图像,所述图像是使用由荧光现象发射的光所形成的(Barrett和Myers2003,FoundationsofImageScience.InWileySeriesinpureandAppliedOpticsed.SalehB.E.A.USA,NewJersey,Hoboken:JohnWiley&Sons,Inc)。荧光显微术是荧光成像系统的一个实例,其中被成像的特征很小并通过光学放大获得。将可能含有靶分析物的样品与用合适的荧光分子标记的对该靶分析物特异的试剂(例如SOMAmer)混合。在施加恰当的结合条件及任选的洗涤步骤之后,将经标记的样品置于显微镜的物镜下。设置显微镜的参数以匹配荧光标记的特性。固相式细胞术是用于检测固体表面上单个颗粒/细胞的方法。通常,固相式细胞术是在膜上实现的。基于图像的定量系统将结合任何选定标记在膜上的定位提供其数量、大小和形状。将可能含有靶分析物的样品通过具有适当孔径(即对于细菌而言,0.4μm)的黑膜过滤器(例如聚酯或聚碳酸酯)过滤。然后,将保留下来的细胞用经合适的荧光分子标记的对该靶分析物特异的试剂(例如SOMAmer)标记。随后用激光扫描所述过滤器,所述激光允许膜上的荧光事件(例如经标记的微生物)被一系列检测单元所检测到。这使得能够对膜上的靶分析物进行检测和计数(Reynolds和Fricker1999,JApplMicrobiol86,785–795;Vanhee等人2009,NatProtoc4,224-231)。基于荧光的分析方法是测量荧光信号总量的方法,其用于检测和/或测量已经合适的荧光标签标记的靶分析物的量(Skoog等人2007,PrinciplesofInstrumentalAnalysis,第六版,USA,California,Belmont:Brooks/Cole)。此类方法可以在各种载体(例如微板、管、微管、微流体装置)上实施。将可能含有靶分析物的样品与用合适的荧光分子标记的对该靶分析物特异的试剂(例如SOMAmer)混合。在施加恰当的结合条件及任选的洗涤步骤之后,将装有经标记的样品的容器(例如微孔板、小管)暴露于特定波长以恰当地激发荧光染料。通过恰当的光传感器收集(作为靶分析物与荧光试剂结合的结果而发生的)荧光发射。通过传感器对此荧光量进行定量并就与参考数据的相关性进行了处理以提供对分析物的量度。任何荧光分子均可以用于任何基于荧光的检测方法。对于给定的检测方法而言,关键的要求在于适合于所选荧光分子的激发源以及荧光检测器的可用性。用于荧光检测(合适的荧光标记)的波长组合的实例:-激发:488nm(蓝色激光)+发射:530nm(荧光素、AlexaFluor®488)、585nm(R-藻红蛋白–R-PE)以及>670nm(甲藻叶绿素-PerCP)-激发:532-561nm(绿色和黄/绿色激光)+发射:560(AlexaFluor®532)、585(R-PE-R-藻红蛋白)-激发:635nm(红色激光)+发射:660nm(别藻蓝蛋白–APC/花青5–Cy5/eFluor®660/AlexaFluor®647)。根据本发明的方法相比使用抗体提供了若干优点:-在溶液中优越的热稳定性-更低的分子量-更高的多路复用能力-对热、干燥和溶剂的化学稳定性-可逆复性-易于试剂生产-一致的批次间表现-更低的成本。本发明还涉及包含荧光标记的经修饰的慢解离率的适体(SOMAmer),其中所述SOMAmer包含对金黄色葡萄球菌特异的核苷酸序列。如上所述定义了SOMAmer、荧光标记及其优选的实施方案。因此,在另一个方面,本发明涉及包含荧光标记的SOMAmer,其特征在于,所述SOMAmer包含选自下列的核苷酸序列:SEQIDNO:15和SEQIDNO:16或其片段或与其具有至少80%同一性的序列,或在严格条件下与其杂交的序列。在另一个方面,本发明涉及包含荧光标记的SOMAmer,其特征在于,所述SOMAmer包含选自下列的核苷酸序列:SEQIDNO:1、SEQIDNO:2、SEQIDNO:3、SEQIDNO:4、SEQIDNO:5、SEQIDNO:6、SEQIDNO:7、SEQIDNO:8、SEQIDNO:9、SEQIDNO:10、SEQIDNO:11和SEQIDNO:12或其片段或与其具有至少80%同一性的序列,或在严格条件下与其杂交的序列。在另外的方面,本发明涉及包含荧光标记的SOMAmer,其特征在于,所述SOMAmer包含根据SEQIDNO:1或SEQIDNO:3的核苷酸序列。在另外的方面,本发明涉及如上文所定义的包含荧光标记的SOMAmer在检测样品中金黄色葡萄球菌细胞上的用途。根据本发明的SOMAmer可以被固定在(例如结合或粘附于)基底或载体(例如微载体)上。本发明也涉及包含至少一种如上所述包含荧光标记的SOMAmer的微阵列或生物传感器。生物传感器是用于检测靶分析物的分析装置,其将生物应答转化成电信号。生物传感器的应用使用生物识别元件(如酶、抗体和核酸)以检测靶分子。通常的生物传感器含有三个组件:可以识别或结合分析物的生物传感元件、将检测事件转化成可测量信号的转导元件以及将信号转化成数字格式的显示器。传感元件主要限定生物传感器的选择性和灵敏度。检测分析物通常是基于用电子读数或光学读数传感分析物。根据本发明的包含荧光标记的SOMAmer可以用作生物传感器应用中的生物元件。在另外的实施方案中,本发明涉及包括至少一种如上文定义的包含荧光标记的SOMAmer的试剂盒。根据本发明的试剂盒可以是快速检测试剂盒。所述试剂盒可以例如包括i)至少一种(如2、3或4种)根据本发明的包含荧光标记的SOMAmer以及ii)如何使用所述SOMAmer的说明书。附图说明图1:在用不同浓度的经荧光标记的4520-8(SEQIDNO:3)和4531-56(SEQIDNO:1)SpASOMAmer染色107个细胞(15分钟的结合反应)后,通过流式细胞术检测金黄色葡萄球菌。(a)于不同SOMAmer浓度(n=3)下获得的平均荧光强度(柱)和经染色细胞的百分比(线)的图示。灰色柱:使用4520-8(SEQIDNO:3)时的平均荧光强度,黑色柱:使用4531-56(SEQIDNO:1)时的平均荧光强度。黑线:使用4520-8(SEQIDNO:3)或4531-56(SEQIDNO:1)时的经染色细胞的百分比(同一数据)。(b)使用4531-56(SEQIDNO:1)SpASOMAmer时获得的流式细胞术结果的实例。黑色区域:未染色的细胞群体;用0.07µmoll-1(浅灰色)、0.7µmoll-1(深灰色)和7µmoll-1(黑色实线)染色的细胞群体。设置M1和M2区间以将对照未染色细胞的荧光信号(自体荧光)包括在M1中。因此,位于M2区间中的细胞群体被视为已染色的。图2:在用7µmoll-1的经荧光标记的4531-56(SEQIDNO:1)SpASOMAmer染色107个细胞后,通过流式细胞术检测金黄色葡萄球菌。比较不同的染色时间(n=3)。平均荧光强度以柱表示而经染色细胞的百分比以线图表示。图3:在用0.7µM的经荧光标记的4531-56(SEQIDNO:1)SpASOMAmer染色107个细胞后,通过流式细胞术检测金黄色葡萄球菌。比较不同的染色时间(n=3)。相比经过5分钟的染色温育所获得的强度,使用30分钟的染色温育,平均荧光强度提高了1.4倍。实施例:实施例1:纯化金黄色葡萄球菌靶标用表1中所示的引物从金黄色葡萄球菌NRS384(USA300)的基因组DNA中PCR扩增编码所需靶标或靶域的基因的相关部分,并将其克隆到pCR-ScriptSK+(Stratgene)中。将clfA基因以BamHI-SacI盒的形式转移到表达载体pET-51b(EMD-Novagen)中,所述载体内含氨基末端Strep标签和羧基末端His10标签。对质粒测序以验证基因的身份以及所克隆的DNA片段与载体编码的His标签和Strep标签的序列的正确基因融合。表1:扩增和克隆编码金黄色葡萄球菌细胞表面蛋白的基因在大肠杆菌BL21(DE3)或BL21(DE3)/pLysE(EMD/Novagen)中过表达重组蛋白。相对于生长温度(25-37℃)和诱导时间(4-15h)优化了可溶性蛋白的最佳表达条件。将来自0.1-0.8L培养物的细胞用10mLBugBuster/核酸酶试剂(EMDMillipore)裂解。依序通过Ni-NTA琼脂糖和Strep•Tactin®Superflow™琼脂糖(EMDMillipore)的亲和力层析,将重组的、经His10/Strep标签的蛋白质从可溶性级分中纯化出来。天然的葡萄球菌蛋白质A购自VWR并且用NHS-PEG4-生物素(PierceBiotechnology)进行了生物素酰化。使用QuickStartBradford蛋白质测定试剂盒(BioRad)测定了蛋白质浓度。实施例2:选择SOMAmer将分别使用5-苄基氨羰基-dU(BndU)、5-萘基甲基氨羰基-dU(NapdU)和5-色氨羰基-dU(TrpdU)的文库用于使用金黄色葡萄球菌蛋白质的SELEX。每次选择均从1nmol(1014-1015)含有40个连续随机化位置的序列(其侧接PCR扩增所需的固定序列)开始。SELEX基本上如(Gold等人2010,PLoSOne5:e15004;Ochsner等人2013,DiagnMicrobiolInfectDis.;Vaught等人2010,JAmChemSoc132:4141-4151)所述进行。在整个SELEX及随后的结合测定中使用缓冲液SB18T,其由40mMHEPESpH7.5、0.1MNaCl、5mMKCl、5mMMgCl2和0.05%Tween-20组成。进行了八轮选择,并且从第2轮开始,用10mM硫酸葡聚糖进行动力学挑战以利于慢解离率。用顺磁性TalonDynabeads®Talon®(Invitrogen)(其结合重组蛋白上的His10标签)或用MyOne链亲和素C1微珠(LifeTechnologies)(针对经生物素酰化的SpA)实现SOMAmer–靶标复合物的分配。将选定的序列从与微珠结合的靶标上用80µl40mMNaOH洗脱,用20µl160mMHCl中和并用KODEXDNA聚合酶(Invitrogen-LifeTechnologies)进行PCR扩增。用KODEXDNA聚合酶通过从PCR产物的反义链引物延伸制备了用于下一轮的经修饰的DNA并纯化,如(Gold等人,2010)中所述。对从第3到8轮中选定的DNA的DNA再结合动力学分析(C0t)被用于评估后几轮期间的序列趋同性,指示出一些序列或序列家族的增加的丰度。克隆在溶液结合放射性测试(见下)中表现出良好亲和力(Kd≤10nM)的SOMAmer池并确定48个克隆/池的序列。根据序列模式和多样性选择单个的SOMAmer并采用酶法制备以用于进一步表征。通过标准亚磷酰胺化学法以1µmol的规模制备48-50聚体形式的合成SOMAmer并经过HPLC纯化。其含有5’生物素-dA或5’荧光素-生物素-dA以及在3’端倒置的dT核苷酸(3’idT)以增加针对3’至5’核酸外切酶的稳定性。实施例3:SOMAmer平衡和全细胞放射性标记结合测定在结合测定前,通过在95℃加热5min使SOMAmer适当地折叠,接着经过10-15min时间段冷却至室温。在经放射性标记的SOMAmer(10-20pM)与连续稀释的蛋白质(0.001-100nM)的平衡溶液结合测定中确定亲和力(Kd)并将ZorbaxPSM-300A(AgilentTechnologies)树脂用于分配至过滤平板上,如(Gold等人2010)中所述。在克隆前,也使用表皮葡萄球菌(S.epidermidis)、溶血性链球菌(S.hemolyticus)、化脓性链球菌(S.pyogenes)、粪肠球菌(E.faecalis)、大肠杆菌和铜绿假单胞菌作为对照,在2h的平衡结合测定中测试了SOMAmer池对金黄色葡萄球菌的特异性结合。细胞密度在105–108CFU/mL的范围内,并且向结合缓冲液中加入了0.1mM硫酸葡聚糖和0.35MNaCl以减少非特异性背景。另外,针对与八种不同金黄色葡萄球菌的结合对单个的核酸适体进行筛选,所述金黄色葡萄球菌属于不同的谱系,包括:NRS382、NRS383、NRS384、NRS123、NRS385、NRS386、NRS103(NARSA和ATCC29213(ATCC)。结果:池亲和力测定确认,针对用经BndU、NapdU或TrpU修饰的ssDNA获得的总共22个池,成功选择了SOMAmer,而池亲和力在0.13-8.90nM的范围内。观察到了对金黄色葡萄球菌的特异性结合,但未观察到对表皮葡萄球菌、溶血性链球菌、化脓性链球菌、粪肠球菌、大肠杆菌或铜绿假单胞菌的结合。针对来自每个池的各48个克隆所确定的序列的比对示出了共享相同序列模式的多拷贝克隆和家族。在亲和力测定中筛选了代表性的克隆,而最佳SOMAmer的Kd在0.03-2.17nM的范围内(表2)。表2:用于金黄色葡萄球菌表面蛋白的SOMAmer试剂,显示了针对在SELEX中获得的原始全长序列的亲和力(Kd)SOMAmer对经纯化的金黄色葡萄球菌蛋白质的结合亲和力与所观察到的对全细菌的结合有良好的相关性。一个SpA-NapdU克隆(4520-8;SEQIDNO:3)和一个tSpA-TrpdU克隆(4531-56;SEQIDNO:1)能够结合所有经测试的金黄色葡萄球菌的全细胞,其在放射性标记过滤结合测定中的检测极限为~104个细胞/孔(105–106个细胞/mL)。未观察到对表皮葡萄球菌或乙型链球菌的结合,指示出这些SOMAmer良好的特异性。对于ClfASOMAmer而言,观察到了类似的结合特性。SOMAmer的序列列于表3中。表3:SOMAmer的序列:表3中所提供的序列的“T”核苷酸是经C-5修饰的嘧啶。更具体地讲,靶向SpA蛋白的SOMAmer的“T”核苷酸是NapdUTP(或NapdU)核苷酸,而靶向ClfA蛋白的SOMAmer的“T”核苷酸是BndUTP(或BndU)核苷酸。另外,结合SpA蛋白的适体序列基序(4520)由以下序列表示:GGCWWCGGGWACCWAWWAWNGGWWWAGCC(N)nGWC(SEQIDNO:15),其中所述序列中的“W”表示可能由经C-5修饰的嘧啶所占据的位置,而其中所述序列中的“N”表示可能由任何未修饰或经修饰的核苷酸所占据的位置,并且n为0到2(或0、1或2)。优选地,所述经C-5修饰的嘧啶为NapdU或BndU。更优选地,所述经C-5修饰的嘧啶为NapdU。结合ClfA蛋白的适体序列基序(4503)由以下序列表示:AWCWGGWC(N)nAWCWGGWWWWWAAG(SEQIDNO:16),其中所述序列中的“W”表示可能由经C-5修饰的嘧啶所占据的位置,而其中所述序列中的“N”表示可能由任何未修饰或经修饰的核苷酸所占据的位置。另外,n可以是从1到30(或1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30)或从2到20(或2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20)或从5到18(或5、6、7、8、9、10、11、12、13、14、15、16、17或18)或从10到16(或10、11、12、13、14、15或16)的数。优选地,n为16。优选地,所述经C-5修饰的嘧啶为NapdU或BndU。更优选地,所述经C-5修饰的嘧啶为BndU。实施例4:通过流式细胞术检测金黄色葡萄球菌细胞如上所述以含有5’ABflT(生物素和荧光素)的48聚体的形式合成了针对蛋白质A(SpA)的SOMAmer,用于流式细胞术实验。确认了以下的活性:4520-8(SEQIDNO:3)(Kd=0.17nM)和4531-56(SEQIDNO:1)(Kd=0.09nM)。在胰酶大豆肉汤(TrypcaseSoyBroth,TSB;bioMérieux,Craponne,France)中用冷冻保存的金黄色葡萄球菌DSM1104(或ATCC25923)培养物接种并在32.5℃摇动温育过夜。然后将过夜培养物在新鲜TSB中于32.5℃摇动继代培养直至工作培养物的OD600达到0.8(大约108细菌ml-1)并分成大约107个细胞/管的等分试样。通过在10000g离心2min收获细菌。将团块重悬浮于含有SOMAmer(浓度范围0.07–7µmoll-1)的100µlPBS/25mmoll-1MgCl2中。在室温下温育5、15或30min之后,将细菌在10000g离心2min并将团块用PBS/25mmoll-1MgCl2重悬浮。将此洗涤步骤重复两次。依照相同的程序(不加入SOMAmer)制备了未染色细菌作为对照。然后通过流式细胞术分析了未染色和已染色的细菌。所有实验均用配备了在488nm发射的风冷15mW氩离子激光的FACSCalibur™流式细胞仪(BectonDickinsonBiosciences;LePontdeClaix,France)进行。在FL1通道(530±30nm)中以对数信号的形式收集绿色荧光。在这些测定中确定了作为SOMAmer结合结果产生的平均荧光强度和荧光细胞(在限定的门中,n=10000)百分比。使用BDCellQuest™软件(BectonDickinsonBiosciences)分析来自FACSCalibur™的数据。结果:经荧光标记的SpASOMAmer4520-8(SEQIDNO:3)和4531-56(SEQIDNO:1)被用于评估其通过流式细胞术检测金黄色葡萄球菌的效率。两种SOMAmer在对全金黄色葡萄球菌细胞染色上均表现良好。虽然100%的所述细胞在0.07µmoll-1的低SpASOMAmer浓度下均已经被染色,但是在0.7µmoll-1和7µmoll-1的更高的试剂浓度下,平均荧光强度大幅增加(图1a)。此数据与当高度丰富的细胞表面组分被经荧光标记的SOMAmer饱和时所预期的增加是一致的。确保通过流式细胞术精确区分阴性群体(未染色细胞)和阳性群体(已染色细胞)的SpASOMAmer的最低浓度可以设为0.07µmoll-1(图1b)。为了确定最佳结合时间,进行了时程测定。在存在7µmoll-1SpASOMAmer的情况下,经过仅5-min的结合反应之后,100%的细胞均已经被染色(图2)。通过将结合时间增加至15和30分钟,荧光强度分别提高了约2倍和3倍,导致更好地区分阴性群体和阳性群体。当用更低的SpASOMAmer浓度(0.7µmoll-1)标记细胞时,荧光强度的这种增加不太明显,可能是由于限制了SOMAmer浓度(图3)。所开发的SpASOMAmer经证实对金黄色葡萄球菌具有高染色效率。在实验条件中,通过流式细胞术对金黄色葡萄球菌的最佳检测是在使用低试剂浓度(0.7µmoll-1)和短结合时间(15min)的简单的一步程序中实现的。已经报道了用于使用单个或组合适体的基于流式细胞术的金黄色葡萄球菌检测的DNA适体(Cao等人2009)或用于使用由全细胞SELEX生成的适体检测鼠伤寒沙门氏菌的DNA适体(Dwivedi等人2013)。然而,在这些研究中获得的经适体标记的细胞的百分比未接近100%并且荧光强度相比用本发明的SOMAmer所获得的荧光强度更弱。实施例5:比较根据本发明的SOMAmer与标准适体由于根据本发明的SOMAmer独特的慢解离率特征,相比标准RNA或DNA适体,这些试剂应当具有更好的亲和力和更好的动力学特性。为了证明这一论断,将根据本发明的SpASOMAmer与对金黄色葡萄球菌特异的DNA适体(未知靶抗原)进行了比较。所述DNA适体由IntegratedDNATechnologies制备。本发明的适体和标准适体的方案均与实施例4中所述的相同(标准适体的不同之处:在测定前不加热适体;PBS用作结合缓冲液)。由金黄色葡萄球菌DSM1104所获得的流式细胞术结果:结合剂浓度结合时间已染色细胞的百分比平均荧光强度SOMAmer(4531-56;(SEQIDNO:1))0.7µmoll-15min100%331标准适体159µmoll-160min90%265在60-min的结合时间之后,由159µmoll-1的标准适体所获得的已染色细胞的百分比没有达到100%。而使用0.7µmoll-1的本发明的SOMAmer,在仅5分钟后就使100%的细胞染色。此结果证明,根据本发明的SOMAmer即使在其浓度比标准DNA适体低200倍的情况下,其结合效率依然更好。此实验证明了根据本发明的SOMAmer的慢解离率特征在金黄色葡萄球菌的流式细胞术检测上的益处:可以用更低的试剂浓度在非常短的时限内实现更高的结合/检测效率。序列表<110>MerckPatentGmbH,SOMAlogicInc<120>通过基于荧光的检测方法检测样品中微生物的方法<130>I14/041<160>16<170>PatentIn版本3.5<210>1<211>39<212>DNA<213>人工序列<220><223>SOMAmer:靶标SpA<220><221>t<222>(1)..(1)<223>经C-5修饰的嘧啶<400>1gctcgagttaattcgggatcgggctccggcttttcgaat39<210>2<211>40<212>DNA<213>人工序列<220><223>SOMAmer:靶标SpA<220><221>t<222>(1)..(1)<223>经C-5修饰的嘧啶<400>2ccggcttcgggtacctattatcggtttagcccagtcataa40<210>3<211>40<212>DNA<213>人工序列<220><223>SOMAmer:靶标SpA<220><221>t<222>(1)..(1)<223>经C-5修饰的嘧啶<400>3tcggcttcgggtacctattatcggtttagcccagtcagaa40<210>4<211>40<212>DNA<213>人工序列<220><223>SOMAmer:靶标SpA<220><221>t<222>(1)..(1)<223>经C-5修饰的嘧啶<400>4gcggcttcgggtacctattatcggtttagcccagtcaaaa40<210>5<211>40<212>DNA<213>人工序列<220><223>SOMAmer:靶标SpA<220><221>t<222>(1)..(1)<223>经C-5修饰的嘧啶<400>5gtggcttcgggtacctattatcggtttagcccagtcagaa40<210>6<211>40<212>DNA<213>人工序列<220><223>SOMAmer:靶标SpA<220><221>t<222>(1)..(1)<223>经C-5修饰的嘧啶<400>6gcggcttcgggtacctattatcggtttagccctgtcagga40<210>7<211>48<212>DNA<213>人工序列<220><223>SOMAmer:靶标:SpA<220><221>t<222>(1)..(1)<223>经C-5修饰的嘧啶<400>7gtgatcgagcggcttcgggtacctattattggtttagcccagtcagaa48<210>8<211>40<212>DNA<213>人工序列<220><223>SOMAmer:靶标SpA<220><221>t<222>(1)..(1)<223>经C-5修饰的嘧啶<400>8tcggcttcgggtacctattatcggtttagcccagtctgaa40<210>9<211>39<212>DNA<213>人工序列<220><223>SOMAmer:靶标SpA<220><221>t<222>(1)..(1)<223>经C-5修饰的嘧啶<400>9acggcttcgggtacctattatcggtttagccagtcagaa39<210>10<211>40<212>DNA<213>人工序列<220><223>SOMAmer:靶标ClfA<220><221>t<222>(1)..(1)<223>经C-5修饰的嘧啶<400>10atctggttcaaagtgacgattgggcatctggtttttaagt40<210>11<211>40<212>DNA<213>人工序列<220><223>SOMAmer:靶标ClfA<220><221>t<222>(1)..(1)<223>经C-5修饰的嘧啶<400>11atctggttctaagttacttggcgtaatctggtttttaaga40<210>12<211>40<212>DNA<213>人工序列<220><223>SOMAmer:靶标ClfA<220><221>t<222>(1)..(1)<223>经C-5修饰的嘧啶<400>12atctggttcaaagtggcgattgggcatctggtttttaagt40<210>13<211>25<212>DNA<213>人工序列<220><223>引物序列clfA-3<400>13cggatccagtagctgcagatgcacc25<210>14<211>26<212>DNA<213>人工序列<220><223>引物序列clfA-4<400>14cgagctcgctcatcaggttgttcagg26<210>15<211>34<212>DNA<213>人工序列<220><223>结合SpA的SOMAmer<220><221>n<222>(1)..(1)<223>没有核苷酸或任何未修饰或经修饰的核苷酸<220><221>W<222>(1)..(1)<223>经C-5修饰的嘧啶<220><221>misc_feature<222>(20)..(20)<223>n为a、c、g或t<220><221>misc_feature<222>(30)..(31)<223>n为a、c、g或t<400>15ggcwwcgggwaccwawwawnggwwwagccnngwc34<210>16<211>23<212>DNA<213>人工序列<220><223>结合ClfA的SOMAmer<220><221>W<222>(1)..(1)<223>经C-5修饰的嘧啶<220><221>n<222>(1)..(1)<223>1到30个未修饰或经修饰的核苷酸<220><221>misc_feature<222>(9)..(9)<223>n为a、c、g或t<400>16awcwggwcnawcwggwwwwwaag23当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1