通过不对称扩增确定初始模板浓度的定量方法与流程
本发明涉及用于在核酸扩增反应中定量核酸的方法。
发明背景
定量PCR的一个需要是准确确定给定样品中起始模板的拷贝数,这通常通过测量未知物的扩增的循环阈值(CT;即,为了增加超过预确定的阈值的测量的荧光的循环数)和将此返回与已知拷贝数的标准曲线相比来实现。较低的CT表示更大的起始模板量。通常将CT为确定扩增反应从基线转换为指数扩增阶段的点。
然而,就诊断仪器来说使用标准曲线是困难的,其中通常不方便运行该曲线。此外,标准曲线在反应和反应之间可能不同,取决于反应条件,样品中某些离子的存在等,因此考虑最好的实践是使用对于每个反应产生的独立的标准曲线。对于诊断测定,并且更特别是在通常依赖于单个反应的护理装置的情况下,这显然是不切实际的。
已知使用测定扩增内部的充分表征的扩增,测量与已知度量的偏差;这也基于来自实时数据的CT测量。然而,这不总是方便的,因为内部对照可能与反应成分竞争,降低检测极限和牺牲灵敏度。
对与诊断仪器相兼容的改善的定量方法存在需求。我们描述了一种方法,其提供定量度量,作为相同扩增反应的部分,其还允许使用解链曲线分析来降低反应的复杂性,从单个扩增提供定量和基因分型信息。
发明概述
根据本发明,提供在核酸扩增反应中定量核酸的方法,所述方法包括:
提供模板核酸和第一和第二扩增引物,其中所述第一引物以有限的量存在;
在合适的条件下进行不对称核酸扩增反应,从而在反应的初始阶段产生双链核酸产物,并且一旦限制性引物(limiting primer)耗尽,在反应的后续阶段产生单链核酸产物;
提供对所述单链核酸产物特异的探针,并让所述探针与单链产物杂交;
一旦反应进入后续阶段,通过解链曲线分析的方式检测产生的双链核酸产物和单链核酸产物的相对量;
确定双链产物峰高度与单链产物峰高度的比例是否小于1;并且
如果所述比例小于1,则基于双链产物峰高度与单链产物峰高度的比例定量起始模板的量。
优选地,所述核酸是DNA或cDNA。
不对称PCR具有两个不同的阶段。在第一指数期,产物经连续循环以指数倍增。随着限制性引物耗尽,扩增过渡为产生单链扩增子的阶段。
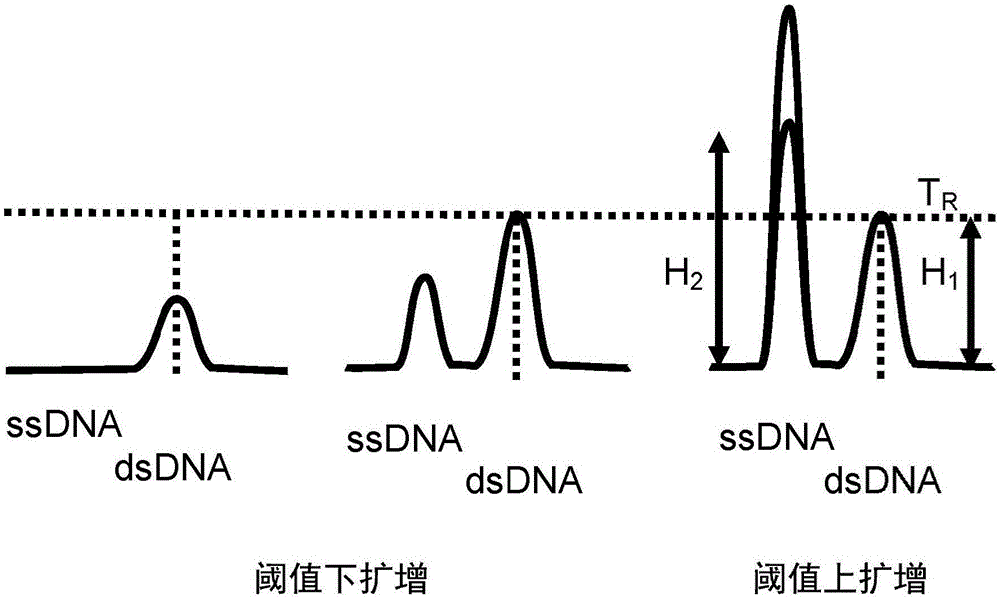
扩增结束时的解链曲线分析允许检测单链产物和双链核酸的量,从而允许产生两个检测峰。一个峰反映作为在指数期间形成的双链的双链体的部分并入的限制性引物,并且由于结合作为线性期的部分形成的单链DNA的探针确定一个峰。线性期后确定的单链峰的高度与起始模板的量成比例。由于上述的混杂的因素,这单独不提供足够的数据以定量起始模板。然而,因为双链产物的量有限(由限制性引物与过量引物的比例限定),双链产物的最大量在从指数期到线性期的过渡处达到阈值,并且不增加超过它。过渡期后,对于要结合的探针存在增加量的单链模板,并且存在因此增加的第二峰(其高度与起始模板量成比例)。双链峰因此用作限定的校准物或参比物,由此测量单链产物的高度。
dsDNA峰也可以用作用于第二峰的接受或拒绝阈值,原因在于其高度仅可以达到最大阈值,并且其还可以用作已知的定量标志物以测量成比例的ssDNA峰高度。即,如果确定的dsDNA与ssDNA的比例小于1,则这是扩增已经达到阈值的指示;该比例可以用作CT的替代物。如果dsDNA与ssDNA的比例大于1,则扩增未达到过渡阈值,并且结果不能可信地用于定量起始模板。因此,如果所述比例大于1,则该方法可以进一步包括放弃反应。备选地,该方法可以进一步包括继续反应直到所述比例小于1。
可以将单链产物的量相对双链产物的量校准化;即,双链产物的量可以预确定(例如,通过使用预确定量的限制性引物),并且该已知测量值用于基于双链与单链产物的比例确定单链产物的量。
双链和单链产物的量通过解链曲线分析来检测。在优选的实施方案中,使用可检测标签;例如,为了检测双链产物,可以使用优先结合双链核酸的荧光染料。优选的这样的染料是Green或相关染料。
在其他实施方案中,限制性引物本身可以用可检测标签标记;这允许引物结合到要检测和区分的双链产物中。合适的染料可以是荧光标签,如6-FAM。
单链产物通过对产物内的靶序列特异的探针的方式检测。最初探针可以存在于扩增反应内,或可以在扩增之后加入。可以检测探针的存在,并且因此通过探针从产物的结合或解离的解链曲线分析确定单链产物的量。可以标记探针,例如用荧光标签标记,或可以使用对双链DNA特异的染料检测杂交。在优选的实施方案中,标签或染料提供与用于检测双链产物的标签或染料不同的信号。
所述方法可以进一步包括预确定限制性引物的量,以提供预确定的双链DNA的量的步骤。这可以基于要进行的反应选择,并且可以选择以提供所需程度的对反应的敏感性。例如,在低于限定的拷贝数,仅产生dsDNA,因此可以选择限制性引物的量以给出1∶15至1∶5的dsDNA与ssDNA比例;这保证产物的比例在限定的范围内,由此改善方法的灵敏度并且将峰高度调至特定阈值。
在本发明的某些实施方案中,对单链产物特异的探针可以是可以用于区分靶序列的等位基因的探针;例如,存在于起始模板中的特定基因的等位基因。例如,探针可以是如国际专利公开WO2012/093262中所述的那样,其内容通过参考结合于本文。该公开描述了利用与具有不同解链温度的突变体和野生型等位基因杂交的探针,使用探针作为阻断探针以优先扩增基因座的突变体等位基因。相似的探针可以用于本方法,以区别靶基因的等位基因。以此方式,本方法可以不仅定量起始模板,而且用于对模板基因分型。在该实施方案中,探针以比其与第二等位基因杂交所用的解链温度低的解链温度(Tm)与第一等位基因杂交;引物在寡核苷酸探针结合位点侧面的第一和第二位点处与样品中的核酸杂交;其中引物:样品的Tm高于探针:第一等位基因的Tm;并且所述方法包括以下步骤:将反应混合物维持在探针:第一等位基因Tm和探针:第二等位基因Tm之间的温度,从而探针优先与第二等位基因杂交;对反应混合物进行热循环扩增,该扩增包括解链阶段、退火阶段和延伸阶段,其中延伸和退火阶段的温度在探针:第一等位基因Tm和探针:第二等位基因Tm之间,从而探针在这些阶段与第二等位基因杂交;由此扩增第一等位基因;并且探针与样品的杂交在为或低于探针:第一等位基因Tm的温度,和在为或低于探针:第二等位基因Tm的较高温度检测。
在本发明的进一步实施方案中,探针可以是接头探针,如国际申请WO2013/041853中所述的,其内容通过参考结合于本文。该申请描述了使用具有由接头核酸序列分开的锚区域和报告区域的探针,所述锚区域和报告区域具有不相关的解链温度。该探针也可以用于进行靶点的基因分型,其中报告区域设计为当与野生型和突变体等位基因序列杂交时,具有第一和第二解链温度。
附图简述
现在将仅通过实施例和参考附图来描述本发明的这些和其他方面,其中:
图1显示不对称PCR的指数和线性扩增阶段中DNA的量的示意图;
图2显示来自样品反应的单链和双链DNA的相对峰高度;
图3显示对样品中的结核分枝杆菌(Mycobacterium tuberculosis)进行的样品测定的结果;和
图4至7显示对丙型肝炎病毒(HCV)进行的样品测定的结果。
附图详述
首先参考图1,这显示不对称PCR扩增反应中DNA量的示意图。该反应包括模板,以及第一和第二引物,第一引物以有限的量存在。在最初指数阶段,两种引物都以足够量存在以允许在连续循环中倍增产物,并产生双链DNA。一旦限制性引物耗尽,反应过渡到线性阶段,其中产生单链扩增子,其以线性增加而不是指数增加。
如果将限制性引物使用荧光团标记,或如果使用双链特异性染料如Green,则双链产物的量可以容易地使用解链曲线分析进行定量。加入用于单链产物的分开的探针-例如,使用第二荧光团标记-也可以用于定量单链产物。探针可以存在于反应混合物中,或可以在扩增后加入。此外,以不同特异性与不同靶序列杂交的探针的使用可以用于进一步分析单链产物。例如,单链产物可以通过解链曲线分析测定以区分不同基因型。
双链产物的量由限制性引物的量限制,从而双链产物的最大量是已知的。这允许双链产物用于校准确定量的单链产物,或作为参考值以在解链曲线分析期间由测量的峰高度确定单链产物的量。
引物标记的产物也可以用于产生CT值,其用作对反应的核对;此外,线性期之后单链产物的荧光与起始模板的量成比例。
然而,因为双链产物受限制性引物的量限制,这也可以用于核对反应的量和作为内部对照。如图2中所示,反应将产生双链产物直至最大量。在随后的扩增循环中该量将不增加,而单链产物不这样受限,并且因此继续增加。因此扩增可以进行,直到其到线性期,并且可以确定产生的核酸的相对量(例如,通过在荧光解链曲线分析中确定峰高度)。dsDNA峰可以用作对于ssDNA峰的接受或放弃阈值-如果峰的比例小于1(即,存在比dsDNA多的ssDNA),则反应已经经过过渡阶段并且ssDNA的量可以认为与起始模板成比例。
相反,如果峰的比例大于1(存在比ssDNA多的dsDNA),则反应还没有经过过渡阶段,并且不能认为ssDNA的量与起始模板直接成比例。在该情况下,因为已经失败,放弃测定。备选地,可以继续反应,直到峰比例小于1。
以此方式,H1(dsDNA峰的高度)与H2(ssDNA峰的高度)的比例的测量都给予内部控制以保证反应完成,并且如果dsDNA的峰量已知,可以用作已知量标签。这可以给出起始模板量的绝对值以及相对定量。同样,H1(dsDNA)的绝对值可以用于确定反应是否完成。
该方法的实例在图3中显示。使用结核分枝杆菌作为模型系统,将一个引物标记,用FAM-T替代两个T,并且另一个引物未标记。使用对扩增的序列特异的探针来检测扩增。
反应条件以及探针和引物如英国专利申请GB1317355.4中所用的。简言之,合成两种接头探针,覆盖跨MTB rpoB基因的密码子507-520和520-533的90bp区域。使用氰基乙基亚磷酰胺方法制备寡核苷酸。在每个探针中探针的两个报告结构域由接头连接。每个探针的3’端包括阻断基团。注意,两个接头探针覆盖基因组序列的毗邻区。探针序列是:
rpoB(507>520)连接的-探针
(5′>3′)
(SEQ ID NO 1)
rpoB(520>533)连接的-探针
(5′>3′)
(SEQ ID NO 2)
1=荧光素dT
2=磷酸区块
3=三甲氧基芪
*=肌苷残基(5个/探针)
用于来自样品的靶rpoB序列的PCR扩增的引物显示如下:
FWD引物v1
(5’>3’)
GCAGACGTTGATCAACATCC(SEQ ID NO 3)
FWD引物v2
(5’>3’)
CGTGGAGGCGATCACACCGCAGACGTT(SEQ ID NO 4)。
使用这些探针,可能检测由于探针序列和靶序列之间的错配引起的解链温度的改变导致的靶序列中突变的存在。单碱基错配可以以高灵敏度检测。参见,例如,国际专利申请WO2013/041853,其描述了使用相似的探针(尽管仅是单个探针,不是相邻探针对)来检测rpoB基因中的SNP突变。
标记的探针在对称和不对称PCR中都给出好的扩增检测(即,在标记的引物不是有限的情况下,和其有限的情况下)。两个峰(ss和ds的)检测允许建立过渡阈值;降低有限的标记的引物的量能够用于降低该阈值(参见图3.1中的解链曲线,表明分别是>10^5个模板拷贝数和<10^5个模板拷贝数的过渡阈值)。
计算峰高度的比例(dsDNA与ssDNA的比例,参见图3.2)给出超过至少5个对数(logs)的起始拷贝数至100拷贝的目标模型系统的好的近似值。如可以看到的,起始拷贝数的对数以线性方式与峰高度比例相关。因此,扩增反应后确定峰高度比例允许确定起始拷贝数。图上两条分开的线表示来自使用150um和250um探针的线性图的数据。
以此方式,使用限制性引物进行不对称PCR,接着比较双链和单链产物的量,表明提供确定起始模板量的有用方法。例如,反应可以在测试样品上利用已知量的限制性引物进行。一旦达到所需的dsDNA与ssDNA比例,则可以确定峰高度。dsDNA的量由限制性引物的量控制,而ssDNA的量与起始模板的量成比例。因此,dsDNA峰可以用作已知量以确定反应中ssDNA的量。由此,可以确定起始模板的量。
尽管这些实例描述了限制性引物的浓度与起始模板拷贝数的比较,测定可以同样地(并且更直接地)比较每个的拷贝数或每个的浓度,条件是给定的DNA序列的拷贝数可以从浓度确定,并且反之亦然。
测定的进一步说明在图4-7中显示。这些表明样品中丙型肝炎病毒(HCV)的量的定量的实例。对一系列已知起始拷贝数的样品进行不对称PCR。
引物和探针如下:
HCV-Fwd:5’-1GCTAGCCGAGAGTGTGGGT-3’(SEQ ID NO5)
HCV-Rev:5’-TGCACGGTCTACGAGACCTCC(SEQ ID NO6)
1=三甲氧基芪
粗体下划线=荧光素dT
正向引物是限制性引物。
病毒载量探针1:
1GCCT5GTGGTAC5GCCTGAT66666AGGGTGCT5GCGAG5GCCCC3(SEQ ID NO 7)
1=TMS(三甲氧基芪)
5=荧光素dT
6=肌苷
3=丙醇
探针是WO2013/041853中所述类型的接头探针,其中两个片段由聚肌苷分隔,并且在与靶标杂交时具有不相关的解链温度。
反应条件和循环次数如下:
循环参数
利用不同起始量的HCV模板(HCV5马德里质粒)进行几次测定。结果显示在图4中。这表明,与起始模板无关,引物峰(即,检测结合有引物的dsDNA的峰)处于恒定的高度,而ssDNA峰的高度取决于起始模板的量而变化(NTC=无模板对照)。起始模板和ssDNA峰高度之间的关系是线性的,参见图5。这允许测定内(intra assay)定量,其中峰比例可以用于确定起始模板的量。
调节限制性引物的浓度导致表示标记的引物(相当于dsDNA)的峰的大小的逐步增加,和由探针测定的靶序列强度的减少。参见图6。在有很多限制性引物(本实施例中为0.25um)的情况下,dsDNA峰高度与ssDNA峰高度的比例接近1;然而,只要其仍然小于1,就仍然可以使用该测定。此外,不同起始量的靶标之间的区别变得更窄。用于这些图的起始模板的浓度与图4中使用的相同;除了限制性引物的浓度之外,其他反应条件也是一样。不考虑限制性引物浓度,如图7中所示的,保持起始模板拷贝数的对数和峰比例之间的线性关系(x轴是对数的)。注意,在这些图中,显示的比例是ssDNA与dsDNA的比例,不是图3中所示的dsDNA与ssDNA的比例。因此,对于这些结果,所需要的比例大于1;对于某些值,未达到该比例,例如0.1um限制性引物和2.5x10^4个起始模板。尽管如此,保持这一关系。重要的是,尽管在这些特定实例中的检测极限相对差(低拷贝数给出小于1的ssDNA与dsDNA比例),但这是特定测定设计的后果。该结果用于证明原理,预期该原理对一定范围的备选反应条件有效。
- 还没有人留言评论。精彩留言会获得点赞!