用于在移植受体中监测免疫抑制疗法的方法与流程
本申请要求2014年3月14日提交的美国临时申请No.61/953582,该申请全文以援引方式并入本文。
技术领域
本发明涉及监测移植受体中同种异体移植物状态的方法,以及监测和调节施用于移植受体的免疫抑制疗法的方法。
背景技术:
免疫系统在对象(例如人类个体)中起防御作用,但也可引起疾病、紊乱和其它不良状况。在向个体中进行非自身(同种异体)细胞、组织或器官的医疗目的移植的情况下,受体的免疫系统识别同种异体移植物对于身体是外来的,并且激活各种机制以排斥同种异体移植物。因此,有必要对正常免疫系统的移植排斥反应进行医学抑制。抑制受体免疫抑制的医学实践已经发展为包括预防性药学试剂的方案,通常以诱导疗法开始以消耗淋巴细胞,然后是旨在抑制淋巴细胞激活或复制的维持药物,例如皮质类固醇、钙调神经磷酸酶抑制剂(例如他克莫司),和其他的淋巴细胞复制抑制剂(例如霉酚酸酯)。改变或变更给予移植受体的免疫抑制药物量主要是经验指导。移植后,免疫抑制剂的剂量随时间降低,以降低副作用的发生率和严重性,例如传染病风险增加,且同时仍避免同种异体移植物的免疫排斥。
移植后,可以在移植受体一生剩余时间内监测其体内的同种异体移植物状态,包括同种异体移植物的评估函数和免疫介导的同种异体移植物排斥。例如,在心脏移植中,排斥监测可以包括在移植的第一年内安排至多15个活组织检查,以提供心肌的标本给病理学家进行组织学评价。每个活检程序对患者而言均是侵入性(经静脉导管进入心脏右心室的经皮通道)、不方便和有手术风险的,而且昂贵。此外,活检取样是极端局部化的,因此将缺失心脏中任何非活组织检查区域的组织学异常。活检的分级是主观的,且活检结果不一致在独立病理学家之间是常见的。在移植受体的标准临床护理中,除了周期性活检之外,还有多种临床实验室诊断测试,其提供同种异体移植物状态相关的一些信息。例如,测量钙调神经磷酸酶抑制剂药物的血清谷水平以评估预期覆盖的充分性。其他测定则检测针对同种异体移植物的抗体的存在。活组织检查主要用于在第一年内监测移植排斥,但是这种侵入性方法对于在较长期(例如,移植后一年之后)患者维护治疗中指导个体化免疫抑制疗法并不太适用也并未成熟。非侵入性基因表达方法通过检查免疫细胞中的基因表达状态来指示免疫系统状态。AlloMap分子表达测试是一种FDA批准测试,可用于心脏移植受体。用于监测其他实体器官移植的测试正在开发中。
除了现有的监测移植状态的侵入性活检方法之外,目前尚无经证实能够用于指导移植受体长期保养免疫抑制药物个体化(和进一步最小化)的特异性测试。主要来自注册研究的数据已经确定了移植物丧失或死亡的某些临床风险因素,例如受体年龄、性别和种族,以及诸如冷缺血、时间和年龄等供体特征。然而,确定这些临床风险因素并不能取代对移植受体个体化治疗和常规监测的需要。
需要一种用于诊断和监测移植受体中同种异体移植物状态的改良非侵入性方法,以及用于确定是否需要对施用于移植受体的免疫抑制疗法进行调节的方法。
技术实现要素:
在一个方面中,本发明涉及用于在对象中监测免疫抑制疗法的方法,所述方法包括:a.提供来自样品的细胞游离DNA,其中所述样品取自作为来自供体的器官移植物的受体的对象;b.对来自所述细胞游离DNA的单核苷酸多态性(SNPs)组进行测序,其中所述SNPs组适用于区分源于供体的细胞游离DNA和源于受体的细胞游离DNA;c.测定所述组中的SNP等位基因分布模式相对于预期纯合或杂合分布模式的差异,以确定所述源于供体的细胞游离DNA水平;和d.诊断所述对象中的所述移植器官状态,其中所述源自供体的细胞游离DNA在一段时间间隔内的水平变化或差异,指示移植器官状态,也是用于调节免疫抑制疗法的依据。
在又一个方面中,本发明涉及用于在对象中监测免疫抑制疗法的方法,所述方法包括:a.提供来自样品的细胞游离DNA,其中所述样品取自作为来自供体的器官移植物的受体的对象;b.对来自所述细胞游离DNA的单核苷酸多态性(SNPs)组进行测序,其中所述SNPs组适用于区分源于供体的细胞游离DNA和源于受体的细胞游离DNA;c.测定所述组中的SNP等位基因分布模式相对于预期纯合或杂合分布模式的差异,以确定所述源于供体的细胞游离DNA水平;d.诊断所述对象中的所述移植器官状态,其中所述源自供体的细胞游离DNA在一段时间间隔内的水平变化或差异指示移植器官状态;e.调节施加于对象的免疫抑制疗法。在可以与前述任一实施例组合的一些实施例中,所述源于供体的细胞游离DNA在所述时间间隔期间的水平或差异增加表示移植排斥,需要调节免疫抑制疗法,和/或需要进一步检查所述移植器官状态。在可以与前述任一实施例组合的一些实施例中,所述源于供体的细胞游离DNA在所述时间间隔期间的水平或差异减小表示移植耐受,需要调节免疫抑制疗法,和/或需要进一步检查所述移植器官状态。在可以与前述任一实施例组合的一些实施例中,所述源于供体的细胞游离DNA在所述时间间隔期间的水平或差异不变表示移植排斥状态稳定和/或调节免疫抑制疗法的机会。在可以与前述任一实施例组合的一些实施例中,增加给予所述对象的免疫抑制疗法。在可以与前述任一实施例组合的一些实施例中,降低给予所述对象的免疫抑制疗法。在可以与前述任一实施例组合的一些实施例中,维持给予所述对象的免疫抑制疗法。在可以与前述任一实施例组合的一些实施例中,所述器官移植物为肾脏移植物。在可以与前述任一实施例组合的一些实施例中,所述器官移植物为心脏移植物。在可以与前述任一实施例组合的一些实施例中,所述样本为血浆样本。在可以与前述任一实施例组合的一些实施例中,所述SNPs组包括至少20个独立SNPs。在可以与前述任一实施例组合的一些实施例中,所述SNPs组包括选自以下各项的独立SNPs:rs1004357,rs10092491,rs1019029,rs1027895,rs10488710,rs10500617,rs1058083,rs10768550,rs10773760,rs10776839,rs1109037,rs12480506,rs1294331,rs12997453,rs13134862,rs13182883,rs13218440,rs1336071,rs1358856,rs1410059,rs1478829,rs1490413,rs1498553,rs1523537,rs1554472,rs159606,rs1736442,rs1821380,rs1872575,rs2046361,rs2073383,rs214955,rs2175957,rs221956,rs2255301,rs2269355,rs2270529,rs2272998,rs2291395,rs2292972,rs2342747,rs2399332,rs2503107,rs2567608,rs279844,rs2811231,rs2833736,rs2920816,rs315791,rs321198,rs338882,rs3744163,rs3780962,rs4288409,rs430046,rs4364205,rs445251,rs4530059,rs4606077,rs464663,rs4789798,rs4796362,rs4847034,rs521861,rs560681,rs5746846,rs576261,rs590162,rs6444724,rs6591147,rs6811238,rs689512,rs6955448,rs7041158,rs7205345,rs722290,rs7229946,rs740598,rs7520386,rs7704770,rs8070085,rs8078417,rs891700,rs901398,rs9546538,rs9606186,rs985492,rs9866013,rs987640,rs9905977,rs993934,and rs9951171。在可以与前述任一实施例组合的一些实施例中,对所述SNPs组的测序使用多重测序平台来执行。在可以与前述任一实施例组合的一些实施例中,所述时间间隔是移植物从供体向受体对象的转移发生后的约12至14个月。在可以与前述任一实施例组合的一些实施例中,所述方法还包括测试病毒载量。在一些实施例中,所述测试包括测试选自CMV、EBV、指环病毒(anellovirus)和BKV的病毒的存在。在可以与前述任一实施例组合的一些实施例中,所述方法还包括进行一项或多项基因表达谱测试。在一些实施例中,所述基因表达谱测试为AlloMap测试。
在一个方面中,本发明涉及用于在对象中监测移植器官的方法,所述方法包括:a.提供来自样品的细胞游离DNA,其中所述样品取自作为来自供体的器官移植物的受体的对象;b.对来自所述细胞游离DNA的单核苷酸多态性(SNPs)组进行测序,其中所述SNPs组适用于区分源于供体的细胞游离DNA和源于受体的细胞游离DNA;c.测定所述组中的SNP等位基因分布模式相对于预期纯合或杂合分布模式的差异,以确定所述源于供体的细胞游离DNA水平;和d.诊断所述对象中的所述移植器官状态,其中所述源自供体的细胞游离DNA在一段时间间隔内的水平变化或差异,指示移植器官状态。
在又一个方面中,本发明涉及用于在对象中调节免疫抑制疗法的方法,所述方法包括:a.提供来自样品的细胞游离DNA,其中所述样品取自作为来自供体的器官移植物的受体的对象;b.对来自所述细胞游离DNA的单核苷酸多态性(SNPs)组进行测序,其中所述SNPs组适用于区分源于供体的细胞游离DNA和源于受体的细胞游离DNA;c.测定所述组中的SNP等位基因分布模式相对于预期纯合或杂合分布模式的差异,以确定所述源于供体的细胞游离DNA水平;d.诊断所述对象中的所述移植器官状态,其中所述源自供体的细胞游离DNA在一段时间间隔内的水平变化或差异,指示移植器官状态,也是用于调节免疫抑制疗法的依据。
在又一个方面中,本发明涉及用于在对象中调节免疫抑制疗法的方法,所述方法包括:a.提供来自样品的细胞游离DNA,其中所述样品取自作为来自供体的器官移植物的受体的对象;b.对来自所述细胞游离DNA的单核苷酸多态性(SNPs)组进行测序,其中所述SNPs组适用于区分源于供体的细胞游离DNA和源于受体的细胞游离DNA;c.测定所述组中的SNP等位基因分布模式相对于预期纯合或杂合分布模式的差异,以确定所述源于供体的细胞游离DNA水平;d.诊断所述对象中的所述移植器官状态,其中所述源自供体的细胞游离DNA在一段时间间隔内的水平变化或差异指示移植器官状态;e.调节施加于所述对象的免疫抑制疗法。在可以与前述任一实施例组合的一些实施例中,所述源于供体的细胞游离DNA在所述时间间隔期间的水平或差异增加表示移植排斥,需要调节免疫抑制疗法,和/或需要进一步检查所述移植器官状态。在可以与前述任一实施例组合的一些实施例中,所述源于供体的细胞游离DNA在所述时间间隔期间的水平或差异减小表示移植耐受,需要调节免疫抑制疗法,和/或需要进一步检查所述移植器官状态。在可以与前述任一实施例组合的一些实施例中,所述源于供体的细胞游离DNA在所述时间间隔期间的水平或差异不变表示移植排斥状态稳定和/或调节免疫抑制疗法的机会。在可以与前述任一实施例组合的一些实施例中,增加给予所述对象的免疫抑制疗法。在可以与前述任一实施例组合的一些实施例中,降低给予所述对象的免疫抑制疗法。在可以与前述任一实施例组合的一些实施例中,维持给予所述对象的免疫抑制疗法。在可以与前述任一实施例组合的一些实施例中,所述器官移植物为肾脏移植物。在可以与前述任一实施例组合的一些实施例中,所述器官移植物为心脏移植物。在可以与前述任一实施例组合的一些实施例中,所述器官移植物选自肝脏移植物、肺移植物和胰脏移植物。在可以与前述任一实施例组合的一些实施例中,所述样本为血浆样本。在可以与前述任一实施例组合的一些实施例中,所述SNPs组包括选自以下各项的独立SNPs:rs1004357,rs10092491,rs1019029,rs1027895,rs10488710,rs10500617,rs1058083,rs10768550,rs10773760,rs10776839,rs1109037,rs12480506,rs1294331,rs12997453,rs13134862,rs13182883,rs13218440,rs1336071,rs1358856,rs1410059,rs1478829,rs1490413,rs1498553,rs1523537,rs1554472,rs159606,rs1736442,rs1821380,rs1872575,rs2046361,rs2073383,rs214955,rs2175957,rs221956,rs2255301,rs2269355,rs2270529,rs2272998,rs2291395,rs2292972,rs2342747,rs2399332,rs2503107,rs2567608,rs279844,rs2811231,rs2833736,rs2920816,rs315791,rs321198,rs338882,rs3744163,rs3780962,rs4288409,rs430046,rs4364205,rs445251,rs4530059,rs4606077,rs464663,rs4789798,rs4796362,rs4847034,rs521861,rs560681,rs5746846,rs576261,rs590162,rs6444724,rs6591147,rs6811238,rs689512,rs6955448,rs7041158,rs7205345,rs722290,rs7229946,rs740598,rs7520386,rs7704770,rs8070085,rs8078417,rs891700,rs901398,rs9546538,rs9606186,rs985492,rs9866013,rs987640,rs9905977,rs993934,and rs9951171。在可以与前述任一实施例组合的一些实施例中,所述SNPs组包括具有>0.4的总群体次要等位基因频率、>0.4的目标种群次要等位基因频率、6个潜在等位基因转换或颠换的最低聚合酶错误率且各独立SNP之间的基因组距离>500kb的SNPs。在可以与前述任一实施例组合的一些实施例中,所述SNPs组包括选自以下各项的独立SNPs:rs10488710,rs279844,rs1048290,rs1049379,rs1051614,rs1052637,rs1055851,rs1056033,rs1056149,rs1064074,rs1078004,rs10831567,rs6811238,rs11106,rs11210490,rs1126899,rs1127472,rs1127893,rs1130857,rs1049544,rs11547806,rs12237048,rs430046,rs12508837,rs12529,rs12717,rs13184586,rs13295990,rs13428,rs13436,rs1374570,rs14080,rs1411271,rs576261,rs14155,rs1151687,rs1565933,rs1600,rs1678690,rs1881421,rs1897820,rs1898882,rs2056844,rs20575,rs10092491,rs2070426,rs2071888,rs2075322,rs2180314,rs2185798,rs2227910,rs2228560,rs2229571,rs2229627,rs2245285,rs2342747,rs2248490,rs2253592,rs2254357,rs2275047,rs2279665,rs2279776,rs2281098,rs2287813,rs4364205,rs2289751,rs2289818,rs2292830,rs2294092,rs2295005,rs2296545,rs2297236,rs2302443,rs2306049,rs1022478,rs445251,rs230898,rs231235,rs2342767,rs236152,rs2362450,rs2384571,rs2455230,rs246703,rs2480345,rs248385,rs2498982,rs2505232,rs2509943,rs2519123,rs2523072,rs2571028,rs2657167,rs28686812,rs2946994,rs1294331,rs10419826,rs3088241,rs3110623,rs3173615,rs3190321,rs3205187,rs344141,rs35596415,rs362124,rs36657,rs1872575,rs159606,rs3731877,rs3734311,rs3735615,rs3740199,rs3748930,rs3751066,rs3790993,rs3802265,rs3803763,rs1004357,rs3803798,rs3809972,rs3810483,rs3812571,rs3813609,rs3814182,rs3816800,rs3826709,rs3829655,rs3951216,rs1019029,rs408600,rs41317515,rs436278,rs448012,rs475002,rs4845480,rs4849167,rs4865615,rs1027895,rs4890012,rs492594,rs4940019,rs4971514,rs523104,rs528557,rs545500,rs561930,rs57010808,rs57285449,rs10500617,rs6061243,rs609521,rs62490396,rs625223,rs638405,rs6459166,rs648802,rs6510057,rs6764714,rs10768550,rs6790129,rs6794,rs6807362,rs6838248,rs713598,rs7161563,rs726009,rs7289,rs7301328,rs7332388,rs10773760,rs743616,rs743852,rs745142,rs7451713,rs7526132,rs7543016,rs7601771,rs7785899,rs7825,rs8009219,rs10776839,rs8025851,rs8058696,rs8076632,rs8097,rs8103906,rs874881,rs9262,rs9289122,rs936019,rs9393728,rs1109037,rs977070,rs9865242,rs12480506,rs560681,rs12997453,rs13134862,rs13218440,rs1358856,rs1410059,rs1478829,rs1498553,rs1523537,rs4606077,rs1554472,rs1736442,rs1821380,rs2046361,rs214955,rs2175957,rs2255301,rs2269355,rs2270529,rs2272998,rs2291395,rs2292972,rs2399332,rs2503107,rs2567608,rs2811231,rs2833736,rs315791,rs321198,rs6955448,rs338882,rs3780962,rs4288409,rs4530059,rs464663,rs4789798,rs4796362,rs4847034,rs521861,rs1058083,rs5746846,rs590162,rs6444724,rs6591147,rs689512,rs7205345,rs722290,rs740598,rs7520386,rs221956,rs7704770,rs8070085,rs8078417,rs891700,rs901398,rs9546538,rs9606186,rs985492,rs9866013,rs987640,rs13182883,rs9905977,rs993934,rs9951171,rs10274334,rs10421285,rs1043413,rs1044010,rs1045248,rs1045644,和rs1047979。在一些实施例中,所述SNP组包括所述独立SNPs的约195至约200个,约200至约205个,约210至约215个,约215至约220个,约220至约225个,约225至约230个,约230至约235个,约235至约240个,约240至约245个,约245至约250个,约250至约255个,约255至约260个,约260至约265个,或约260至约266个。在可以与前述任一实施例组合的一些实施例中,所述SNP组包括rs10488710,rs279844,rs1048290,rs1049379,rs1051614,rs1052637,rs1055851,rs1056033,rs1056149,rs1064074,rs1078004,rs10831567,rs6811238,rs11106,rs11210490,rs1126899,rs1127472,rs1127893,rs1130857,rs1049544,rs11547806,rs12237048,rs430046,rs12508837,rs12529,rs12717,rs13184586,rs13295990,rs13428,rs13436,rs1374570,rs14080,rs1411271,rs576261,rs14155,rs1151687,rs1565933,rs1600,rs1678690,rs1881421,rs1897820,rs1898882,rs2056844,rs20575,rs10092491,rs2070426,rs2071888,rs2075322,rs2180314,rs2185798,rs2227910,rs2228560,rs2229571,rs2229627,rs2245285,rs2342747,rs2248490,rs2253592,rs2254357,rs2275047,rs2279665,rs2279776,rs2281098,rs2287813,rs4364205,rs2289751,rs2289818,rs2292830,rs2294092,rs2295005,rs2296545,rs2297236,rs2302443,rs2306049,rs1022478,rs445251,rs230898,rs231235,rs2342767,rs236152,rs2362450,rs2384571,rs2455230,rs246703,rs2480345,rs248385,rs2498982,rs2505232,rs2509943,rs2519123,rs2523072,rs2571028,rs2657167,rs28686812,rs2946994,rs1294331,rs10419826,rs3088241,rs3110623,rs3173615,rs3190321,rs3205187,rs344141,rs35596415,rs362124,rs36657,rs1872575,rs159606,rs3731877,rs3734311,rs3735615,rs3740199,rs3748930,rs3751066,rs3790993,rs3802265,rs3803763,rs1004357,rs3803798,rs3809972,rs3810483,rs3812571,rs3813609,rs3814182,rs3816800,rs3826709,rs3829655,rs3951216,rs1019029,rs408600,rs41317515,rs436278,rs448012,rs475002,rs4845480,rs4849167,rs4865615,rs1027895,rs4890012,rs492594,rs4940019,rs4971514,rs523104,rs528557,rs545500,rs561930,rs57010808,rs57285449,rs10500617,rs6061243,rs609521,rs62490396,rs625223,rs638405,rs6459166,rs648802,rs6510057,rs6764714,rs10768550,rs6790129,rs6794,rs6807362,rs6838248,rs713598,rs7161563,rs726009,rs7289,rs7301328,rs7332388,rs10773760,rs743616,rs743852,rs745142,rs7451713,rs7526132,rs7543016,rs7601771,rs7785899,rs7825,rs8009219,rs10776839,rs8025851,rs8058696,rs8076632,rs8097,rs8103906,rs874881,rs9262,rs9289122,rs936019,rs9393728,rs1109037,rs977070,rs9865242,rs12480506,rs560681,rs12997453,rs13134862,rs13218440,rs1358856,rs1410059,rs1478829,rs1498553,rs1523537,rs4606077,rs1554472,rs1736442,rs1821380,rs2046361,rs214955,rs2175957,rs2255301,rs2269355,rs2270529,rs2272998,rs2291395,rs2292972,rs2399332,rs2503107,rs2567608,rs2811231,rs2833736,rs315791,rs321198,rs6955448,rs338882,rs3780962,rs4288409,rs4530059,rs464663,rs4789798,rs4796362,rs4847034,rs521861,rs1058083,rs5746846,rs590162,rs6444724,rs6591147,rs689512,rs7205345,rs722290,rs740598,rs7520386,rs221956,rs7704770,rs8070085,rs8078417,rs891700,rs901398,rs9546538,rs9606186,rs985492,rs9866013,rs987640,rs13182883,rs9905977,rs993934,rs9951171,rs10274334,rs10421285,rs1043413,rs1044010,rs1045248,rs1045644和rs1047979。在可以与前述任一实施例组合的一些实施例中,对所述SNPs组的测序使用多重测序平台来执行。在可以与前述任一实施例组合的一些实施例中,对所述样本中的所述源于供体的细胞游离DNA的测定不使用基因型信息。在可以与前述任一实施例组合的一些实施例中,所述方法还包括测试感染剂的存在。在可以与前述任一实施例组合的一些实施例中,所述感染剂选自病毒、细菌、真菌和寄生虫。在一些实施例中,所述病毒选自巨细胞病毒,Epstein-Barr病毒,指环病毒和BK病毒。在可以与前述任一实施例组合的一些实施例中,所述方法还包括进行一项或多项基因表达谱测试。在可以与前述任一实施例组合的一些实施例中,基于所述源自供体的细胞游离DNA水平结果和所述基因表达谱测试结果,计算联合评分。在一些实施例中,所述基因表达谱测试为AlloMap测试。
附图说明
图1展示了来自经历过急性细胞排斥的心脏移植受体的血浆中的源自供体的细胞游离DNA(dd-cfDNA)高于不经历排斥的受体的血浆。数据是使用来自心脏移植受体的收集在PPT管中的血浆产生的。基于同一患者就诊时进行的心内膜活检的状态,将患者样品分配为NR(非排斥)和R(排斥)类别。源自供体的细胞游离DNA表达为如本文所述测量的细胞游离总DNA的百分比。t检验表明各组不同(P=0.017)。
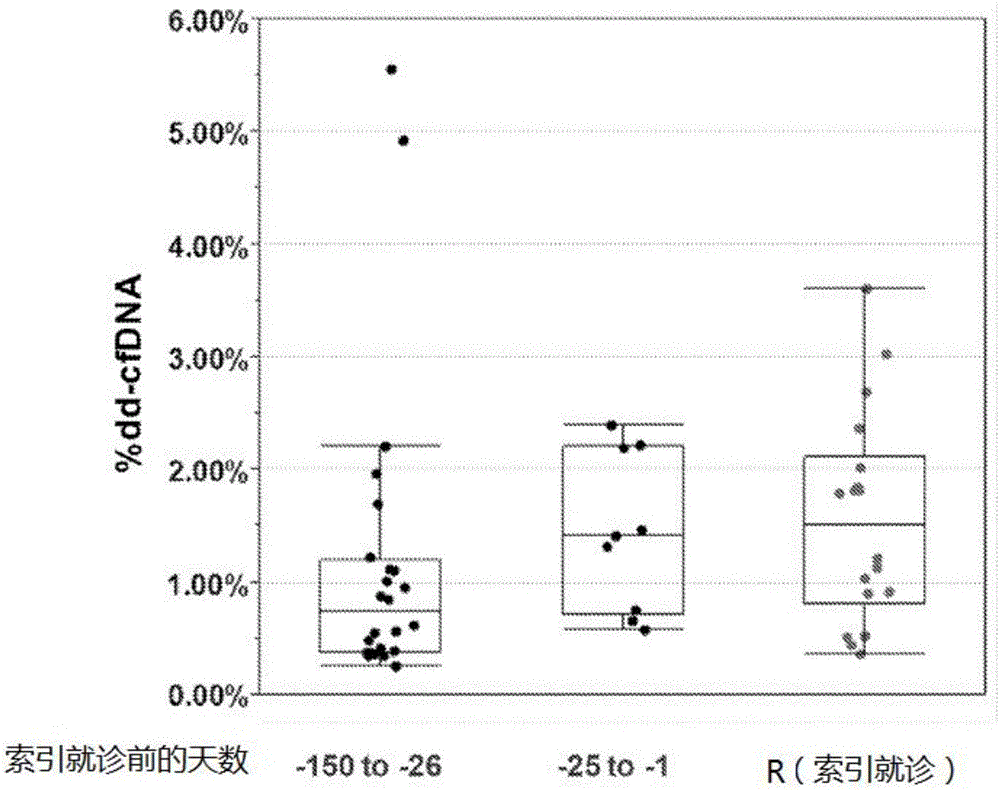
图2展示了dd-cfDNA在心脏移植排斥之前升高。数据是使用来自心脏移植受体的收集在PPT管中的血浆产生的。基于同一患者就诊时进行的心内膜活检的状态,将患者样品分配为R(排斥)状态。根据排斥反应就诊之前的时间(25天或以下,或25天以上)对排斥事件之前的就诊进行分组。源自供体的细胞游离DNA表达为如本文所述测量的细胞游离总DNA的百分比。
图3展示了在通过提高免疫抑制疗法治疗心脏移植受体的急性细胞排斥后,dd-cfDNA减少。数据是使用来自心脏移植受体的收集在PPT管中的血浆产生的。基于同一患者就诊时执行的心内膜活检,将患者样品分为R(排斥,三角形)或NR(非排斥,圆形)状态。源自供体的细胞游离DNA表达为如本文所述测量的细胞游离总DNA的百分比。该患者基于2R排斥的心内膜活检状态(移植后225天的指标事件)接受强的松大剂量免疫抑制。
图4展示了在通过提高免疫抑制疗法治疗心脏移植受体的急性细胞排斥后,dd-cfDNA减少。使用来自肾移植受体的通过CPT处理的上清液收集得到的血浆产生数据。基于活检结果将患者样品分配为R(排斥,三角形),基于低血清肌酐分配为NR(非排斥,圆形)。源自供体的细胞游离DNA表达为如本文所述测量的细胞游离总DNA的百分比。
图5展示了心脏移植后来自Streck BCT血浆采集管的dd-cfDNA值。患者样品对于排斥状态或结果是盲化的。三个对象,每个三次访问,每次采取不同的形状符号。源自供体的细胞游离DNA表达为如本文所述测量的细胞游离总DNA的百分比。
图6A-图6C说明dd-cfDNA是来自血液标志物的基因表达谱中的独特信号,且两者的组合可更好地鉴别排斥。图6A示出了来自心脏移植受体的dd-cfDNA水平。使用在PPT管中收集的心脏移植受体的血浆产生cfDNA数据。基于同一患者就诊时进行的心内膜活检的状态,将患者样品分配为R(排斥)状态。源自供体的细胞游离DNA表达为如本文所述测量的细胞游离总DNA的百分比。图6B示出了图6A中移植受体的AlloMap数据。使用以CPT管收集的单核细胞产生基因表达数据。通过AlloMap分子表达测试来测量基因表达。图6C示出了dd-cfDNA数据和AlloMap数据的组合。将dd-cfDNA(图6A)和AlloMap(图6B)的值缩放至相同的范围并且相加组合。根据受体-操作者特征图曲线下面积的测量,组合得分在区分排斥与非排斥方面由于单独的cfDNA或基因表达。
图7示出了本申请所述的多态标记分析方法的示例性工作流程。
具体实施方式
以下描述将帮助本领域技术人员能够制作和使用各种实施例。对具体设备、技术和应用的描述仅作为示例提供。对于本领域普通技术人员而言,对本文描述的示例的各种改进是显而易见的,并且在不脱离各种实施例的思路和范围的情况下,本文定义的一般原理可以应用于其他示例和应用。因此,各种实施例并不旨在局限于本文所描述和展示的示例,而是符合与权利要求一致的范围。
本发明涉及监测移植受体中同种异体移植物状态的方法,以及监测和调节施用于移植受体的免疫抑制疗法的方法。
概览
本发明至少部分基于申请人对用于探测移植受体中同种异体移植物状态的技术开发。移植受体含有对受体身体而言的外来同种异体移植物。这引发了来自受体免疫系统的免疫应答,其可导致急性和/或慢性移植排斥。申请人的方法涉及分析来自移植受体的细胞游离DNA(cfDNA),以诊断移植物状态,并指示调整施用于移植受体的免疫抑制疗法的需要。不受理论束缚地,认为移植排斥与移植(供体)器官或组织中的细胞死亡相关,其将从垂死供体细胞中释放源自供体的DNA,从而将源自供体的细胞的细胞游离DNA(dd-cfDNA)释放到受体的血流中。为了测定受体中同种异体移植物状态,可以从来自受体的样品例如体液中提取细胞游离DNA,并且可以对各种多态性标志物例如单核苷酸多态性(SNP)基因座进行测序,其中多态性标志物组,例如SNPs组,适合于区分源自供体的细胞游离DNA和源自受体的细胞游离DNA(rd-cfDNA)。选择用于所述组中的特定多态性标志包括被鉴定为在任何两个个体中相同的概率低的标志,因此适用于区分源自受体的细胞游离DNA和源自供体的细胞游离DNA。所述组中的多态标记数目,例如,组中的SNPs的数目,应足以区分受体和供体等位基因,即使在亲缘个体(除非是同卵双胞胎)中。可以测定该组中多态型标志物的等位基因分布模式,以确定与预期纯合(即每个等位基因为0%或100%)或杂合(即每个等位基因为50%)分布模式相比的模式差异,其可以用于确定源自供体的细胞游离DNA水平。对供体和受体的个体基因分型以确定多态基因座的哪个等位基因属于供体和/或受体不是必要的,因为多态标记等位基因分布模式与预期纯合或杂合分布模式的差异将指示源自供体的细胞游离DNA在从移植受体分离的细胞游离DNA分子群体中的存在。换句话说,假定来自细胞游离DNA样品的多数信号是来自受体的DNA,且少数信号是源自供体的DNA,且该信息可以用于计算细胞游离DNA样品中的源自供体的DNA水平。源自供体的细胞游离DNA随时间的水平变化或差异可以用于指示移植受体中的同种异体移植物状态,以及指示调节或维持施用于对象的免疫抑制疗法的需要。
因此,本发明提供了监测移植受体中同种异体移植物状态的方法,以及监测和/或调节正在或将要施用于移植受体的免疫抑制治疗的方法。监测同种异体移植物状态,涉及分析可提供同种异体移植物生理状态的相关有用信息的各个方面,例如,来自移植受体的样品中供体来源的细胞游离DNA水平。本发明的方法可以用于预测未来移植排斥的风险,例如,从来自移植受体的样品分析此后3-6个月内排斥的风险。本发明的方法还可以用于诊断或预测同种异体移植物功能障碍的风险,例如慢性肾功能不全或心脏同种异体移植血管病变(CAV)(例如在对移植受体样品进行分析后的未来1-2年内)。本发明的方法还可以用于提供移植受体免疫状态的评估,其可以用于指导移植受体中的免疫抑制治疗的相关决定。本发明的方法还可以用于指导与向移植受体施用的免疫抑制治疗的调整相关的决定。本发明的方法的其他益处和/或用途对于本领域技术人员将是显而易见的。
细胞游离DNA
本发明的方法涉及分析来自移植受体的细胞游离DNA,以诊断移植物的状态和/或指示调节施用于移植受体的免疫抑制疗法的需要。细胞游离DNA通常指存在于细胞外部的DNA,例如存在于对象的体液(例如血液、血浆、血清等)中的DNA。细胞游离DNA可以源自细胞内的多个位置。细胞游离DNA可以源自例如细胞核DNA和线粒体DNA。不受理论束缚地,一般认为细胞游离DNA通过细胞的细胞凋亡或坏死(即细胞死亡)从细胞释放。因此,不受理论束缚地,一般认为在移植排斥期间,移植(供体)细胞的凋亡或坏死将导致源自供体的细胞游离DNA被释放到移植受体的体液中。经手移植排斥的移植受体,其体液中可能具有细胞游离DNA群体,包括来源于自身的内源性细胞游离DNA(源自受体的细胞游离DNA)以及来源于供体的细胞游离DNA(源自供体的细胞游离DNA)。根据本发明的方法确定移植受体中源自供体的细胞游离DNA随时间的水平变化和/或差异,可以用于诊断同种异体移植物状态,并指示调节免疫抑制疗法的需要。
细胞游离RNA也可以从移植受体收集,并通过如上所述的类似方法分析,并且还可以分析来自特异性标记基因的受体RNA水平,以诊断移植状态和/或指示调节对移植受体施用免疫抑制疗法的需要。因此,本发明的方法通常涉及:分析来自移植受体的细胞游离核酸,以诊断移植物状态和/或指示调节施用于移植受体的免疫抑制疗法的需要。
对象与样本
本发明的方法涉及从来自受体的样品提供细胞游离DNA,所述对象是供体同种异体移植物的受体。在这个意义上,对象是含有来自供体的同种异体移植物的移植受体,并且通常是人类移植受体。移植受体可能已经接受来自供体的多种同种异体移植物中的一种或多种。同种异体移植物可以包括移植器官。移植的器官可以包括例如心脏、肾脏、肺、肝脏、胰腺、角膜、器官系统或其他实体器官。移植受体从供体接受的移植物还可以包括其他同种异体移植物,例如骨髓移植物、胰岛细胞、干细胞、皮肤组织、皮肤细胞或异种移植物。
所提供的样品可以包括从移植受体分离的体液。从移植受体获得的样品含有细胞游离DNA,且样品中存在的总细胞游离DNA可以是完全源自受体的细胞游离DNA,或样品中存在的总细胞游离DNA可以包括源自受体的细胞游离DNA和源自供体的细胞游离DNA。样品可以包括来自移植受体的体液,例如血浆、血清、全血、汗液、泪液、唾液、耳流液、痰、来自骨髓悬液的液体、淋巴液、尿、唾液、精液、阴道流、脑脊液、脑液、腹水、乳汁、呼吸道分泌物和肠或泌尿生殖道流体。在样品是血浆的一些实施例中,可以取用源自移植受体的静脉血的血浆。
一旦获得样品,即可以直接使用、冷冻或以其它方式短时间储存在通过防止降解和/或被基因组DNA或其他核酸污染而保持细胞游离DNA的完整性的条件下。在特定时间取得的样品的量可能变化,并且可能依赖于另外的因素,例如任何对样品进行重复分析的需要。在一些实施例中,获得的样品多至50、40、30、20、10、9、8、7、6、5、4、3、2或1mL。在一些实施例中,获得的样品1-50、2-40、3-30或4-20mL。在一些实施例中,获得的样品超过5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100mL。
样品可以在一段时间内(即在一段时间间隔内)从移植受体获得。移植事件后,从移植受体获取样品的时间可以变化。可以在不同时间和不同时间段从移植受体获取样品,用于根据本发明的方法确定同种异体移植物状态。例如,可以在移植事件后数天和数周后、约三个月后、约六个月后、约九个月后或小于一年后从移植受体获取样品。样品可以在移植事件一周年之前的不同时间、移植事件的一周年或移植事件的一周年后不同时间从移植受体获取。例如,在移植后一周年,样品可以在第12个月(即移植事件的一周年)开始从移植受体获取,并且在此此后一段时间内继续取样。在一些实施例中,从移植受体获得样品的时间段为在从供体到受体的移植发生后的最初几天内。这可以用于监测诱导治疗。在一些实施例中,从移植受体获得样品的时间段是在免疫抑制方案递减期间,该时期发生在从供体移植到受体后的前12个月期间。在一些实施例中,从移植受体获得样品的时间段为初始长期免疫抑制维持期期间,始于从供体到受体的移植发生后约12-14个月。在一些实施例中,从移植受体获得样品的时间段是在免疫抑制方案的整个长期维持期间,在从供体到受体的移植后超过12个月的任何时间发生。
当要从移植受体获得多个样品时,取样的频率可以变化。在已经开始从移植受体获取样品后,采样可以是在初始取样事件后约每周一次、约每2周一次、约每3周一次、约每月约一次、约每两个月一次、约每三个月一次、约每四个月一次、约每五个月一次、约每六个月一次、约每年一次或约每两年或更多一次。
在一些实施例中,移植受体具有从移植事件的一周年(即移植事件后12个月)开始连续一至三个月取得的体液样品,提供总共4-6个样品用于在三个月时间段内进行分析,其样品大约每两周收集一次。在一些实施例中,移植受体具有从移植事件的一周年(即移植事件后12个月)开始,每周一次,持续一至三个月的体液样品,提供总共十二个样品,用于在三个月时间段内进行分析。从移植受体获得样品的总持续时间以及获得这样的样品的频率可以变化,且取决于多种因素,例如临床进展。例如,移植受体可以具有用于在其一生的持续时间内分析细胞游离DNA的样品。对于给定的移植受体,本领域技术人员将能够确定适当的取样时间和频率。
移植受体中的细胞游离DNA分析
本发明的方法涉及分析来自移植受体的细胞游离DNA。在从移植受体分离出细胞游离DNA后,可以使用各种方法和技术来分析细胞游离DNA。根据本发明的方法分析细胞游离DNA,涉及分析来自细胞游离DNA的多态标记物组。在一些实施例中,多态性标志物是单核苷酸多态性(SNPs)。在一些实施例中,选择包含在改组中的SNPs,至少部分是基于该组SNP足以区分源自供体的细胞游离DNA和源自受体的细胞游离DNA。
多态标记组
从移植受体获得的细胞游离DNA的分析涉及分析来自细胞游离DNA的多态标记物组。可以选择各种多态性标记以包括在待分析的组中,只要多态性标记组整体适合用于区分源自供体的细胞游离DNA和源自受体的细胞游离DNA即可。每个移植受体可以使用相同的多态标记物组;无需为不同的移植受体定制个性化多态标记组。
各种类型的多态标记可以包括在多态标记组中。多态性标记物存在于含有多态性的DNA区域。多态性通常是指群体中两个或更多个遗传决定的替代序列或等位基因的存在。多态性标记或位点是发生分化或多态性的位点。多态性可以包含例如一个或多个碱基改变、插入、重复或缺失。多态性基因座可以小至一个碱基对,例如SNP。多态性标记可以包括例如单核苷酸多态性(SNPs),限制性片段长度多态性(RFLP)、短串联重复(STR)、可变数目的串联重复(VNTR)、高变区、微卫星、二核苷酸重复、四核苷酸重复、简单序列重复和插入元件。多态性标记可以包含一个或多个甲基化修饰碱基。其它类型的多态性和多态性标记对于本领域技术人员来说是显而易见的。两种核酸之间的多态性可以是天然存在的,或可以因暴露于或接触化学品、酶或其它试剂或暴露于引起核酸损害的媒介引起,例如紫外线辐射、诱变剂或致癌物。
多态标记组中可以采用多态标记类型的各种组合。例如,多态性标记组可以包括SNPs和短串联重复,或任何其他类型的多态性标记。在一些实施例中,多态标记物组完全由SNPs组成;因此,多态标记物组是SNP组。多态型标记组中的其它多态标记组合对本领域技术人员是显而易见的。
如本领域技术人员可以理解的,从细胞游离DNA中分析的多态标记的适当数量和种类选择可以变化。待分析的多态性标志物组可以包括至少10个,至少15个,至少20个,至少25个,至少30个,至少35个,至少40个,至少45个,至少50个,至少55个,至少60,至少65,至少70,至少75,至少80,至少85,至少90,至少95,至少100,至少105,至少110或至少115个至少120,至少150,至少200,至少250,至少300,至少350,至少400,至少450,至少500,至少1000或至少,500或更多个独立的多态性标记。
在一些实施例中,多态型标志组是一组SNPs。要包含在SNP组或任何其他多态型标志组中的的SNPs,可以是此前确定为适合于区分任何两个无亲缘个体的SNPs(Pakstis et al.,2010)。例如,SNP组可能包括如下人类SNP中的一个或多个(根据dbSNP数据库编号命名):rs1004357,rs10092491,rs1019029,rs1027895,rs10488710,rs10500617,rs1058083,rs10768550,rs10773760,rs10776839,rs1109037,rs12480506,rs1294331,rs12997453,rs13134862,rs13182883,rs13218440,rs1336071,rs1358856,rs1410059,rs1478829,rs1490413,rs1498553,rs1523537,rs1554472,rs159606,rs1736442,rs1821380,rs1872575,rs2046361,rs2073383,rs214955,rs2175957,rs221956,rs2255301,rs2269355,rs2270529,rs2272998,rs2291395,rs2292972,rs2342747,rs2399332,rs2503107,rs2567608,rs279844,rs2811231,rs2833736,rs2920816,rs315791,rs321198,rs338882,rs3744163,rs3780962,rs4288409,rs430046,rs4364205,rs445251,rs4530059,rs4606077,rs464663,rs4789798,rs4796362,rs4847034,rs5601681,rs5746846,rs560681,rs590162,rs6444724,rs6591147,rs6811238,rs689512,rs6955448,rs7041158,rs7205345,rs722290,rs7229946,rs740598,rs7520386,rs7704770,rs8070085,rs8078417,rs8970085,rs901398,rs9546538,rs9606186,rs985492,rs9866013,rs987640,rs9905977,rs993934和rs9951171。
SNPs的选择,也可以基于,例如,总群体次要等位基因>0.4,目标群体次要等位基因频率>0.4,6种潜在等位基因转换或颠换的最低聚合酶错误率(在测试体系中),以及低基因组连锁度,例如,SNPs之间的距离>500kb。
所述SNP组可以包括,例如,一个或多个以下人类SNPs(根据dbSNP编号命名):rs10488710,rs279844,rs1048290,rs1049379,rs1051614,rs1052637,rs1055851,rs1056033,rs1056149,rs1064074,rs1078004,rs10831567,rs6811238,rs11106,rs11210490,rs1126899,rs1127472,rs1127893,rs1130857,rs1049544,rs11547806,rs12237048,rs430046,rs12508837,rs12529,rs12717,rs13184586,rs13295990,rs13428,rs13436,rs1374570,rs14080,rs1411271,rs576261,rs14155,rs1151687,rs1565933,rs1600,rs1678690,rs1881421,rs1897820,rs1898882,rs2056844,rs20575,rs10092491,rs2070426,rs2071888,rs2075322,rs2180314,rs2185798,rs2227910,rs2228560,rs2229571,rs2229627,rs2245285,rs2342747,rs2248490,rs2253592,rs2254357,rs2275047,rs2279665,rs2279776,rs2281098,rs2287813,rs4364205,rs2289751,rs2289818,rs2292830,rs2294092,rs2295005,rs2296545,rs2297236,rs2302443,rs2306049,rs1022478,rs445251,rs230898,rs231235,rs2342767,rs236152,rs2362450,rs2384571,rs2455230,rs246703,rs2480345,rs248385,rs2498982,rs2505232,rs2509943,rs2519123,rs2523072,rs2571028,rs2657167,rs28686812,rs2946994,rs1294331,rs10419826,rs3088241,rs3110623,rs3173615,rs3190321,rs3205187,rs344141,rs35596415,rs362124,rs36657,rs1872575,rs159606,rs3731877,rs3734311,rs3735615,rs3740199,rs3748930,rs3751066,rs3790993,rs3802265,rs3803763,rs1004357,rs3803798,rs3809972,rs3810483,rs3812571,rs3813609,rs3814182,rs3816800,rs3826709,rs3829655,rs3951216,rs1019029,rs408600,rs41317515,rs436278,rs448012,rs475002,rs4845480,rs4849167,rs4865615,rs1027895,rs4890012,rs492594,rs4940019,rs4971514,rs523104,rs528557,rs545500,rs561930,rs57010808,rs57285449,rs10500617,rs6061243,rs609521,rs62490396,rs625223,rs638405,rs6459166,rs648802,rs6510057,rs6764714,rs10768550,rs6790129,rs6794,rs6807362,rs6838248,rs713598,rs7161563,rs726009,rs7289,rs7301328,rs7332388,rs10773760,rs743616,rs743852,rs745142,rs7451713,rs7526132,rs7543016,rs7601771,rs7785899,rs7825,rs8009219,rs10776839,rs8025851,rs8058696,rs8076632,rs8097,rs8103906,rs874881,rs9262,rs9289122,rs936019,rs9393728,rs1109037,rs977070,rs9865242,rs12480506,rs560681,rs12997453,rs13134862,rs13218440,rs1358856,rs1410059,rs1478829,rs1498553,rs1523537,rs4606077,rs1554472,rs1736442,rs1821380,rs2046361,rs214955,rs2175957,rs2255301,rs2269355,rs2270529,rs2272998,rs2291395,rs2292972,rs2399332,rs2503107,rs2567608,rs2811231,rs2833736,rs315791,rs321198,rs6955448,rs338882,rs3780962,rs4288409,rs4530059,rs464663,rs4789798,rs4796362,rs4847034,rs521861,rs1058083,rs5746846,rs590162,rs6444724,rs6591147,rs689512,rs7205345,rs722290,rs740598,rs7520386,rs221956,rs7704770,rs8070085,rs8078417,rs891700,rs901398,rs9546538,rs9606186,rs985492,rs9866013,rs987640,rs13182883,rs9905977,rs993934,rs9951171,rs10274334,rs10421285,rs1043413,rs1044010,rs1045248,rs1045644,和rs1047979。在一些实施例中,266个上述SNPs均包含在来自细胞游离DNA的待分析的多肽标志组中。
SNP组可包括例如至少10个,至少15个,至少20个,至少25个,至少30个,至少35个,至少40个,至少45个,至少50个,至少55,至少60,至少65,至少70,至少75,至少80,至少85,至少90,至少95,至少100,至少105,至少110或至少115,至少120,至少150,至少200,至少205,至少210,至少215,至少220,至少225,至少230,至少235,至少240,至少245,至少250,至少255,至少260或至少265个266个如上确定的独立SNP。
SNP组可以包括,例如,266个如上确定的独立SNP中的约10至约20个,约20至约30个,约30至约40个,约40至约50个,约50至约60个,约60至约70个,约70约80至约90个,约90至约100个,约100至约110个,约110至约120个,约120至约130个,约130至约140个,约140至约150个,约150至约约160至约170个,约170至约180个,约180至约190个,约190至约200个,约200至约210个,约210至约220个,约220至约230个,约230至约240个,约240至约250个,约250至约260,或约250至约266个。
SNP组可以包括,例如,266个如上确定的独立SNP中的约195至约200个,约200至约205个,约210至约215个,约215至约220个,约220至约225个,约225至约230个,约230至约235个,约235至约240个,约240至约245个,约245至约250个,约250至约255个,约255至约260个,约260至约265个,或约260至约266个。
扩增和测序
可以扩增从移植受体分离的细胞游离DNA,用于下游技术和分析,例如分析来自细胞游离DNA的多态标记物组。用于DNA提取的各种方法和实验方案是本领域公知的,并且在本文中进行了描述(参见例如Current Protocols in Molecular Biology,最新版本)。可以使用QIAamp循环核酸试剂盒或其他合适的市售试剂盒提取细胞游离DNA。提取细胞游离DNA的其它示例性方法是公知的(参见,例如,Cell-Free Plasma DNA as a Predictor of Outcome in Severe Sepsis and Septic Shock.Clin.Chem.2008,v.54,p.1000-1007;Prediction of MYCN Amplification in Neuroblastoma Using Serum DNA and Real-Time Quantitative Polymerase Chain Reaction.JCO 2005,v.23,p.5205-5210;Circulating Nucleic Acids in Blood of Healthy Male and Female Donors.Clin.Chem.2005,v.51,p.1317-1319;Use of Magnetic Beads for Plasma Cell-free DNA Extraction:Toward Automation of Plasma DNA Analysis for Molecular Diagnostics.Clin.Chem.2003,v.49,p.1953-1955;Chiu RWK,Poon LLM,Lau TK,Leung TN,Wong EMC,Lo YMD.Effects of blood-processing protocols on fetal and total DNA quantification in maternal plasma.Clin Chem 2001;47:1607-1613;和Swinkels et al.Effects of Blood-Processing Protocols on Cell-free DNA Quantification in Plasma.Clinical Chemistry,2003,vol.49,no.3,525-526)。
扩增DNA的方法在本领域中同样是公知的,并且在本文中进行了描述。扩增通常涉及可以产生核酸拷贝的任何装置、方法或技术。细胞游离DNA的扩增可以包括例如聚合酶链反应(PCR)技术,例如线性扩增(参见USPN 6,132,997)、滚环扩增等。可以通过例如数字PCR或测序扩增细胞游离DNA以用于DNA的下游分析。Fluidigm Access ArrayTM系统,RainDance Technologies RainDrop系统或用于多重扩增的其它技术,均可用于多重扩增或高度平行单一DNA扩增。扩增可以包括使用高保真聚合酶,例如FastStart High Fidelity(Roche),Expand High Fidelity(Roche),Phusion Flash II(ThermoFisher Scientific),Phusion Hot Start II(ThermoFisher Scientific),KAPA HiFi Kapa BioSystems)或KAPA2G(Kapa Biosystems)。
扩增可以包括向每个单独分子添加独特序列的初始PCR循环,称为分子索引化。分子索引化允许定量评估每个SNP扩增子的两个等位基因的绝对水平,因此可以提高确定源自供体的细胞游离DNA百分比的精度和准确性。
扩增的DNA也可以进行额外的方法,例如标记(也称为条形码或标签)。索引DNA的方法是本领域公知的并且在本文中进行了描述。索引将允许使用多重测序平台,其与多种测序系统(例如Illumina HiSeq,MiSeq和ThermoFisher Scientific Ion PGM和Ion Proton)兼容。多重测序允许通过使用DNA索引特异性鉴定测序的DNA的样品来源来一次测定来自多个样品的DNA。
用于分析的DNA的量可以变化。在一些实施例中,从样品中获得的用于进一步遗传分析的DNA小于1pg,5pg,10pg,20pg,30pg,40pg,50pg,100pg,200pg,500pg,1ng,5ng,10ng,20ng,30ng,40ng,50ng,100ng,200ng,500ng,1μg,5μg,10μg,20μg,30μg,40μg,50μg,100μg,200μg,500μg或1mg DNA从样品中获得用于进一步的遗传分析。在一些情况下,约1-5pg,5-10pg,10-100pg,100pg-1ng,1-5ng,5-10ng,10-100ng或100ng-1μg。
本发明的方法涉及从细胞游离DNA测序靶基因座以及分析序列数据。用于DNA测序和分析的各种方法和实验方案是本领域公知的并且在本文中进行了描述。例如,可以使用高通量DNA测序技术完成DNA测序。下一代高通量测序的示例包括例如大规模平行签名测序,聚合酶克隆测序,454焦磷酸测序,使用HiSeq,MiSeq和其他平台的Illumina(Solexa)测序,SOLiD测序,离子半导体测序(Ion Torrent),DNA纳米球测序,透视单分子测序,单分子实时(SMRT)测序,和选定区域数字分析(DANSRTM)。参见,例如,"Next-Generation Sequencing Update".Genetic Engineering&Biotechnology News 28(15);Quail,Michael;Smith,Miriam E;Coupland,Paul;Otto,Thomas D;Harris,Simon R;Connor,Thomas R;Bertoni,Anna;Swerdlow,Harold P;Gu,Yong(1January 2012)."A tale of three next generation sequencing platforms:comparison of Ion torrent,pacific biosciences and illumina MiSeq sequencers".BMC Genomics 13(1):341;Liu,Lin;Li,Yinhu;Li,Siliang;Hu,Ni;He,Yimin;Pong,Ray;Lin,Danni;Lu,Lihua;Law,Maggie(1January 2012)."Comparison of Next-Generation Sequencing Systems".Journal of Biomedicine and Biotechnology 2012:1-11;Qualitative and quantitative genotyping using single base primer extension coupled with matrix-assisted laser desorption/ionization time-of-flight mass spectrometryMethods Mol Biol.2009;578:307-43;Chu T,Bunce K,Hogge WA,Peters DG.A novel approach toward the challenge of accurately quantifying fetal DNA in maternal plasma.Prenat Diagn 2010;30:1226-9;和Suzuki N,Kamataki A,Yamaki J,Homma Y.Characterization of circulating DNA in healthy human plasma.Clinica chimica acta;international journal of clinical chemistry 2008;387:55-8)。类似地,用于序列数据的初级和次级分析的软件程序是本领域公知的。
当存在来自移植受体的多个待测序的细胞游离DNA样品时,例如当从移植受体随时间获取多个样品时,可以单独对每个样品测序,或者可以使用多重测序将多个样品一起测序。
分析多肽标记等位基因分布模式和测定源自供体的细胞游离DNA
本发明的方法涉及相对于预期纯合或杂合分布模式,测定多态标记物组中多态标记等位基因分布模式的差异。所述模式分析允许测定从移植受体获得的细胞游离DNA样品中源自供体的细胞游离DNA水平。
通常,个体含有给定多态性标志物(如SNP)的纯合或杂合DNA。个体对于给定多态标记的一个等位基因可以是纯合的,包含该多态标记的一个等位基因为100%,且包含该多态标记的另一个等位基因为0%(例如对于给定的多态标记,给定多态性标记的等位基因A为100%,给定多态性标记的等位基因B为0%)。个体对于给定的多态标记也可以是杂合的,由此包含该多态标记的50%等位基因A和50%等位基因B。因此,如果样品中的所有DNA来源于单个个体,则预期在该样品中的DNA的任何给定多态性标记均显示纯合分布模式(即一个等位基因100%,;另一等位基因0%)或杂合分布模式(即一个等位基因50%且另一等位基因50%)。然而,如果DNA样品含有源自多于一个个体的DNA(例如来自移植受体的细胞游离DNA样品含有源自受体的DNA和源自供体的DNA),则给定多态性标记的多态标记等位基因分布可能从预期的纯合或杂合分布模式发生变化。这是因为两个个体对于给定多态性标记不一定具有相同合子性(例如个体1对于给定多态性标记的给定等位基因是纯合的,而个体2对于同一多态性标记的等位基因是杂合的)。当发生这种情况时,可以观察到预期等位基因分布模式相对于预期纯合或杂合分布模式的差异。该差异可用于评估来自单一个体的DNA样品中是否存在外来DNA。关于本发明的方法,多态性标记物组中的多态性标记物等位基因分布模式相对于预期纯合或杂合分布模式的差异,用于确定来自移植受体的细胞游离DNA样品中的源自供体的细胞游离DNA水平。
当根据本发明的方法分析来自细胞游离DNA的多态性标记序列数据时,可以观察到来自多态性标记的等位基因的多数信号,并且可以观察到来自多态性标记的等位基因的少数信号。关于从移植受体分离的细胞游离DNA,由于假定来自移植受体的细胞游离DNA样品中的大多数DNA来源于受体自身的内源DNA,因此进一步假定多数信号代表源于受体细胞游离DNA的多态性标记的等位基因,而少数信号代表源自供体的细胞游离DNA的多态性标记的等位基因。例如,两个等位基因平均分布的多态性标志物,例如SNPs,假定为大部分都来源于受体。偏离该平均分布则表示存在来自源自供体的细胞游离DNA的等位基因的影响。
可以基于来自序列数据的等位基因判定进行各种计算。例如,本发明的方法可以涉及计算细胞游离DNA总量的各种细胞游离DNA浓度或其百分比。总的来说,由于假定从移植受体分离的样品中来自细胞游离DNA的多数信号是源自受体的DNA,且少数信号是源自供体的DNA,因此该信息可用于计算细胞游离DNA样品中的源于供体的DNA百分比。
如上所述,供体和受体的个体基因分型不需要确定多态性标志物的哪个等位基因属于供体和/或受体,因为多态性标志物等位基因分布模式与预期纯合或杂合分布模式的差异,指示了从移植受体分离的细胞游离DNA分子群体中存在源自供体的细胞游离DNA。因此,可以在不使用来自移植受体、来自移植供体的基因型信息和/或来自任何来源的任何其他基因型信息的情况下,确定从移植受体获得的样品中源自供体的细胞游离DNA水平。所述无需考虑的基因型信息包括,例如,整个基因组整体或部分的基因型,或分析中的特定多态性标记的基因型。在一些实施例中,不进行移植受体的个体基因分型。在一些实施例中,不进行移植供体的个体基因分型。在一些实施例中,移植受体和移植供体都不进行单独基因分型。在一些实施例中,当测定从移植受体获得的样品中源自供体的细胞游离DNA水平时,不考虑来自移植受体的基因型信息。在一些实施例中,当确定来自移植受体的样品中源自供体的细胞游离DNA水平时,不考虑来自移植供体的基因型信息。在一些实施例中,在不考虑来自移植受体的基因型信息且不考虑移植供体的基因型信息的情况下,测定从移植受体获得的样品中源自供体的细胞游离DNA水平。在一些实施例中,可以在不使用基因型信息的情况下,测定从移植受体获得的样品中源自供体的细胞游离DNA水平。
计算的改进可以包括,估算和减去由于扩增或测序错误引起的信号水平,以提高精度和精度。例如,可以使用适当选择的SNPs子集来估计该子集的总和、平均值、中值或标准偏差,以产生对源自供体的细胞游离DNA总水平的计算。在给定的采样时间,来自相同对象的多个样品均具有相同的跨SNPs多态性分布模式,其可以用于改善对来自该对象的个体样品中源自供体的细胞游离DNA的估计。
可以以多种方式表达存在于细胞游离DNA样品中的源自供体的细胞游离DNA的量。在一些实施例中,将来自源自供体的细胞游离DNA中的一种或多种DNA分子的量确定为样品中总DNA分子的百分比。在一些实施例中,将来自源自供体的细胞游离DNA中的一种或多种DNA分子的量确定为样品中总DNA的比例。在一些实施例中,将来自源自供体的细胞游离DNA中的一种或多种DNA分子的量确定为相对于样品中的一种或多种参考DNA分子的比例或百分比。例如,源自供体的细胞游离DNA的总量可以确定为细胞游离DNA样品中总DNA分子的10%。或者,相对于细胞游离DNA样品中的总DNA分子,源自供体的细胞游离DNA总量可以为1:10的比率。在一些实施例中,来自源自供体的细胞游离DNA中的一种或多种DNA分子的量可以确定为浓度。例如,细胞游离DNA样品中源自供体的细胞游离DNA总量可以确定为1μg/mL。这里描述的值仅仅是示例性的,用于说明表达源自供体的细胞游离DNA数量的各种方式。来自移植受体的细胞游离DNA样品中,源自供体的细胞游离DNA的百分比可能极低(例如,等于或低于细胞游离DNA样品中的总DNA含量的0.5%)。应注意,细胞游离DNA样品中,源自受体的细胞游离DNA的量也可以用表达源自供体的细胞游离DNA的方式来表达。细胞游离DNA样品中的DNA分子的给定来源、类型或序列数量的其他表达方法,对于本领域技术人员是显而易见的。
本发明的上述实施例可以以各种方式实现。例如,实施例的一些方面可以使用硬件、软件或其组合来实现。当以软件实现时,软件代码可以用任何合适的处理器或处理器组合执行,无论其设置在单个计算机中还是分布在多个计算机中。应当理解,执行上述功能的任何组件或组件组合可以通常看作是控制上述功能的一个或多个控制器。所述一个或多个控制器可以以许多方式实现,诸如利用专用硬件或以微代码或软件编程以执行上述功能的通用硬件(例如,一个或多个处理器)。
在此方面,应当注意,本发明的各种特征的实现,可以使用至少一个非暂时性计算机可读存储介质(例如,计算机存储器、软盘、光盘、磁带等等),其在计算机程序(即,多个指令)上编码,当在处理器上执行时,其执行上述讨论的功能。计算机可读存储介质可以是可传输的,使得其上存储的程序可以加载到任何计算机资源上,以实现本申请所述公开内容的某些方面。此外,应当注意,对在执行时执行上述功能的计算机程序的引用,不限于在主计算机上运行的应用程序。相反,此述的术语“计算机程序”是在一般意义上指代可用于处理器编程以实现本发明的某些方面的任何类型计算机代码(例如,软件或微代码)。
测定同种异体移植物状态
本发明中用于测定来自移植受体的样品中源自供体的细胞游离DNA水平的方法,可用于确定移植受体中的同种异体移植物状态。一般来说,在移植受体中,源自供体的细胞游离DNA随时间的变化水平或差异超过合适的阈值,具有关于同种异体移植物状态的信息性。
阈或阈值,通常指代指示一种条件是否存在或风险是否存在的任何预定水平或水平范围。阈值可以采取各种形式。它可以是单个临界值,例如中值或平均值。作为另一示例,阈值可以从条件或风险存在之前或在治疗过程之后的基线值加以确定。这样的基线可以指示对象中与正在测试的风险或病症不相关的正常或其他状态。例如,基线值可以是在实际移植事件之前来自移植受体的样品中源自供体的细胞游离DNA水平,其可能是零或可忽略值,但也可以指示系统中的基线误差。在一些实施例中,阈值可以是正在测试的对象的基线值。由于其涉及在移植受体中区分源自供体的细胞游离DNA水平显著变化或差异,因此阈值的变化可能相当大。本领域技术人员能够认识到用于确定移植受体中源自供体的细胞游离DNA随时间的水平显著变化或差异的适当参数和方法。一旦选择了合适的分析参数,确定移植受体中源自供体的细胞游离DNA在一段时间内水平变化或差异,可以指示同种异体移植物状态。
在一些实施例中,移植受体中源自供体的细胞游离DNA水平或差异随时间的增加表明移植排斥、调节免疫抑制疗法的需要、免疫抑制疗法肾毒性、感染和/或进一步研究同种异体移植状态的需要。不受理论束缚地,一般认为如果源自供体的细胞游离DNA水平在移植受体中随着时间增加,那么同种异体移植物的细胞经历的凋亡和/或坏死随着时间逐渐增加,其指示着移植排斥。
在一些实施例中,移植受体中源自供体的细胞游离DNA水平或差异随时间降低,指示着移植耐受性、调节免疫抑制疗法的需要和/或进一步研究同种异体移植状态的需要。不受理论束缚地,一般认为如果源自供体的细胞游离DNA水平随着时间在移植受体中降低,那么同种异体移植物的细胞随着时间经历凋亡和/或坏死随着时间逐渐减少,其指示着移植耐受、过度免疫抑制或适当免疫抑制。
在一些实施例中,移植受体中源自供体的细胞游离DNA水平或差异随时间没有变化,指示着稳定的移植排斥状态和/或调节免疫抑制疗法的机会。不受理论束缚地,一般认为如果源自供体的细胞游离DNA水平在移植受体中随时间没有改变,那么同种异体移植物的细胞随时间经历凋亡的稳态水平,这表明稳定的移植排斥状态。稳定的移植排斥状态指示了分析时间段期间的同种异体移植物状态,但是不指示同种异体移植的发展前进发展方向,无论是朝向排斥或耐受。例如,同种异体移植物可以在移植受体中经历活性排斥,但是稳定的移植排斥状态表明同种异体移植排斥的速率在其分析期间没有改变(即,移植排斥的速率未增加或减少)。类似地,同种异体移植物可以在移植受体中经历活性耐受,但稳定的移植排斥状态表明同种异体移植物耐受率在其分析期间没有改变(即,移植耐受率未增加或降低)。
调节免疫抑制疗法
本发明中用于测定来自移植受体的样品中源自供体的细胞游离DNA水平的方法,可用于指示调节施用于移植受体的免疫抑制疗法的需要。一般来说,在移植受体中的源自供体的细胞游离DNA随时间的水平变化或差异超过合适的阈值,可提供确定调节施用于移植受体的免疫抑制疗法的需要的信息。
免疫抑制疗法通常是指,施用抑制对象免疫应答的免疫抑制剂或其它治疗剂。示例性的免疫抑制剂可包括例如抗凝剂、抗疟药、心脏药、非甾体抗炎药(NSAID),以及类固醇,包括例如Ace抑制剂,阿司匹林,硫唑嘌呤,B7RP-1-fc,β-阻断剂、布雷那钠,坎帕斯-1H,塞来考昔,氯喹,皮质类固醇,香豆素,环磷酰胺,环孢菌素A,DHEA,脱氧精胍菌素,地塞米松,双氯芬酸,多柔比星,依托度酸,依维莫司,FK778,吡罗昔康,非诺洛芬,氟比洛芬,肝素,肼屈嗪,羟氯喹,CTLA-4或LFA3免疫球蛋白,布洛芬,吲哚美辛,ISAtx-247,酮洛芬,酮咯酸,来氟米特,甲氯芬那酸盐,甲芬那酸,美吡拉明,6-巯基嘌呤,美洛昔康,甲氨蝶呤,咪唑立宾,霉酚酸酯,萘普生,奥沙普秦,羟氯喹,NOX-100,泼尼松,甲泼尼龙,雷帕霉素(西罗莫司),舒林酸,他克莫司(FK506),胸腺球蛋白,托美丁,特发霉素,UO126,和抗体,包括例如α淋巴细胞,阿达木单抗,抗CD3,抗CD25,抗IL2R,和抗TAC抗体,巴利昔单抗,达利珠单抗,依那西普,hu5C8,英夫利昔单抗,OKT4和那他珠单抗。
在一些实施例中,移植受体中源自供体的细胞游离DNA的水平或差异随时间增加,表明需要增加对移植受体施用的免疫抑制疗法。增加对移植受体施用的免疫抑制疗法的决定,可以基于另外的临床因素,例如移植受体的健康。在一些实施例中,增加施用于对象的免疫抑制疗法。
在一些实施例中,移植受体中源自供体的细胞游离DNA的水平或差异随时间降低,表明需要减少施用于移植受体的免疫抑制疗法。减少施用于移植受体的免疫抑制疗法的决定,可以基于另外的临床因素,例如移植受体的健康。在一些实施例中,减少施用于对象的免疫抑制疗法。
在一些实施例中,移植受体中源自供体的细胞游离DNA的水平或差异随时间没有变化,表面无需调节施用于移植受体的免疫抑制疗法,或免疫抑制疗法可被维持。维持对移植受体施用的免疫抑制疗法的决定,可以基于另外的临床因素,例如移植受体的健康。在一些实施例中,维持对对象施用的免疫抑制疗法。
在一些实施例中,免疫抑制疗法的调节,包括改变施用于移植受体的免疫抑制剂或其它免疫抑制疗法的类型或形式。在移植受体未接受免疫抑制疗法的一些实施例中,本发明的方法可以指示开始对移植受体施用免疫抑制疗法的需要。
应当注意,当确定是否需要或缺乏调节施用于移植受体的免疫抑制疗法时,移植受体中源自供体的细胞游离DNA水平可能不是考虑的唯一因素。例如,对于在一段时间间隔内表现出源自供体的细胞游离DNA水平升高且感染严重程度增加的移植受体,增加或甚至维持当前免疫抑制疗法可能均是不可取的。因此,应当注意,取决于是否存在其它对照临床因素,可以增加、减少或维持对移植受体施用的免疫抑制疗法,而不管移植受体中源自供体的细胞游离DNA的确定水平如何。
其他分析
本发明的方法可以与来自移植受体的样品的其他分析一起或结合进行,以诊断同种异体移植物状态和/或指示调节施用于对象的免疫抑制疗法的需要。
在一些实施例中,测试了移植受体中感染因子的存在或水平。可以测试的感染剂包括:例如,病毒;细菌,如铜绿假单胞菌,肠杆菌,诺卡氏菌,肺炎链球菌,金黄色葡萄球菌,和军团杆菌;真菌,如假丝酵母,曲霉,隐球菌,卡氏肺囊虫;或者寄生虫,如弓形虫。
在一些实施例中,测试移植受体中病毒感染因子的存在或水平。可以在来自移植受体的样品中获得的核酸中分析病毒生物标志物,以确定移植受体中病毒的存在或水平。可以测试的病毒包括例如巨细胞病毒,Epstein-Barr病毒,指环病毒和BK病毒。对病毒的存在或水平的测试结果,可用于对移植受体的免疫状态进行分类,并确定移植受体中的感染状态。在一些实施例中,在分类为具有临床显著感染高风险的移植受体中,减少或至少不增加免疫抑制疗法。在一些实施例中,在归类为具有临床显著感染低风险的移植受体中,增加或至少不减少免疫抑制疗法。应当注意,由于其他临床因素可以用于为调整免疫抑制疗法的决定提供信息,可以将目前施用于移植受体的免疫抑制疗法增加、减少或维持,而不考虑对病毒的存在或水平的测试结果和/或临床重大感染风险分类。
在一些实施例中,本发明的方法还涉及进行AlloMap测试,以帮助确定移植物受体中同种异体移植物状态。AlloMap测试涉及使用从外周血单核细胞(PBMC)分离的RNA进行定量实时聚合酶链反应(qRT-PCR)测定。分析所选的若干基因的表达,并且将该基因表达数据用于提供与移植受体中同种异体移植物状态相关的信息。AlloMap测试是本领域已知的。AlloMap测试的结果可以与本发明的方法结合使用,连同或不连同从组合测试中定义单个评分的方法,以确定移植受体中同种异体移植物状态和/或指示需要以调节施用于移植受体的免疫抑制疗法。
在一些实施例中,本发明的方法涉及确定可用于表示移植受体中同种异体移植物状态的组合评分。组合评分通常基于用于探测移植受体中同种异体移植物状态的多个(例如两个或更多个)测定的结果来计算。例如,可基于移植受体中源自供体的细胞游离DNA测定水平和基于基因表达谱分析测定的结果,计算组合评分,例如测量选定基因的AlloMap测试表达。可以基于从移植受体获得的单个样品,或者可以基于在一段时间间隔内从移植受体获取的样品,计算组合评分。组合评分可用于确定移植受体中同种异体移植物状态和/或指示调节施用于移植受体的免疫抑制疗法的需要。
本发明的方法公开还可以使用用于诊断移植受体中同种异体移植物状态和/或确定需要调节免疫抑制疗法的其它生物标志物分析、基因表达测定法和其它测定法,连同或不连同从组合测试定义单个得分的方法,这对于本领域技术人员将是显而易见的。
可以进行另外的分析以鉴定移植受体中的新的、转移性或复发性癌症的标志物。引物可以设计为扩增已知发生遗传突变的区域,以通过鉴定已知肿瘤相关突变来提供癌症的早期检测。这可能是至少部分有利的,因为移植受体可能由于过度免疫抑制而面临发展某些恶性肿瘤的更高风险。
以下示例用于说明所提供的实施例,而不旨在限制本发明的范围。
实施例
实施例1-分析细胞游离DNA以确定移植受体中的移植器官状态并确定调节免疫抑制疗法的需要
本实施例展示了对包含来自移植受体的细胞游离DNA的样品进行分析以确定样品中源自供体的细胞游离DNA水平。源自供体的细胞游离DNA随时间的水平变化或差异用于诊断移植器官在移植受体中的状态,以及指示对调节或维持施用于移植物受体的免疫抑制疗法的需要。
对象选择
选择在本实施例所述测定12个月之前即为肾移植对象的人类患者。该患者正接受免疫抑制疗法的治疗以防止同种异体移植物排斥。在移植事件后的第12个月(一周年)开始,在连续三个月期间,每周从该对象采集单独的血浆样品。相应地,移植受体将在其移植事件后的第12、13和14个月期间接收分析。本实施例中描述的方法适用于从移植受体分离的一个或多个样品。
血浆采集
从对象提取血液,由此该血液样品中分离血浆并从该血浆中提取细胞游离DNA。根据先前所述的静脉穿刺法(Clinical and Laboratory Standards Institute,2012),将血样收集在细胞游离DNA的血液采集管(Streck)中。Streck管完全充满血液样品。将管从适配器中取出,并通过轻微翻转立即混合大约8至10次。收集后的至多14天内,将管在6-37℃的温度范围内运输和储存。在处理样品时,将含有血液样品的Streck管在室温下以1600×g离心20分钟。小心地取出所得血浆层并转移至15mL管中。然后将该血浆样品在室温下以1600×g离心10分钟。小心取出所得血浆层并置于新管中,然后血浆样品可以进行处理以提取细胞游离DNA(cf DNA)。在血浆收集期间也可以使用PPT血浆制备管(Becton Dickinson)和CPT倒出(pour-off)法。
细胞游离DNA(cfDNA)提取
取血浆样品中的约5mL血浆进行细胞游离DNA提取。对于细胞游离DNA血液采集管(Streck),可以使用Qiagen实验方案(QIAamp Circulating Nucleic Acid Handbook,2011)的第26页并经以下修改:在第28页的步骤4中,培养期为60℃下1小时℃;且第29页的步骤15中,用30μL Buffer AVE洗脱。对于PPT血浆制备管(Becton Dickinson),可以使用Qiagen实验方案(QIAamp Circulating Nucleic Acid Handbook,2011)的第22页并经以下修改:在第25页的步骤15中,用21μL Buffer AVE洗脱。QIAsymphony方法也可用于提取cfDNA。其它DNA提取方法还可以包括基于苯酚/氯仿的提取方法。
SNP选择
从对象的血浆样品中提取细胞游离DNA之后,可以在细胞游离DNA中测定各种SNP。选择多种SNP用于分析。可以选择能够提供最高可能次要等位基因频率(最接近50%)的SNPs。对象基因组中的SNPs位置可能变化;可能允许遗传连锁,但是SNPs的部分遗传分离,例如>200bp的分离,也可能是可取的。待使用的SNPs数量和种类应当提供足以准确估计对象的血浆样品中存在的源自供体cfDNA百分比的力度。在该测定中使用的SNPs包括先前鉴定的那些(Pakstis et al.,2010)。为了扩增SNPs,设计了92个引物对(Fluidigm)。
DNA扩增材料
为了扩增包括细胞游离DNA中所需SNPs的靶向区域,对用于扩增过程的各种材料进行了组装。使用FastStart高保真PCR系统(Roche)。设计并制备了92个引物对(IDT或Fluidigm/Fluidgim设计)。使用ExoI和ExoI缓冲液(New England BioLabs)。后续方法包括Fluidigm预扩增实验方案(参见“Access Array System for Illumina Sequencing System”的第152页)。使用的仪器包括PCR机、板式离心机和涡旋器。
DNA扩增
根据Fluidigm Access Array方法和实验方案(参见Access Array System for Illumina Sequencing System的第63页)扩增细胞游离DNA。可用于该扩增方案的材料包括Fluidigm Access Array或芯片、FastStart高保真PCR系统(Roche)、1X Access Array收获液(Fluidigm,PN 100-1031)、20X Access Array加载试剂(Fluidigm),以及如上所述设计的92个引物对。用于该扩增实验方案的仪器包括两个IFC控制器AX(Fluidigm)和一个FC1循环仪(Fluidigm)。
条码化
在扩增细胞游离DNA后,将扩增的DNA进行条码化。例如,如果来自所有样品的细胞游离DNA分子一起进行测序,可以通过条码化来唯一地标定所检测到的任一扩增DNA来自三个样品中的哪一个。根据Fluidigm Access Array方法和实验方案(参见Illumina Sequencing System的Access Array System的第70页)对扩增的细胞游离DNA进行条码化。用于该条码化方案的材料包括FastStart高保真PCR系统(Roche)和用于Illumina测序仪(Fluidigm)的Access Array条码文库(Access Array Barcode Library)。使用的仪器包括PCR机、板式离心机和涡旋器。
测序
在细胞游离DNA经条码化之后,对其进行测序。根据Fluidigm/Illumina测序方案对条码化的细胞游离DNA以多重测序进行测序(参见Access Array System for Illumina Sequencing System的第134页)。用于该测序方案的材料包括FL1和FL2测序引物(Fluidigm)、HT1缓冲液(Illumina)和MiSeq试剂盒v2(Illumina)。使用的仪器包括MiSeq测序仪器(Illumina)。
数据分析
在对细胞游离DNA进行测序后,对其进行分析以确定如上所述的各种SNP等位基因的存在和/或数量。主要分析设计从MiSeq仪器生成FASTQ输出文件。二级分析涉及将MiSeq测序的输出序列与参考序列比对,在本例中,参考序列是来自人类基因组的序列。使用比对软件“Bowtie”以默认设置进行与整个基因组的比对。根据需要,可以进行变更,从而仅比对期望的扩增子。等位基因感知比对器还可以用于实现与非参照等位基因的更好比对(50%的比对)。在比对完成后,使用“LoFreq”软件程序分配变体频率(Wilm et al.,2012)。三级分析涉及分析的质量控制方面。进行数据分析,以确保已达到读取最小数目而实现足量计数。还进行了数据分析,以确保已经达到高于背景而低于杂合调节水平的最小数量SNP基因座。所述下限(背景)和上限(移植受体杂合基因座)可以变化。此外,可以确定基因组DNA并指定临界值。
用于三级数据的方法,将确定给定样品中源自供体的细胞游离DNA水平。该分析包括确定上限和下限临界值,为纯合和杂合SNPs赋值,将杂合SNPs乘以2,计算中位值和计算置信区间(CI)。用于提高分析质量的其它分析方法和/或方法包括基于似然性(likelihood)确定每个等位基因的贡献,在每个测序反应中使用具有限定的噪声水平/基因座的对照DNA,,基于似然性或β分布分配纯合或杂合状态,并分配可能经加权来处理低端处的压缩失真的判定。应当注意,来自对象的每一额外样品均可能提高确定源自供体细胞游离DNA百分比的准确性的置信度。测定移植器官状态
上述数据分析方法用于测定取自移植受体的各细胞游离DNA样品中源自供体的细胞游离DNA水平。数据分析包括比较三个样品中的每一个中源自供体的细胞游离DNA水平,以确定在从移植受体分离的细胞游离DNA中,源自供体的细胞游离DNA水平是否在随时间增加、减少或维持在相对恒定的水平。源自供体的细胞游离DNA水平或差异随时间的增加指示着移植排斥,需要调整免疫抑制疗法和/或需要进一步调查移植器官状态。源自供体的细胞游离DNA的水平或差异的降低指示着移植耐受,需要调节免疫抑制疗法和/或需要进一步研究移植器官状态。源自供体的细胞游离DNA的水平或差异随时间没有变化指示着稳定的移植排斥状态和/或调整免疫抑制疗法的机会。
实施例2–对细胞游离DNA以确定移植受体中的移植器官状态并确定调节免疫抑制疗法的需要的其他分析
本实施例展示了,在如实施例1所述的分析的基础上,对包含来自移植受体的细胞游离DNA的样品进行其他分析,以确定样品中源自供体的细胞游离DNA水平。源自供体的细胞游离DNA随时间的水平变化或差异用于诊断移植器官在移植受体中的状态,以及指示对调节或维持施用于移植物受体的免疫抑制疗法的需要。
对象选择
选择在本实施例所述测定12个月之前即为肾移植对象的人类患者。该患者正接受免疫抑制疗法的治疗以防止同种异体移植物排斥。在移植事件后的第12个月(一周年)开始,在连续三个月期间,每周从该对象采集单独的血浆样品。相应地,移植受体将在其移植事件后的第12、13和14个月期间接收分析。本实施例中描述的方法适用于从移植受体分离的一个或多个样品。
血浆采集
从对象提取血液,由此该血液样品中分离血浆并从该血浆中提取细胞游离DNA。根据先前所述的静脉穿刺法(Clinical and Laboratory Standards Institute,2012),将血样收集在细胞游离DNA的血液采集管(Streck细胞游离DNA BCT)中。Streck管完全充满血液样品。将管从适配器中取出,并通过轻微翻转立即混合大约8至10次。收集后的至多14天内,将管在6-37℃的温度范围内运输和储存。在处理样品时,将含有血液样品的Streck管在室温下以1600×g离心20分钟。小心地取出所得血浆层并转移至15mL管中。然后将该血浆样品在室温下以1600×g离心10分钟,取出上清液并置于新管中,在室温下以16000×g离心10分钟。小心取出所得血浆层并置于新管中,然后血浆样品可以进行处理以提取细胞游离DNA(cf DNA)。在血浆收集期间也可以使用PPT血浆制备管(Becton Dickinson)和CPT倒出(pour-off)法。
细胞游离DNA(cfDNA)提取
取血浆样品中的约5mL血浆进行细胞游离DNA提取。对于细胞游离DNA血液采集管(Streck),可以使用Qiagen实验方案(QIAamp Circulating Nucleic Acid Handbook,2011)的第26页并经以下修改:在第28页的步骤4中,培养期为60℃下1小时℃;且第29页的步骤15中,用30μL Buffer AVE洗脱。对于PPT血浆制备管(Becton Dickinson),可以使用Qiagen实验方案(QIAamp Circulating Nucleic Acid Handbook,2011)的第22页并经以下修改:在第25页的步骤15中,用21μL Buffer AVE洗脱。QIAsymphony方法也可用于提取cfDNA。其它DNA提取方法还可以包括基于苯酚/氯仿的提取方法。
SNP选择
从对象的血浆样品中提取细胞游离DNA之后,可以在细胞游离DNA中测定各种SNP。选择多种SNP用于分析。可以选择能够提供最高可能次要等位基因频率(最接近50%)的SNPs。对象基因组中的SNPs位置可能变化;可能允许遗传连锁,但是SNPs的部分遗传分离,例如>200bp的分离,也可能是可取的。待使用的SNPs数量和种类应当提供足以准确估计对象的血浆样品中存在的源自供体cfDNA百分比的力度。在该测定中使用的SNPs包括先前鉴定的那些(Pakstis et al.,2010),以及其他经选择满足大于0.4次要等位基因频率(公认的低DNA聚合酶错误率)和低连锁度的其他SNPs。为了扩增SNPs,设计了266个引物对(Fluidigm)。
DNA预扩增
为了扩增包括细胞游离DNA中所需SNPs的靶向区域,对用于扩增过程的各种材料进行了组装。使用高保真聚合酶如FastStart高保真PCR系统(Roche),Expand High Fidelity(Roche),Phusion Flash II(ThermoFisher Scientific),Phusion Hot Start II(ThermoFisher Scientific),KAPA HiFi(Kapa BioSystems)或KAPA2G Kapa Biosystems)。设计并制备了266个引物对(IDT或Fluidigm/Fluidgim设计)。使用ExoI和ExoI缓冲液(New England BioLabs)。后续方法包括Fluidigm预扩增实验方案(参见“Access Array System for Illumina Sequencing System”的第152页)。使用的仪器包括PCR机、板式离心机和涡旋器。
DNA扩增
根据Fluidigm Access Array方法和实验方案(参见Access Array System for Illumina Sequencing System的第63页)扩增细胞游离DNA。可用于该扩增方案的材料包括Fluidigm Access Array或芯片、高保真聚合酶(例如FastStart High Fidelity(Roche),Expand High Fidelity(Roche),Phusion Flash II(ThermoFisher Scientific),Phusion Hot Start II(ThermoFisher Scientific),KAPA HiFi(Kapa BioSystems)或KAPA2G(Kapa Biosystems))、1X Access Array收获液(Fluidigm,PN 100-1031)、20X Access Array加载试剂(Fluidigm),以及如上所述设计的266个引物对。用于该扩增实验方案的仪器包括两个IFC控制器AX(Fluidigm)和一个FC1循环仪(Fluidigm)。
索引化(亦称为条码化)
在扩增细胞游离DNA后,使用索引序列(也称为条码或标签)对扩增的DNA进行索引化。例如,如果来自所有样品的细胞游离DNA分子一起进行测序,可以通过索引化来唯一地标定所检测到的任一扩增DNA来自三个样品中的哪一个。根据Fluidigm Access Array方法和实验方案(参见Illumina Sequencing System的Access Array System的第70页)对扩增的细胞游离DNA进行索引化。用于该索引化方案的材料包括高保真聚合酶如FastStart高保真PCR系统(Roche)、Expand High Fidelity(Roche)、Phusion Flash II(ThermoFisher Scientific)、Phusion Hot Start II(ThermoFisher Scientific)、KAPA HiFi(Kapa BioSystems)或KAPA2G Kapa Biosystems),和用于Illumina测序仪(Fluidigm)的Access Array条码文库(Access Array Barcode Library,也称为索引文库)。使用的仪器包括PCR机、板式离心机和涡旋器。
测序
在细胞游离DNA经扩增和索引化之后,对其进行测序。根据Fluidigm/Illumina测序方案对索引化的细胞游离DNA以多重测序进行测序(参见Access Array System for Illumina Sequencing System的第134页)。用于该测序方案的材料包括FL1和FL2测序引物(Fluidigm)、HT1缓冲液(Illumina)和MiSeq试剂盒v3(Illumina)。使用的仪器包括MiSeq测序仪器(Illumina)。
数据分析
在对细胞游离DNA进行测序后,对其进行分析以确定如上所述的各种SNP等位基因的存在和/或数量(例如参见图7)。主要分析设计从MiSeq仪器生成FASTQ输出文件。二级分析涉及将MiSeq测序的输出序列与参考序列比对,在本例中,参考序列是来自人类基因组的序列。使用“Cutadapt”和“TrimGalore”软件包进行末尾裁剪。使用比对软件“BWA”与包含该组扩增后的扩增子的基因组区域进行比对。等位基因感知比对器还可以用于实现与非参照等位基因的更好比对(50%的比对)。在比对完成后,使用“SAMtools”软件程序和定制为令所含测序错误最小化的设定来分配变体频率。三级分析涉及分析的质量控制方面。进行数据分析,以确保已达到读取最小数目而实现每个SNP位置的足量计数,并确保受体中无其他等位基因存在。还进行了数据分析,以确保已经达到高于背景而低于杂合调节水平的最小和最大数量SNP基因座。所述下限(背景)和上限(移植受体杂合基因座)可以变化。另外,还有用于确保足够输入DNA以通过确定杂合SNP数据的质量来实现精确测量的度量。此外,可以确定基因组DNA并指定临界值。
在三级数据中使用的方法将确定给定样品中源自供体的细胞游离DNA水平。该分析包括确定受体中的纯合SNPs组,确定受体纯合SNPs的等位基因频率的上限和下限临界值,估计供体来源的细胞游离DNA的百分比,计算剩余纯合受体SNPs的平均值,以及基于供体和受体之间的关系评估乘数,并计算置信区间(CI)。用于改善分析质量的其它分析方法和/或方法包括:基于拟然性或贝叶斯定理估计每个SNP的供体或受体等位基因分布,或估计源自供体的细胞游离DNA百分比,并在每个测序反应中使用限定了各基因座噪声水平的对照DNA。应当注意,来自对象的每一额外样品均可能提高确定源自供体细胞游离DNA百分比的准确性的置信度。
测定移植器官状态
上述数据分析方法用于测定取自移植受体的各细胞游离DNA样品中源自供体的细胞游离DNA水平。数据分析包括比较三个样品中的每一个中源自供体的细胞游离DNA水平,以确定在从移植受体分离的细胞游离DNA中,源自供体的细胞游离DNA水平是否在随时间增加、减少或维持在相对恒定的水平。源自供体的细胞游离DNA水平或差异随时间的增加指示着移植排斥,需要调整免疫抑制疗法和/或需要进一步调查移植器官状态。源自供体的细胞游离DNA的水平或差异的降低指示着移植耐受,需要调节免疫抑制疗法和/或需要进一步研究移植器官状态。源自供体的细胞游离DNA的水平或差异随时间没有变化指示着稳定的移植排斥状态和/或调整免疫抑制疗法的机会。
实施例3–分析细胞游离DNA以确定移植受体中的心脏移植器官状态并预测调节免疫抑制疗法的需要
本实施例展示了对包含来自18个移植受体的细胞游离DNA的样品进行分析,以确定样品中源自供体的细胞游离DNA水平。源自供体的细胞游离DNA随时间的水平变化用于诊断移植器官在移植受体中的状态,并预测该移植器官的未来状态,以及指示对调节或维持施用于移植物受体的免疫抑制疗法的需要。
对象选择
选择在本实施例所述测定之前的心脏移植对象的人类患者。所述患者正接受免疫抑制疗法的治疗以防止同种异体移植物排斥。在连续五个月期间,在所述对象根据标准护理要求在各中心就诊时从该对象采集单独的血浆样品。本实施例中描述的方法适用于从移植受体分离的一个或多个样品。
血浆采集
从对象提取血液,由此该血液样品中分离血浆并从该血浆中提取细胞游离DNA。根据先前所述的静脉穿刺法(Clinical and Laboratory Standards Institute,2012),将血样收集在PPT管中。PPT管(血浆制备管,Becton Dickinson)完全充满血液样品。将管从适配器中取出,并通过轻微翻转立即混合。收集后,将管根据厂商说明书离心,并在-80℃下存储。在处理样品时,将所述管解冻,小心地取出所得血浆层并转移至干净管中。然后将该血浆样品在室温下以1600×g离心10分钟,取出上清液并置于新管中,在室温下以16000×g离心10分钟。小心取出所得血浆层并置于新管中制备以提取细胞游离DNA(cf DNA)。
细胞游离DNA(cfDNA)提取
取血浆样品中的约1mL血浆进行细胞游离DNA提取。对于PPT血浆制备管(Becton Dickinson),使用Qiagen实验方案(QIAamp Circulating Nucleic Acid Handbook,2011)的第22页并经以下修改:在第25页的步骤15中,用21μL Buffer AVE洗脱。
SNP选择
选用了多种SNPs用于分析,以估计对象血浆样品中存在的源自供体的cfDNA百分比。选择用于分析的SNPs为:rs10488710,rs279844,rs1048290,rs1049379,rs1051614,rs1052637,rs1055851,rs1056033,rs1056149,rs1064074,rs1078004,rs10831567,rs6811238,rs11106,rs11210490,rs1126899,rs1127472,rs1127893,rs1130857,rs1049544,rs11547806,rs12237048,rs430046,rs12508837,rs12529,rs12717,rs13184586,rs13295990,rs13428,rs13436,rs1374570,rs14080,rs1411271,rs576261,rs14155,rs1151687,rs1565933,rs1600,rs1678690,rs1881421,rs1897820,rs1898882,rs2056844,rs20575,rs10092491,rs2070426,rs2071888,rs2075322,rs2180314,rs2185798,rs2227910,rs2228560,rs2229571,rs2229627,rs2245285,rs2342747,rs2248490,rs2253592,rs2254357,rs2275047,rs2279665,rs2279776,rs2281098,rs2287813,rs4364205,rs2289751,rs2289818,rs2292830,rs2294092,rs2295005,rs2296545,rs2297236,rs2302443,rs2306049,rs1022478,rs445251,rs230898,rs231235,rs2342767,rs236152,rs2362450,rs2384571,rs2455230,rs246703,rs2480345,rs248385,rs2498982,rs2505232,rs2509943,rs2519123,rs2523072,rs2571028,rs2657167,rs28686812,rs2946994,rs1294331,rs10419826,rs3088241,rs3110623,rs3173615,rs3190321,rs3205187,rs344141,rs35596415,rs362124,rs36657,rs1872575,rs159606,rs3731877,rs3734311,rs3735615,rs3740199,rs3748930,rs3751066,rs3790993,rs3802265,rs3803763,rs1004357,rs3803798,rs3809972,rs3810483,rs3812571,rs3813609,rs3814182,rs3816800,rs3826709,rs3829655,rs3951216,rs1019029,rs408600,rs41317515,rs436278,rs448012,rs475002,rs4845480,rs4849167,rs4865615,rs1027895,rs4890012,rs492594,rs4940019,rs4971514,rs523104,rs528557,rs545500,rs561930,rs57010808,rs57285449,rs10500617,rs6061243,rs609521,rs62490396,rs625223,rs638405,rs6459166,rs648802,rs6510057,rs6764714,rs10768550,rs6790129,rs6794,rs6807362,rs6838248,rs713598,rs7161563,rs726009,rs7289,rs7301328,rs7332388,rs10773760,rs743616,rs743852,rs745142,rs7451713,rs7526132,rs7543016,rs7601771,rs7785899,rs7825,rs8009219,rs10776839,rs8025851,rs8058696,rs8076632,rs8097,rs8103906,rs874881,rs9262,rs9289122,rs936019,rs9393728,rs1109037,rs977070,rs9865242,rs12480506,rs560681,rs12997453,rs13134862,rs13218440,rs1358856,rs1410059,rs1478829,rs1498553,rs1523537,rs4606077,rs1554472,rs1736442,rs1821380,rs2046361,rs214955,rs2175957,rs2255301,rs2269355,rs2270529,rs2272998,rs2291395,rs2292972,rs2399332,rs2503107,rs2567608,rs2811231,rs2833736,rs315791,rs321198,rs6955448,rs338882,rs3780962,rs4288409,rs4530059,rs464663,rs4789798,rs4796362,rs4847034,rs521861,rs1058083,rs5746846,rs590162,rs6444724,rs6591147,rs689512,rs7205345,rs722290,rs740598,rs7520386,rs221956,rs7704770,rs8070085,rs8078417,rs891700,rs901398,rs9546538,rs9606186,rs985492,rs9866013,rs987640,rs13182883,rs9905977,rs993934,rs9951171,rs10274334,rs10421285,rs1043413,rs1044010,rs1045248,rs1045644,和rs1047979。为了扩增SNPs,涉及了266个引物对(Fluidigm)。
DNA预扩增
为了扩增包括细胞游离DNA中所需SNPs的靶向区域,对各种材料进行组装并将其用于扩增过程。使用Phusion Hot Start II(ThermoFisher Scientific)。设计并制备了266个引物对(IDT或Fluidigm/Fluidgim设计)。使用ExoI和ExoI缓冲液(New England BioLabs)。后续方法包括Fluidigm预扩增实验方案(参见“Access Array System for Illumina Sequencing System”的第152页)。使用的仪器包括PCR机、板式离心机和涡旋器。
DNA扩增
根据Fluidigm Access Array方法和实验方案(参见Access Array System for Illumina Sequencing System的第63页),扩增源自预扩增的细胞游离DNA。可用于该扩增方案的材料包括Fluidigm Access Array或芯片、高保真聚合酶Phusion Flash II(ThermoFisher Scientific)、1X Access Array收获液(Fluidigm,PN 100-1031)、20X Access Array加载试剂(Fluidigm),以及如上所述设计的266个引物对。用于该扩增实验方案的仪器包括两个IFC控制器AX(Fluidigm)和一个FC1循环仪(Fluidigm)。
索引化(亦称为条码化)
在扩增细胞游离DNA后,使用索引序列(也称为条码或标签)对扩增的DNA进行索引化。例如,如果来自所有样品的细胞游离DNA分子一起进行测序,可以通过索引化来唯一地标定所检测到的任一扩增DNA来自三个样品中的哪一个。根据Fluidigm Access Array方法和实验方案(参见Illumina Sequencing System的Access Array System的第70页)对扩增的细胞游离DNA进行索引化。用于该索引化方案的材料包括高保真聚合酶Phusion Hot Start II(ThermoFisher Scientific)和用于Illumina测序仪(Fluidigm)的Access Array条码文库(Access Array Barcode Library,也称为索引文库)。使用的仪器包括PCR机、板式离心机和涡旋器。
测序
在细胞游离DNA经扩增和索引化之后,对其进行测序。根据Fluidigm/Illumina测序方案对索引化的细胞游离DNA以多重测序进行测序(参见Access Array System for Illumina Sequencing System的第134页)。用于该测序方案的材料包括FL1和FL2测序引物(Fluidigm)、HT1缓冲液(Illumina)和MiSeq试剂盒v3(Illumina)。使用MiSeq测序仪器(Illumina)对细胞游离DNA进行测序。
数据分析
在对细胞游离DNA进行测序后,对其进行分析以确定如上所述的各种SNP等位基因的存在和/或数量(例如图7中的概要)。主要分析设计从MiSeq仪器生成FASTQ输出文件。二级分析涉及将MiSeq测序的输出序列与人类基因组参考序列比对。使用“Cutadapt”和“TrimGalore”软件包进行末尾裁剪。使用比对软件“BWA”与包含该组扩增后的扩增子的基因组区域进行比对。在比对完成后,使用“SAMtools”软件程序和定制为令所含测序错误最小化的设定来分配变体频率。
此类数据的三级分析主要涉及分析的质量控制方面。进行数据分析,以确保已达到读取最小数目而实现每个SNP位置的足量计数,并确保受体中无其他等位基因存在。还进行了数据分析,以确保已经达到高于背景而低于杂合调节水平的最小和最大数量SNP基因座。所述下限(背景)和上限(移植受体杂合基因座)可以变化。另外,还有用于确保足够输入DNA以通过确定杂合SNP数据的质量来实现精确测量的度量。此外,可以确定基因组DNA并指定临界值。
在三级数据中使用的方法,确定给定样品中源自供体的细胞游离DNA水平。所述分析包括:通过减去每个转换或颠换的经验错误率来调整用于测序或扩增错误的SNPs次要等位基因频率,确定次要等位基因频率低于在0.1至0.25之间的临界值的SNPs集合作为受体纯合子,然后使用所述SNPs中的次要等位基因水平,将供体贡献计算为总细胞游离DNA百分比。去掉值小于0.0008次等位基因频率的SNPs。将剩余SNP中的下55.4%的中位数加倍,并与上44.6%的SNPs的中位数求平均数,以估计供体贡献。
测定移植器官状态
上述数据分析方法用于测定取自移植受体的各细胞游离DNA样品中源自供体的细胞游离DNA水平。数据分析包括将每个样品中的源自供体的细胞游离DNA水平与来自该病例的其他样品比较,以确定在从移植受体分离的细胞游离DNA中,源自供体的细胞游离DNA水平是否在随时间增加、减少或维持在相对恒定的水平。源自供体的细胞游离DNA水平或差异随时间的增加指示着移植排斥,如图1和图2所示。图1显示了充分表征的排斥和高百分比供体来源细胞游离DNA之间的关系。图2显示了升高的细胞游离DNA用于预测大约一个月内即将发生的排斥的能力。这暗示着医生可能需要调整免疫抑制疗法,和/或需要进一步调查移植器官状态。
实施例4–分析细胞游离DNA以确定移植受体中的移植器官状态,调节免疫抑制疗法,并监测治疗
本实施例展示了对包含来自心脏移植受体的细胞游离DNA的样品进行分析并确定样品中源自供体的细胞游离DNA水平。源自供体的细胞游离DNA随时间的水平变化用于诊断移植器官在移植受体中的状态,以及指示对调节或维持施用于移植物受体的免疫抑制疗法的需要。随后可以使用供体来源的细胞游离DNA水平的持续变化来监测免疫抑制疗法变化的成功。
对象选择
选择在本实施例所述测定之前的心脏移植对象的人类患者。所述患者正接受免疫抑制疗法的治疗以防止同种异体移植物排斥。在从排斥发生后的三个月内,在所述对象根据标准护理要求常规就诊时采集单独的血浆样品。相应地,所述移植受体在排斥事件后的数周内接受分析。本实施例中描述的方法适用于从移植受体分离的一个或多个样品。
血浆采集
从对象提取血液,由此该血液样品中分离血浆并从该血浆中提取细胞游离DNA。根据先前所述的静脉穿刺法(Clinical and Laboratory Standards Institute,2012),将血样收集在PPT管中。PPT管(血浆制备管,Becton Dickinson)完全充满血液样品。将管从适配器中取出,并通过轻微翻转立即混合。收集后,将管根据厂商说明书离心,并在-80℃下存储。在处理样品时,将所述管解冻,小心地取出所得血浆层并转移至干净管中。然后将该血浆样品在室温下以1600×g离心10分钟,取出上清液并置于新管中,在室温下以16000×g离心10分钟。小心取出所得血浆层并置于新管中,并处理血浆样品以提取细胞游离DNA(cf DNA)。
细胞游离DNA(cfDNA)提取
取血浆样品中的约1mL血浆进行细胞游离DNA提取。对于PPT血浆制备管(Becton Dickinson),使用Qiagen实验方案(QIAamp Circulating Nucleic Acid Handbook,2011)的第22页并经以下修改:在第25页的步骤15中,用21μL Buffer AVE洗脱。
SNP选择
选用了多种SNPs用于分析,以估计对象血浆样品中存在的源自供体的cfDNA百分比。选择用于分析的SNPs为:rs10488710,rs279844,rs1048290,rs1049379,rs1051614,rs1052637,rs1055851,rs1056033,rs1056149,rs1064074,rs1078004,rs10831567,rs6811238,rs11106,rs11210490,rs1126899,rs1127472,rs1127893,rs1130857,rs1049544,rs11547806,rs12237048,rs430046,rs12508837,rs12529,rs12717,rs13184586,rs13295990,rs13428,rs13436,rs1374570,rs14080,rs1411271,rs576261,rs14155,rs1151687,rs1565933,rs1600,rs1678690,rs1881421,rs1897820,rs1898882,rs2056844,rs20575,rs10092491,rs2070426,rs2071888,rs2075322,rs2180314,rs2185798,rs2227910,rs2228560,rs2229571,rs2229627,rs2245285,rs2342747,rs2248490,rs2253592,rs2254357,rs2275047,rs2279665,rs2279776,rs2281098,rs2287813,rs4364205,rs2289751,rs2289818,rs2292830,rs2294092,rs2295005,rs2296545,rs2297236,rs2302443,rs2306049,rs1022478,rs445251,rs230898,rs231235,rs2342767,rs236152,rs2362450,rs2384571,rs2455230,rs246703,rs2480345,rs248385,rs2498982,rs2505232,rs2509943,rs2519123,rs2523072,rs2571028,rs2657167,rs28686812,rs2946994,rs1294331,rs10419826,rs3088241,rs3110623,rs3173615,rs3190321,rs3205187,rs344141,rs35596415,rs362124,rs36657,rs1872575,rs159606,rs3731877,rs3734311,rs3735615,rs3740199,rs3748930,rs3751066,rs3790993,rs3802265,rs3803763,rs1004357,rs3803798,rs3809972,rs3810483,rs3812571,rs3813609,rs3814182,rs3816800,rs3826709,rs3829655,rs3951216,rs1019029,rs408600,rs41317515,rs436278,rs448012,rs475002,rs4845480,rs4849167,rs4865615,rs1027895,rs4890012,rs492594,rs4940019,rs4971514,rs523104,rs528557,rs545500,rs561930,rs57010808,rs57285449,rs10500617,rs6061243,rs609521,rs62490396,rs625223,rs638405,rs6459166,rs648802,rs6510057,rs6764714,rs10768550,rs6790129,rs6794,rs6807362,rs6838248,rs713598,rs7161563,rs726009,rs7289,rs7301328,rs7332388,rs10773760,rs743616,rs743852,rs745142,rs7451713,rs7526132,rs7543016,rs7601771,rs7785899,rs7825,rs8009219,rs10776839,rs8025851,rs8058696,rs8076632,rs8097,rs8103906,rs874881,rs9262,rs9289122,rs936019,rs9393728,rs1109037,rs977070,rs9865242,rs12480506,rs560681,rs12997453,rs13134862,rs13218440,rs1358856,rs1410059,rs1478829,rs1498553,rs1523537,rs4606077,rs1554472,rs1736442,rs1821380,rs2046361,rs214955,rs2175957,rs2255301,rs2269355,rs2270529,rs2272998,rs2291395,rs2292972,rs2399332,rs2503107,rs2567608,rs2811231,rs2833736,rs315791,rs321198,rs6955448,rs338882,rs3780962,rs4288409,rs4530059,rs464663,rs4789798,rs4796362,rs4847034,rs521861,rs1058083,rs5746846,rs590162,rs6444724,rs6591147,rs689512,rs7205345,rs722290,rs740598,rs7520386,rs221956,rs7704770,rs8070085,rs8078417,rs891700,rs901398,rs9546538,rs9606186,rs985492,rs9866013,rs987640,rs13182883,rs9905977,rs993934,rs9951171,rs10274334,rs10421285,rs1043413,rs1044010,rs1045248,rs1045644,和rs1047979。为了扩增SNPs,涉及了266个引物对(Fluidigm)。
DNA预扩增
为了扩增包括细胞游离DNA中所需SNPs的靶向区域,对各种材料进行组装并将其用于扩增过程。使用Phusion Hot Start II(ThermoFisher Scientific)。设计并制备了266个引物对(IDT或Fluidigm/Fluidgim设计)。使用ExoI和ExoI缓冲液(New England BioLabs)。后续方法包括Fluidigm预扩增实验方案(参见“Access Array System for Illumina Sequencing System”的第152页)。使用的仪器包括PCR机、板式离心机和涡旋器。
DNA扩增
根据Fluidigm Access Array方法和实验方案(参见Access Array System for Illumina Sequencing System的第63页),扩增源自预扩增的细胞游离DNA。可用于该扩增方案的材料包括Fluidigm Access Array或芯片、高保真聚合酶Phusion Flash II(ThermoFisher Scientific)、1X Access Array收获液(Fluidigm,PN 100-1031)、20X Access Array加载试剂(Fluidigm),以及如上所述设计的266个引物对。用于该扩增实验方案的仪器包括两个IFC控制器AX(Fluidigm)和一个FC1循环仪(Fluidigm)。
索引化(亦称为条码化)
在扩增细胞游离DNA后,使用索引序列(也称为条码或标签)对扩增的DNA进行索引化。例如,如果来自所有样品的细胞游离DNA分子一起进行测序,可以通过索引化来唯一地标定所检测到的任一扩增DNA来自三个样品中的哪一个。根据Fluidigm Access Array方法和实验方案(参见Illumina Sequencing System的Access Array System的第70页)对扩增的细胞游离DNA进行索引化。用于该索引化方案的材料包括高保真聚合酶Phusion Hot Start II(ThermoFisher Scientific)和用于Illumina测序仪(Fluidigm)的Access Array条码文库(Access Array Barcode Library,也称为索引文库)。使用的仪器包括PCR机、板式离心机和涡旋器。
测序
在细胞游离DNA经扩增和索引化之后,对其进行测序。根据Fluidigm/Illumina测序方案对索引化的细胞游离DNA以多重测序进行测序(参见Access Array System for Illumina Sequencing System的第134页)。用于该测序方案的材料包括FL1和FL2测序引物(Fluidigm)、HT1缓冲液(Illumina)和MiSeq试剂盒v3(Illumina)。使用MiSeq测序仪器(Illumina)对细胞游离DNA进行测序。
数据分析
在对细胞游离DNA进行测序后,对其进行分析以确定如上所述的各种SNP等位基因的存在和/或数量(例如图7中的概要)。主要分析设计从MiSeq仪器生成FASTQ输出文件。二级分析涉及将MiSeq测序的输出序列与人类基因组参考序列比对。使用“Cutadapt”和“TrimGalore”软件包进行末尾裁剪。使用比对软件“BWA”与包含该组扩增后的扩增子的基因组区域进行比对。在比对完成后,使用“SAMtools”软件程序和定制为令所含测序错误最小化的设定来分配变体频率。
此类数据的三级分析主要涉及分析的质量控制方面。进行数据分析,以确保已达到读取最小数目而实现每个SNP位置的足量计数,并确保受体中无其他等位基因存在。还进行了数据分析,以确保已经达到高于背景而低于杂合调节水平的最小和最大数量SNP基因座。所述下限(背景)和上限(移植受体杂合基因座)可以变化。另外,还有用于确保足够输入DNA以通过确定杂合SNP数据的质量来实现精确测量的度量。此外,可以确定基因组DNA并指定临界值。
在三级数据中使用的方法,确定给定样品中源自供体的细胞游离DNA水平。所述分析包括:通过减去每个转换或颠换的经验错误率来调整用于测序或扩增错误的SNPs次要等位基因频率,确定次要等位基因频率低于在0.1至0.25之间的临界值的SNPs集合作为受体纯合子,然后使用所述SNPs中的次要等位基因水平,将供体贡献计算为总细胞游离DNA百分比。去掉值小于0.0008次等位基因频率的SNPs。将剩余SNP中的下55.4%的中位数加倍,并与上44.6%的SNPs的中位数求平均数,以估计供体贡献。
测定移植器官状态
上述数据分析方法用于测定取自移植受体的各细胞游离DNA样品中源自供体的细胞游离DNA水平。数据分析包括将每个样品中的源自供体的细胞游离DNA水平与来自该病例的其他样品比较,以确定在从移植受体分离的细胞游离DNA中,源自供体的细胞游离DNA水平是否在随时间增加、减少或维持在相对恒定的水平。图1显示了充分表征的排斥和高百分比供体来源细胞游离DNA之间的关系。在本例中,如图3所示,病例经历了排斥(通过心内膜活检确定),并且具有高水平的dd-cfDNA(>5%)。对患者进行推注类固醇免疫抑制疗法。在治疗后第20和51天取得的后续样品证明,可以通过检查dd-cfDNA水平返回到指示无排斥的水平,来监测免疫抑制疗法的成功(图3)。
实施例5–分析细胞游离DNA以确定移植受体中的肾脏移植物状态,调节免疫抑制疗法,并监测治疗
本实施例展示了对包含来自肾脏移植受体的细胞游离DNA的样品进行分析并确定样品中源自供体的细胞游离DNA水平。源自供体的细胞游离DNA随时间的水平变化或差异用于诊断移植器官在移植受体中的状态,以及指示对调节或维持施用于移植物受体的免疫抑制疗法的需要。对象选择
选择在本实施例所述测定8天之前的肾脏移植对象的人类患者。所述患者正接受免疫抑制疗法的治疗以防止同种异体移植物排斥。在从移植后第8天的第一次排斥反应发生后的连续三个月内,从所述对象采集单独的血浆样品。相应地,所述移植受体在排斥事件后的数周内接受分析。本实施例中描述的方法适用于从移植受体分离的一个或多个样品。
血浆采集
从对象提取血液,由此该血液样品中分离血浆并从该血浆中提取细胞游离DNA。根据先前所述的静脉穿刺法(Clinical and Laboratory Standards Institute,2012),将血样收集在CPT管中。CPT管(Becton Dickinson)完全充满血液样品。将管从适配器中取出,并通过轻微翻转立即混合。收集后,将管根据厂商说明书离心,并将血浆和单核细胞级分倒入含有5ml PBS的管中。将该第二管离心以沉淀细胞,并保留血浆上清液,在-80℃下存储。在处理样品时,将所述管解冻,将血浆样品在室温下以1600×g离心10分钟,取出上清液并置于新管中,在室温下以16000×g离心10分钟。小心取出所得血浆层并置于新管中,并处理血浆样品以提取细胞游离DNA(cf DNA)。
细胞游离DNA(cfDNA)提取
取血浆样品中的约2mL血浆进行细胞游离DNA提取。对于细胞游离DNA血液采集管(Streck),可以使用Qiagen实验方案(QIAamp Circulating Nucleic Acid Handbook,2011)的第26页并经以下修改:在第28页的步骤4中,培养期为60℃下1小时℃;且第29页的步骤15中,用30μL Buffer AVE洗脱。对于PPT血浆制备管(Becton Dickinson),使用Qiagen实验方案(QIAamp Circulating Nucleic Acid Handbook,2011)的第22页并经以下修改:在第25页的步骤15中,用21μL Buffer AVE洗脱。
SNP选择
选用了多种SNPs用于分析,以估计对象血浆样品中存在的源自供体的cfDNA百分比。选择用于分析的SNPs为:rs10488710,rs279844,rs1048290,rs1049379,rs1051614,rs1052637,rs1055851,rs1056033,rs1056149,rs1064074,rs1078004,rs10831567,rs6811238,rs11106,rs11210490,rs1126899,rs1127472,rs1127893,rs1130857,rs1049544,rs11547806,rs12237048,rs430046,rs12508837,rs12529,rs12717,rs13184586,rs13295990,rs13428,rs13436,rs1374570,rs14080,rs1411271,rs576261,rs14155,rs1151687,rs1565933,rs1600,rs1678690,rs1881421,rs1897820,rs1898882,rs2056844,rs20575,rs10092491,rs2070426,rs2071888,rs2075322,rs2180314,rs2185798,rs2227910,rs2228560,rs2229571,rs2229627,rs2245285,rs2342747,rs2248490,rs2253592,rs2254357,rs2275047,rs2279665,rs2279776,rs2281098,rs2287813,rs4364205,rs2289751,rs2289818,rs2292830,rs2294092,rs2295005,rs2296545,rs2297236,rs2302443,rs2306049,rs1022478,rs445251,rs230898,rs231235,rs2342767,rs236152,rs2362450,rs2384571,rs2455230,rs246703,rs2480345,rs248385,rs2498982,rs2505232,rs2509943,rs2519123,rs2523072,rs2571028,rs2657167,rs28686812,rs2946994,rs1294331,rs10419826,rs3088241,rs3110623,rs3173615,rs3190321,rs3205187,rs344141,rs35596415,rs362124,rs36657,rs1872575,rs159606,rs3731877,rs3734311,rs3735615,rs3740199,rs3748930,rs3751066,rs3790993,rs3802265,rs3803763,rs1004357,rs3803798,rs3809972,rs3810483,rs3812571,rs3813609,rs3814182,rs3816800,rs3826709,rs3829655,rs3951216,rs1019029,rs408600,rs41317515,rs436278,rs448012,rs475002,rs4845480,rs4849167,rs4865615,rs1027895,rs4890012,rs492594,rs4940019,rs4971514,rs523104,rs528557,rs545500,rs561930,rs57010808,rs57285449,rs10500617,rs6061243,rs609521,rs62490396,rs625223,rs638405,rs6459166,rs648802,rs6510057,rs6764714,rs10768550,rs6790129,rs6794,rs6807362,rs6838248,rs713598,rs7161563,rs726009,rs7289,rs7301328,rs7332388,rs10773760,rs743616,rs743852,rs745142,rs7451713,rs7526132,rs7543016,rs7601771,rs7785899,rs7825,rs8009219,rs10776839,rs8025851,rs8058696,rs8076632,rs8097,rs8103906,rs874881,rs9262,rs9289122,rs936019,rs9393728,rs1109037,rs977070,rs9865242,rs12480506,rs560681,rs12997453,rs13134862,rs13218440,rs1358856,rs1410059,rs1478829,rs1498553,rs1523537,rs4606077,rs1554472,rs1736442,rs1821380,rs2046361,rs214955,rs2175957,rs2255301,rs2269355,rs2270529,rs2272998,rs2291395,rs2292972,rs2399332,rs2503107,rs2567608,rs2811231,rs2833736,rs315791,rs321198,rs6955448,rs338882,rs3780962,rs4288409,rs4530059,rs464663,rs4789798,rs4796362,rs4847034,rs521861,rs1058083,rs5746846,rs590162,rs6444724,rs6591147,rs689512,rs7205345,rs722290,rs740598,rs7520386,rs221956,rs7704770,rs8070085,rs8078417,rs891700,rs901398,rs9546538,rs9606186,rs985492,rs9866013,rs987640,rs13182883,rs9905977,rs993934,rs9951171,rs10274334,rs10421285,rs1043413,rs1044010,rs1045248,rs1045644,和rs1047979。为了扩增SNPs,涉及了266个引物对(Fluidigm)。
DNA预扩增
为了扩增包括细胞游离DNA中所需SNPs的靶向区域,对各种材料进行组装并将其用于扩增过程。使用高保真DNA聚合酶FastStart High Fidelity(Roche)。设计并制备了266个引物对(IDT或Fluidigm/Fluidgim设计)。使用ExoI和ExoI缓冲液(New England BioLabs)。后续方法包括Fluidigm预扩增实验方案(参见“Access Array System for Illumina Sequencing System”的第152页)。使用的仪器包括PCR机、板式离心机和涡旋器。
DNA扩增
根据Fluidigm Access Array方法和实验方案(参见Access Array System for Illumina Sequencing System的第63页),扩增源自预扩增的细胞游离DNA。可用于该扩增方案的材料包括Fluidigm Access Array或芯片、高保真聚合酶FastStart High Fidelity(Roche)、1X Access Array收获液(Fluidigm,PN 100-1031)、20X Access Array加载试剂(Fluidigm),以及如上所述设计的266个引物对。用于该扩增实验方案的仪器包括两个IFC控制器AX(Fluidigm)和一个FC1循环仪(Fluidigm)。
索引化(亦称为条码化)
在扩增细胞游离DNA后,使用索引序列(也称为条码或标签)对扩增的DNA进行索引化。例如,如果来自所有样品的细胞游离DNA分子一起进行测序,可以通过索引化来唯一地标定所检测到的任一扩增DNA来自三个样品中的哪一个。根据Fluidigm Access Array方法和实验方案(参见Illumina Sequencing System的Access Array System的第70页)对扩增的细胞游离DNA进行索引化。用于该索引化方案的材料包括高保真DNA聚合酶FastStart High Fidelity(Roche)和用于Illumina测序仪(Fluidigm)的Access Array条码文库(Access Array Barcode Library,也称为索引文库)。使用的仪器包括PCR机、板式离心机和涡旋器。
测序
在细胞游离DNA经扩增和索引化之后,对其进行测序。根据Fluidigm/Illumina测序方案对索引化的细胞游离DNA以多重测序进行测序(参见Access Array System for Illumina Sequencing System的第134页)。用于该测序方案的材料包括FL1和FL2测序引物(Fluidigm)、HT1缓冲液(Illumina)和MiSeq试剂盒v3(Illumina)。使用MiSeq测序仪器(Illumina)对细胞游离DNA进行测序。
数据分析
在对细胞游离DNA进行测序后,对其进行分析以确定如上所述的各种SNP等位基因的存在和/或数量(例如图7中的概要)。主要分析设计从MiSeq仪器生成FASTQ输出文件。二级分析涉及将MiSeq测序的输出序列与人类基因组参考序列比对。使用“Cutadapt”和“TrimGalore”软件包进行末尾裁剪。使用比对软件“BWA”与包含该组扩增后的扩增子的基因组区域进行比对。在比对完成后,使用“SAMtools”软件程序和定制为令所含测序错误最小化的设定来分配变体频率。
此类数据的三级分析主要涉及分析的质量控制方面。进行数据分析,以确保已达到读取最小数目而实现每个SNP位置的足量计数,并确保受体中无其他等位基因存在。还进行了数据分析,以确保已经达到高于背景而低于杂合调节水平的最小和最大数量SNP基因座。所述下限(背景)和上限(移植受体杂合基因座)可以变化。另外,还有用于确保足够输入DNA以通过确定杂合SNP数据的质量来实现精确测量的度量。此外,可以确定基因组DNA并指定临界值。
在三级数据中使用的方法,确定给定样品中源自供体的细胞游离DNA水平。所述分析包括:通过减去每个转换或颠换的经验错误率来调整用于测序或扩增错误的SNPs次要等位基因频率,确定次要等位基因频率低于在0.1至0.25之间的临界值的SNPs集合作为受体纯合子,然后使用次要等位基因水平将供体贡献计算为主要等位基因百分比。去掉5%最高值和5%最低值,并计算剩余SNP次要等位基因值的平均值。该值估计了供体贡献的杂合水平,因此将其乘以2以确定对供体贡献的最终估计。
测定移植器官状态
上述数据分析方法用于测定取自移植受体的各细胞游离DNA样品中源自供体的细胞游离DNA水平。数据分析包括将每个样品中的源自供体的细胞游离DNA水平与来自该病例的其他样品比较,以确定在从移植受体分离的细胞游离DNA中,源自供体的细胞游离DNA水平是否在随时间增加、减少或维持在相对恒定的水平。图1显示了充分表征的排斥和高百分比供体来源细胞游离DNA之间的关系。在本例中,如图4所示,肾脏移植受体经历了排斥(通过肾活检确定),并且具有高水平的dd-cfDNA(>8%)。对患者通过调节免疫抑制疗法进行治疗。在治疗后第40和69天取得的后续样品证明,可以通过检查dd-cfDNA水平返回到指示无排斥的水平(低于1%dd-cfDNA,图4),来监测免疫抑制疗法的成功。
实施例6–对细胞游离DNA进行系列分析以监测移植受体中的移植器官状态
本实施例展示了对包含来自心脏移植受体的细胞游离DNA的样品进行分析,以确定样品中源自供体的细胞游离DNA水平。源自供体的细胞游离DNA随时间的水平变化或差异用于诊断移植器官在移植受体中的状态,以及指示对调节或维持施用于移植物受体的免疫抑制治疗的需要。
对象选择
选择在本实施例所述测定之前的心脏移植对象的人类患者。所述患者正接受免疫抑制疗法的治疗以防止同种异体移植物排斥,但是在测试时特定的治疗信息是盲化的。病例选择标准要求患者是没有排斥迹象或其他移植器官状态相关问题的稳定患者。根据医师规定的护理标准在临床就诊期间从这些受试者收集单独的血浆样品。本实施例中描述的方法适用于从移植受体分离的一个或多个样品。
血浆采集
从对象提取血液,由此该血液样品中分离血浆并从该血浆中提取细胞游离DNA。根据先前所述的静脉穿刺法(Clinical and Laboratory Standards Institute,2012),将血样收集在细胞游离DNA血管采集管(Streck细胞游离DNA BCT)中。Steck管完全充满血液样品。将管从适配器中取出,并通过轻微翻转立即混合约8-10次。收收集后的至多7天内,将管在6-37℃的温度范围内运输和储存。在处理样品时,将含有血液样品的Streck管在室温下以1600×g离心20分钟。小心地取出所得血浆层并转移至15mL管中。然后将该血浆样品在室温下以1600×g离心10分钟,取出上清液并置于新管中,在室温下以16000×g离心10分钟。小心取出所得血浆层并置于新管中,并处理血浆样品以提取细胞游离DNA(cf DNA)。
取血浆样品中的约5mL血浆进行细胞游离DNA提取。对于细胞游离DNA血液采集管(Streck),可以使用Qiagen实验方案(QIAamp Circulating Nucleic Acid Handbook,2011)的第26页并经以下修改:在第28页的步骤4中,培养期为60℃下1小时℃;且第29页的步骤15中,用30μL Buffer AVE洗脱。
SNP选择
选用了多种SNPs用于分析,以估计对象血浆样品中存在的源自供体的cfDNA百分比。选择用于分析的SNPs为:rs10488710,rs279844,rs1048290,rs1049379,rs1051614,rs1052637,rs1055851,rs1056033,rs1056149,rs1064074,rs1078004,rs10831567,rs6811238,rs11106,rs11210490,rs1126899,rs1127472,rs1127893,rs1130857,rs1049544,rs11547806,rs12237048,rs430046,rs12508837,rs12529,rs12717,rs13184586,rs13295990,rs13428,rs13436,rs1374570,rs14080,rs1411271,rs576261,rs14155,rs1151687,rs1565933,rs1600,rs1678690,rs1881421,rs1897820,rs1898882,rs2056844,rs20575,rs10092491,rs2070426,rs2071888,rs2075322,rs2180314,rs2185798,rs2227910,rs2228560,rs2229571,rs2229627,rs2245285,rs2342747,rs2248490,rs2253592,rs2254357,rs2275047,rs2279665,rs2279776,rs2281098,rs2287813,rs4364205,rs2289751,rs2289818,rs2292830,rs2294092,rs2295005,rs2296545,rs2297236,rs2302443,rs2306049,rs1022478,rs445251,rs230898,rs231235,rs2342767,rs236152,rs2362450,rs2384571,rs2455230,rs246703,rs2480345,rs248385,rs2498982,rs2505232,rs2509943,rs2519123,rs2523072,rs2571028,rs2657167,rs28686812,rs2946994,rs1294331,rs10419826,rs3088241,rs3110623,rs3173615,rs3190321,rs3205187,rs344141,rs35596415,rs362124,rs36657,rs1872575,rs159606,rs3731877,rs3734311,rs3735615,rs3740199,rs3748930,rs3751066,rs3790993,rs3802265,rs3803763,rs1004357,rs3803798,rs3809972,rs3810483,rs3812571,rs3813609,rs3814182,rs3816800,rs3826709,rs3829655,rs3951216,rs1019029,rs408600,rs41317515,rs436278,rs448012,rs475002,rs4845480,rs4849167,rs4865615,rs1027895,rs4890012,rs492594,rs4940019,rs4971514,rs523104,rs528557,rs545500,rs561930,rs57010808,rs57285449,rs10500617,rs6061243,rs609521,rs62490396,rs625223,rs638405,rs6459166,rs648802,rs6510057,rs6764714,rs10768550,rs6790129,rs6794,rs6807362,rs6838248,rs713598,rs7161563,rs726009,rs7289,rs7301328,rs7332388,rs10773760,rs743616,rs743852,rs745142,rs7451713,rs7526132,rs7543016,rs7601771,rs7785899,rs7825,rs8009219,rs10776839,rs8025851,rs8058696,rs8076632,rs8097,rs8103906,rs874881,rs9262,rs9289122,rs936019,rs9393728,rs1109037,rs977070,rs9865242,rs12480506,rs560681,rs12997453,rs13134862,rs13218440,rs1358856,rs1410059,rs1478829,rs1498553,rs1523537,rs4606077,rs1554472,rs1736442,rs1821380,rs2046361,rs214955,rs2175957,rs2255301,rs2269355,rs2270529,rs2272998,rs2291395,rs2292972,rs2399332,rs2503107,rs2567608,rs2811231,rs2833736,rs315791,rs321198,rs6955448,rs338882,rs3780962,rs4288409,rs4530059,rs464663,rs4789798,rs4796362,rs4847034,rs521861,rs1058083,rs5746846,rs590162,rs6444724,rs6591147,rs689512,rs7205345,rs722290,rs740598,rs7520386,rs221956,rs7704770,rs8070085,rs8078417,rs891700,rs901398,rs9546538,rs9606186,rs985492,rs9866013,rs987640,rs13182883,rs9905977,rs993934,rs9951171,rs10274334,rs10421285,rs1043413,rs1044010,rs1045248,rs1045644,和rs1047979。为了扩增SNPs,涉及了266个引物对(Fluidigm)。
DNA预扩增
为了扩增包括细胞游离DNA中所需SNPs的靶向区域,对各种材料进行组装并将其用于扩增过程。使用Phusion Hot Start II(ThermoFisher Scientific)。设计并制备了266个引物对(IDT或Fluidigm/Fluidgim设计)。使用ExoI和ExoI缓冲液(New England BioLabs)。后续方法包括Fluidigm预扩增实验方案(参见“Access Array System for Illumina Sequencing System”的第152页)。使用的仪器包括PCR机、板式离心机和涡旋器。
DNA扩增
根据Fluidigm Access Array方法和实验方案(参见Access Array System for Illumina Sequencing System的第63页),扩增源自预扩增的细胞游离DNA。可用于该扩增方案的材料包括Fluidigm Access Array或芯片、高保真聚合酶Phusion Flash II(ThermoFisher Scientific)、1X Access Array收获液(Fluidigm,PN 100-1031)、20X Access Array加载试剂(Fluidigm),以及如上所述设计的266个引物对。用于该扩增实验方案的仪器包括两个IFC控制器AX(Fluidigm)和一个FC1循环仪(Fluidigm)。
索引化(亦称为条码化)
在扩增细胞游离DNA后,使用索引序列(也称为条码或标签)对扩增的DNA进行索引化。例如,如果来自所有样品的细胞游离DNA分子一起进行测序,可以通过索引化来唯一地标定所检测到的任一扩增DNA来自三个样品中的哪一个。根据Fluidigm Access Array方法和实验方案(参见Illumina Sequencing System的Access Array System的第70页)对扩增的细胞游离DNA进行索引化。用于该索引化方案的材料包括高保真聚合酶Phusion Hot Start II(ThermoFisher Scientific)和用于Illumina测序仪(Fluidigm)的Access Array条码文库(Access Array Barcode Library,也称为索引文库)。使用的仪器包括PCR机、板式离心机和涡旋器。
测序
在细胞游离DNA经扩增和索引化之后,对其进行测序。根据Fluidigm/Illumina测序方案对索引化的细胞游离DNA以多重测序进行测序(参见Access Array System for Illumina Sequencing System的第134页)。用于该测序方案的材料包括FL1和FL2测序引物(Fluidigm)、HT1缓冲液(Illumina)和MiSeq试剂盒v3(Illumina)。使用MiSeq测序仪器(Illumina)对细胞游离DNA进行测序。
数据分析
在对细胞游离DNA进行测序后,对其进行分析以确定如上所述的各种SNP等位基因的存在和/或数量(例如图7中的概要)。主要分析设计从MiSeq仪器生成FASTQ输出文件。二级分析涉及将MiSeq测序的输出序列与人类基因组参考序列比对。使用“Cutadapt”和“TrimGalore”软件包进行末尾裁剪。使用比对软件“BWA”与包含该组扩增后的扩增子的基因组区域进行比对。在比对完成后,使用“SAMtools”软件程序和定制为令所含测序错误最小化的设定来分配变体频率。
此类数据的三级分析主要涉及分析的质量控制方面。进行数据分析,以确保已达到读取最小数目而实现每个SNP位置的足量计数,并确保受体中无其他等位基因存在。还进行了数据分析,以确保已经达到高于背景而低于杂合调节水平的最小和最大数量SNP基因座。所述下限(背景)和上限(移植受体杂合基因座)可以变化。另外,还有用于确保足够输入DNA以通过确定杂合SNP数据的质量来实现精确测量的度量。此外,可以确定基因组DNA并指定临界值。
在三级数据中使用的方法,确定给定样品中源自供体的细胞游离DNA水平。所述分析包括:通过减去每个转换或颠换的经验错误率来调整用于测序或扩增错误的SNPs次要等位基因频率,确定次要等位基因频率低于在0.1至0.25之间的临界值的SNPs集合作为受体纯合子,然后使用所述SNPs中的次要等位基因水平,将供体贡献计算为总细胞游离DNA百分比。去掉值小于0.0008次等位基因频率的SNPs。将剩余SNP中的下55.4%的中位数加倍,并与上44.6%的SNPs的中位数求平均数,以估计供体贡献。
测定移植器官状态
上述数据分析方法用于测定取自移植受体的各细胞游离DNA样品中源自供体的细胞游离DNA水平。数据分析包括将每个样品中的源自供体的细胞游离DNA水平与来自该病例的其他样品比较,以确定在从移植受体分离的细胞游离DNA中,源自供体的细胞游离DNA水平是否在随时间增加、减少或维持在相对恒定的水平。源自供体的细胞游离DNA水平或差异随时间增加,指示着移植排斥,如图1所示。图5显示了源自供体的细胞游离DNA百分比的稳定性质。这表明医生不需要在这些稳定的患者中调整免疫抑制治疗。
实施例7–结合基因表达测试分析细胞游离DNA以确定心脏移植受体中的移植器官状态
本实施例展示了对包含来自一组55个移植受体的细胞游离DNA的样品进行分析,以确定样品中源自供体的细胞游离DNA水平。此外,使用含有来自外周血单核细胞的RNA的样品,使用AlloMap分子表达测试进行测量,以确定基因表达水平。源自供体的细胞游离DNA随时间的水平变化用于诊断移植器官在移植受体中的状态,预测移植器官的未来状态,以及指示对调节或维持施用于移植物受体的免疫抑制治疗的需要。
对象选择
选择在本实施例所述测定之前的心脏移植对象的人类患者。所述患者正接受免疫抑制疗法的治疗以防止同种异体移植物排斥。在所述对象根据标准护理要求在各中心就诊时从该对象采集单独的血浆样品。本实施例中描述的方法适用于从移植受体分离的一个或多个样品。
RNA收集,处理和测试
如AlloMap分子表达测试(经FDA批准的用于临床监测稳定心脏移植受者的基因表达谱)所述,收集外周血单核细胞(PBMC),稳定RNA,分离RNA,产生cDNA,并通过实时定量PCR测量cDNA。
血浆采集
从对象提取血液,由此该血液样品中分离血浆并从该血浆中提取细胞游离DNA。根据先前所述的静脉穿刺法(Clinical and Laboratory Standards Institute,2012),将血样收集在PPT管中。PPT管(血浆制备管,Becton Dickinson)完全充满血液样品。将管从适配器中取出,并通过轻微翻转立即混合。收集后,将管根据厂商说明书离心,并在-80℃下存储。在处理样品时,将所述管解冻,小心地取出所得血浆层并转移至干净管中。然后将该血浆样品在室温下以1600×g离心10分钟,取出上清液并置于新管中,在室温下以16000×g离心10分钟。小心取出所得血浆层并置于新管中,并处理血浆样品以提取细胞游离DNA(cf DNA)。
细胞游离DNA(cfDNA)提取
取血浆样品中的约1mL血浆进行细胞游离DNA提取。对于PPT血浆制备管(Becton Dickinson),使用Qiagen实验方案(QIAamp Circulating Nucleic Acid Handbook,2011)的第22页并经以下修改:在第25页的步骤15中,用21μL Buffer AVE洗脱。
SNP选择
选用了多种SNPs用于分析,以估计对象血浆样品中存在的源自供体的cfDNA百分比。选择用于分析的SNPs为:rs10488710,rs279844,rs1048290,rs1049379,rs1051614,rs1052637,rs1055851,rs1056033,rs1056149,rs1064074,rs1078004,rs10831567,rs6811238,rs11106,rs11210490,rs1126899,rs1127472,rs1127893,rs1130857,rs1049544,rs11547806,rs12237048,rs430046,rs12508837,rs12529,rs12717,rs13184586,rs13295990,rs13428,rs13436,rs1374570,rs14080,rs1411271,rs576261,rs14155,rs1151687,rs1565933,rs1600,rs1678690,rs1881421,rs1897820,rs1898882,rs2056844,rs20575,rs10092491,rs2070426,rs2071888,rs2075322,rs2180314,rs2185798,rs2227910,rs2228560,rs2229571,rs2229627,rs2245285,rs2342747,rs2248490,rs2253592,rs2254357,rs2275047,rs2279665,rs2279776,rs2281098,rs2287813,rs4364205,rs2289751,rs2289818,rs2292830,rs2294092,rs2295005,rs2296545,rs2297236,rs2302443,rs2306049,rs1022478,rs445251,rs230898,rs231235,rs2342767,rs236152,rs2362450,rs2384571,rs2455230,rs246703,rs2480345,rs248385,rs2498982,rs2505232,rs2509943,rs2519123,rs2523072,rs2571028,rs2657167,rs28686812,rs2946994,rs1294331,rs10419826,rs3088241,rs3110623,rs3173615,rs3190321,rs3205187,rs344141,rs35596415,rs362124,rs36657,rs1872575,rs159606,rs3731877,rs3734311,rs3735615,rs3740199,rs3748930,rs3751066,rs3790993,rs3802265,rs3803763,rs1004357,rs3803798,rs3809972,rs3810483,rs3812571,rs3813609,rs3814182,rs3816800,rs3826709,rs3829655,rs3951216,rs1019029,rs408600,rs41317515,rs436278,rs448012,rs475002,rs4845480,rs4849167,rs4865615,rs1027895,rs4890012,rs492594,rs4940019,rs4971514,rs523104,rs528557,rs545500,rs561930,rs57010808,rs57285449,rs10500617,rs6061243,rs609521,rs62490396,rs625223,rs638405,rs6459166,rs648802,rs6510057,rs6764714,rs10768550,rs6790129,rs6794,rs6807362,rs6838248,rs713598,rs7161563,rs726009,rs7289,rs7301328,rs7332388,rs10773760,rs743616,rs743852,rs745142,rs7451713,rs7526132,rs7543016,rs7601771,rs7785899,rs7825,rs8009219,rs10776839,rs8025851,rs8058696,rs8076632,rs8097,rs8103906,rs874881,rs9262,rs9289122,rs936019,rs9393728,rs1109037,rs977070,rs9865242,rs12480506,rs560681,rs12997453,rs13134862,rs13218440,rs1358856,rs1410059,rs1478829,rs1498553,rs1523537,rs4606077,rs1554472,rs1736442,rs1821380,rs2046361,rs214955,rs2175957,rs2255301,rs2269355,rs2270529,rs2272998,rs2291395,rs2292972,rs2399332,rs2503107,rs2567608,rs2811231,rs2833736,rs315791,rs321198,rs6955448,rs338882,rs3780962,rs4288409,rs4530059,rs464663,rs4789798,rs4796362,rs4847034,rs521861,rs1058083,rs5746846,rs590162,rs6444724,rs6591147,rs689512,rs7205345,rs722290,rs740598,rs7520386,rs221956,rs7704770,rs8070085,rs8078417,rs891700,rs901398,rs9546538,rs9606186,rs985492,rs9866013,rs987640,rs13182883,rs9905977,rs993934,rs9951171,rs10274334,rs10421285,rs1043413,rs1044010,rs1045248,rs1045644,和rs1047979。为了扩增SNPs,涉及了266个引物对(Fluidigm)。
DNA预扩增
为了扩增包括细胞游离DNA中所需SNPs的靶向区域,对各种材料进行组装并将其用于扩增过程。使用Phusion Hot Start II(ThermoFisher Scientific)。设计并制备了266个引物对(IDT或Fluidigm/Fluidgim设计)。使用ExoI和ExoI缓冲液(New England BioLabs)。后续方法包括Fluidigm预扩增实验方案(参见“Access Array System for Illumina Sequencing System”的第152页)。使用的仪器包括PCR机、板式离心机和涡旋器。
DNA扩增
根据Fluidigm Access Array方法和实验方案(参见Access Array System for Illumina Sequencing System的第63页),扩增源自预扩增的细胞游离DNA。可用于该扩增方案的材料包括Fluidigm Access Array或芯片、高保真聚合酶Phusion Flash II(ThermoFisher Scientific)、1X Access Array收获液(Fluidigm,PN 100-1031)、20X Access Array加载试剂(Fluidigm),以及如上所述设计的266个引物对。用于该扩增实验方案的仪器包括两个IFC控制器AX(Fluidigm)和一个FC1循环仪(Fluidigm)。
索引化(亦称为条码化)
在扩增细胞游离DNA后,使用索引序列(也称为条码或标签)对扩增的DNA进行索引化。例如,如果来自所有样品的细胞游离DNA分子一起进行测序,可以通过索引化来唯一地标定所检测到的任一扩增DNA来自三个样品中的哪一个。根据Fluidigm Access Array方法和实验方案(参见Illumina Sequencing System的Access Array System的第70页)对扩增的细胞游离DNA进行索引化。用于该索引化方案的材料包括高保真聚合酶Phusion Hot Start II(ThermoFisher Scientific)和用于Illumina测序仪(Fluidigm)的Access Array条码文库(Access Array Barcode Library,也称为索引文库)。使用的仪器包括PCR机、板式离心机和涡旋器。
测序
在细胞游离DNA经扩增和索引化之后,对其进行测序。根据Fluidigm/Illumina测序方案对索引化的细胞游离DNA以多重测序进行测序(参见Access Array System for Illumina Sequencing System的第134页)。用于该测序方案的材料包括FL1和FL2测序引物(Fluidigm)、HT1缓冲液(Illumina)和MiSeq试剂盒v3(Illumina)。使用MiSeq测序仪器(Illumina)对细胞游离DNA进行测序。
cfDNA数据分析
在对细胞游离DNA进行测序后,对其进行分析以确定如上所述的各种SNP等位基因的存在和/或数量(例如图7中的概要)。主要分析设计从MiSeq仪器生成FASTQ输出文件。二级分析涉及将MiSeq测序的输出序列与人类基因组参考序列比对。使用“Cutadapt”和“TrimGalore”软件包进行末尾裁剪。使用比对软件“BWA”与包含该组扩增后的扩增子的基因组区域进行比对。在比对完成后,使用“SAMtools”软件程序和定制为令所含测序错误最小化的设定来分配变体频率。
此类数据的三级分析主要涉及分析的质量控制方面。进行数据分析,以确保已达到读取最小数目而实现每个SNP位置的足量计数,并确保受体中无其他等位基因存在。还进行了数据分析,以确保已经达到高于背景而低于杂合调节水平的最小和最大数量SNP基因座。所述下限(背景)和上限(移植受体杂合基因座)可以变化。另外,还有用于确保足够输入DNA以通过确定杂合SNP数据的质量来实现精确测量的度量。此外,可以确定基因组DNA并指定临界值。
在三级数据中使用的方法,确定给定样品中源自供体的细胞游离DNA水平。所述分析包括:通过减去每个转换或颠换的经验错误率来调整用于测序或扩增错误的SNPs次要等位基因频率,确定次要等位基因频率低于在0.1至0.25之间的临界值的SNPs集合作为受体纯合子,然后使用所述SNPs中的次要等位基因水平,将供体贡献计算为总细胞游离DNA百分比。去掉值小于0.0008次等位基因频率的SNPs。将剩余SNP中的下55.4%的中位数加倍,并与上44.6%的SNPs的中位数求平均数,以估计供体贡献。
测定移植器官状态
上述数据分析方法用于测定取自移植受体的各细胞游离DNA样品中源自供体的细胞游离DNA水平。数据分析包括将每个样品中的源自供体的细胞游离DNA水平与来自该病例的其他样品比较,以确定在从移植受体分离的细胞游离DNA中,源自供体的细胞游离DNA水平是否在随时间增加、减少或维持在相对恒定的水平。源自供体的细胞游离DNA水平或差异随时间的增加指示着移植排斥,如图1和图6A所示。两图显示了充分表征的排斥和高百分比供体来源细胞游离DNA之间的关系。图6B展示了充分表征的排斥反应与基因表达标志的AlloMap分子表达测试结果之间的关系。图6C展示了源自供体的细胞游离DNA和基因表达的组合结果可以更好地区分排斥和非排斥的能力。将两个值(百分比dd-cfDNA和AlloMap)缩放至相同范围,然后相加组合,以产生单一评分。这表明如果使用cfDNA和基因表达,并且以这种方式或类似方法组合,医生将更好地获得移植器官状态的相关信息。
参考文献
Clinical and Laboratory Standards Institute.H3-A6,(2012)Procedures for the Collection of Diagnostic Blood Specimens by Venipuncture;Approved Standard-Sixth Edition,Vol.27,No.26.
QIAamp Circulating Nucleic Acid Handbook,(2011),Second Edition.
Pakstis AJ,Speed WC,Fang R,Hyland FC,Furtado MR,Kidd JR,Kidd KK.(2010)SNPs for a universal individual identification panel.Hum Genet;127(3):315-24.
Access Array System for Illumina Sequencing System,P/N 100-3770,Rev.G1.
Andreas Wilm,Pauline Poh Kim Aw,Denis Bertrand,Grace Hui Ting Yeo,Swee Hoe Ong,Chang Hua Wong,Chiea Chuen Khor,Rosemary Petric,Martin Lloyd Hibberd and Niranjan Nagarajan.(2012)LoFreq:A sequence-quality aware,ultra-sensitive variant caller for uncovering cell-population heterogeneity from high-throughput sequencing datasets.Nucleic Acids Res.40(22):11189-201。
- 还没有人留言评论。精彩留言会获得点赞!
- 作为AXL抑制剂的杂环化合物的制作方法与工艺
- HPTP‑β抑制剂的制作方法与工艺
- 作为LSD1抑制剂的环丙胺的制作方法与工艺
- KRAS G12C的抑制剂的制作方法与工艺
- 调节雌激素受体突变体的方法和组合物与流程
- 作为PI3K抑制剂的吡啶并[1,2‑A]嘧啶酮类似物的制作方法与工艺
- 作为PI3K抑制剂的吡啶并[1,2‑A]嘧啶酮类似物的制作方法与工艺
- 包含Ⅲ类受体酪氨酸激酶抑制剂和烷基化组蛋白‑脱乙酰酶抑制剂融合分子EDO‑S101的药物组合及其在治疗癌症中的用途的制作方法与工艺
- 包含Ⅲ类受体酪氨酸激酶抑制剂和烷基化组蛋白‑脱乙酰酶抑制剂融合分子EDO‑S101的药物组合及其在治疗癌症中的用途的制作方法与工艺
- 新型雌激素相关受体α抑制剂及其医学用途的制作方法与工艺
- 作为原肌球蛋白受体激酶(Trk)抑制剂的取代的吡唑并[1,5‑a]吡啶的制作方法与工艺
- 一种核孤儿受体TR3抑制剂多肽及其应用的制作方法与工艺
- 程序性死亡受体1基因抑制剂及其制备方法与应用与流程
- 作为H3受体抑制剂的包含哌啶和哌嗪环的氨基甲酸酯/脲衍生物的制作方法与工艺
- 一种雄性激素受体抑制剂的结晶形式及其制备方法与流程
- 一种雄性激素受体抑制剂的结晶形式及其制备方法与流程
- 丙型肝炎病毒辅助受体CD36的特异性抑制剂在制备防治丙型肝炎病毒感染药物中的应用的制造方法与工艺
- IRE‑1α抑制剂的制造方法与工艺
- 白细胞介素‑23受体的口服肽抑制剂以及其治疗炎症性肠病的用途的制造方法与工艺
- 一类孪药型HMG‑CoA还原酶抑制剂及其合成方法与制造工艺
- Flt3蛋白在制备肝癌对索拉菲尼疗效评估试剂盒中的应用
- 用于治疗癌症的雄激素受体抑制剂与akt抑制剂的组合的制作方法
- 一种药物中间体2-芳酰基吲哚衍生物的合成方法
- 一种作用于EGFR敏感突变激酶EGFR<sup>L858R</sup>,EGFR<sup>(d746-750)</sup>的6-取代氨基嘌呤类化合物及 ...的制作方法
- 一种6-溴喹啉的制备方法
- 一种基于巢式复合cold-pcr的t790m突变检测方法
- 具抗肿瘤活性的表皮生长因子受体酪氨酸激酶抑制剂irsf和irsh及其制备方法和应用
- 具抗肿瘤活性的表皮生长因子受体酪氨酸激酶抑制剂irsf和irsh及其制备方法和应用
- 一种多维替尼的制备方法
- 具有抗肿瘤活性的表皮生长因子受体酪氨酸激酶抑制剂nxgf和nxgh及其制备方法和应用