一种未活化烯烃氢三氟甲基化的制备方法及应用与流程
本发明涉及化合物合成领域,更具体涉及一种未活化烯烃氢三氟甲基化的制备方法,同时还涉及一种未活化烯烃氢三氟甲基化的制备方法在合成药物分子中的应用。
背景技术:
三氟甲基(CF3)的强吸电子性和C-F键的稳定性,使得结构中含有三氟甲基的有机化合物,其极性、偶极距、亲脂性和代谢稳定性都会有显著的改变,因此此类化合物被广泛应用于医药、农药和新型功能材料等领域。例如,除草剂氟乐灵(Trifluralin)、治疗精神抑郁的药物盐酸氟西汀(Prozac)和治疗II型糖尿病的药物捷诺维(Januvia)中都含有三氟甲基。
在三氟甲基取代的有机化合物的合成方法中,不饱和烯烃的氢三氟甲基化反应是一种直接有效的方法,但是以未活化烯烃为底物的相关文献却鲜有报道。而且在已报道仅有的几例合成方法中,也存在着诸多不足,比如较高的催化剂用量,昂贵的三氟甲基化试剂等,限制了该类反应的应用性。因此通过改变过渡金属催化剂和选用价格低廉的三氟甲基化试剂,以温和的条件高效的制备出一系列含有三氟甲基的化合物,有利于推进此类反应于实际生产中的应用。
技术实现要素:
本发明的目的是在于提供了一种未活化烯烃氢三氟甲基化的制备方法,方法易行,操作简便,选用廉价的三氟甲基化试剂,以温和的条件实现未活化烯烃的氢三氟甲基化反应,制备出一系列含有三氟甲基的目标化合物。该制备方法以可见光为光源,三氟甲基亚磺酸钠为氟化试剂,成本较低,适合大规模生产,而且所需催化剂用量低,反应活性高,适用于一系列不同取代基的底物,适合在天然产物结构中引入三氟甲基,制备药物分子。
本发明的另一个目的是在于提供了一种未活化烯烃氢三氟甲基化的制备方法在合成药物分子中的应用。药物炔雌醇能够刺激垂体合成和释放促性腺激素,主要用于补充雌激素不足,治疗性腺功能不良等疾病。该药物的主要结构为雌酚酮,利用本发明所提供的方法在雌酚酮分子上引入三氟甲基,可显著提高该药物的药效和生理活性,治疗所需药品的总剂量大大降低,也极大的避免了副作用的风险。为了实现上述的目的,本发明采用以下技术措施:
其技术构思是:一种未活化烯烃氢三氟甲基化的方法,在可见光光照条件下, 以铱的络合物(Ir[dF(CF3)ppy]2(dtbpy)PF6)为光催化剂,三氟甲基亚磺酸钠(CF3SO2Na,百灵威化学试剂公司)为三氟甲基化试剂,甲醇(国药化学试剂公司)为溶剂,使未活化的烯烃I发生氢三氟甲基化反应,制备出含有三氟甲基的目标化合物II。
铱的络合物在可见光的光照下,催化三氟甲基亚磺酸钠生成三氟甲基自由基,该自由基进攻未活化烯烃I,生成中间体,三氟甲基连接于末端,相邻的位置生成新的自由基。该中间体从铱的络合物中攫取一个电子形成碳负离子,而后从溶剂中获得质子,生成反马氏规则的目标化合物II。化学反应方程式如下:
反应方程式中所述化合物I和II中R1基团的定义相同,为苯氧基、对甲基苯氧基、对甲氧基苯氧基、对氯苯氧基、对溴苯氧基、间碘苯氧基、对醛基苯氧基、对乙酰基苯氧基、苯基、对甲基苯硫基、苯甲酸酯基、酞酰亚胺基、苯磺酰基、苯酚酯基、N,N-甲基苯基-酰胺基或苯酮基。
反应方程式中所述化合物I和II中CH2单元的重复数n定义相同,为0、2或4。
反应方程式中所述化合物I和II中取代基R2定义相同,为氢、甲基或苯基。
一种未活化烯烃氢三氟甲基化的制备方法,其步骤是:
A、在舒伦克(Schlenk)管中加入未活化烯烃I,三氟甲基亚磺酸钠和光催化剂Ir[dF(CF3)ppy]2(dtbpy)PF6;所述的三氟甲基亚磺酸钠与结构I所示化合物的物质的量之比为2.0-3.0,更优选为2.0;所述的光催化剂Ir[dF(CF3)ppy]2(dtbpy)PF6的用量为结构I所示化合物的物质的量的1.0%-2.0%,更优选为2.0%;
B、抽真空换氩气后,加入溶剂(甲醇);所述的溶剂为N,N-二甲基甲酰胺与水1:1(体积比)混合溶液、二甲基亚砜与与水1:1(体积比)混合溶液、甲醇与水1:1(体积比)混合溶液、乙腈与水1:1(体积比)混合溶液、二氯甲烷与水1:1(体积比)混合溶液、甲醇、乙醇、异丙醇、叔丁醇中至少一种,更优选为甲醇;所述的溶剂甲醇的毫升数与结构I所示化合物的物质的量之比为8.0-12.0,更优选为12.0;
C、以荧光灯照射舒伦克管,搅拌进行反应;所述的荧光灯波长范围为可见光,功率为36W;所述的反应温度为室温(20-25℃,以下相同),反应时间为22-26小时;
D、反应结束后,向体系中加入水淬灭反应,乙酸乙酯萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物经乙酸乙酯/石油醚混合溶剂柱层析,分离纯化得到目标产物II。所述的乙酸乙酯/石油醚混合溶剂的比例依据产物极性不同而具体选择,柱层析采用硅胶为固定相。
一种未活化烯烃氢三氟甲基化的制备方法在合成药物分子中的应用,其步骤是:
A.在舒伦克(Schlenk)管中加入雌酚酮衍生物I-19(88.1mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和光催化剂Ir[dF(CF3)ppy]2(dtbpy)PF6(2mol%,5.6mg);所述的三氟甲基亚磺酸钠与I-19的物质的量之比为2.0;所述的光催化剂Ir[dF(CF3)ppy]2(dtbpy)PF6的用量为I-19的物质的量的2.0%;
B.抽真空换氩气后,加入溶剂(甲醇)3mL;所述的溶剂为甲醇;所述的溶剂甲醇的毫升数与I-19的物质的量之比为12.0;
C.以荧光灯照射舒伦克管,搅拌进行反应;所述的荧光灯波长范围为可见光,功率为36W;所述的反应温度为室温(20-25℃,以下相同),反应时间为24小时;
D.反应结束后,向体系中加入水淬灭反应,乙酸乙酯萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物经乙酸乙酯/石油醚混合溶剂柱层析,分离纯化得到三氟甲基化的雌酚酮衍生物II-1986mg,产率81%。所述的乙酸乙酯/石油醚混合溶剂的比例为1:50,柱层析采用硅胶为固定相。
本发明与现有技术相比,具有以下优点和效果:
1.该方法主要原料大部分来源丰富,成本较低,尤其是选用了价格比较低廉的三氟甲基亚磺酸钠作为三氟甲基化试剂;
2.该方法仅需要使用较低的光催化剂用量,即可实现反应物较高的转化数;
3.该方法反应条件温和,简便易操作;
4.该方法应用性广,可适用于各种不同类型的底物,制备出一系列含有三氟甲基的目标化合物。
附图说明
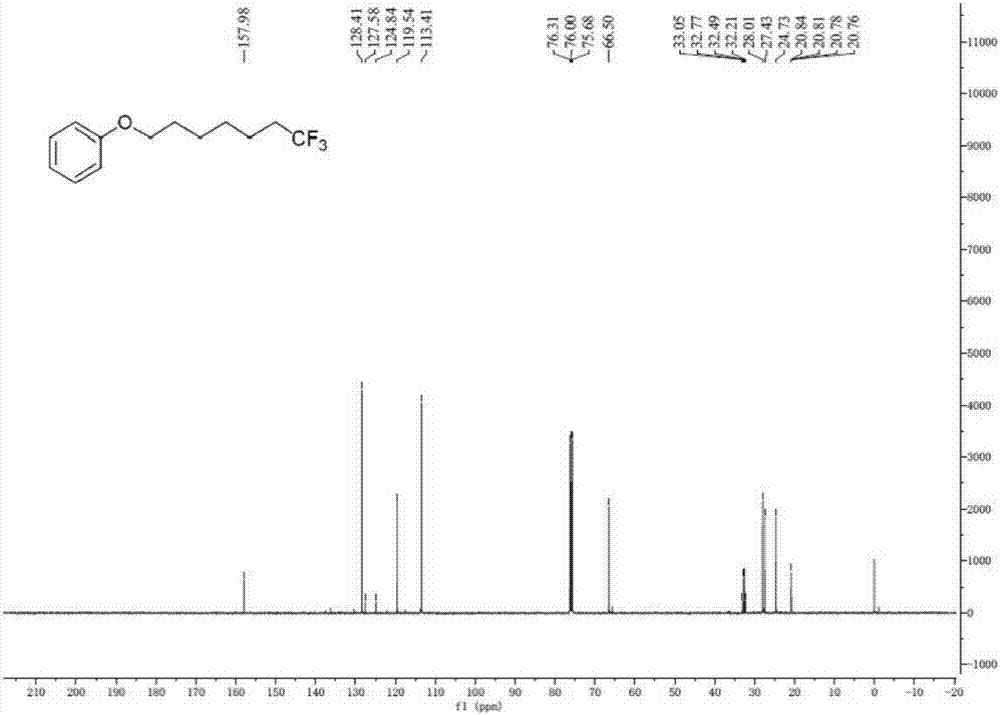
图1为本发明实施例1所制备的化合物II-1的核磁氢谱图。
图2为本发明实施例1所制备的化合物II-1的核磁碳谱图。
图3为本发明实施例1所制备的化合物II-1的核磁氟谱图。
图4为本发明实施例19所制备的化合物II-19的核磁氢谱图。
图5为本发明实施例19所制备的化合物II-19的核磁碳谱图。
图6为本发明实施例19所制备的化合物II-19的核磁氟谱图。
具体实施方式
下面通过实施例,进一步阐明本发明的突出特点,仅在于说明本发明而决不限制本发明。
实施例1:
化合物II-1的制备:
A、在舒伦克(Schlenk)管中加入未活化烯烃I-1(R1=苯氧基,R2=氢,n=4)(44.1mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和光催化剂Ir[dF(CF3)ppy]2(dtbpy)PF6(2mol%,5.6mg);所述的三氟甲基亚磺酸钠与I-1的物质的量之比为2.0;所述的光催化剂Ir[dF(CF3)ppy]2(dtbpy)PF6的用量为I-1的物质的量的2.0%;
B、抽真空换氩气后,加入溶剂(甲醇)3mL;所述的溶剂为甲醇;所述的溶剂甲醇的毫升数与I-1的物质的量之比为12.0;
C、以荧光灯照射舒伦克管,搅拌进行反应;所述的荧光灯波长范围为可见光,功率为36W;所述的反应温度为室温(20-25℃,以下相同),反应时间为24小时;
D、反应结束后,向体系中加入水淬灭反应,乙酸乙酯萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物经乙酸乙酯/石油醚混合溶剂柱层析,分离纯化得到目标产物II-150mg,产率77%。所述的乙酸乙酯/石油醚混合溶剂的比例为0:100,柱层析采用硅胶为固定相。
1H NMR(400MHz,CDCl3)δ7.28(t,J=8.0Hz,2H),6.99–6.83(m,3H),3.95(t,J=6.4Hz,2H),2.18–1.99(m,2H),1.84–1.74(m,2H),1.67–1.38(m,6H).
13C NMR(101MHz,CDCl3)δ157.98,128.41,126.21(d,J=276.3Hz),119.54,113.41,66.50,32.63(q,J=28.3Hz),28.01,27.43,24.73,20.80(q,J=2.9Hz).
19F NMR(376MHz,CDCl3)δ-66.37.GC-MS:m/z 246(M+).
实施例2:
化合物II-2的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-2(R1=对甲基苯氧基,R2=氢,n=4)(47.6mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物以纯石油醚进行柱层析,分离纯化得到目标产物II-253mg,产率82%。
1H NMR(400MHz,CDCl3)δ7.06(d,J=8.2Hz,2H),6.78(d,J=8.5Hz,2H),3.91(t,J=6.4Hz,2H),2.27(s,3H),2.15–1.98(m,2H),1.81–1.72(m,2H),1.64–1.35(m,6H).
13C NMR(101MHz,CDCl3)δ156.96,129.91,129.79,127.30(d,J=276.2Hz),114.35,67.74,33.69(q,J=28.3Hz),29.11,28.50,25.78,21.87(q,J=2.9Hz),20.46.
19F NMR(376MHz,CDCl3)δ-66.39.GC-MS:m/z 260(M+).
实施例3:
化合物II-3的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-3(R1=对甲氧基苯氧基,R2=氢,n=4)(51.6mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4 干燥,过滤,旋转蒸发除去溶剂。残留物以纯石油醚进行柱层析,分离纯化得到目标产物II-356mg,产率82%。
1H NMR(400MHz,CDCl3)δ6.85–6.79(m,4H),3.90(t,J=6.4Hz,2H),3.76(s,3H),2.16–1.98(m,2H),1.81–1.70(m,2H),1.65–1.36(m,6H).
13C NMR(101MHz,CDCl3)δ153.78,153.23,127.31(d,J=276.2Hz),115.42,114.65,68.34,55.71,33.68(q,J=28.3Hz),29.17,28.51,25.78,21.87(q,J=2.8Hz).
19F NMR(376MHz,CDCl3)δ-66.40.
实施例4:
化合物II-4的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-4(R1=对氯苯氧基,R2=氢,n=4)(52.7mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物以纯石油醚进行柱层析,分离纯化得到目标产物II-450mg,产率71%。
1H NMR(400MHz,CDCl3)δ7.22(d,J=9.0Hz,2H),6.81(d,J=9.0Hz,2H),3.91(t,J=6.4Hz,2H),2.16–2.00(m,2H),1.82–1.72(m,2H),1.65–1.39(m,6H).
13C NMR(101MHz,CDCl3)δ157.65,129.30,127.24(d,J=276.3Hz),125.40,115.72,68.00,33.65(q,J=28.4Hz),28.95,28.44,25.71,21.83(q,J=2.9Hz).
19F NMR(376MHz,CDCl3)δ-66.38.
实施例5:
化合物II-5的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-5(R1=对溴苯氧基,R2 =氢,n=4)(63.8mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物以纯石油醚进行柱层析,分离纯化得到目标产物II-560mg,产率74%。
1H NMR(400MHz,CDCl3)δ7.36(d,J=9.0Hz,2H),6.76(d,J=9.0Hz,2H),3.91(t,J=6.4Hz,2H),2.17–1.99(m,2H),1.84–1.72(m,2H),1.67–1.37(m,6H).
13C NMR(101MHz,CDCl3)δ158.14,132.23,127.22(d,J=276.3Hz),116.25,112.67,67.93,33.65(q,J=28.4Hz),28.92,28.44,25.70,21.82(q,J=2.9Hz).
19F NMR(376MHz,CDCl3)δ-66.38.GC-MS:m/z 324(M+).
实施例6:
化合物II-6的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-6(R1=邻碘苯氧基,R2=氢,n=4)(75.5mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物以纯石油醚进行柱层析,分离纯化得到目标产物II-674mg,产率80%。
1H NMR(400MHz,CDCl3)δ7.76(dd,J=7.8,1.6Hz,1H),7.27(ddd,J=8.3,7.4,1.6Hz,1H),6.79(dd,J=8.2,1.2Hz,1H),6.69(td,J=7.7,1.3Hz,1H),4.00(t,J=6.2Hz,2H),2.17–2.01(m,2H),1.89–1.79(m,2H),1.66–1.39(m,6H).
13C NMR(101MHz,CDCl3)δ157.49,139.42,129.43,127.26(d,J=276.3Hz),122.40,112.01,86.66,68.82,33.65(q,J=28.3Hz),28.82,28.36,25.80,21.82(q,J=2.9Hz).
19F NMR(376MHz,CDCl3)δ-66.34.GC-MS:m/z 372(M+).
实施例7:
化合物II-7的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-7(R1=对醛基苯氧基,R2=氢,n=4)(51.1mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物经乙酸乙酯/石油醚=1:20混合溶剂进行柱层析,分离纯化得到目标产物II-753mg,产率78%。
1H NMR(400MHz,CDCl3)δ9.88(s,1H),7.83(d,J=8.7Hz,2H),6.99(d,J=8.7Hz,2H),4.05(t,J=6.4Hz,2H),2.17–2.01(m,2H),1.89–1.76(m,2H),1.66–1.41(m,6H).
13C NMR(101MHz,CDCl3)δ190.85,164.13,132.01,129.83,127.21(d,J=276.3Hz),114.72,68.11,33.63(q,J=28.4Hz),28.81,28.40,25.67,21.81(q,J=2.9Hz). 19F NMR(376MHz,CDCl3)δ-66.37.GC-MS:m/z 274(M+).
实施例8:
化合物II-8的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-8(R1=对乙酰基苯氧基,R2=氢,n=4)(54.6mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物经乙酸乙酯/石油醚=1:20混合溶剂进 行柱层析,分离纯化得到目标产物II-863mg,产率88%。
1H NMR(400MHz,CDCl3)δ7.93(d,J=8.9Hz,2H),6.91(d,J=8.9Hz,2H),4.02(t,J=6.4Hz,2H),2.55(s,3H),2.17–2.00(m,2H),1.87–1.75(m,2H),1.66–1.41(m,6H).
13C NMR(101MHz,CDCl3)δ196.82,162.99,130.60,130.19,127.21(d,J=276.3Hz),114.10,67.94,33.63(q,J=28.3Hz),28.84,28.41,26.33,25.68,21.81(q,J=2.9Hz).
19F NMR(376MHz,CDCl3)δ-66.38.GC-MS:m/z 288(M+).
实施例9:
化合物II-9的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-9(R1=苯基,R2=氢,n=2)(33.1mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物经纯石油醚进行柱层析,分离纯化得到目标产物II-943mg,产率85%。
1H NMR(400MHz,CDCl3)δ7.30(t,J=7.4Hz,2H),7.20(dd,J=13.9,7.2Hz,3H),2.65(t,J=7.5Hz,2H),2.19–2.02(m,2H),1.78–1.54(m,4H).
13C NMR(101MHz,CDCl3)δ141.68,128.39,128.33,127.14(d,J=273.2Hz),125.79,35.48,33.59(q,J=28.4Hz),30.46,21.51(q,J=2.9Hz).
19F NMR(376MHz,CDCl3)δ-66.32.
实施例10:
化合物II-10的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-10(R1=对甲基苯硫基, R2=氢,n=2)(44.6mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物经纯石油醚进行柱层析,分离纯化得到目标产物II-1040mg,产率65%。
1H NMR(400MHz,CDCl3)δ7.25(d,J=8.1Hz,2H),7.10(d,J=8.0Hz,2H),2.88(t,J=6.8Hz,2H),2.32(s,3H),2.16–1.98(m,2H),1.74–1.60(m,4H).
13C NMR(101MHz,CDCl3)δ136.41,132.23,130.34,129.75,127.04(d,J=276.3Hz),34.04,33.33(q,J=28.6Hz),28.22,21.01(q,J=3.2Hz).(one carbon signal isoverlapped)
19F NMR(376MHz,CDCl3)δ-66.35.GC-MS:m/z 248(M+).
实施例11:
化合物II-11的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-11(R1=苯甲酸酯基,R2=氢,n=4)(51.1mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物以乙酸乙酯/石油醚=1:50混合溶剂进行柱层析,分离纯化得到目标产物II-1143mg,产率63%。
1H NMR(400MHz,CDCl3)δ8.04(d,J=7.2Hz,2H),7.56(t,J=7.4Hz,1H),7.44(t,J=7.8Hz,2H),4.32(t,J=6.5Hz,2H),2.16–1.97(m,2H),1.84–1.71(m,2H),1.66–1.37(m,6H).
13C NMR(101MHz,CDCl3)δ166.64,132.89,130.40,129.53,128.36,127.21(d,J=276.2Hz),64.80,33.64(q,J=28.4Hz),28.49,28.37,25.73,21.81(q,J=2.9Hz). 19F NMR(376MHz,CDCl3)δ-66.40.
实施例12:
化合物II-12的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-12(R1=酞酰亚胺基,R2=氢,n=4)(57.3mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物以乙酸乙酯/石油醚=1:10混合溶剂进行柱层析,分离纯化得到目标产物II-1256mg,产率75%。
1H NMR(400MHz,CDCl3)δ7.88–7.82(m,2H),7.72(dd,J=5.5,3.0Hz,2H),3.69(t,J=7.2Hz,2H),2.18–1.95(m,2H),1.75–1.64(m,2H),1.62–1.50(m,2H),1.48–1.31(m,4H).
13C NMR(101MHz,CDCl3)δ168.41,133.88,132.07,127.14(d,J=276.0Hz),123.16,37.74,33.58(q,J=28.3Hz),28.31,28.21,26.39,21.72(q,J=2.9Hz).
19F NMR(376MHz,CDCl3)δ-66.42.
实施例13:
化合物II-13的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-13(R1=对溴苯氧基,R2=甲基,n=2)(60.3mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4 干燥,过滤,旋转蒸发除去溶剂。残留物以纯石油醚进行柱层析,分离纯化得到目标产物II-1353mg,产率68%。
1H NMR(400MHz,CDCl3)δ7.40–7.33(m,2H),6.79–6.73(m,2H),4.05–3.85(m,2H),2.28–2.08(m,2H),2.07–1.85(m,2H),1.74–1.64(m,1H),1.08(d,J=6.3Hz,3H).
19F NMR(376MHz,CDCl3)δ-63.21.GC-MS:m/z 310(M+).
实施例14:
化合物II-14的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-14(R1=苯磺酰基,R2=氢,n=0)(42.1mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物以乙酸乙酯/石油醚=1:5进行柱层析,分离纯化得到目标产物II-1433mg,产率55%。
1H NMR(400MHz,CDCl3)δ7.87(d,J=7.2Hz,2H),7.65(t,J=7.5Hz,1H),7.55(t,J=7.7Hz,2H),3.28–3.17(m,2H),2.58–2.41(m,2H).
13C NMR(101MHz,CDCl3)δ138.07,134.47,129.70,128.11,125.41(d,J=276.5Hz),49.35(q,J=2.9Hz),28.04(q,J=31.5Hz).
19F NMR(376MHz,CDCl3)δ-65.94.
实施例15:
化合物II-15的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-15(R1=苯酚酯基,R2=氢,n=0)(37.0mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和 Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物以乙酸乙酯/石油醚=1:20进行柱层析,分离纯化得到目标产物II-1532mg,产率58%。
1H NMR(400MHz,CDCl3)δ7.39(t,J=7.9Hz,2H),7.26(d,J=6.4Hz,1H),7.08(d,J=8.0Hz,2H),2.96–2.79(m,2H),2.68–2.47(m,2H).
13C NMR(101MHz,CDCl3)δ169.60,150.38,129.56,127.80,126.43(d,J=276.0Hz),121.35,29.37(q,J=30.2Hz),27.35(q,J=3.3Hz).
19F NMR(376MHz,CDCl3)δ-66.89.
实施例16:
化合物II-16的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-16(R1=苯酚酯基,R2=甲基,n=0)(40.5mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物以乙酸乙酯/石油醚=1:20进行柱层析,分离纯化得到目标产物II-1650mg,产率86%。
1H NMR(400MHz,CDCl3)δ7.38(t,J=7.9Hz,2H),7.24(t,J=7.9Hz,1H),7.07(d,J=7.6Hz,2H),3.14–2.97(m,1H),2.87–2.68(m,1H),2.36–2.19(m,1H),1.44(d,J=7.1Hz,3H).
13C NMR(101MHz,CDCl3)δ173.05,150.52,129.53,126.30(d,J=276.8Hz),126.11,121.33,37.09(q,J=28.9Hz),34.28(q,J=2.7Hz),17.62.
19F NMR(376MHz,CDCl3)δ-64.80.GC-MS:m/z 232(M+).
实施例17:
化合物II-17的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-17(R1=N,N-甲基苯基-酰胺基,R2=甲基,n=0)(43.8mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物以乙酸乙酯/石油醚=1:20进行柱层析,分离纯化得到目标产物II-1732mg,产率52%。
1H NMR(400MHz,CDCl3)δ7.48–7.42(m,2H),7.41–7.35(m,1H),7.23–7.16(m,2H),3.27(s,3H),2.85–2.61(m,2H),2.05–1.85(m,1H),1.10(d,J=6.5Hz,3H).
13C NMR(101MHz,CDCl3)δ174.26,143.50,129.96,128.21,127.27,126.45(d,J=277.0Hz),37.62,37.57(q,J=28.1Hz),30.91(q,J=2.5Hz),18.75.
19F NMR(376MHz,CDCl3)δ-65.20.GC-MS:m/z 245(M+).
实施例18:
化合物II-18的制备:
在10mL舒伦克(Schlenk)管中加入未活化烯烃I-18(R1=苯酮基,R2=苯基,n=0)(52.1mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和Ir[dF(CF3)ppy]2(dtbbpy)PF6(5.6mg,0.005mmol)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯(3×10mL)萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物以乙酸乙酯/石油醚=1:20进行柱层析, 分离纯化得到目标产物II-1843mg,产率62%。
1H NMR(400MHz,CDCl3)δ7.96(d,J=7.2Hz,2H),7.50(t,J=7.4Hz,1H),7.40(t,J=7.6Hz,2H),7.31(d,J=4.3Hz,4H),7.25–7.19(m,1H),4.91(dd,J=7.7,5.5Hz,1H),3.42–3.19(m,1H),3.41–3.22(m,1H).
13C NMR(101MHz,CDCl3)δ196.75,137.41,135.67,133.39,129.36,128.85,128.69,128.06,127.86,126.41(d,J=277.1Hz),47.18(q,J=2.4Hz),37.37(q,J=28.2Hz).
19F NMR(376MHz,CDCl3)δ-64.60.
实施例19:
雌酚酮衍生物II-19的制备:
在舒伦克(Schlenk)管中加入雌酚酮衍生物I-19(88.1mg,0.25mmol),三氟甲基亚磺酸钠(78.0mg,0.50mmol)和光催化剂Ir[dF(CF3)ppy]2(dtbpy)PF6(2mol%,5.6mg)。抽真空换氩气后,加入溶剂(甲醇)3mL,以荧光灯照射舒伦克管,搅拌进行反应。荧光灯波长范围为可见光,功率为36W,反应温度为室温,反应时间为24小时。反应结束后,向体系中加入水淬灭反应,乙酸乙酯萃取,分离出有机相后,用无水Na2SO4干燥,过滤,旋转蒸发除去溶剂。残留物以乙酸乙酯/石油醚=1:50进行柱层析,分离纯化得到三氟甲基化的雌酚酮衍生物II-1986mg,产率81%。
1H NMR(400MHz,CDCl3)δ7.19(d,J=8.6Hz,1H),6.70(dd,J=8.6,2.6Hz,1H),6.64(d,J=2.5Hz,1H),3.93(t,J=6.4Hz,2H),2.95–2.83(m,2H),2.54–2.46(m,1H),2.43–2.34(m,1H),2.30–1.90(m,8H),1.84–1.71(m,2H),1.68–1.36(m,11H),0.90(s,3H).
13C NMR(101MHz,CDCl3)δ220.86,157.08,137.74,131.98,127.26(d,J=276.3Hz),126.34,114.56,112.10,67.61,50.45,48.02,44.01,38.39,35.90,33.67(q,J=28.3Hz),31.60,29.68,29.07,28.45,26.58,25.94,25.76,21.84(q,J=2.8Hz),21.60,13.87.
19F NMR(376 MHz,CDCl3)δ-66.35.GC-MS:m/z 422(M+)。
- 还没有人留言评论。精彩留言会获得点赞!