一种用于快速培养小球藻的培养基及其培养方法与流程
本发明属于生物技术领域,具体涉及一种用于快速培养小球藻的培养基及其培养方法。
背景技术:
小球藻是一种球形单细胞绿藻,直径3~8μm,以光合自生长繁殖,是第一种被人工培养的微藻,富含丰富的氨基酸、蛋白质、多糖、不饱和脂肪酸等营养成份,具有很高的医疗保健价值。在水产养殖中,小球藻促进浮游动物如轮虫、桡足类、枝角类和丰年虫的生长于繁殖,还可作为许多鱼、虾、贝类的优质开口饵料,为养殖动物发育初期提供充足的营养物质。此外,小球藻在生长过程中能消耗掉水体中部分氮、磷等有机肥,从而达到净化调节水质的目的,在水产养殖应用上是一种重要的微藻资源。
为使小球藻达到快速高密度生长的同时还能保证高品质的藻细胞,须对前期进行异养培养阶段的培养基及方法进行创新优化,促使小球藻快速生长。中国专利cn102465098a、cn1807572a都是快速培养普通小球藻的培养基组合物,前者是在常规se培养基的基础上添加亚硫酸钠和有机碳源获得,创新性不是很大,同时操作起来较繁琐;后者则改变了培养基配方,但是有机碳源葡萄糖的耗用率较高,成本比较大;专利cn104830691a中描述了一种小球藻培养方法即在指数生长期中期,过滤出部分小球藻,在补充营养物质继续培养,操作繁琐,小球藻指数生长期的中期不易检测,操作不方便,不适合规模化培养小球藻。
随着水产养殖业的发展,小球藻规模化的培养也不短扩大,其前期异养阶段藻细胞品质的高低直接影响到后期小球藻自养情况, 同时也是判断其是否能够达到高密度生长繁殖的关键。
技术实现要素:
本发明的目的是提供一种适用于小球藻光自养-异养混合培养的培养基及培养方法。通过使用该培养基组合物和该方法相结合可使小球藻在较短培养周期内达到高品质、高密度的培养效果,并在培养结束时藻细胞可达到光自养培养水平,实现规模化培养。
为实现上述目的,本发明提供了一种用于快速培养小球藻的培养基,所述的培养基组合物主要成份为ch3coona、nacl、kh2po4、k2hpo4、ch3ch2coona、(nh4)2so4、mgso4、feso4、znso4、mnso4、na2edta。
在本发明一个实施方案中,所述的培养基含有如下组分:ch3coona1.5~4g/l、nacl0.5~2g/l、kh2po40.2~1.5g/l、k2hpo40.1~1g/l、ch3ch2coona0.1~1g/l、(nh4)2so40.05~0.2g/l、mgso4·7h2o0.08~0.3g/l、feso4·7h2o1~15mg/l、znso4·7h2o0.1~3mg/l、mnso4·h2o0.1~3mg/l、na2edta0.5~5mg/l。
进一步,所述的培养基含有如下组分:ch3coona2.0~3.5g/l、nacl0.8~1.5g/l、kh2po40.5~1.2g/l、k2hpo40.3~0.8g/l、ch3ch2coona0.3~0.8g/l、(nh4)2so40.08~0.15g/l、mgso4·7h2o0.1~0.25g/l、feso4·7h2o5~10mg/l、znso4·7h2o0.5~2mg/l、mnso4·h2o0.5~2mg/l、na2edta1.5~4mg/l。
更进一步,所述的培养基含有如下组分:ch3coona2.5~3g/l、nacl1~1.2g/l、kh2po40.6~1g/l、k2hpo40.4~0.7g/l、ch3ch2coona0.4~0.7g/l、(nh4)2so40.1~0.13g/l、mgso4·7h2o0.15~0.2g/l、feso4·7h2o6~8mg/l、znso4·7h2o0.8~1.5mg/l、mnso4·h2o0.8~1.5mg/l、na2edta2~3mg/l。
其中,所述的培养基ph值为7.0~7.5。
本发明还提供利用本发明的培养基组合物快速培养小球藻的方 法,其为将小球藻接种到所述的培养基中,初始接种量为105~106细胞/ml,在温度为26~32℃,光照强度为2800~3800lux,光暗比为16:8的条件下进行培养,每天分别于早、中、晚各对藻液充气30min,防止藻细胞沉底;在藻细胞密度达到107~108细胞/ml时,按1l藻液5~25g的量,往藻液中添加葡萄糖溶液继续培养,此时藻细胞密度达到2.0×108~2.5×108细胞/ml,即可收获全部小球藻。
与现有技术相比,本发明公开的快速小球藻培养基组合物及其培养方法,可以迅速使小球藻成为生长优势藻种,培养基制作过程及培养方法简单方便;这种培养基组合物不仅可使未经驯化的普通小球藻在较短的培养周期内藻细胞达到高密度的培养水平,而且藻细胞品质达到与全程异养培养的小球藻同等水平,藻细胞蛋白质含量保持在60%以上,培养周期结束时小球藻可进行光自养培养,从而实现普通小球藻的快速高产培养模式,具有广阔的应用前景。
附图说明
图1不同小球藻培养基组合物对比试验。
图2培养过程中添加不同碳源对比试验。
图3培养过程中不同时间添加葡萄糖碳源的对比实验。
图4本发明的3个实施例培养效果对比实验。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例1
称取各成分,溶于蒸馏水中,配制成培养基:
ch3coona1.5g/l、nacl0.5g/l、kh2po40.5g/l、k2hpo40.2g/l、ch3ch2coona0.5g/l、(nh4)2so40.2g/l、mgso4·7h2o0.15g/l、feso4·7h2o6mg/l、znso4·7h2o0.8mg/l、mnso4·h2o0.8mg/l、na2edta2mg/l。培养基ph值在7.0左 右。
小球藻培养方法具体步骤操作如下:
将小球藻藻细胞按105细胞/ml的比例接种至配置好的培养基组合物中,在温度为26℃,光照强度为3400lux,光暗比为16:8的条件下进行培养,并分别于每天早、中、晚各对藻液充气30min,通气量为1l/min。在培养中后期(第7天左右,此时藻细胞密度达到107~108细胞/ml),按1l藻液10g的量,往藻液中添加葡萄糖溶液继续培养,接种后第10天,即可收获全部小球藻。
实施例2
称取各成分,溶于蒸馏水中,配制成培养基:
ch3coona2.8g/l、nacl0.8g/l、kh2po40.6g/l、k2hpo40.55g/l、ch3ch2coona0.5g/l、(nh4)2so40.11g/l、mgso4·7h2o0.18g/l、feso4·7h2o7mg/l、znso4·7h2o1mg/l、mnso4·h2o1.2mg/l、na2edta2.5mg/l。ph值在7.5左右。
小球藻培养方法具体步骤操作如下:
将小球藻藻细胞按106细胞/ml的比例接种至配置好的培养基组合物中,在温度为28℃,光照强度为3000lux,光暗比为16:8的条件下进行培养,并分别于每天早、中、晚各对藻液充气30min,通气量为1l/min。在培养中后期(第7天左右,此时藻细胞密度达到107~108细胞/ml),按1l藻液5g的量,往藻液中添加葡萄糖溶液继续培养,接种后第10天,即可收获全部小球藻。实施例3
称取各成分,溶于蒸馏水中,配制成培养基:
ch3coona4g/l、nacl2g/l、kh2po41.5g/l、k2hpo41g/l、ch3ch2coona0.1g/l、(nh4)2so40.08g/l、mgso4·7h2o0.25g/l、feso4·7h2o15mg/l、znso4·7h2o3mg/l、mnso4·h2o2mg/l、na2edta5mg/l。ph值在7.3左右。
小球藻培养方法具体步骤操作如下:
将小球藻藻细胞按106细胞/ml的比例接种至配置好的培养基组合物中,在温度为32℃,光照强度为2800lux,光暗比为16:8的条件下进行培养,并分别于每天早、中、晚各对藻液充气30min,通气量为1l/min。在培养中后期(第7天左右,此时藻细胞密度达到107~108细胞/ml),按1l藻液20g的量,往藻液中添加葡萄糖溶液继续培养,接种后第10天,即可收获全部小球藻。实施例4
称取各成分,溶于蒸馏水中,配制成培养基:
ch3coona1.5g/l、nacl0.5g/l、kh2po41.5g/l、k2hpo41g/l、ch3ch2coona0.1g/l、(nh4)2so40.05g/l、mgso4·7h2o0.08g/l、feso4·7h2o15mg/l、znso4·7h2o3mg/l、mnso4·h2o3mg/l、na2edta5mg/l。ph值在7.3左右。
小球藻培养方法具体步骤操作如下:
将小球藻藻细胞按106细胞/ml的比例接种至配置好的培养基组合物中,在温度为30℃,光照强度为3800lux,光暗比为16:8的条件下进行培养,并分别于每天早、中、晚各对藻液充气30min,通气量为1l/min。在培养中后期(第7天左右,此时藻细胞密度达到107~108细胞/ml),按1l藻液5g的用量,往藻液中添加葡萄糖溶液继续培养,接种后第10天,即可收获全部小球藻。
实施例5
称取各成分,溶于蒸馏水中,配制成培养基:
ch3coona4g/l、nacl2g/l、kh2po40.2g/l、k2hpo40.1g/l、ch3ch2coona1g/l、(nh4)2so40.2g/l、mgso4·7h2o0.3g/l、feso4·7h2o1mg/l、znso4·7h2o0.1mg/l、mnso4·h2o0.1mg/l、na2edta0.5mg/l。ph值在7.4左右。
小球藻培养方法具体步骤操作如下:
将小球藻藻细胞按106细胞/ml的比例接种至配置好的培养基 组合物中,在温度为27℃,光照强度为3000lux,光暗比为16:8的条件下进行培养,并分别于每天早、中、晚各对藻液充气30min,通气量为1l/min。在培养中后期(第7天左右,此时藻细胞密度达到107~108细胞/ml),按1l藻液25g的量,往藻液中添加葡萄糖溶液继续培养,接种后第10天,即可收获全部小球藻。
试验例1
采用本发明实施例1制备的小球藻培养基组合物及培养方法进行对比试验。
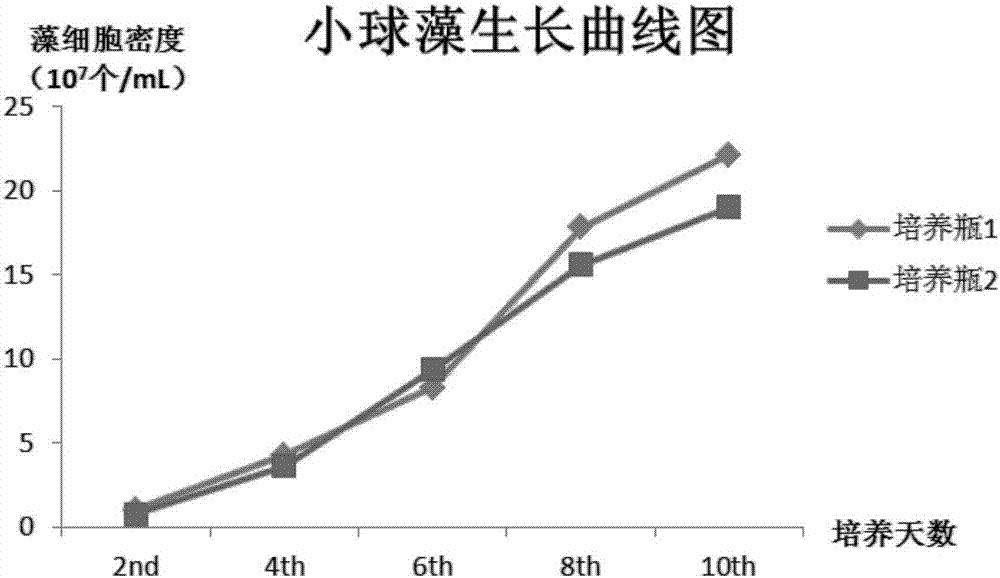
培养瓶1(实验组):在500m的l锥形瓶中加入300ml本发明实施例1制备的小球藻培养基组合物,接种量:浓度为1×106细胞/ml的小球藻藻液200ml;
培养条件:按照实施例1所述的小球藻培养方法进行培养。
培养瓶2(对照组),在500ml锥形瓶中加入300mlf/2藻类培养基,培养基由nano375mg/l、nah2po4·h2o5mg/l、na2sio3·9h2o20mg/l、na2edta5mg/l、fecl3·6h2o3.5mg/l、cuso4·5h2o0.01mg/l、znso4·7h2o0.02mg/l、cocl2·6h2o0.02mg/l、mncl·4h2o0.2mg/l、na2moo4.·2h2o0.08mg/l、维生素b10.1mg/l、维生素b120.5mg/l、生物素0.5mg/l组成,接种量:浓度为1×106细胞/ml的小球藻藻液200ml;培养条件:与实施例1一致。
以培养瓶1中本发明所述培养基为实验组,以培养瓶2为对照组,每隔两天用血球计数板分别对两瓶藻液的小球藻藻细胞进行计数,其结果如图1所示:
由图1可以看出,使用本发明所述培养基培养的培养瓶1中小球藻其藻细胞生长繁殖速度明显高于使用f/2培养基的培养瓶2,在第十天培养周期结束时藻细胞密度达2.2×108细胞/ml,明显高于对照组约5×107细胞/ml,且使用本发明所述培养基的小球藻其生长速 度在中后期也明显快于f/2培养基,说明了使用本发明实施例1所述的小球藻培养基组合物及培养方法具有显著的生长优势。
试验例2
采用本发明实施例2制备的小球藻培养基组合物及培养方法进行对比试验。
培养瓶1(实验组):在500m的l锥形瓶中加入300ml本发明实施例2制备的小球藻培养基组合物,接种量:浓度为1×106细胞/ml的小球藻藻液200ml;
培养条件:按照实施例2所述的小球藻培养方法进行培养,在培养中后期(第7天左右,此时藻细胞密度达到107~108细胞/ml),往藻液中添加15g/l的葡萄糖继续培养,接种后第10天收获全部小球藻。
培养瓶2(对照组),在500m的l锥形瓶中加入300ml本发明实施例2制备的小球藻培养基组合物,接种量:浓度为1×106细胞/ml的小球藻藻液200ml;培养条件:与实施例1所述的培养方法进行培养,在培养中后期(第6天,此时藻细胞密度达到107~108细胞/ml),往藻液中添加15g/l的尿素继续培养,接种后第10天收获全部小球藻。
以培养瓶1中本发明所述培养基为实验组,以培养瓶2为对照组,每隔两天用血球计数板分别对两瓶藻液的小球藻藻细胞进行计数,其结果如图2所示。
由图2可以看出,在同样使用本发明所述培养基的培养条件下,前期两个培养瓶中的小球藻长势基本持平,但在第六天两个不同培养瓶分别加入葡萄糖和尿素(有机碳源和无机碳源)后,培养瓶1的藻细胞数量逐渐多于培养瓶2,后期培养瓶1的藻细胞密度约2.3×108细胞/ml,培养瓶2的藻细胞密度约1.8×108细胞/ml,藻细胞生长速度培养瓶1明显高于培养2,说明了在同样使用本发明实施 例2制备的培养基的条件下,采用本发明实施例2所述的中后期添加葡萄糖的小球藻培养方法具有显著生长优势。
试验例3
采用本发明实施例3制备的小球藻培养基组合物及培养方法进行对比试验。
培养瓶1(对照组),在500m的l锥形瓶中加入300ml本发明实施例3制备的小球藻培养基组合物,接种量:浓度为1×106细胞/ml的小球藻藻液200ml;培养条件:与实施例1所述的培养方法进行培养,不同之处,在培养早期(第1天),往藻液中添加25g/l的葡糖糖进行培养,接种后第10天收获全部小球藻。
培养瓶2(实验组):在500m的l锥形瓶中加入300ml本发明实施例3制备的小球藻培养基组合物,接种量:浓度为1×106细胞/ml的小球藻藻液200ml;
培养条件:按照实施例3所述的小球藻培养方法进行培养。
以培养瓶1为对照组,以培养瓶2中本发明实施例3所述的培养基为实验组,每隔两天用血球计数板分别对两瓶藻液的小球藻藻细胞进行计数,其结果如图3所:
由图3可以看出,培养瓶1由于接种同时添加葡萄糖的原因在前六天藻细胞生长速度均优于培养瓶2,在第六天培养瓶2添加葡萄糖后,培养瓶2中的藻细胞生长速度显著提高,第七天是藻细胞浓度已和培养瓶1持平,到第十天培养周期结束时培养瓶2中小球藻藻细胞数量超过培养瓶1约3.2×107细胞/ml,说明了在同样使用葡萄糖进行异养培养的条件下,采用本发明实施例3所述的中后期添加葡萄糖的培养方法小球藻具有显著生长优势。
试验例4
采用本发明实施例1、实施例2、实施例3制备的小球藻培养基组合物及培养方法进行对比试验。
培养瓶1:在500m的l锥形瓶中加入300ml本发明实施例1制备的小球藻培养基组合物,接种量:浓度为1×106细胞/ml的小球藻藻液200ml;
培养条件:按照实施例1所述的小球藻培养方法进行培养。
培养瓶2:在500m的l锥形瓶中加入300ml本发明实施例2制备的小球藻培养基组合物,接种量:浓度为1×106细胞/ml的小球藻藻液200ml;
培养条件:按照实施例2所述的小球藻培养方法进行培养,。
培养瓶3:在500m的l锥形瓶中加入300ml本发明实施例3制备的小球藻培养基组合物,接种量:浓度为1×106细胞/ml的小球藻藻液200ml;
培养条件:按照实施例3所述的小球藻培养方法进行培养。
本发明实施例1、实施例2、实施例3制备的小球藻培养基组合物及培养方法进行对比试验结果如图4所示。
试验结果表明,本发明实施例1、实施例2、实施例3制备的小球藻培养基组合物及培养方法都能够显著提高小球藻的生长繁殖速度,其中实施例2培养的小球藻培养瓶2效果最佳。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!