用于胃癌早期诊断及预后评估的NDRG4基因甲基化检测的试剂盒及其应用的制作方法
本发明涉及疾病相关DNA检测
技术领域:
,更具体地涉及用于胃癌早期诊断及预后评估的NDRG4基因甲基化检测的试剂盒及其应用。
背景技术:
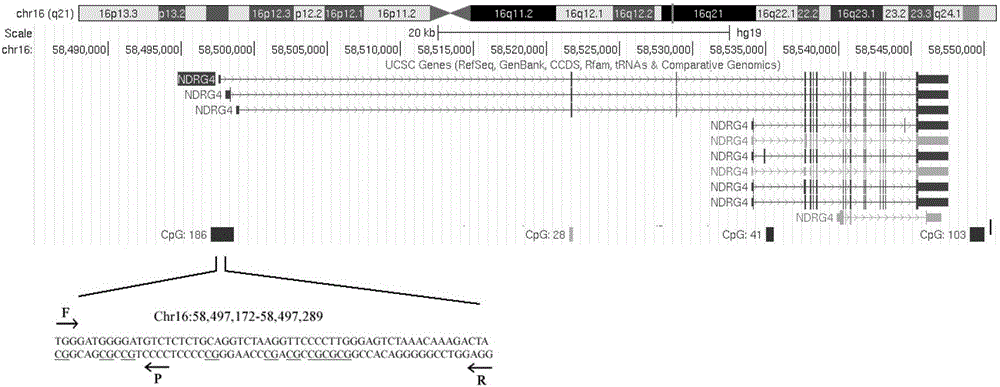
:胃癌是严重危害人类健康的最常见的恶性肿瘤之一,发病率位居所有恶性肿瘤的第二位,死亡率列所有恶性肿瘤的第三位。目前根治性手术仍然是胃癌的主要治疗方式,也是唯一有希望治愈胃癌的手段。但临床上仍有大多数患者确诊时已是中晚期,手术效果不佳,直接影响预后。因此深入研究胃癌发生、发展的分子机制,可为胃癌早期诊断提供依据,同时也为临床治疗提供有效的靶点治疗,具有重要的临床意义。胃癌的病因被认为是环境因素及遗传因素共同作用的结果。就胃癌发展在基因组学层面的研究来看,胃癌是一多基因异常改变,经历多步骤多阶段发展过程而导致的疾病,不同基因功能异常在胃癌发展不同阶段起不同作用。近年来研究发现,除了遗传学改变,表观遗传学改变亦参与了胃癌的发生发展过程。表观遗传学修饰是指不涉及基因组的碱基序列改变,却能导致可遗传性的表型变异,主要包括DNA甲基化修饰、组蛋白修饰、染色体重塑、RNA干扰等。目前研究发现:基因组的广泛低甲基化是肿瘤细胞的一个普遍特征;肿瘤抑制基因启动子区的高甲基化可导致抑癌基因沉默、失活致表达产物减少或丧失。DNA甲基化与胃癌之间关系密切,研究发现在胃癌的各个阶段都能检测有基因甲基化的存在,甚至癌前病变阶段也能发现。因此,DNA甲基化可为胃癌早期诊断、判断预后和靶向治疗提供新的思路。N-myc下游调控基因4(N-Mycdownstreamregulatedgene4,NDRG4)属于抑癌基因NDRG基因家族成员。该基因家族在人体多种其他正常组织中高表达,在某些肿瘤组织中不表达或低表达,低表达则可能与启动子高甲基化相关。因此,NDRG4与肿瘤相关性的研究备受重视。有研究表明,NDRG4的表达水平随着胶质瘤恶性程度的升高而降低,且NDRG4表达水平与胶质瘤患者预后呈正相关,提示NDRG4基因的抑癌效应具有肿瘤细胞来源特异性。目前,目前,国内外还没有公开任何关于检测NDRG4基因启动子区甲基化程度评估胃癌患病风险和总体预后的试剂盒的相关研究报道。技术实现要素:本发明所要解决的技术问题是提供操作简便,周期短,灵敏度高,特异性好以及检测准确率高的用于胃癌早期诊断及预后评估的NDRG4基因甲基化检测的试剂盒及其应用。本发明解决上述技术问题所采用的技术方案为一种用于胃癌早期诊断及预后评估的NDRG4基因甲基化检测的试剂盒,包括一对NDRG4基因启动子区甲基化特异性扩增引物及荧光定量探针,具体核苷酸序列如下:上游引物:5'-TGGGATGGGGATGTTTTTGT-3';下游引物:5'-CCTCCAAACCCCCTATAACC-3';荧光定量探针:5'-6-FAM-AAAACGACGCTACCGTAATCTTTA-BHQ1-3'。所述试剂盒还包括荧光定量甲基化特异性PCR反应体系,其组成为:20μl的荧光定量甲基化特异性PCR反应体系的组成为:2×HotTaqMaterMix10.0ul;5μM的上、下游引物各1.0μl;2μM的探针1.0μl;H2O5.0μl,DNA样本模板2.0μl;荧光定量甲基化特异性PCR反应条件如下:(1)95℃预变性10min;(2)95℃变性15s,60℃退火45s,共45个循环,期间连续采集荧光信号;(3)40℃维持10min,每例标本设三个复孔,QiagenEpiTectmethylatedDNA作为阳性对照和QiagenEpiTectunmethylatedDNA作为阴性对照,水为空白对照。所述试剂盒还包括检测参照基因ACTB甲基化程度的甲基化特异性引物对及探针,具体核苷酸序列如下:上游引物:5'-TGGTGATGGAGGAGGTTTAGTAAGT-3';下游引物:5'-AACCAATAAAACCTACTCCTCCCTTAA-3';荧光定量探针:5'-6-FAM-ACCACCACCCAACACACAATAACAAACACA-BHQ1-3'。上述用于胃癌早期诊断及预后评估的NDRG4基因甲基化检测的试剂盒的用途,可用于制备胃癌早期诊断和预后评估的试剂或试剂盒。与现有技术相比,本发明的优点在于:本发明用于胃癌早期诊断及预后评估的NDRG4基因甲基化检测的试剂盒,针对胃癌的早期诊断和预后评估,设计获得了一组位于调控转录功能区域的NDRG4基因启动子区甲基化的引物和探针,扩增区域位于基因转录起始位点的上游-377bp至-260bp,并且成功组建成试剂盒,对于NDRG4基因启动子区甲基化的检测,具有较高的灵敏度和特异性,能够辅助诊断早期胃癌,并具有预测胃癌患者术后总体生存情况的应用前景,具体优点如下:1)本发明结合生物数据库寻找NDRG4基因具有调控下游转录功能的特定序列,并通过双荧光素酶实验验证了该序列的生物学功能,有助于提高NDRG4基因启动子区甲基化检测的灵敏度和特异性;2)通过检测同样的胃癌DNA样本含量,该试剂盒比现有技术(申请号:201610048731.2)具有更高的灵敏度,特异性和准确性;3)该试剂盒除了辅助胃癌早期诊断,还可以预测胃癌患者术后的总体生存情况,临床医生可以根据患者携带的NDRG4启动子区甲基化水平,及时调整患者的治疗方案,对携带高甲基化的NDRG4基因患者,医生应给予更密切的术后观察,从而指导临床胃癌患者的个性化治疗;综上所述,本发明用于胃癌早期诊断及预后评估的NDRG4基因甲基化检测的试剂盒可解决样本中DNA含量少、丢失率高、带有致癌污染物等缺陷,相对传统胃癌检测技术具有发现早,灵敏度高,周期短、操作简单方便,检测效率高,针对性强,特异性好,检测结果准确可靠、灵活快速和经济节约的优点,有利于胃癌的早期发现和及时治疗。附图说明图1为NDRG4基因启动子区被检测序列所在区域(具体位置为Chr16:58,497,172-58,497,289);图2为NDRG4基因扩增片段双荧光素酶报告基因活性检测;图3为目的基因NDRG4基因和参照基因ACTB基因荧光定量甲基化特异性PCR的扩增曲线;图4为NDRG4基因启动子区甲基化水平在癌组织与癌旁组织的比较;图5为本发明NDRG4基因启动子区甲基化方法在诊断胃癌时的ROC曲线;图6为现有的NDRG4基因启动子区甲基化方法在诊断胃癌时的ROC曲线;图7为NDRG4基因启动子区甲基化水平在胃癌细胞(MKN-74,SGC-7901,AGS,BGC-823,HGC-27,MKN-45,MGC-803)和人胃黏膜细胞(GES-1)的比较;图8为胃癌患者NDRG4基因高甲基化与低甲基化的Kapla-Meier生存曲线(随着时间的增加,该曲线一般呈下降趋势,下降速度慢的在图形上表现为坡度小、曲线平缓,意味着较高的生存率);图9为Cox风险比例回归模型中以NDRG4基因甲基化水平的高低为协变量分组,同时调整了单因素分析中较为重要的协变量(P<0.05,包括患者年龄、肿瘤大小、分化、淋巴结是否转移、TNM分期和疾病复发)做的生存曲线图,从而说明NDRG4基因甲基化水平可作为胃癌患者总体预后的独立预测因子。具体实施方式以下结合附图实施例对本发明作进一步详细描述。1、研究对象和样本的收集收集浙江省杭州市某医院2007年12月至2010年2月普外科手术切除的胃癌组织以及相应配对的癌旁正常组织各110例,其中癌组织取自肿瘤组织的中心位置,癌旁组织距离癌组织5cm以上且为非癌组织,所有病例手术前均未行放疗和化疗并经病理组织学检查证实。患者年龄21~83岁,其中男性76例,女性34例;有吸烟史30例,无吸烟史80例;有饮酒史28例,无饮酒史82例;肿瘤大小:≥6cm43例,<6cm67例。根据美国癌症联合委员会(AJCC)胃癌TNM分期:I和II期17例,III和IV期93期;无淋巴结转移16例,有淋巴结转移94例;组织分化程度:高分化或中分化47例,低分化或无分化63例。所取标本离体后立即于液氮罐转运,然后存在于-80℃冰箱。纳入标准:①初治的胃癌患者;②胃部病变均经病理证实;③胃部病灶要求为原发病灶,而非转移病灶;④术前未行放化疗;⑤无其他恶性肿瘤病史。排除标准:①无法得到病理证实的胃部病变;②有严重的未控制的内科疾病或急性感染者;③妊娠或哺乳期妇女。预设最长随访时间5年,以胃癌患者死亡为终点事件,生存时间从术日算起。所有入组对象均告知并签署知情同意书。2、细胞培养含10%胎牛血清的DMEM培养基培养胃癌细胞株(MKN-74,SGC-7901,AGS,BGC-823,HGC-27,MKN-45,MGC-803)和人胃黏膜细胞(GES-1),于37℃,5%CO2饱和湿度恒温孵育箱内。3、组织样本和细胞株全基因组DNA的提取采用QIAampDNAMiniKit(Qiagen,Hilden,德国)DNA提取试剂盒提取组织全基因组DNA,再通过NanoDrop2000超微量分光光度计(ThermoFisherScientific,美国)检测所得DNA的浓度,以供NDRG4基因启动子区甲基化水平的检测。4、甲基化修饰采用EZDNAMethylationGoldTMKit甲基化转化试剂盒(Zymoresearch,美国),严格按照试剂盒说明步骤进行操作。经此步后,DNA序列中未甲基化的胞嘧啶(C)转变为尿嘧啶(U)。5、TCGA数据库450K甲基化和mRNA测序数据的相关性分析下载TCGA数据库中372个胃癌患者癌组织IlluminaHumanMethylation450K甲基化芯片数据和IlluminaHiSeq_RNA-SeqV2基因表达数据。提取NDRG4基因启动子区所有CpG位点的甲基化数据和基因表达数据做相关性分析,可见表1中与基因表达高度负相关的CpG位点位于上游5’端chr16:58,497,231-chr16:58,497,240,提示该区域为潜在的调控下游转录功能的特定序列。因此,发明人针对该区域设计甲基化特异性引物对和探针,用荧光定量甲基化特异性PCR进行甲基化水平检测。被检测序列所在全基因组位置如图1所示。表1Illumina450K甲基化芯片中NDRG4基因启动子区甲基化位点与基因表达的相关性序号甲基化位点基因组位置相关系数P值1cg04190807chr16:58,497,231-0.4072.79E-172cg00687686chr16:58,497,237-0.3992.65E-163cg04942472chr16:58,497,240-0.3781.72E-164cg01466678chr16:58,497,395-0.3416.56E-135cg11306587chr16:58,497,714-0.3842.10E-146cg13031432chr16:58,497,767-0.3952.81E-167cg00984694chr16:58,498,152-0.4058.31E-188cg04797985chr16:58,498,190-0.3651.24E-139cg05469759chr16:58,498,456-0.3352.51E-1210cg08384171chr16:58,498,535-0.3712.51E-1211cg00262031chr16:58,498,575-0.3591.35E-1512cg06650115chr16:58,498,586-0.3851.23E-15一般而言,基因启动子位于基因转录起始位点的上游2000个碱基的区域内。在已申请的专利中(申请号:201610048731.2),NDRG4基因的甲基化扩增序列位于基因转录起始位点的上游-154bp至-83bp,其甲基化水平在肠癌组织中较正常结肠组织明显升高。根据表1可以看出,胃癌中NDRG4基因启动子区不同位点的甲基化水平与基因表达的相关性均不同,且越靠近基因序列上游5’端的甲基化水平对基因表达的调控能力越强(即相关系数绝对值越大),由此可知,肠癌中NDRG4基因启动子区不同位点的甲基化水平与基因表达的相关性也不相同。因此,寻找具有调控基因表达作用的特定序列有助于提高NDRG4基因甲基化检测的灵敏度和特异性。另一方面,虽然胃癌和结直肠癌均属于消化道恶性肿瘤,但其在发病机制、疾病转归、治疗策略等方面均不相同,同样地,NDRG4基因甲基化在其中起到的生物学作用也有所不同。6、双荧光素酶报告基因活性检测双荧光素酶报告基因载体中含有能在同一细胞中同时表达的两种荧光素酶基因,一个是萤火虫荧光素酶报告基因,另一个是海肾荧光素酶报告基因。萤火虫荧光素酶报告基因为主要报告基因,启动子区目的片段被克隆至载体上。若目的片段具有转录因子结合位点,则使萤火虫荧光素酶转录,激活萤火虫荧光素酶蛋白翻译,萤火虫荧光值上升,而作为标准化内参照的海肾荧光素酶的表达不受影响,此时萤火虫荧光素酶活性/海肾荧光素酶活性值上升,从而确定目的片段是否具有基因表达调控作用。检测荧光素酶活性时,操作间温度设定为22℃,避光。双荧光素酶报告基因系统检测步骤如下:①裂解细胞:弃去旧的细胞培养液,每孔加100μl报告基因细胞裂解液,充分裂解细胞。②细胞完成裂解后,每孔细胞转移至EP离心管,离心混合均匀。③缓慢融解萤火虫荧光素酶检测试剂和海肾荧光素酶检测缓冲液至室温,海肾荧光素酶检测底物(100×)置于冰浴备用。④按照1:100比例,向海肾荧光素酶检测缓冲液加入海肾荧光素酶检测底物(100×),配制成海肾荧光素酶检测工作液。⑤开启GLO-MAX20/20荧光检测仪,设置检测参数,检测间隔时间为2s,检测时间为10s。⑥检测萤火虫荧光素酶活性值F(FirelyLueiferase)时,每个细胞样品加入100μl萤火虫荧光素酶检测试剂,混匀后将EP离心管立即放入GLO-MAX20/20荧光检测仪,计算F值。⑦加入100μl海肾荧光素酶检测工作液,混匀后立即放入GLO-MAX20/20荧光检测仪,计算海肾荧光素酶活性值R(RenillaLuciferase)。⑧完成所有样品测定后,相对荧光素酶活性为F与R的比值。通过设置阳性对照和空白对照,发现NDRG4基因扩增片段的相对荧光素酶活性比值比空白质粒高(P<0.01),说明该片段具有启动子活性,可调节基因表达(图2)。7、荧光定量甲基化特异性PCR20μl的荧光定量PCR反应体系的组成为:2×HotTaqMaterMix10.0μl;上、下游引物各1.0μl(5μM);探针1.0μl(2μM);H2O5.0μl,样本模板2.0μl。荧光定量甲基化特异性PCR反应条件如下:(1)95℃预变性10min;(2)95℃变性15s,60℃复性45s,共45个循环,期间连续采集荧光信号;(3)40℃维持10min。每例标本设三个复孔,QiagenEpiTectmethylatedDNA作为阳性对照和QiagenEpiTectunmethylatedDNA作为阴性对照,水为空白对照。NDRG4基因启动子区甲基化检测采用的引物及探针序列如下:上游引物:5'-TGGGATGGGGATGTTTTTGT-3';下游引物:5'-CCTCCAAACCCCCTATAACC-3';荧光定量探针:5'-6-FAM-AAAACGACGCTACCGTAATCTTTA-BHQ1-3';参照基因ACTB甲基化检测采用的引物及探针序列如下:上游引物:5'-TGGTGATGGAGGAGGTTTAGTAAGT-3';下游引物:5'-AACCAATAAAACCTACTCCTCCCTTAA-3';荧光定量探针:5'-6-FAM-ACCACCACCCAACACACAATAACAAACACA-BHQ1-3'。8、甲基化数据计算通过RocheLightCycler480荧光定量PCR仪检测的结果,RocheLightCycler480荧光定量PCR仪的计算过程是,首先通过ACTB参照基因来对目的基因进行相对定量,然后再用阳性对照DNA的相对定量对实验样品值进一步作归一化处理,通过以下换算得到甲基化百分比参数(PMR):PMR=(GENEsample/REFsample)/(GENEpositive/REFpositive)×100%其中,GENE为目的基因,REF为参照基因,sample为实验样本,positive为甲基化阳性对照DNA。图3中所示为对应ACTB基因和NDRG4基因启动子区荧光定量甲基化特异性PCR的扩增曲线。荧光定量甲基化特异性PCR是通过甲基化特异性PCR扩增反应中每一个循环产物荧光信号的实时检测从而实现对起始模板的定量分析。在实时荧光定量PCR反应中,引入一种荧光化学物质,随着PCR反应产物不断累计,荧光信号强度也等比例增加。每经过一个循环,收集一个荧光强度信号,从而可以通过荧光强度变化监测产物量的变化,得到一条荧光扩增曲线。图3的横坐标为每个反应管内的荧光信号达到设定的阈值时所经历的循环数(Ct值),纵坐标为荧光值。Ct值越小,表明目标序列的浓度越高,而代表甲基化水平的PMR值可直接在LightCycler480软件中得出。9、结果分析本次实验采用SPSS18.0对数据进行整理分析。发明人对NDRG4基因启动子区甲基化水平进行配对t检验,发现:癌组织中NDRG4基因甲基化水平高于癌旁组织,且差异有统计学意义(P值小于0.001,见图4)。为了定量地反映NDRG4基因甲基化诊断胃癌风险的准确性大小,发明人进一步分析了其受试者工作特征曲线(ROC曲线)。图5显示,NDRG4基因甲基化诊断胃癌风险的ROC曲线下面积(AUC)为0.730,与0.5相比差异有统计学意义(P<0.001),提示NDRG4基因该启动子区序列的甲基化用于胃癌早期诊断的准确性较高。一般可以将正确诊断指数最大的分界点确定为最佳诊断分界点,即图5中最靠近坐标图左上方的点为敏感性和特异性均较高的临界值,该点对应的纵坐标为敏感性,横坐标为(1-特异性)。因此,荧光定量甲基化特异性PCR检测NDRG4基因甲基化用于诊断胃癌的敏感性为65.5%,特异性为77.3%。图6为采用现有技术(申请号:201610048731.2)中的NDRG4基因甲基化方法诊断胃癌风险的ROC曲线,其曲线下面积为0.654,灵敏度为62.2%,特异性为67.3%,其准确性,灵敏度和特异性均低于本发明。根据多数文献报道,PMR值>4%,代表高甲基化;PMR值<4%,代表低甲基化,因此发明人以癌组织PMR值4%为临界值,将甲基化水平分为高甲基化和低甲基化,发现:NDRG4基因启动子区高甲基化的人群患胃癌的危险性为NDRG4基因启动子区低甲基化的4.609倍(P=6.32E-6,见表2)。表2NDRG4基因启动子区甲基化水平在癌组织与癌旁组织间的比较注:P值小于0.05,具有统计学意义。此外,该试剂盒在细胞水平也做了进一步的验证。发明人在细胞水平检测了NDRG4基因启动子区甲基化水平,发现:不同分化程度的胃癌细胞株(MKN-74,SGC-7901,AGS,BGC-823,HGC-27,MKN-45,MGC-803)的NDRG4基因启动子区甲基化水平均比人胃黏膜细胞(GES-1)的高(所有P值小于0.05,见图7)。该结果验证了在组织上发现的甲基化差异。通过分析NDRG4基因启动子区甲基化水平与胃癌预后的关系,发明人对110个癌组织样本进行Kapla-Meier生存分析,结果显示,NDRG4启动子区高甲基化的胃癌患者术后总体生存时间明显缩短(P=0.002,见表3,图8)。另外,将单因素分析中较为重要的变量(P<0.05)纳入多因素分析中,可见NDRG4基因启动子区甲基化水平可作为胃癌患者预后评估的独立因素,且差异具有统计学意义(风险比为1.887,95%CI=1.107-3.218,P=0.020,见表3,图9)。表3NDRG4基因启动子区甲基化水平与胃癌总体生存期的关系注:P值小于0.05,具有统计学意义。NA表示此数据无法计算。本发明的优势在于:1、本发明结合生物数据库寻找NDRG4基因具有调控下游转录功能的特定序列,并通过双荧光素酶报告基因活性检测验证了该序列的生物学功能,有助于提高NDRG4基因甲基化检测的灵敏度和特异性。2、将该试剂盒与现有技术(申请号:201610048731.2)相比,通过检测等量的胃癌DNA样本含量,该试剂盒具有更高的敏感性,临床上有助于减少患者漏诊的概率,适合早期筛查。3、该试剂盒除了辅助胃癌早期诊断,还可以预测胃癌患者术后的总体生存情况,达到临床胃癌患者的个性化治疗。此外,该试剂盒利用荧光定量特异性PCR法检测胃癌患者组织样本中NDRG4基因甲基化程度,具有以下显著特点:1、操作简便,周期短。该试剂盒可同时测定190个样本,大大缩短检测时间,适合医院或研究所大规模推广应用。2、稳定性。该试剂盒在-20℃温度下可保存12个月,其灵敏度和特异度都没有下降。本发明计划采用分析胃癌患者术后癌组织与癌旁组织DNA中的NDRG4基因甲基化程度,结合现代的生物信息技术和统计学原理,提供操作简便、灵敏度高、周期短、检测结果稳定可靠的甲基化定量检测方法,同时为患者的治疗随访和预后评估提供科学依据。在本发明中,所述DNA样本可以来源于任何生物样品;更优选地,所述待测DNA选自组织(包括石蜡包埋组织)、细胞、血液、血清、血浆、唾液、精液、尿液,粪便及其他分泌物。上述说明并非对本发明的限制,本发明也并不限于上述举例。本
技术领域:
的普通技术人员在本发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围,本发明的保护范围以权利要求书为准。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1