抗IGF1R和CD3特异性双靶向抗体、含该双靶向抗体表达盒的微环DNA及应用的制作方法
本发明涉及生物医药和诊疗领域,具体涉及一种抗igf1r和cd3特异性双靶向抗体、含该双靶向抗体表达盒的微环dna及应用。
背景技术:
胰岛素样生长因子(igfs)系统是一个有吸引力的肿瘤治疗靶点,于1957年由saman和daughaday发现,因其与胰岛素有高度同源性且作用类似于胰岛素而得名。igfs由两个配体(igf1和igf2)、两个受体(igf1r、igf2r)和六种高亲和力结合蛋白(igfbps)组成。igf1r是一种跨膜的酪氨酸蛋白激酶受体,以细胞外段的α亚基、跨膜区β亚基组成的四聚体形式存在,以二硫键结合igf配体激发自身β亚基的酪氨酸磷酸化,从而激活两个主要的信号转导通路:磷酸肌醇3激酶(pi3k)-蛋白激酶b(pkb/akt)信号通路和促有丝分裂原活化蛋白激酶(mapk)通路。mapk信号通路的激活的结果是促进细胞增殖,而激活pi3k途径导致细胞凋亡抑制和刺激蛋白合成。多项研究证实,igf1r在人类包括肺癌、肝癌、乳腺癌等多种恶性肿瘤中存在过表达,是一个极有前景的肿瘤治疗靶点。
近年来,在肿瘤免疫治疗领域,出现了利用双靶向抗体(bispecificantibody,bsab)介导t细胞重要的角色,具有t细胞受体(tcellreceptor,tcr),能特异性识别并结合表达目标抗原的细胞,并分泌穿孔素和颗粒酶杀灭靶细胞。肿瘤细胞由于缺少免疫粘附分子和共刺激分子等原因,使得机体免疫无法有效识别和活化,从而使得ctl无法清除癌细胞。bsab能够同时与t细胞和肿瘤细胞特异性抗原结合,可在t细胞与肿瘤细胞之间形成免疫突触(immunesynapse),发挥t细胞受体(tcr)一样的功能,从而激活t细胞免疫机制,介导t细胞杀死靶细胞。
目前报道了几种igf1r抗体,能特异性识别并结合igf1r抗原及igf1r阳性肿瘤细胞,这几种抗体包括:
(1)cixutumumab抗体,由imclone公司研发,目前正在针对复发性胸腺瘤的临床ii期实验,该抗体是全人源抗体,免疫原性低,但只能结合igf1r抗原和igf1r表达阳性的细胞,不能结合t细胞,无法介导t细胞杀伤;只能通过adcc或cdc靶向杀灭igf1r抗原阳性肿瘤细胞。目前临床实验显示:对复发性胸腺瘤临床疗效尚较好。
(2)ganitumab抗体,由amgen和millennium公司联合研发,曾经进展到针对晚期乳腺癌的临床ii期实验,以及针对晚期胰腺癌的临床iii期实验。该抗体是全人源抗体,免疫原性低,但只能结合igf1r抗原和igf1r表达阳性的细胞,不能结合t细胞,无法介导t细胞杀伤;只能通过adcc或cdc靶向杀灭igf1r抗原阳性肿瘤细胞。目前临床实验尚不乐观:ganitumab不能改善绝经后激素受体阳性晚期乳腺癌患者的生存期,晚期胰腺癌的临床iii期实验也无显著效果并被宣布中止。
(3)figitumumab抗体,由pfizer和schering-plough公司联合研发,曾经进展到针对非小细胞肺癌的临床iii期实验。该抗体是全人源抗体,免疫原性低,但只能结合igf1r抗原和igf1r表达阳性的细胞,不能结合t细胞,无法介导t细胞杀伤;只能通过adcc或cdc靶向杀灭igf1r抗原阳性肿瘤细胞。目前临床实验尚不乐观:pfizer公司已经中止figitumumab非小细胞肺癌ⅲ期试验。
(4)rg1507抗体,由genmab和roche公司联合研发,曾经进展到针对晚期乳腺癌的临床ii期实验,以及针对晚期胰腺癌的临床iii期实验。该抗体是全人源抗体,免疫原性低,但只能结合igf1r抗原和igf1r表达阳性的细胞,不能结合t细胞,无法介导t细胞杀伤;只能通过adcc或cdc靶向杀灭igf1r抗原阳性肿瘤细胞。目前临床实验:因为研究相同信号通路药物冲突,非安全问题,临床ii期实验被宣布中止。
(5)dalotuzumab抗体,由merck&co.公司研发,该抗体是人源化抗体,免疫原性较低,但只能结合igf1r抗原和igf1r表达阳性的细胞,不能结合t细胞,无法介导t细胞杀伤;只能通过adcc或cdc靶向杀灭igf1r抗原阳性肿瘤细胞。目前进展到临床ii实验:针对多种晚期肿瘤(非小小细胞肺癌,结肠癌,卵巢癌等),效果尚未知。
(6)robatumumab抗体,由merck&co.和schering-plough公司联合研发,该抗体是人源化抗体,免疫原性较低,但只能结合igf1r抗原和igf1r表达阳性的细胞,不能结合t细胞,无法介导t细胞杀伤;只能通过adcc或cdc靶向杀灭igf1r抗原阳性肿瘤细胞。目前进展到针对结直肠癌的临床ii实验,效果尚未知。
目前报道的几种igf1r抗体只能结合igf1r抗原和igf1r表达阳性的细胞,不能结合t细胞,无法介导t细胞杀伤;只能通过adcc、cdc或放射性同位素标记靶向杀灭igf1r抗原阳性肿瘤细胞。
本发明旨在提供一个高效、低成本、抗igf1r和cd3特异性双靶向抗体及其制备方法和应用。
技术实现要素:
第一方面,本发明提供了一种特异性双靶向抗体,所述特异性双靶向抗体具有特异性与人类cd3结合的第一抗原结合结构域和特异性与igf1r抗原结合的第二抗原结合结构域。
本发明提供了的特异性双靶向抗体(bispecificantibody,bsab),能够同时与cd3和igf1r抗原结合;特异地识别并结合igf1r抗原阳性细胞,同时也结合表达cd3的t细胞,可在t细胞与肿瘤细胞之间形成免疫突触(immunesynapse),发挥t细胞受体(tcellreceptor,tcr)一样的功能,从而激活t细胞免疫机制,介导t细胞发挥杀伤igf1r阳性肿瘤细胞的作用,从而清除igf1r阳性肿瘤细胞。
本发明所述的“双靶向”表示“能够同时与cd3和igf1r抗原结合”。
在本发明一个实施例中,本发明提供了的特异性双靶向抗体,可与cd3和igf1r结合;该特异性双靶向抗体在文中亦称为“抗-cd3/抗-igf1r特异性双靶向抗体”。“抗-cd3/抗-igf1r特异性双靶向抗体”的抗-igf1r部分可用于靶向表达igf1r的细胞,如hepg2肝癌细胞系,而特异性双靶向抗体分子的抗-cd3部分可用于活化t细胞。通过与igf1r阳性细胞上的igf1r和t细胞上的cd3的同时结合,促进活化的t细胞定向杀死(细胞裂解)被靶向的igf1r阳性细胞。
本发明的抗-cd3/抗-igf1r特异性双靶向抗体,特别地,用于诊断、治疗igf1r阳性肿瘤细胞,以及治疗、预防和/或控制与igf1r的异常表达和/或由igf1r的异常表达引发的生理紊乱的方法和组合物。这样的紊乱包括但不限于:癌症、非癌过度增生性细胞紊乱。
本发明的示例性特异性双靶向抗体列于文中的表1和表2。本发明提供的特异性双靶向抗体中,第一抗原结合结构域和第二抗原结合结构域均包括的重链可变区(hcvr)和轻链可变区(lcvr))。表1列出了本发明提供的特异性双靶向抗体的hcvr、lcvr的氨基酸序列,及其在序列表中的序列号。表2列出了编码本发明所述的hcvr、lcvr氨基酸序列对应的核苷酸序列,及其在序列表中的序列号。
本发明提供的特异性双靶向抗体的氨基酸序列包括:至少一条第一抗原结合结构域的hcvr氨基酸序列、至少一条第一抗原结合结构域的lcvr氨基酸序列、至少一条第二抗原结合结构域的hcvr氨基酸序列、以及至少一条第二抗原结合结构域的lcvr氨基酸序列;具体hcvr和lcvr优选为任一选自表1的氨基酸序列。
编码本发明提供的特异性双靶向抗体的核苷酸序列包括:至少一条第一抗原结合结构域的hcvr核苷酸序列、至少一条第一抗原结合结构域的lcvr核苷酸序列、至少一条第二抗原结合结构域的hcvr核苷酸序列、以及至少一条第二抗原结合结构域的lcvr核苷酸序列;具体hcvr和lcvr优选为任一选自表2的核苷酸序列。
表1序列表中的氨基酸序列
在本发明一实施例中,3条不同序列的抗-cd3×抗-igf1r特异性双靶向抗体,在表1中编号分别为bsab-1、bsab-2、bsab-3,其中bsab-1是经过筛选出的最佳效果的特异性双靶向抗体。
在本发明一些实施例中,表1各序列具体为:
sequenceno.1中,
cd3.hcvr
qvqlvqsgaevkkpgasvkvsckasgytftdyymhwvrqapgqglewmgrvnpnrrgttynqkfegrvtmttdtststaymelrslrsddtavyycaranwldywgqgttvtvss;
sequenceno.2中,
cd3.lcvr
diqmtqspsslsasvgdrvtitcsvsssvssiylhwyqqkpgkapklliystsnlasgvpsrfsgsgsgtdftltisslqpedfatyycqvysgypltfgggtkveik;
sequenceno.3中,
igf1r-hcvr
qvqlqesgpglvkpsgtlsltcavsggsisssnwwswvrqppgkglewigeiyhsgstnynpslksrvtisvdksknqfslklssvtaadtavyycarwtgrtdafdiwgqgtmvtvss;
sequenceno.4中,
igf1r-lcvr
dvvmtqsplslpvtpgepasiscrssqsllhsngynyldwylqkpgqspqlliylgsnrasgvpdrfsgsgsgtdftlkisrveaedvgvyycmqgthwpltfgqgtkveik;
sequenceno.5中,
igf1r-hcvr
qvqlqesgpglvkpsgtisltcavsggslsgsnwwswvrqppgkglewigeiyhsgstnynpsiksrvtisvdkgknqfslklsgvtaadtavyycarwtgktdafdiwgqgtmvtvss
sequenceno.6中,
igf1r-lcvr
dvvmtqsplslpvtpgepagiscrgsqsilhsngynyldwylqkpsqgpqiliylgsnrasgvpdrfsgsgsgtdftlkisrveaedvgvyycmqgthwpltfsqgtkveik
sequenceno.7中,
igf1r-hcvr
qvqlqesgpglvkpsstisltcavsgsslsgsnwwswvrqppskglewigeiyhsgstnynpsiksrvtigvdksknqfslklsgvtaadtavyycarwtsktdafdlwgqgtmvtvss
sequenceno.8中,
igf1r-lcvr
dvvmtqsplslpvtpgepaglscrssqsllhsngynyldwyiqkpgqspqlliylgsnrasgvpdrfsgsgsstdftlklsrveaedvgvyycmqgthwpitfgqgtkveik
sequenceno.9中,
igf1r-hcvr
qvqlqesgpglvkpssgtisltcavsgsslsgsnwwswvrqppskgilewlgeiyhsgstnynpsiksrvtigvdksknqfslklsgvtaadtavyycakwtsktdafdlwgqgtmvtvss
sequenceno.10中,
igf1r-lcvr
dvvmtqsplslpvtpgepaglgcrssqsllhsngynyldwyiqkpgqspqliliylgsnrasgvpdrfsgsgsstdftlklsrveaedvgvyycmqgthwpitfgqgtkveik
表2序列表中的核苷酸序列
在本发明一些实施例中,表2各序列具体为:
sequenceno.11,
cd3.hcvr
caggttcagctggtgcagtctggtgctgaggtgaagaagcctggtgcctcagtgaaggtctcctgcaaggcttctggttacacattcactgactactacatgcactgggtgagacaggcccctggtcaaggtcttgagtggatgggtagagttaatcctaaccggaggggtactacctacaaccagaaattcgagggccgtgtcaccatgaccacagacacatccaccagcacagcctacatggagctgcgtagcctgcgttctgacgacaccgccgtgtattactgcgcccgtgctaactggcttgactactggggccagggcaccaccgtcaccgtctcctcc;
sequenceno.12,
cd3.lcvr
cagatgacccagtctccatcctccctgtctgcatctgttggagacagagtcaccatcacttgcagtgtcagctcaagtgtttcctccatttacttgcactggtatcagcagaaaccagggaaagcccctaagctcctgatctatagcacatccaacttggcttctggagtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgccaagtctacagtggttaccctctcaccttcggcggagggaccaaggtggagatcaaa;
sequenceno.13中,
igf1r-hcvr
caggtgcagctgcaggagagcggccccggcctggtgaagcccagcggcaccctgagcctgacctgcgccgtgagcggcggcagcatcagcagcagcaactggtggagctgggtgcgccagccccccggcaagggcctggagtggatcggcgagatctaccacagcggcagcaccaactacaaccccagcctgaagagccgcgtgaccatcagcgtggacaagagcaagaaccagttcagcctgaagctgagcagcgtgaccgccgccgacaccgccgtgtactactgcgcccgctggaccggccgcaccgacgccttcgacatctggggccagggcaccatggtgaccgtg;
sequenceno.14中,
igf1r-lcvr
gacgtggtgatgacccagagccccctgagcctgcccgtgacccccggcgagcccgccagcatcagctgccgcagcagccagagcctgctgcacagcaacggctacaactacctggactggtacctgcagaagcccggccagagcccccagctgctgatctacctgggcagcaaccgcgccagcggcgtgcccgaccgcttcagcggcagcggcagcggcaccgacttcaccctgaagatcagccgcgtggaggccgaggacgtgggcgtgtactactgcatgcagggcacccactggcccctgaccttcggccagggcaccaaggtggagatcaag;
sequenceno.15中,
igf1r-hcvr
caggtgcagctgcaggagagcggccccggcctggtgaagcccagcggcaccatcagcctgacctgcgccgtgagcggcggcagcctgagcggcagcaactggtggagctgggtgcgccagccccccggcaagggcctggagtggatcggcgagatctaccacagcggcagcaccaactacaaccccagcatcaagagccgcgtgaccatcagcgtggacaagggcaagaaccagttcagcctgaagctgagcggcgtgaccgccgccgacaccgccgtgtactactgcgcccgctggaccggcaagaccgacgccttcgacatctggggccagggcaccatggtgaccgtgagcagc
sequenceno.16中,
igf1r-lcvr
gacgtggtgatgacccagagccccctgagcctgcccgtgacccccggcgagcccgccggcatcagctgccgcggcagccagagcatcctgcacagcaacggctacaactacctggactggtacctgcagaagcccagccagggcccccagatcctgatctacctgggcagcaaccgcgccagcggcgtgcccgaccgcttcagcggcagcggcagcggcaccgacttcaccctgaagatcagccgcgtggaggccgaggacgtgggcgtgtactactgcatgcagggcacccactggcccctgaccttcagccagggcaccaaggtggagatcaag
sequenceno.17中,
igf1r-hcvr
caggtgcagctgcaggagagcggccccggcctggtgaagcccagcagcaccatcagcctgacctgcgccgtgagcggcagcagcctgagcggcagcaactggtggagctgggtgcgccagccccccagcaagggcctggagtggatcggcgagatctaccacagcggcagcaccaactacaaccccagcatcaagagccgcgtgaccatcggcgtggacaagagcaagaaccagttcagcctgaagctgagcggcgtgaccgccgccgacaccgccgtgtactactgcgcccgctggaccagcaagaccgacgccttcgacctgtggggccagggcaccatggtgaccgtgagcagc
sequenceno.18中,
igf1r-lcvr
gacgtggtgatgacccagagccccctgagcctgcccgtgacccccggcgagcccgccggcctgagctgccgcagcagccagagcctgctgcacagcaacggctacaactacctggactggtacatccagaagcccggccagagcccccagctgctgatctacctgggcagcaaccgcgccagcggcgtgcccgaccgcttcagcggcagcggcagcagcaccgacttcaccctgaagctgagccgcgtggaggccgaggacgtgggcgtgtactactgcatgcagggcacccactggcccatcaccttcggccagggcaccaaggtggagatcaag
sequenceno.19中,
igf1r-hcvr
caggtgcagctgcaggagagcggccccggcctggtgaagcccagcagcggcaccatcagcctgacctgcgccgtgagcggcagcagcctgagcggcagcaactggtggagctgggtgcgccagccccccagcaagggcatcctggagtggctgggcgagatctaccacagcggcagcaccaactacaaccccagcatcaagagccgcgtgaccatcggcgtggacaagagcaagaaccagttcagcctgaagctgagcggcgtgaccgccgccgacaccgccgtgtactactgcgccaagtggaccagcaagaccgacgccttcgacctgtggggccagggcaccatggtgaccgtgagcagc
sequenceno.20中,
igf1r-lcvr
gacgtggtgatgacccagagccccctgagcctgcccgtgacccccggcgagcccgccggcctgggctgccgcagcagccagagcctgctgcacagcaacggctacaactacctggactggtacatccagaagcccggccagagcccccagctgatcctgatctacctgggcagcaaccgcgccagcggcgtgcccgaccgcttcagcggcagcggcagcagcaccgacttcaccctgaagctgagccgcgtggaggccgaggacgtgggcgtgtactactgcatgcagggcacccactggcccatcaccttcggccagggcaccaaggtggagatcaag
具体地,sequenceno.9-16分别对应编码sequenceno.1-8的氨基酸序列。
鉴于序列同源性,本领域技术人员可以理解的是,如下实施方案应纳入本发明保护范围:
在本发明一些实施例中,所述的第一抗原结合结构域的hcvr为与表1中所示的第一抗原结合结构域中任一hcvr氨基酸序列具有至少90%、至少95%、至少98%或至少99%同源性的氨基酸序列。
在本发明一些实施例中,所述的第一抗原结合结构域的lcvr为与表1中所示的第一抗原结合结构域中任一lcvr氨基酸序列具有至少90%、至少95%、至少98%或至少99%同源性的氨基酸序列。
在本发明一些实施例中,所述的第二抗原结合结构域的hcvr为与表1中所示的第一抗原结合结构域中任一hcvr氨基酸序列具有至少90%、至少95%、至少98%或至少99%同源性的氨基酸序列。
在本发明一些实施例中,所述的第二抗原结合结构域的lcvr为与表1中所示的第一抗原结合结构域中任一lcvr氨基酸序列具有至少90%、至少95%、至少98%或至少99%同源性的氨基酸序列。
在本发明一些实施例中,所述的编码第一抗原结合结构域hcvr的序列为与表2中所示的第一抗原结合结构域中任一hcvr核苷酸序列具有至少90%、至少95%、至少98%或至少99%同源性的核苷酸序列。
在本发明一些实施例中,所述的编码第一抗原结合结构域lcvr的序列为与表2中所示的第一抗原结合结构域中任一lcvr核苷酸序列具有至少90%、至少95%、至少98%或至少99%同源性的核苷酸序列。
在本发明一些实施例中,所述的编码第二抗原结合结构域hcvr的序列为与表2中所示的第一抗原结合结构域中任一hcvr核苷酸序列具有至少90%、至少95%、至少98%或至少99%同源性的核苷酸序列。
在本发明一些实施例中,所述的编码第二抗原结合结构域lcvr的序列为与表2中所示的第一抗原结合结构域中任一lcvr核苷酸序列具有至少90%、至少95%、至少98%或至少99%同源性的核苷酸序列。
可以理解的,由于“核苷酸序列”具有碱基简并、突变等情况,行业内普通技术人员可调整某些碱基的种类,所述的碱基变化虽然导致了密码子的变化,但不会引起密码子翻译的氨基酸的变化,很常见的,亮氨酸的密码子就具有多种密码子,比如:uua、uug、cuu。
此外,本发明所述的igf1r抗体氨基酸序列来自于人源抗体氨基酸序列,在将来人体应用中能降低宿主抗移植物反应(hostversusgraftreaction,hvgr)。核苷酸序列经过密码子优化,利于在哺乳动物细胞内表达。
在本发明一些实施例中,所述特异性双靶向抗体的氨基酸序列为:任选自表1中的序列,按如下连接形式为(a)~(h)中的一种组合所得(“vlcd3”表示特异性双靶向抗体的第一抗原结合结构域的lcvr;“vhcd3”表示特异性双靶向抗体的第一抗原结合结构域的hcvr;“vligf1r”表示特异性双靶向抗体的第二抗原结合结构域的lcvr;“vhigf1r”表示特异性双靶向抗体的第二抗原结合结构域的hcvr):
(a)vligf1r-linker1-vhigf1r-linker2-vlcd3-linker3-vhcd3,
(b)vhigf1r-linker1-vligf1r-linker2-vlcd3-linker3-vhcd3,
(c)vligf1r-linker1-vhigf1r-linker2-vhcd3-linker3-vlcd3,
(d)vhigf1r-linker1-vligf1r-linker2-vhcd3-linker3-vlcd3,
(e)vlcd3-linker1-vhcd3-linker2-vligf1r-linker3-vhigf1r,
(f)vlcd3-linker1-vhcd3-linker2-vhigf1r-linker3-vligf1r,
(g)vhcd3-linker1-vlcd3-linker2-vligf1r-linker3-vhigf1r,
(h)vhcd3-linker1-vlcd3-linker2-vhigf1r-linker3-vligf1r,
其中,横杠“-”代表各氨基酸序列顺序排列。
在本发明一个实施例中,第一抗原结合结构域或第二抗原结合结构域的hcvr(vh)和lcvr(vl)之间的linker(linker1,linker3)的氨基酸序列为(ggggs)n(n=1-4)、(ggs)4或(gly)n(n=6-8),但不限于此。
在本发明一个实施例中,各抗原结合结构域之间的linker(linker2)的氨基酸序列为(ggggs)n(n=1-4),但不限于此。
在本发明一优选实施例中,双特异性单链抗体氨基酸序列为具有与(a)~(h)任一所示序列的同源性不小于90%、95%、98%或99%的氨基酸序列。
在本发明一些实施例中,各抗原结合结构域的hcvr(vh)和lcvr(vl)之间、各抗原结合结构域之间通过linker相连,linker为连接肽,该连接肽主要采用了以甘氨酸和丝氨酸为主构成的多肽序列,其中,甘氨酸是分子量最小、侧链最短的氨基酸,可增加侧链的柔韧性;丝氨酸是亲水性最强的氨基酸,可增加肽链的亲水性。
在本发明一些实施例中,所述特异性双靶向抗体的n段具有免疫球蛋白κ链信号肽的氨基酸序列。
本发明提供的所述特异性双靶向抗体的n端加上了免疫球蛋白轻链κ链的分泌信号肽,从而保证抗体的表达并分泌到宿主细胞外。
第二方面,本发明还提供了一种制备如第一方面所述的特异性双靶向抗体的方法,该方法包括:将第一方面所述的特异性双靶向抗体序列用于构建表达所述的特异性双靶向抗体的重组表达载体;导入宿主细胞;在表达条件下,培养宿主细胞,表达,分离纯化,获得所述特异性双靶向抗体。
第三方面,本发明还提供了如第一方面所述的特异性双靶向抗体按下述一种或多种方法进行应用:
(1)将所述特异性双靶向抗体单独进行应用;
(2)将所述特异性双靶向抗体与化疗、放疗、手术、生物治疗、免疫治疗中的一种或几种联合应用;
(3)采用体内投递的方式将所述特异性双靶向抗体直接投递到患者体内进行治疗;
(4)先通过体外转染技术将所述特异性双靶向抗体与免疫效应细胞混合,然后将所述混有特异性双靶向抗体的免疫效应细胞输回患者体内实施治疗。
在本发明一些实施例中,如第三方面所述的应用(3)和(4)中,向患者施用如上所述的抗体,可向患者施用多于一次。
在本发明一些实施例中,如第三方面所述的应用(3)中,所述的投递的方式为靶向投递,包括但不限于采用可靶向投递的liposome脂质体(或其多聚体)等行业常用载体进行投递。
通过向包括人的哺乳动物施用本发明第一方面提供的抗体或第四方面提供的药物组合物,可预防或治疗肝癌或其他igf1r的相关疾病,比如igf1r表达异常或紊乱相关的疾病。
第四方面,本发明提供了一种药物组合物,包括至少一种如第一方面所述的特异性双靶向抗体,及可药用的载剂、赋形剂或稀释剂。
本发明提供的药物组合物可根据常规方法制成药物制剂。制剂过程中,优选将抗体与载体混合或用载体稀释,或装入容器形式的载体中。当载体作为稀释剂时,其可以为固体、半固体或液体,用作用于抗体的囊泡、赋形剂或培养基。因此,制剂可以是片剂、丸剂、粉剂、袋装剂、胶囊、酏剂、混悬剂、乳剂、溶液剂、糖浆剂、气溶胶、软和硬明胶胶囊、注射用无菌溶液、无菌粉剂等形式。合适的载体、赋形剂或稀释剂的实例包括乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石粉、硬脂酸镁和矿物油。制剂还可以包括填充剂、抗凝血剂、润滑剂、润湿剂、调味剂、乳化剂、防腐剂等。
在本发明一些实施例中,所述的药物组合物还包括第二治疗剂,第二治疗剂为任何有利地与所述的特异性双靶向抗体组合的活性剂。包括但不限于结合和/或活化cd3讯号传递的其他活性剂(包括其他抗体或其抗原结合片段等),和/或不直接与cd3结合,但却活化或刺激免疫细胞活化的活性剂。
在本发明一些实施例中,所述的第二治疗剂包括与抗体协同作用的干扰剂、抗igf1r单克隆抗体、抗igf1r多克隆抗体、核苷类似物、dna聚合酶抑制剂、sirna制剂、用作抗病毒剂的治疗用疫苗、细胞因子、毒素、化学治疗剂、放射治疗剂、激素、抗体fc片段、tlr激动剂、含cpg的分子或免疫共刺激分子。
第五方面,本发明提供了一种诊断试剂,包括至少一种如第一方面所述的特异性双靶向抗体,及诊断剂,所述的诊断剂包括但不限于荧光团、发色团、染料、放射性同位素、化学发光分子、顺磁性离子或自旋捕获试剂。
第六方面,本发明提供了一种抗体药物,为任一如第一方面所述的特异性双靶向抗体,与人类cd3结合并于体外诱导人类t细胞增殖。
第七方面,本发明提供了一种抗体药物,为任一如第一方面所述的特异性双靶向抗体,与人类cd3结合并于体外诱导t细胞介导的对igf1r阳性细胞进行杀伤。
第八方面,本发明提供了一种核酸分子,编码如第一方面所述的特异性双靶向抗体的氨基酸序列;在某些实施方式中,所述的核酸分子编码的氨基酸序列,为与如第一方面所述特异性双靶向抗体的氨基酸序列具有至少90%、至少95%、至少98%或至少99%同源性的氨基酸序列。
第九方面,本发明提供了一种表达如第一方面所述的特异性双靶向抗体的重组载体;在某些实施方式中,所述的重组载体具有本发明第八方面提供的任一核酸分子序列。
在本发明一些实施例中,所述的载体为微环dna重组母质粒或微环dna。
在本发明一些实施例中,所述微环dna重组母质粒是在微环dna空质粒的多克隆位点中插入本发明第八方面提供的任一核酸分子序列组合而成。具体插入方法可采用常规的基因克隆,也可采用无缝克隆(seamlesscloning)。
在本发明一些实施例中,所述微环dna空质粒优选为p2фc31质粒或pmc.bespx质粒。具体地,所述空质粒p2фc31构建方法参照chenzy等,moleculartherapy,8(3),495-500(2003)、chenzy等,humangenetherapy,16(1),126-131(2005)和美国专利us7897380b2。具体地,所述空质粒pmc.bespx构建方法及全基因序列参照chenzy等,naturebiotechnology,28,(12),1289-1291(2010)。
本发明典型实施例中采用的p2фc31质粒、pmc.bespx质粒分别获得的p2фc31重组母质粒、pmc.bespx重组母质粒,区别在于:p2фc31载体上具有编码фc31重组酶和i-sce1内切酶的核苷酸序列,而pmc.bespx载体上没有编码фc31重组酶和i-sce1内切酶的核苷酸序列,所以采用pmc.bespx载体制备的微环dna母质粒更加优质,大大减少了重组酶和内切酶的核苷酸序列的污染;但是pmc.bespx需配套使用了大肠杆菌e.colizycy10p3s2t工程菌,zycy10p3s2t工程菌具有编码фc31重组酶和i-sce1内切酶功能,无фc31重组酶(即phic31组酶)和i-sce1内切酶核苷酸编码序列的pmc.bespx重组母质粒需要配套使用zycy10p3s2t工程菌才能产生体内位点特异性重组(而大肠杆菌e.colitop10无此功能)并最终生产出微环dna;相应的,p2фc31重组母质粒可配套使用top10即可产生体内位点特异性重组,并最终生产出微环dna。
在本发明一些实施例中,所述的微环dna为本发明提供的微环dna重组母质粒通过特异性重组位点的位点特异性重组产生。本发明提供的微环dna重组母质粒具有特异性重组位点,所述的“微环dna重组母质粒”通过特异性重组位点的位点特异性重组产生微环dna和骨架dna序列。p2фc31重组母质粒生产微环dna的方法参照chenzy等,moleculartherapy,8(3),495-500(2003)、chenzy等,humangenetherapy,16(1),126-131(2005)和美国专利us7897380b2。pmc.bespx重组母质粒生产微环dna的方法参照chenzy等,naturebiotechnology,28,(12),1289-1291(2010)。
如本文所用,“骨架dna序列”具有标准质粒中负责细菌质粒的复制、或筛选含质粒的宿主等功能的dna序列,比如细菌复制序列、抗性基因、未甲基化的cpg基序等。
在本发明一些实施例中,所述的重组载体还包含表达目的多肽(本发明中为特异性双靶向抗体)所需的所有必要元件的基因表达系统,通常其包括以下元件:启动子、编码多肽的基因序列,终止子;此外还可选择性包括信号肽编码序列等;这些元件是操作性相连的。
如本文所用,所述的“可操作地连接”是指两个或多个核酸区域或核酸序列的功能性的空间排列。例如:启动子区被置于相对于目的基因核酸序列的特定位置,使得核酸序列的转录受到该启动子区域的引导,从而,启动子区域被“可操作地连接”到该核酸序列上。优选地,所述信号肽为免疫球蛋白κ链信号肽。优选地,所述标签为his标签、gst标签、c-myc标签和flag标签中的至少一种。以上的信号肽和标签种类为本发明人的优选方式,本领域技术人员可以根据具体需要选择合适的信号肽和标签。
第十方面,本发明提供了一种具有如第九方面所述载体的宿主细胞(优选为真核细胞或包括人在内的哺乳动物细胞);还提供了将如第九方面所述载体导入宿主细胞中的方法;还提供了通过在允许产生抗体的条件下培养具有所述载体的宿主细胞,并分离力所产生的抗体的方法。
第十一方面,本发明提供了一种检测试剂盒,包括固体检测支持物,所述的固体检测支持物包含至少一种如第一方面所述的特异性双靶向抗体。在一些实施方式中,所述固体支持物是可连接大分子如抗体、蛋白质、多肽、肽、多核苷酸的固体表面,如磁性珠、胶乳珠、微量滴定板孔、玻璃平板、尼龙、琼脂糖、聚丙烯酰胺、二氧化硅颗粒、硝酸纤维素膜等。
第十二方面,本发明提供了一种在待测样品中检测异常细胞的方法,其包括使所述样品与至少一种如第一方面所述的特异性双靶向抗体相接触。在一些实施方式中,所述的样品来自肝脏或经切除的肿瘤床。
如本发明所述,“异常细胞”是具有对于该细胞类型为非典型特征(包括非典型生长、非典型位置处的典型生长或针对非典型靶标的典型作用)的任何细胞。这样的细胞包括癌细胞、良性增生细胞或发育异常细胞、炎性细胞或自身免疫细胞。
在本发明一些实施例中,采用如第十二方面所述的方法对移植前捐赠的组织或器官进行筛选,以提供基本不含igf1r的组织或器官。
在本发明一些实施例中,采用如第十二方面所述的方法对血液供给品进行筛选,以提供基本不含igf1r的血液供给品。
第十三方面,如第一方面所述的特异性双靶向抗体或如第九方面所述的重组载体在制备诊断、预防、治疗igf1r相关疾病的试剂或药物中的应用。
如本发明所述的,所述的“igf1r疾病”包括但不限于igf1r表达异常或紊乱相关疾病,比如,igf1r抗原阳性的肝癌。
第十四方面,本发明还提供了采用如第一方面所述的特异性双靶向抗体治疗癌症或肿瘤的方法,包括下述方法的任意一种:
(1)将所述基因工程抗体单独用于治疗癌症或肿瘤;
(2)将所述基因工程抗体与化疗、放疗、手术、生物治疗、免疫治疗中的一种或几种联合用于治疗癌症或肿瘤;
(3)采用体内靶向投递的方式将所述基因工程抗体直接投递到患者体内进行癌症或肿瘤治疗;
(4)先通过体外转染技术将所述基因工程抗体与免疫效应细胞混合,然后将所述混有基因工程抗体的免疫效应细胞输回患者体内实施癌症或肿瘤治疗。
在本发明一些实施例中,所述方法(4)中,所述免疫效应细胞为cik细胞或d-cik细胞。
在本发明一些实施例中,所述方法(4)中,所述的第一方面的特异性双靶向抗体与免疫效应细胞混合的比例为:0.001~1ug/ul的特异性双靶向抗体与1×104~1.6×105免疫效应细胞混合。
本发明提供的技术方案,通过设计一组特异性双靶向抗体,并将抗体表达框(dna序列)插入微环dna载体(优选为kayma*,hecyandchenzy*(*通讯作者).arobustsystemforproductionofminicirclednavecrtors.natbiotechnology,28:1287,2010)中。由微环dna表达的抗体具有以下特性:1)特异性结合igf1r阳性抗原;2)特异性结合t细胞;3)介导t细胞对igf1r抗原阳性细胞发挥杀伤作用。此外,在一些实施例中,由于抗体表达框带有分泌信号肽的编码序列,抗体表达后能分泌至胞外、保持生物活性。
附图说明
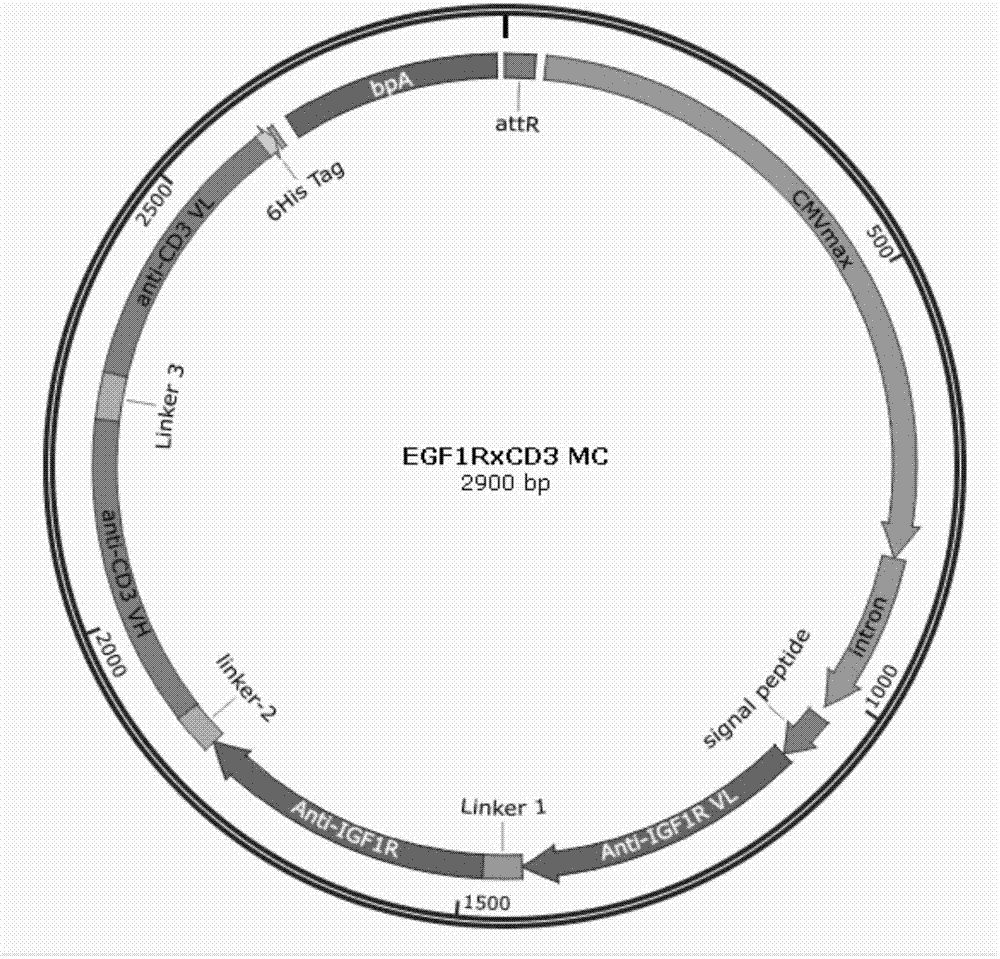
图1为本发明实施例1制备的微环母质粒的质粒图谱;
图2为本发明实施例2制备的微环dna的质粒图谱;
图3为本发明实施例3提供的westernblot检测培养基上清中bsab抗体表达水平的结果;
图4-5为本发明实施例4提供的igf1r×cd3bsab细胞结合实验流式细胞仪检测结果;其中,a-e分别表示bsab-1、bsab-2、bsab-3、bsab-4、以及阳性对照的结果;
图6-7本发明实施例5提供的igf1r×cd3bsab联合dcik细胞杀伤实验的加样分组和结果。
具体实施方式
以下所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
本发明实施例中无特别说明外,所用试剂及耗材均为市售商品。
实施例1
具有编码igf1r×cd3bsab抗体核苷酸序列的微环母质粒的构建,包括如下步骤:
1)设计bsab抗体基因表达盒
本发明实施例1的bsab抗体基因表达盒除含有编码bsab的核苷酸序列之外,还包括启动子、分泌信号肽、蛋白纯化标签、polya加尾信号的编码序列。
在一具体实施方式中,本发明实施例1的bsab抗体基因表达盒包括依次连接的:
编码免疫球蛋白κ链信号肽的核苷酸序列(murineigkapa-chainsignalpeptide,seqidno:21)-bsab抗体的基因序列(vligf1r-linker1-vhigf1r-linker2-vhcd3-linker3-vlcd3;具体核苷酸序列对应表2中的igf1rlcvr-linker1-igf1rhcvr-linker2-cd3hcvr-linker3-cd3lcvr)-编码组氨酸6-his标签的核苷酸序列(seqidno:22)-双重终止密码子(tagtga);其中,
编码免疫球蛋白κ链信号肽的核苷酸序列,如seqidno:21所示。
编码组氨酸6-his标签的核苷酸序列,如seqidno:22所示。
本发明实施例1的bsab抗体基因表达盒还包括巨细胞病毒cmv启动子的核苷酸序列,位于signalpeptide分泌信号肽的n段;序列为seqidno:23。
本发明实施例1的bsab抗体基因表达盒还包括牛生长激素多聚核苷酸polya(bghpolya)的核苷酸序列,位于终止密码子(tgatag)的c端;序列为seqidno:24。
为了增强微环dna载体的表达效率,添加了元件chimericintron(介于cmv启动子和signalpeptide分泌信号肽之间;文献报道,在多种细胞上能增强10-20倍),序列为seqidno:25。
本发明实施例1的bsab抗体基因表达盒中,linker1,linker2的氨基酸序列相同,均为(ggggs)3,核苷酸序列有所不同,分别为sequenceno.26和sequenceno.27所示核苷酸序列。
linker3氨基酸序列为veggsggsggsggsggvd,核苷酸序列为sequenceno.28所示核苷酸序列。
具体地,各序列如下:
sequenceno.21中,
murineigkapa-chainsignalpeptide
atgggctggagctgcatcatcctgttcctggtggccaccgccaccggcgtgcacagc;
sequenceno.22中,
6-his
catcatcaccatcatcat;
sequenceno.23中,
cmvpromoter
gtcaatattggccattagccatattattcattggttatatagcataaatcaatattggctattggccattgcatacgttgtatctatatcataatatgtacatttatattggctcatgtccaatatgaccgccatgttggcattgattattgactagttattaatagtaatcaattacggggtcattagttcatagcccatatatggagttccgcgttacataacttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccattgacgtcaataatgacgtatgttcccatagtaacgccaatagggactttccattgacgtcaatgggtggagtatttacggtaaactgcccacttggcagtacatcaagtgtatcatatgccaagtccgccccctattgacgtcaatgacggtaaatggcccgcctggcattatgcccagtacatgaccttacgggactttcctacttggcagtacatctacgtattagtcatcgctattaccatggtgatgcggttttggcagtacaccaatgggcgtggatagcggtttgactcacggggatttccaagtctccaccccattgacgtcaatgggagtttgttttggcaccaaaatcaacgggactttccaaaatgtcgtaataaccccgccccgttgacgcaaatgggcggtaggcgtgtacggtgggaggtctatataagcagaggtcgtttagtgaaccgtcagatcactagtagctttattgcggtagtttatcacagttaaattgct;
sequenceno.24中,
bghpolya
ggtgatcagcctcgactgtgccttctagttgccagccatctgttgtttgcccctcccccgtgccttccttgaccctggaaggtgccactcccactgtcctttcctaataaaatgaggaaattgcatcgcattgtctgagtaggtgtcattctattctggggggtggggtggggcaggacagcaagggggaggattgggaagacaatagcaggcatgctggggatgcggtgggctctatggaaccagctg;
sequenceno.25中,
chimericintron
aacgcagtcagtgctcgactgatcacaggtaagtatcaaggttacaagacaggtttaaggaggccaatagaaactgggcttgtcgagacagagaagattcttgcgtttctgataggcacctattggtcttactgacatccactttgcctttctctccacaggggtaccgaagccgctagcgctaccggtc;
sequenceno.26中,
linker1
ggaggaggcggcagcggcggaggcggcagcggcggaggcggcagc;
sequenceno.27中,
linker2
ggcggcggaggcagcggcggcggaggcagcggcggaggcggatcc;
sequenceno.28中,
linker3
gtcgaaggtggaagtggaggttctggtggaagtggaggttcaggtggagttgac;
2)将所述的bsab抗体基因表达盒插入p2фc31空载体或pmc.besxp空载体的attb和attp位点之间,具体步骤包括a)或b)中的任一一种:
a)
具体步骤参照发明人在2014年递交的pct申请(申请号:pct/cn2014/083741)说明书:
实施例1“一种含基因工程抗体基因表达盒的微环dna重组母质粒p2фc31.bab的构建方法”,至获得本发明实施例2的具有编码igf1r×cd3bsab抗体核苷酸序列的p2фc31微环母质粒;以及
实施例6“一种含基因工程抗体基因表达盒的微环dna重组母质粒pmc.bab的构建方法”的步骤;至获得本发明实施例2的具有编码igf1r×cd3bsab抗体核苷酸序列的pmc.besxp微环母质粒。
本发明步骤1-2)与上述pct申请不同的地方仅在于,本发明实施例2步骤1-2)将上述pct申请实施例1或6中的“bite的基因序列”替换为本发明实施例2的“igf1r×cd3bsab的基因序列”。
b)
直接采用酶切-连接的方法,在bsab抗体基因表达盒两端设计smai-apai两个酶切位点与pmc.besxp空载体或p2фc31空载体,将合成的bsab抗体基因表达盒通过酶切-连接的方式插入p2фc31空载体或pmc.besxp空载体的attb和attp位点之间;分别获得本发明实施例1的具有编码bsab抗体核苷酸序列的p2фc31微环母质粒或pmc.besxp微环母质粒。
本发明实施例1制备的pmc.besxp微环母质粒的质粒图谱如图1所示(命名为p-igf1r×cd3)。
实施例2
具有编码igf1r×cd3bsab抗体核苷酸序列的微环dna的构建
参照发明人在2014年递交的pct申请(申请号:pct/cn2014/083741)说明书:
实施例2和实施例7“一种含基因工程抗体基因表达盒的微环dna的制备方法”,分别至获得本发明实施例2的具有编码igf1r×cd3bsab抗体核苷酸序列的微环dna。
本发明与上述pct申请实施例2和实施例7不同的地方仅在于,本发明实施例3将上述pct申请实施例2或7中的微环母质粒替换为本发明实施例1提供的微环母质粒。
本发明实施例2制备的微环图谱如图2所示。
实施例3
bsab抗体的表达和纯化,包括如下步骤:
(1)igf1r×cd3bsab抗体在hek293t细胞中的表达
采用x-tremegenehpdnatransfectionreagent质粒转染试剂盒(roche公司)将实施例3的微环dna(图2所示微环母质粒制备的微环dna)转染hek293t细胞(dmemmedium,10%fbs),hek293t细胞转染igf1rbsab微环载体72小时后,用westernblot检测培养基上清和细胞质中igf1rbsab抗体表达水平,结果如图3所示,所有bsab在细胞质中均有表达,在上清中都有分泌表达。
(2)igf1r×cd3bsab抗体的纯化
将有分泌表达的抗体bsab-1中量规模转染hek293t细胞,收集培养上清,再采用his-tag亲和树脂纯化(his-tagpurificationresin,roche),纯化后的抗体采用elisa法检测蛋白质浓度;纯化后蛋白浓度调节至1.0mg/ml,置于-80℃长期保存,备用于流式细胞术检测。
实施例4
流式细胞术检测igf1r×cd3bsab与jurkat、hepg2细胞的结合活性,包括如下步骤:
a)细胞培养:jurkat细胞(1640medium,10%fbs;悬浮生长,cd3表达的细胞系);hepg2(dmemmedium,10%fbs;igf1r表达的肝癌细胞系),
b)胰酶消化hepg2,加含血清培养基中和后离心弃上清得细胞;jurkat为悬浮细胞直接离心收集细胞;
c)均用预冷pbs洗涕2次,200g离心5min,收集细胞,分别计数;
d)平均分配每实验组1×105个/组样品,分组如下:
jurkat细胞,3组:空白组(blank,pmc.besxp空载体转染hek293t细胞后的上清;预先准备);igf1r×cd3bsab组(实施例3所得纯化后的抗体;预先准备),阳性对照组,商品化抗体anti-cd3(bd公司,cat.555340)
hepg2细胞,3组:分组如上,空白组&igf1rbsab组(实施例3所得纯化后的抗体;预先准备)jurkat,2组:分组如上,空白组和igf1r×cd3bsab组(实施例3所得纯化后的抗体;预先准备),阳性对照组,商品化抗体anti-igf1r(abcam公司,cat.ab172965)
e)孵育一抗:加入上述各组抗体,100μl/组冰上孵育30min;
f)洗涤:加入1ml预冷pbs洗涤,200g离心5min,收集细胞,
g)孵育二抗:空白组和bsab组加事先预冷并稀释好的apc-mouseanti-6his抗体的pbs100μl(1:1000稀释),阳性对照组加入相应的二抗,冰上孵育30min。
h)洗涤和检测:加入1ml预冷pbs洗涤,200g离心5min,收集细胞,再用200μlpbs重悬。上流式细胞仪(bdc6)检测结合情况(阳性细胞百分比)。
实验结果:图4为bsab结合cd3阳性细胞(jurkat)的流式细胞仪检测结果;图5为bsab结合igf1r抗原阳性细胞(hepg2)的流式细胞仪检测结果。图4和图5中,流式图中左边曲线为空白组,右边曲线为bsab实验组。图4结果显示,bsab均有cd3结合能力,bsab-4结合力最弱,bsab-1的cd3结合能力最强,仅次于阳性对照。图5结果显示,bsab-1特异性结合igf1r抗原阳性细胞(hepg2)的能力比较明显。
实施例5
igf1r×cd3bsab抗体联合dcik细胞杀伤hepg2细胞实验
本例中靶细胞(t)为hepg2细胞;效应细胞(e)为dcik细胞(树突状细胞调节的细胞因子诱导的杀伤细胞,dendriticcellactivatedandcytokineinducedkillercell),杀瘤实验采用商品化试剂盒cytotox96non-radioactivecytotoxicityassay(promega公司,cat.g1780)
步骤参考试剂盒说明书,具体如下:
a)胰酶消化法收集培养好的靶细胞(hepg2),计数后,重悬于含5%fbs的dmem培养基中,按照2×104/孔和图6中分组,接种到96孔板中。
b)离心法收集效应细胞dcik(e)并计数,重悬于含5%fbs的dmem培养基中,分别按照e:t=4:1和e:t=8:1的比例,根据中图6中分组加入相应的孔中。
c)按照图6加入各bsab(将纯化液稀释为1ug/ml,即1ng/ul),加入量为10ng/孔,10μl,设置一组无bsab对照(dcik组),每组4个复孔;
d)37℃细胞培养箱孵育3小时15分;
e)靶细胞最大释放乳酸脱氢酶(ldh)孔加入10μl裂解液,混匀;
f)37℃细胞培养箱继续孵育45分钟后,将96孔250g离心4分钟,转移10μl各孔上清到新的96孔板中,再各孔加入50μl的ldh底物液,室温孵育30分钟;
g)各孔加入50μl的终止液,490nm处测定吸光度。
h)根据吸光度值,按照下面公式计算杀瘤效率:
杀瘤效率(%)=[(ebsab-espon-tspon)/(tmax-tspon)]×100
其中,ebsab代表各实验组释放乳酸脱氢酶(ldh);espon代表效应细胞自发释放ldh;tspon代表靶细胞自发释放ldh,tmax代表靶细胞最大释放ldh。(按照实际说明书,所有孔的数据处理前均减去培养基背景对照,实验组减去体积校正值)。
bsab联合dcik细胞杀伤hepg2细胞实验的结果如图7所示。
在图7中,纵轴表示杀瘤率的相对值;横坐标表示不同组别及效靶比(e:t)。
由图7可知,与单独dcik组(无bsab组)相比,加入igf1r-cd3bsab均有杀瘤率提高,其中igf1r×cd3bsab-1杀瘤效果最好,在效靶比(e:t)为4:1和8:1时,分别可达50.19%、90.36%,说明igf1r×cd3bsab能特异性介导dcik(主要t细胞)对靶细胞杀伤。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺