一种实时荧光PCR检测肺炎支原体核酸及耐药突变的引物、探针、方法及试剂盒与流程
本发明涉及分子生物学技术领域,尤其涉及一种实时荧光PCR检测肺炎支原体核酸及耐药突变的引物、探针、方法及试剂盒。
背景技术:
肺炎支原体(Mycoplasma Pneumoniae,MP)是造成儿童、老年人呼吸道感染的主要病原体,也是引起社区获得性肺炎的常见病原体。主要引起肺炎以及气管炎、支气管炎、哮喘等临床症状和一些严重的临床并发症。大环内酯类抗生素是目前治疗肺炎支原体肺炎的首选药物,抗生素滥用导致MP耐药性不断升高。
培养法是检测肺炎支原体的金标准,一旦检出,即可确诊。但其缺点在于需要的时间长,一般培养需2周左右,生长条件苛刻,当标本中MP数量少、培养基营养标准不够或操作方法不当时,就会出现假阴性结果;ELISA具有快速、敏感、简便、易于标准化等优点,应用于肺炎支原体,可检测IgM和IgG抗体,方法敏感,特异性高,是诊断肺炎支原体感染实用可靠的手段。肺炎支原体感染后可产生特异性的IgM、IgG类抗体,其中IgM类抗体出现最早,检测MP-IgM可作为早期感染的诊断指标,但重症感染及再感染者可能无此抗体产生。
技术实现要素:
本发明提供一种实时荧光PCR检测肺炎支原体核酸及耐药突变的引物、探针、方法及试剂盒,解决现有技术中培养法是检测肺炎支原体耗时长、生长条件苛刻、检测结果不准确的技术问题。
本发明的目的是通过以下技术方案实现的:
一种实时荧光PCR检测肺炎支原体核酸及耐药突变的引物和探针,检测肺炎支原体特异性P1基因的引物核苷酸序列如SEQIDNO:2~3所示,检测肺炎支原体特异性P1基因的Taqman探针的核苷酸序列如SEQIDNO:4所示;检测耐药突变位点2063(A/G)和2064(A/G)基因的引物核苷酸序列如SEQIDNO:6~7所示,检测耐药突变位点2063(A/G)基因的Taqman探针的核苷酸序列如SEQIDNO:8所示;检测耐药突变位点2064(A/G)基因的Taqman探针的核苷酸序列如SEQIDNO:10所示;检测内标基因int的引物核苷酸序列如SEQIDNO:12~13所示,检测内标基因int的Taqman探针的核苷酸序列如SEQIDNO:14所示。
一种实时荧光PCR检测肺炎支原体核酸及耐药突变的方法,包括:
样本核酸制备,以获得核酸模板;
分别针对肺炎支原体特异性P1基因、2063(A/G)基因、2064(A/G)基因、内标基因int设计特异性引物和荧光标记探针,其中,检测肺炎支原体特异性P1基因的引物核苷酸序列如SEQIDNO:2~3所示,检测肺炎支原体特异性P1基因的Taqman探针的核苷酸序列如SEQIDNO:4所示;检测耐药突变位点2063(A/G)和2064(A/G)基因的引物核苷酸序列如SEQIDNO:6~7所示,检测耐药突变位点2063(A/G)基因的Taqman探针的核苷酸序列如SEQIDNO:8所示;检测耐药突变位点2064(A/G)基因的Taqman探针的核苷酸序列如SEQIDNO:10所示;检测内标基因int的引物核苷酸序列如SEQIDNO:12~13所示,检测内标基因int的Taqman探针的核苷酸序列如SEQIDNO:14所示;
取阳性对照品、阴性对照品置于离心管中,分别加入核酸抽提液充分混匀,并进行加热和离心处理,取上清液用于荧光PCR检测;
配置酶试剂,其中,所述酶试剂由水生栖热菌DNA聚合酶(Taq酶)和尿嘧啶-N-糖基化酶(UNG酶)混合组成;
将P1基因PCR检测混合液与酶试剂震荡混匀,进行离心混匀;将2063(A/G)基因PCR检测混合液与酶试剂震荡混匀,进行离心处理;将2064(A/G)基因PCR检测混合液与酶试剂震荡混匀,进行离心处理
分别取加酶混匀后的PCR检测混合液置于荧光PCR管中,取样本核酸抽提上清液、阴性对照品核酸抽提上清液、阳性对照品核酸抽提上清液和内标加入已有PCR检测混合液的荧光PCR管中,进行荧光PCR扩增,反应条件为:37℃×2min,94℃×2min,循环1次;93℃×15s,60℃×30s,循环40次;单点荧光检测在60℃,并在此采集荧光信号,所述内标为含有内标int基因片段的质粒;
对于P1、2063(A/G)、2064(A/G)基因,采用荧光PCR仪上的FAM通道进行扩增,对于int基因,采用荧光PCR仪上的VIC通道进行扩增,通过荧光定量PCR仪所收集数据确定检测位点的基因型。
一种实时荧光PCR检测肺炎支原体核酸及耐药突变的试剂盒,包括核酸抽提液、第一引物探针混合液、第二引物探针混合液、第三引物探针混合液、PCR反应酶系、内标、阴性对照品、阳性对照品和分隔并集中包装这些试剂瓶或管的包装盒,其中,所述第一引物探针混合液由脱氧核糖核苷三磷酸dN(U)TP、P1基因的上、下游引物及一条荧光标记探针、内标基因的上、下游引物及一条荧光标记探针组成;所述第二引物探针混合液由脱氧核糖核苷三磷酸dN(U)TP、2063(A/G)基因的上、下游引物及一条荧光标记探针、内标基因的上、下游引物及一条荧光标记探针组成;所述第三引物探针混合液由脱氧核糖核苷三磷酸dN(U)TP、2064(A/G)基因的上、下游引物及一条荧光标记探针、内标基因的上、下游引物及一条荧光标记探针组成。
其中,检测肺炎支原体特异性P1基因的引物核苷酸序列如SEQIDNO:2~3所示,检测肺炎支原体特异性P1基因的Taqman探针的核苷酸序列如SEQIDNO:4所示;检测耐药突变位点2063(A/G)和2064(A/G)基因的引物核苷酸序列如SEQIDNO:6~7所示,检测耐药突变位点2063(A/G)基因的Taqman探针的核苷酸序列如SEQIDNO:8所示;检测耐药突变位点2064(A/G)基因的Taqman探针的核苷酸序列如SEQIDNO:10所示;检测内标基因int的引物核苷酸序列如SEQIDNO:12~13所示,检测内标基因int的Taqman探针的核苷酸序列如SEQIDNO:14所示。
本发明的有益效果为:采用Taqman-MGB探针实时荧光PCR法,分别针对肺炎支原体特异性P1基因、23S rRNA基因耐药突变基因(2063A/G,2064A/G)、内标核酸设计引物和荧光标记探针,通过PCR反应检测荧光信号,扩增曲线结合CT值判断检测结果,通过荧光信号的变化实现目的基因的检测。本发明具有准确率高、特异性强、灵敏度高的特点,能够对咽拭子样本中的肺炎支原体及耐药突变位点进行快速、准确检测。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可根据这些附图获得其他的附图。
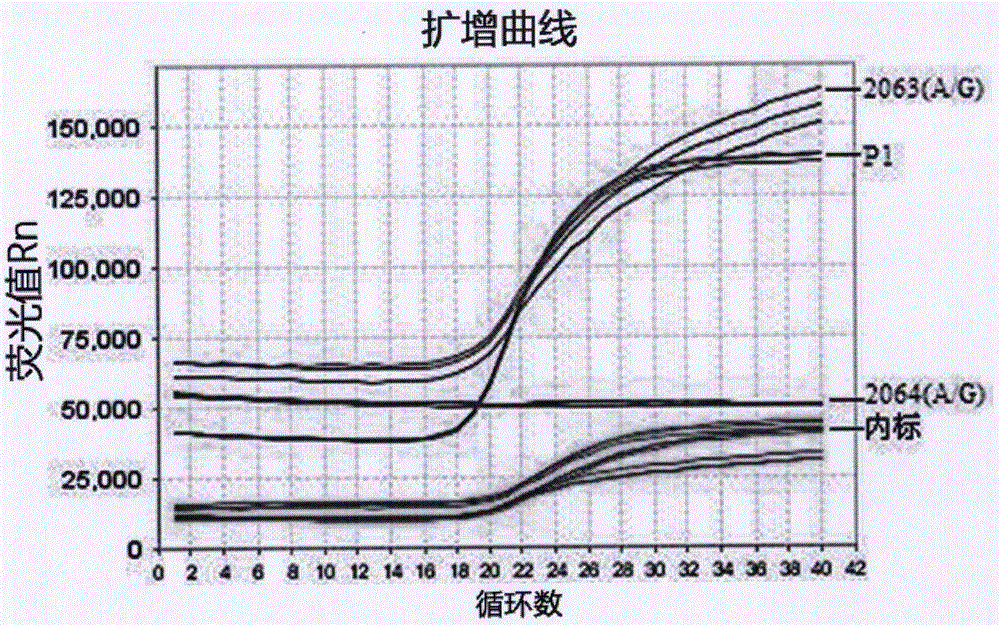
图1为本发明实施例四的肺炎支原体感染样本的荧光定量PCR曲线图;
图2为本发明实施例四的2063(A/G)突变阳性样本的荧光定量PCR曲线图;
图3为本发明实施例四的2064(A/G)突变阳性样本的荧光定量PCR曲线图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和具体实施方式对本发明作进一步详细的说明。
实施例一
本发明实施例提供了一种实时荧光PCR检测肺炎支原体核酸及耐药突变的引物和探针,检测肺炎支原体特异性P1基因的引物核苷酸序列如SEQIDNO:2~3所示,检测肺炎支原体特异性P1基因的Taqman探针的核苷酸序列如SEQIDNO:4所示;检测耐药突变位点2063(A/G)和2064(A/G)基因的引物核苷酸序列如SEQIDNO:6~7所示,检测耐药突变位点2063(A/G)基因的Taqman探针的核苷酸序列如SEQIDNO:8所示;检测耐药突变位点2064(A/G)基因的Taqman探针的核苷酸序列如SEQIDNO:10所示;检测内标基因int的引物核苷酸序列如SEQIDNO:12~13所示,检测内标基因int的Taqman探针的核苷酸序列如SEQIDNO:14所示;
其中,P1基因设计的特异性引物的序列如下:
上游引物P-P1-F:5’-TAAGTTCGTTGGTAGGGAAC-3’
下游引物P-P1-R:5’-CAACCTGAACTTAGTAGCGCAA-3’
针对P1基因的TaqMan荧光标记探针序列如下:
T-P1:5’-FAM-ATGGGTGATACCGCT-MGB-3’
针对2063(A/G)基因设计的特异性引物的序列如下:
上游引物P-23S-F:5’-ATCCAGGTACGGGTGAAGAC-3’
下游引物P-23S-R:5’-CGCATCAACAAGTCCTAGCGAA-3’
针对2063(A/G)基因的TaqMan荧光标记探针序列如下:
T-2063(A/G):5’-FAM-CGGGACGGGAAGAC-MGB-3’
针对2064(A/G)基因的特异性引物与2063(A/G)基因的特异性引物相同,针对2064(A/G)基因的TaqMan荧光标记探针序列如下:
T-2064(A/G):5’-FAM-GACGGAGAGACCCC-MGB-3’
int基因设计的特异性引物的序列如下:
上游引物P-int-F:5’-CCACACGACTCTCGGCAAC-3’
下游引物P-int-R:5’-TCGATGGTTCACGGGATTCT-3’
针对int基因的TaqMan荧光标记探针序列如下:
T-int:5’-VIC-CTCGGCTCTCGCATC-MGB-3’
P1、2063(A/G)、2064(A/G)基因探针的核苷酸序列5’端标记的荧光报告基团为FAM,3’端标记MGB基团;int基因探针的核苷酸序列5’端标记的荧光报告基团为VIC,3’端标记MGB基团。
实施例二
本发明实施例中又提供了一种实时荧光PCR检测肺炎支原体核酸及耐药突变的方法,包括:
步骤101、样本核酸制备,以获得核酸模板;
步骤102、分别针对肺炎支原体特异性P1基因、2063(A/G)基因、2064(A/G)基因、内标基因int设计特异性引物和荧光标记探针;
其中,检测肺炎支原体特异性P1基因的引物核苷酸序列如SEQIDNO:2~3所示,检测肺炎支原体特异性P1基因的Taqman探针的核苷酸序列如SEQIDNO:4所示;检测耐药突变位点2063(A/G)和2064(A/G)基因的引物核苷酸序列如SEQIDNO:6~7所示,检测耐药突变位点2063(A/G)基因的Taqman探针的核苷酸序列如SEQIDNO:8所示;检测耐药突变位点2064(A/G)基因的Taqman探针的核苷酸序列如SEQIDNO:10所示;检测内标基因int的引物核苷酸序列如SEQIDNO:12~13所示,检测内标基因int的Taqman探针的核苷酸序列如SEQIDNO:14所示;
本发明实施例中的内标基因(internal amplification control,int),是鉴别仪器故障、试剂因素、聚合酶活性因素或样本中存在抑制物等造成的结果不理想的原因。水稻核糖体DNA内转录间隔区ITS1基因与目的基因同源性极低,可以选取该基因片段作为内标。对P1、2063(A/G)、2064(A/G)基因序列进行同源性比对,选取保守片段分别设计针对这3个基因的特异性引物和荧光标记探针。
步骤103、取阳性对照品、阴性对照品置于离心管中,分别加入核酸抽提液充分混匀,并进行加热和离心处理,取上清液用于荧光PCR检测;
步骤104、配置酶试剂;
其中,所述酶由水生栖热菌DNA聚合酶(Taq酶)和尿嘧啶-N-糖基化酶(UNG酶)混合组成;
步骤105、将P1基因PCR检测混合液与酶试剂震荡混匀,进行离心混匀;将2063(A/G)基因PCR检测混合液与酶试剂震荡混匀,进行离心处理;将2064(A/G)基因PCR检测混合液与酶试剂震荡混匀,进行离心处理;
步骤106、分别取加酶混匀后的PCR检测混合液置于荧光PCR管中,取样本核酸抽提上清液、阴性对照品核酸抽提上清液、阳性对照品核酸抽提上清液和内标加入已有PCR检测混合液的荧光PCR管中,进行荧光PCR扩增;
其中,反应条件为:37℃×2min,94℃×2min,循环1次;93℃×15s,60℃×30s,循环40次;单点荧光检测在60℃,并在此采集荧光信号,所述内标为含有内标int基因片段的质粒;
步骤107、对于P1、2063(A/G)、2064(A/G)基因,采用荧光PCR仪上的FAM通道进行扩增,对于int基因,采用荧光PCR仪上的VIC通道进行扩增,通过荧光定量PCR仪所收集数据确定检测位点的基因型。
其中,检测结果根据CT值进行判定,仪器FAM通道CT栏显示Undet.同时VIC通道CT值≤35,表示检测样品低于检测限,报告为阴性;待检样品在FAM通道、VIC通道CT值均≤35,检测结果报告为阳性;待检样品FAM通道CT显示在35~40之间,VIC通道CT值≤35,需重复测定,FAM通道CT显示仍在35~40之间,且扩增曲线呈S型,则判断为阳性;若扩增结果为一直线,则判断为阴性。
本发明采用Taqman探针实时荧光PCR方法。NCBI blast同源性比对肺炎支原体特异性P1基因、耐药突变位点2063(A/G)、2064(A/G)、内标int基因,选取P1、2063(A/G)、2064(A/G)、int基因保守片段设计引物和荧光标记探针。P1、2063(A/G)、2064(A/G)基因探针5’端标记FAM荧光素为荧光报告基团(用R表示),3’端标记MGB基团(用Q表示);int基因设计的探针5’端标记VIC荧光素为荧光报告基团(用R表示),3’端标记MGB基团(用Q表示),Q基团能在近距离吸收R基团发出的荧光信号。PCR反应进入退火阶段时,探针先与模板结合,随后引物模板结合,此时探针上R基团发出的荧光信号被Q基团吸收,仪器检测不到荧光信号;当反应进行到延伸阶段时,Taq DNA聚合酶5’→3’外切酶将探针降解,探针上的R基团游离出来,Q基团无法吸收R基团发出的的荧光信号,检测器能检测到荧光信号。随着PCR反应的进行,PCR产物的增加与荧光信号的增长呈现对应关系。通过荧光信号增长曲线,实现目的基因的检测。
实施例三
本发明实施例提供了一种实时荧光PCR检测肺炎支原体核酸及耐药突变的试剂盒,包括核酸抽提液、第一引物探针混合液、第二引物探针混合液、第三引物探针混合液、PCR反应酶系、内标、阴性对照品、阳性对照品和分隔并集中包装这些试剂瓶或管的包装盒,其中,所述第一引物探针混合液由脱氧核糖核苷三磷酸dN(U)TP、P1基因的上、下游引物及一条荧光标记探针组成、内标基因的上、下游引物及一条荧光标记探针组成;所述第二引物探针混合液由脱氧核糖核苷三磷酸dN(U)TP、2063(A/G)基因的上、下游引物及一条荧光标记探针、内标基因的上、下游引物及一条荧光标记探针组成;所述第三引物探针混合液由脱氧核糖核苷三磷酸dN(U)TP、2064(A/G)基因的上、下游引物及一条荧光标记探针、内标基因的上、下游引物及一条荧光标记探针组成。
其中,检测肺炎支原体特异性P1基因的引物核苷酸序列如SEQIDNO:2~3所示,检测肺炎支原体特异性P1基因的Taqman探针的核苷酸序列如SEQIDNO:4所示;检测耐药突变位点2063(A/G)和2064(A/G)基因的引物核苷酸序列如SEQIDNO:6~7所示,检测耐药突变位点2063(A/G)基因的Taqman探针的核苷酸序列如SEQIDNO:8所示;检测耐药突变位点2064(A/G)基因的Taqman探针的核苷酸序列如SEQIDNO:10所示;检测内标基因int的引物核苷酸序列如SEQIDNO:12~13所示,检测内标基因int的Taqman探针的核苷酸序列如SEQIDNO:14所示。
所述核酸抽提液由3%(M/V)Chelex-100、1%(V/V)Tris-HCl,1M,pH9.0组成。
所述第一引物探针混合液、所述第二引物探针混合液和所述第三引物探针混合液分别由2μL 10×PCR Buffer、2μL25mmol/LMgCl2、3.4μL 2.5mmol/L dN(U)TP、0.8μL 10μmol/L目的基因引物、0.2μL 10μmol/L目的基因探针、0.4μL 10μmol/L内标基因引物、0.2μL 10μmol/L内标基因探针和5.75μL灭菌纯化水组成。
PCR反应酶系由5U/μL Taq DNA聚合酶和1U/μL UNG酶按体积比3∶2比例混合组成。
PCR扩增的条件为:37℃×2min,94℃×2min,循环1次;93℃×15s,60℃×30s,循环40次;单点荧光检测在60℃,对于P1、2063(A/G)、2064(A/G)基因,采用荧光PCR仪上的FAM通道进行扩增,对于int基因,采用荧光PCR仪上的VIC通道进行扩增。
所述阳性对照品为含有灭活的E-P1、E-23S(2063A/G)、E-23S(2064A/G)菌的混合液,菌浓度为105CFU/mL;阴性对照品为含有灭活的大肠杆菌溶液,菌浓度为105CFU/mL,其中,E-P1为含有P1基因片段的工程菌,E-23S(2063A/G)为含有23S(2063A/G)基因片段的工程菌,E-23S(2064A/G)为含有23S(2064A/G)基因片段的工程菌。
本试剂盒具有准确率高,临床试验结果与DNA测序结果总符合率99%以上;特异性强,与咽拭子中常见致病菌肺炎链球菌、流感嗜血杆菌、表皮葡萄球菌、金黄色葡萄球菌、大肠埃希菌、肺炎克雷伯氏菌、产酸克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、白色念珠菌、腺病毒、呼吸道合胞病毒、流感病毒、单纯疱疹病毒、衣原体均无交叉反应;灵敏度高,按照质粒拷贝数确定的最低检测限为103copies/mL,按照菌培养法确定的最低检测限为103CFU/mL。本产品用于体外定性检测人咽拭子样本中肺炎支原体特异性P1基因及耐药突变位点2063(A/G)和2064(A/G)基因。为临床确定肺炎支原体感染及其耐药突变提供辅助诊断方法,为临床医生用药提供参考。
实施例四
本实施例结合具体检测案例说明本发明的具体应用方式,首先收集人痰液和咽拭子样,采用发明实施例三中提供的试剂盒进行检测,统计结果符合率。
1、样本核酸制备
(1)痰液:取痰液加入2倍体积的4%NaOH(自备),摇匀,室温下放置30min液化,12,000rpm 5min。沉淀加无菌生理盐水1mL打匀,12,000rpm 5min;去尽上清,沉淀中直接加入50μL核酸抽提液,充分混匀,98℃ 10min(误差不超过1min)。12,000rpm 5min,取上清2μL做PCR反应。
(2)咽拭子:取1mL样本,12,000rpm 2min;弃去上清,沉淀中直接加入50μL核酸抽提液,充分混匀,98℃ 10min(误差不超过1min)。12,000rpm 5min,取上清2μL做PCR反应。
2、对照品准备
取阳性对照品、阴性对照品各50μL分别置于1.5mL(或0.5mL)离心管中(冻存试剂融化后振荡混匀10sec),分别加入核酸抽提液50μL充分混匀,98℃ 10min,然后12,000rpm 5min,取上清2μL做PCR反应。
3、酶试剂配制
取n×16μL肺炎支原体P1基因PCR检测混合液与n×0.2μL酶(水生栖热菌DNA聚合酶+尿嘧啶-N-糖基化酶)混合,振荡混匀数秒,3000rpm离心混匀数秒;取n×16μL 23S核糖体RNA基因耐药突变(2063A/G)PCR检测混合液与n×0.2μL酶(水生栖热菌DNA聚合酶+尿嘧啶-N-糖基化酶)混合,振荡混匀数秒,3000rpm离心混匀数秒;取n×16μL 23S核糖体RNA基因耐药突变(2064A/G)PCR检测混合液与n×0.2μL酶(水生栖热菌DNA聚合酶+尿嘧啶-N-糖基化酶)混合,振荡混匀数秒,3000rpm离心混匀数秒。
4、加样
分别取上述混合液16μL置于PCR管中,然后将样本、阴性对照品、阳性对照品的处理上清液各2μL分别加入各个已有混合液的PCR管中,同时分别向样本、阴性对照品、阳性对照品PCR管中加入2μL内标,盖好管盖,立即进行荧光PCR扩增反应。
5、PCR扩增
反应管置于定量荧光PCR仪上,推荐循环参数设置:
37℃×2min,94℃×2min,循环1次;93℃×15sec,60℃×30s,循环40次;单点荧光检测在60℃,反应体系为20μL。
荧光通道检测选择:P1基因、2063(A/G)、2064(A/G)选用FAM通道,内标基因选用VIC通道。
6、结果判定
检测结束后,基线调整取6-15个循环的荧光信号,阈值设定原则以阈值线刚好超过阴性对照品检测荧光曲线的最高点。仪器FAM通道CT栏显示Undet.同时VIC通道CT值≤35,表示检测样品低于检测限,报告为阴性;待检样品在FAM通道、VIC通道CT值均≤35,检测结果报告为阳性;待检样品FAM通道CT显示在35~40之间,VIC通道CT值≤35,需重复测定,FAM通道CT显示仍在35~40之间,且扩增曲线呈S型,则判断为阳性;若扩增结果为一直线,则判断为阴性。
7、检测结果检验
本发明的检测结果与细菌培养鉴定与药敏试验结果一致,荧光PCR检测结果如图1-3所示,图1为肺炎支原体感染样本的荧光定量PCR曲线图,可见随着PCR反应的进行,P1基因对应的PCR产物与荧光信号的增长呈现对应关系,可判断P1基因为阳性,2063(A/G)基因和2064(A/G)基因为阴性。图2为2063(A/G)突变阳性样本的荧光定量PCR曲线图,可判断P1基因和2063(A/G)基因均为阳性,2064(A/G)基因为阴性。图3为2064(A/G)突变阳性样本的荧光定量PCR曲线图,可判断P1基因和2064(A/G)基因均为阳性,2063(A/G)基因为阴性。
以上对本发明进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想;同时,对于本领域的一般技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
- 还没有人留言评论。精彩留言会获得点赞!