通过过量表达PtGlim1a基因培育高木质素含量717杨树的方法与流程
本发明属于分子生物学和生物技术领域,更加具体的说,涉及一种通过过量表达PtGlim1a基因培育高木质素含量717杨树的方法。
背景技术:
木质素是地球上数量仅次于纤维素的有机物,林木中木质素占木材干重的15~36%,但是能为化工产业提供木质素原材料的植物并不多,而且随着化石能源的日益枯竭,木质素的需求量大大增加,木质素科学开始飞速发展。木质素的经济效益具有可持续发展性,而且成本较低,木质素及其衍生物具有多种功能,可作为分散剂、吸附剂/解吸剂、石油回收助剂、沥青乳化剂,木质素对人类可持续发展最为重大贡献就在于提供稳定、持续的有机物质来源,其应用前景十分广阔。
技术实现要素:
本发明的目的是克服现有技术的不足,提供一种通过过量表达PtGlim1a基因培育高木质素含量717杨树的方法。
本发明的技术方案概述如下:
通过过量表达PtGlim1a基因培育高木质素含量717杨树的方法,包括如下步骤:
(1)克隆杨树木质素合成基因PtGlim1a;所述基因的核苷酸序列如序列表中SEQ ID NO.1所示;
(2)构建含有杨树木质素合成基因PtGlim1a的重组载体pK2GW7(I)_PtGlim1a;
(3)构建含表达载体pK2GW7(I)_PtGlim1a的农杆菌菌株;
(4)将步骤(3)的农杆菌菌株转化717杨树。
本发明的优点:
本发明将PtGlim1a序列插入至pK2GW7(I)载体,构建了pK2GW7(I)_PtGlim1a高效表达载体,通过农杆菌菌株(C58)导入到717杨树中,使717杨树自身PtGlim1a基因过量表达,从而得到了高木质素含量717杨树。高木质素含量的717杨树可应用到化工领域,用来制作混凝土减水剂、选矿浮选剂、冶炼矿粉粘结剂、耐火材料等,用木质素或木质素衍生物制作的材料污染小,回收效率高,安全系数大。717杨树对环境的适应性好,易种植成本低,可以为生产大规模的化工产品提供性质优良的原材料。
附图说明
图1是杨树木质素合成基因PtGlim1a克隆电泳示意图。
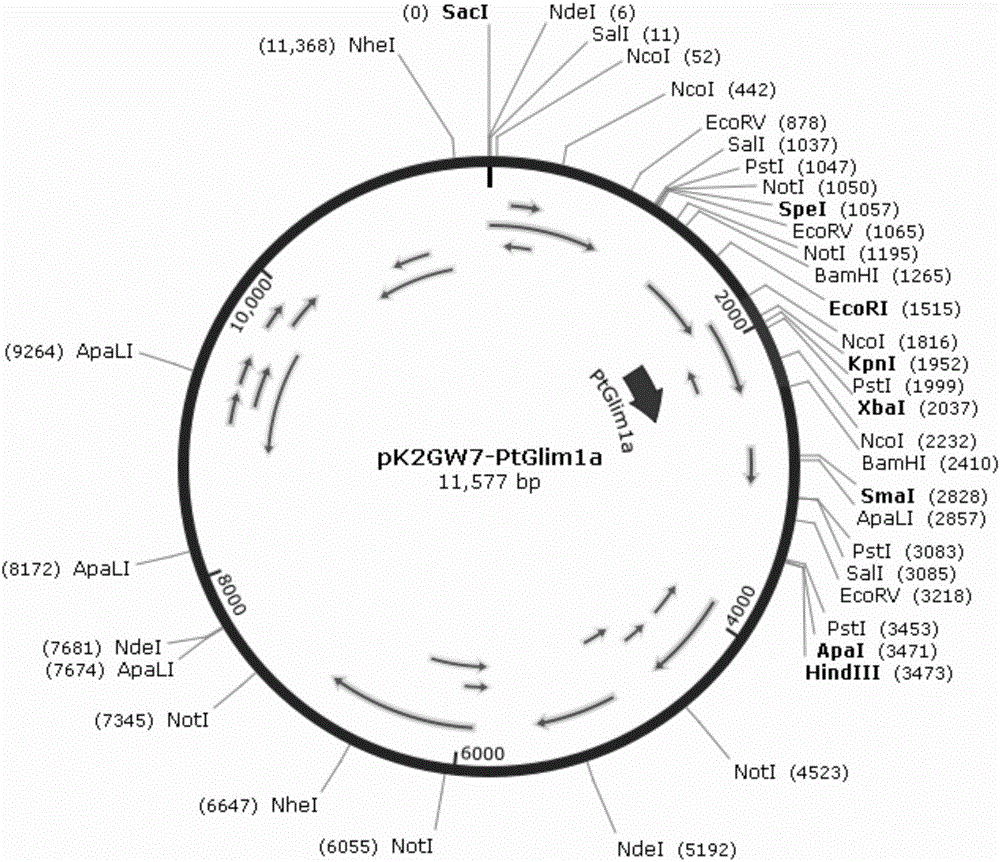
图2是包含本发明的杨树木质素合成基因PtGlim1a的表达载体pK2GW7(I)_PtGlim1a示意图。
图3是pK2GW7(I)_PtGlim1a转化农杆菌C58PCR筛选结果。
图4是PtGlim1a转基因717杨树半定量PCR结果。
图5是PtGlim1a转基因717杨树茎段切片结果。
图6是PtGlim1a转基因717杨树木质素含量测定结果。
具体实施方式
实施例中未注明具体条件的实验方法,通常按照常规条件以及手册中所述的条件,或按照制造厂商所建议的条件。
717杨树为欧洲山杨×银白杨(Populus tremula×P.alba INRA clone N717 1-B4,简称717杨树)。
下面结合具体实施例进一步说明本发明的技术方案。
实施例1
杨树木质素合成基因PtGlim1a的克隆、超表达载体的构建及含超表达载体农杆菌的转化。
首先,以采一年生的毛果杨(Populus trichocarpa)为原料,利用基因克隆技术,获取杨树木质素合成基因PtGlim1a。
取一年生毛果杨(Populus trichocarpa)的形成层,使用植物RNeasy Plant Mini Kit(Trans gene Code#EP101-01 50rxns)提取total RNA,并且利用EasyScript First-Strand cDNA Synthesis SuperMix(Trans gene Code#AE301-03 100rxns)去除基因组DNA干扰,反转录出cDNA。根据NCBI数据库中LIM基因的保守区设计引物SEQ ID No.3:5'-CATGGATCCTCTTCAAGGGAGAACAAGGA-3'和SEQ ID No.4:5'-CGGGAGCTCGCCATGTATGGTAGGAAGGA-3'然后利用RACE-PCR技术(Introgen,RLM-RACE Kit with Manual)获得杨树PtGlim1a基因全长cDNA序列,其具体步骤如下:
1)cDNA第一链的合成
用反转录试剂盒TaKaRa RNA PCR Kit(AMV)Ver.3.0,以毛果杨形成层总RNA为模板,Oligo(dT)为引物,在AMV逆转录酶的作用下合成cDNA第一链,反转录体系如下:
反应条件:42℃60min,99℃5min。
2).杨树木质素合成基因PtGlim1a反转录质量PCR扩增检测
用杨树Actin基因特异引物SEQ ID No.5:5'–TGGTGACGCTGGTATGGTTA-3',SEQ ID No.6:5'-TCCTTCTTGTCCACGCTCTT-3',PCR扩增,以验证反转录反应及RNA质量。PCR反应体系如下:
反应条件:94℃3min;94℃30s,40℃30s,72℃50s,35cycles;72℃5min。
3)杨树木质素合成基因PtGlim1a片段的PCR扩增
以cDNA为模板,以SEQ ID No.3、SEQ ID No.4所示核苷酸为上下游引物,进行PCR反应。
反应体系如下:
PCR反应条件:94℃3min;94℃30s,40℃30s,72℃60s,35cycles;72℃5min。PCR结束后,取5μl PCR产物进行1%琼脂糖凝胶电泳。
对通过RACE技术扩增得到的杨树木质素合成基因PtGlim1a进行测序分析,得到完整的杨树木质素合成基因PtGlim1a全长为588bp(SEQ ID No.1),见图1。
由杨树木质素合成基因PtGlim1a编码的蛋白质,是SEQ ID No.2所示的氨基酸序列。
4)根据杨树木质素合成基因PtGlim1a核苷酸序列设计上下游引物用于PtGlim1a基因的半定量鉴定
SEQ ID No.7:5'-ATCCAGTCGTCAGCATCACT-3'
SEQ ID No.8:5'-GGTAGGAAGGACATGAAAAG-3'
构建超表达载体时,则分别在特异性引物的5’端添加Gateway系统重组位点,
SEQ ID No.9:5’-GGGGACAAGTTTGTACAAAAAAGCAGGCT-3’,
SEQ ID No.10:5’-GGGGACCACTTTGTACAAGAAAGCTGGGT-3’
得到:
SEQ ID No.11:
5'-GGGGACAAGTTTGTACAAAAAAGCAGGCTATCCAGTCGTCAGCATCACT-3'
SEQ ID No.12:
5'-GGGGACCACTTTGTACAAGAAAGCTGGGTGGTAGGAAGGACATGAAAAG-3'
5)attB-PCR产物的合成及纯化回收
PCR离心管中加入以下反应体系
PCR反应条件为:95℃,5min;95℃,30s;58℃,30s;72℃,90s;72℃,10min;4℃,∞。
PCR反应结束后,取1μL PCR产物进行1.0%琼脂糖凝胶电泳,检测PCR产物的质量,其余用作产物的纯化回收。
6)构建含有杨树木质素合成基因PtGlim1a的重组载体
构建含有杨树木质素合成基因PtGlim1a的载体pJET1.2_PtGlim1a、pDONR201_PtGlim1a和表达载体pK2GW7(I)_PtGlim1a
pJET1.2:Thermo,Clone JET PCR Cloning Kit#K1231;pDONR201、pK2GW7(I)载体购于invitrogen;所用大肠杆菌为DH5a感受态细胞,TIANGEN,CB101-2。
胶回收纯化后的杨树木质素合成基因PtGlim1a目的片段利用CloneJET PCR Cloning Kit(pJET1.2:Thermo,Clone JET PCR Cloning Kit#K1231)重组到载体pJET1.2上,得到载体pJET1.2_PtGlim1a。
分别利用载体和目的片段的上下游引物(SEQ ID No.7和SEQ ID No.8)对同一个菌落进行菌落PCR双重验证,筛选阳性菌落测序。
提取测序正确菌液的质粒进行BP反应,得到载体pDONR201_PtGlim1a,筛选出阳性克隆进行测序。同样,提取测序正确菌的质粒进行LR反应,得到表达载体pK2GW7(I)-PtGlim1a(见图2),筛选出阳性克隆。
在BP反应中,5’端、3’端分别含有attB1和attB2位点的PCR产物,与两端分别含有attP1和attP2位点的载体在BP克隆酶的催化下,通过同源重组生成含有目的基因的入门克隆;LR反应中,在LR克隆酶作用下,含有入门PCR产物的入门克隆与含有attR1和attR2序列的目的载体发生定向重组反应,生成带有目的PCR产物的表达载体。
注:本步骤使用的所有材料均购于invitrogen,包括Gateway BP onase II Enzyme Mix Lor:11789-020;Qty:20rxn)),Gateway LR Clonase II Enzyme Mix Lor:1356811;Qty:20rxn),
7)含有杨树木质素合成基因PtGlim1a的重组载体(pK2GW7(I)_PtGlim1a)转化农杆菌感受态细胞
实验所用的农杆菌菌株为C58(购于中国质粒载体菌株细胞株基因保藏中心,http://biovector.blog.163.com/),C58具有利福平抗性(Rif),辅助质粒具有庆大霉素抗性(Gen)。
利用电击农杆菌转化法,将含有杨树木质素合成基因PtGlim1a表达载体pK2GW7(I)_PtGlim1a转化到农杆菌株C58(pMP90)感受态细胞中,28℃,培养36h,菌落PCR挑选阳性克隆菌落(见图3:其中1为1号转基因阳性菌、2为2号转基因阳性菌、3为3号转基因阳性菌、4为4号转基因阳性菌、对照为pK2GW7(I)_PtGlim1a质粒对照)。
实施例2转化杨树
供阳性克隆菌转化的组培苗是717杨树。
(1)将717杨树腋芽或顶芽置于基本培养基上继代繁殖,培养6周获得组培苗;切取所述组培苗1cm不带腋芽的茎段,划伤口后于24℃黑暗条件下预培养3天;
(2)将选取的实施例1获得的阳性克隆菌菌液(OD600=0.8)在室温、4000rpm离心10min,弃去上清液,将沉淀用等体积的M液(M液:MS盐4.4g,蔗糖30g,生长素NAA 1.86mg,细胞分裂素2ip 1.02mg,乙酰丁香酮As 19.86mg,定容至1L,pH=5.7)重悬,24℃,100rpm活化1h得到侵染液;按40个:25mL的比例将步骤(1)预培养的茎段放入所述侵染液中,24℃条件下100rpm侵染1h。经过共培养(M1固体培养基:MS盐4.4g,蔗糖30g,琼脂7.2g,生长素NAA 1.86mg,细胞分裂素2ip 1.02mg,乙酰丁香酮As 19.86mg,定容至1L,pH=5.7;培养条件:26℃,暗条件下共培养36小时)、延迟选择(CIM延迟选择培养基:MS盐4.4g,蔗糖30g,生长素NAA 1.86mg,细胞分裂素2ip 1.02mg,头孢霉素500mg,琼脂7.2g,定容至1L,pH=5.7;培养条件:800Lux弱光下培养8天,光照/黑暗为16h/8h)、诱导不定芽(SIMa筛选培养基中:MS盐4.4g,蔗糖30g,细胞分裂素TDZ 0.05mg,头孢霉素500mg,卡那霉素500mg,琼脂7.2g,定容至1L,pH=5.7;培养条件:26℃,2000Lux,光照/黑暗为16h/8h)、伸长培养(SEM筛选培养基:MS盐4.4g,蔗糖30g,细胞分裂素2ip 1.02mg,头孢霉素500mg,卡那霉素500mg,琼脂7.2g,定容至1L,pH=5.7;培养条件:26℃,2000Lux光照,光照/黑暗为16h/8h,培养4周)、诱导生根(RM培养基的组成为:MS盐2.2g,蔗糖30g,头孢霉素500mg,,卡那霉素500mg,琼脂7.2g,定容至1L,pH=5.7;培养条件:26℃,2000Lux光照,光照/黑暗为16h/8h)多步后,待再生杨树生长正常后,对每一棵独立转化子进行阳性鉴定。
鉴定结果(见图4:其中1为1号转基因阳性苗、2为2号转基因阳性苗、3为3号转基因阳性苗、4为4号转基因阳性苗、5为5号转基因阳性苗;对照1、对照2、对照3为三个平行的WT野生型对照。)
在PCR结果的电泳图中可以看出,转基因的效果很好,1‐5号转基因杨树苗的PtGlim1a基因条带比野生型对照条带亮且内源参照基因表达正常,说明1‐5号转基因杨树苗的内源PtGlim1a基因的表达量明显提高。3号条带相对较亮一些,选择3号转基因植物做后续实验。
(3)将生长2个月的长势均匀的转基因3号杨树移栽至土盆中,待土盆苗生长60d后,分别取植物的6,9,12节间做组织切片观察。待植物生长6个月后,对植物进行木质素含量的测定。
实施例3杨树茎段组织切片
(1)植物材料的固定
用锋利的刀片分别把需要固定的植物茎段切开,茎段长度约5mm,将茎段分别放入2mlEP管中,并加入适量的组织软化剂(组织软化剂:丙酮400μL,磷酸缓冲液5mL,加入去离子水定容至10mL)。将装有材料的EP管放入真空泵中,打开盖子,对其进行抽气直到材料沉入EP管的底部且很少有气泡冒出。然后更换成FAA固定液,在摇床上室温、100rmp过夜约12个小时。
(2)植物材料的包埋
准备若干1.5mL的EP管,用记号笔标好号,配制浓度为6%的琼脂糖凝胶,倒入之前准备好的1.5mL的EP管中,等胶不太烫但又不凝结时,将样品垂直的放入有琼脂糖凝胶的EP管中,调整角度,保证样品垂直与胶面,直至胶凝结。
(3)植物材料的切片
用刀片将包裹有植物材料的琼脂糖凝胶块进行适当的修整,使凝胶的低端尽量为一个平面,即尽可能的保持植物材料的垂直后进行切片。
(4).植物材料切片的染色
将切好的片子分别用事先配置的0.025%的甲苯胺蓝(0.025%的甲苯胺蓝染液0.0025g甲苯胺蓝粉末+10mL的蒸馏水)和盐酸-2%间苯三酚(2%间苯三酚染液2g间苯三酚+95%乙醇100mL)分别染色。
(5)显微镜拍照
将制作好的片子放在电子显微镜下观察拍照,并添加标尺。
通过半定量PCR选取表达水平高的独立转化株系3号(转基因3号杨树)进行植物组织切片观察(见图5:其中图5a为阳性苗茎段切片间苯三酚染色结果,图5b为野生型对照茎段切片间苯三酚染色结果;图5c阳性苗茎段切片自发荧光结果,图5d为野生型对照茎段切片自发荧光结果;)
对比图5a(转基因阳性苗)和图5b(野生型对照苗)、图5c(转基因阳性苗)和图5d(野生型对照苗),从两组图中都可以看出转基因阳性苗木质部比野生型对照苗宽,说明通过转基因技术使PtGlim1a基因过量表达可以培育高木质素含量717杨树。(见图5)
注:本步骤所使用的切片机是振动切片机(leicaVT1000S);显微镜是正置显微镜(ECLIPSE-50i)。
实施例4:木质素含量的分析
本实验所用的提取木质素的方法是:Klason木质素测定法,即硫酸法测定木质素含量。具体步骤如下:
(1)准备实验材料
将选出的转基因阳性苗选9株移栽到土盆里,6个月后挑选出长势较均一的3植株,去皮后将其放在30℃的烘箱中,直至彻底的将其烘干。
将烘干的样品在天平上称重后取约500g,全部放在不锈钢的粉碎机中,充分打磨直到所得的粉末能够大部分通过2mm的筛子。
精确的称取分别为1g(准确称量至0.0001g)的粉末三份,再称取三片定性滤纸的重量,标记。
(2)具体实验步骤操作
用滤纸将三分样品包好,并用细线扎紧,放入索式抽提器中,其高度不能超过索式抽提器内液体回流时管口的高度。
将苯醇混合液加入索式抽提器下面的烧瓶中,打开索氏提取器最下面加热套的开关,调节压力和温度:同时打开水龙头,使冷凝管中充满水,加热抽提8个小时(抽提液在管内循环的次数最好控制在每小时不低于4次)。
将样品取出在通风橱内风干,打开滤纸包,用洁净的毛刷将其转入螺口的20mL的大试管中,标号。
分别吸取3mL浓硫酸加入到3个试管中,用玻璃棒搅匀样品,拧紧试管的盖子,然后摇荡1min,保证样品能够全部的被浓硫酸所浸没。
将这三个大试管放入摇床中,30℃、150rmp,60分钟。
在摇床上摇60分钟后,取出,将试管内的混合物分别倒入三个200mL的锥形瓶中,将蒸馏水加入试管中,多润洗几遍,直到冲干净试管中的物质,最终加入的蒸馏水量为84mL,使浓硫酸的浓度稀释为3%。
然后将锥形瓶包好放入121℃的灭菌锅内,高压灭菌1个小时。
取出灭菌后的溶液,分别将其在真空过滤器中过滤,将所有的锥形瓶中的内容物全部的倒入真空过滤器上的漏斗中,漏斗内要垫入称好重量的定量滤纸,用蒸馏水充分的清洗锥形瓶,多润洗几次,直到锥形瓶内的所有残渣均被洗出。用蒸馏水洗涤后的洗液不能够呈现酸性为止,可以用10%氯化钡溶液检查洗液是否不再为酸性,即加入10%氯化钡溶液洗液却不出现浑浊,同时再用pH试纸检查,试纸边缘不呈酸性即可。
将带有过滤物的滤纸放在事先称好重量的坩埚内,放在105℃的烘箱内,烘干至恒重,约2个小时左右。
待坩埚冷却后称重,所得的重量即为木质素的重量。
(3)数据处理
木质素的提取实验做三次平行实验,每次实验中做三组平行测定,最后得到9组测定数据,对9组实验数据进行方差分析,排除系统误差和随机误差,得到转基因杨树苗的木质素含量。木质素含量测定结果(见图6)。
- 还没有人留言评论。精彩留言会获得点赞!
- 鉴别具有治疗性皮脂抑制活性的ahr受体的配体的方法以及所述配体的制作方法
- 通过PARP1基因、CYP1A1基因和ERCC2基因的SNPs位点进行肺癌易感性检测的试剂盒的制作方法
- 采用基因cyp71av1和cpr共转化提高青蒿中青蒿素含量的方法
- 一种通过cyp1a1基因检测肺癌易感性的试剂盒的制作方法
- 鸭源性冠状病毒ORF1a蛋白基因及其克隆方法与应用的制作方法
- 一种cyp1a1基因多态性检测特异性引物和液相芯片的制作方法
- 雌激素代谢检测试剂盒的制作方法
- 一种筛查子宫内膜癌易感基因的无创检测试剂盒的制作方法
- Cyp5013c2蛋白及其编码基因以及表达cyp5013c2蛋白的四膜虫的制作方法
- 湖北海棠MhSGT1a基因及其应用的制作方法