一种新型吲哚甘氨酸衍生物的合成方法与流程
本发明涉及有机化工领域,特别涉及一种新型吲哚氨基酸衍生物的合成方法。
背景技术:
吲哚甘氨酸衍生物是药物发展和天然产物合成的重要中间体和结构单元[J.Med.Chem.1988,31,1244.;J.Nat.Prod.1998,61,660.],其合成方法得到了一定的关注[Synthesis 2005,13,2198.]。其中最常用的方法是吲哚和亚胺直接通过Mannich-type Friedel–Crafts反应得到[Chem.Commun.2010,46,1550.;Org.Lett.2008,10,933.]。
交叉脱氢偶联(CDC)反应是形成碳-碳键、碳-氮键及碳-氧键最为有效的手段之一,已经被广泛地应用于有机化学的许多领域。其中,吲哚3-位C-H和胺α-位C-H的交叉脱氢偶联反应,一直备受关注[Org.Biomol.Chem.,2016,14,1550and references therein.]。胺在氧化剂促进下,通过单电子转移过程,形成亚胺型中间体,然后吲哚3-位碳亲核进攻亚胺,最终形成吲哚和胺的交叉脱氢偶联产物[J.Am.Chem.Soc.2013,135,1549.]。2012年,大连理工大学于小强课题组报道了吲哚与2-(二取代氨基)乙酸酯在mCPBA条件下的交叉脱氢偶联反应,得到了一系列吲哚甘氨酸衍生物[J.Org.Chem.2012,77,7114.],但得到的吲哚甘氨酸衍生物氮上是烷基基团,想通过断裂C-N键水解成氨基酸非常困难。
酰胺基丙二酸酯是重要的有机合成和医药中间体,是合成氨基酸必不可少的原料,尤其用于α-氨基酸的合成,如作为色氨酸和消痛芥等的中间体,还是合成各种非天然氨基酸的主要中间体。酰胺基丙二酸酯一般作为亲核试剂和卤代烃发生反应,生成取代的酰胺基丙二酸酯,再通过水解制备不同取代的氨基酸。
技术实现要素:
本发明所解决的技术问题是提供一种简便高效合成新型吲哚甘氨酸衍生物的方法。
交叉偶联反应是一类构建C-C键的非常简单有效的方法,但现有技术大部分是利用烷基胺或者苯胺基取代丙二酸酯和吲哚的交叉偶联反应来制备吲哚氨基酸衍生物;以现有的mCPBA,FeCl3等作为氧化剂,采用酰胺基丙二酸酯和吲哚进行交叉偶联反应都得不到相应的吲哚氨基酸衍生物。本发明首次选用不同的铜盐做氧化剂,采用酰胺基丙二酸酯与吲哚类化合物进行交叉偶联反应,制备了一种新型的容易水解成吲哚甘氨酸的吲哚氨基酸衍生物。
本发明通过以吲哚类化合物和酰胺基丙二酸酯在氧化剂条件下合成吲哚类氨基酸衍生物。具体为通过交叉脱氢偶联反应合成吲哚甘氨酸衍生物,以吲哚衍生物1和酰胺基丙二酸酯2为原料,在氧化剂存在下氮气保护发生反应,得到吲哚甘氨酸衍生物3,其合成路线如下:
R1包括H,5-OMe,7-CH3,4-CH3,5-Cl,5-Br,5-CN,5-NO2,2-CH3,2-CO2Et;
R2包括-H,-CH3;
R3包括-Ph,-CH3,-CH2Cl,-CH2Ph,-CH2=CH2,2-呋喃。
其中,所用氧化剂为不同的铜盐:醋酸铜、硝酸铜、溴化亚铜、碘化亚铜或者三氟甲磺酸铜。
所用的氧化剂用量为吲哚摩尔数的2.5倍。
所用反应条件为:在N2保护条件下加热至60-100℃进行反应,反应时间为3-5小时,原料吲哚:酰胺基丙二酸酯:氧化剂的摩尔比=1:1.25:2.5。
合成所用的溶剂为:乙醇、甲苯、1,4-二氧六环、DMF、DMSO、乙腈、THF。
本发明无论是带有吸电子基的吲哚还是带有给电子基的吲哚,都与酰胺基丙二酸酯获得了一定量的目标产物,说明该反应体系适用性广,能兼容各种官能团。
本发明的有益效果:本发明首次将酰胺基丙二酸酯应用于吲哚类化合物的交叉脱氢偶联反应中,丰富了交叉脱氢偶联反应的范围,采用吲哚类化合物和酰胺基丙二酸酯为原料,选用不同的铜盐做氧化剂,利用酰胺基丙二酸酯在铜盐氧化作用下,形成亚胺中间体作为亲电试剂和吲哚发生加成反应,首次得到一种通过水解可以直接制备吲哚甘氨酸的新型取代的吲哚甘氨酸衍生物。该方法是一种非常便捷的方法,与现有技术中的制备方法相比,具有反应原料低毒,反应条件温和,反应时间短,氧化剂便宜易得等许多优点,在合成这一类化合物上具有重要的实际应用价值。
附图说明
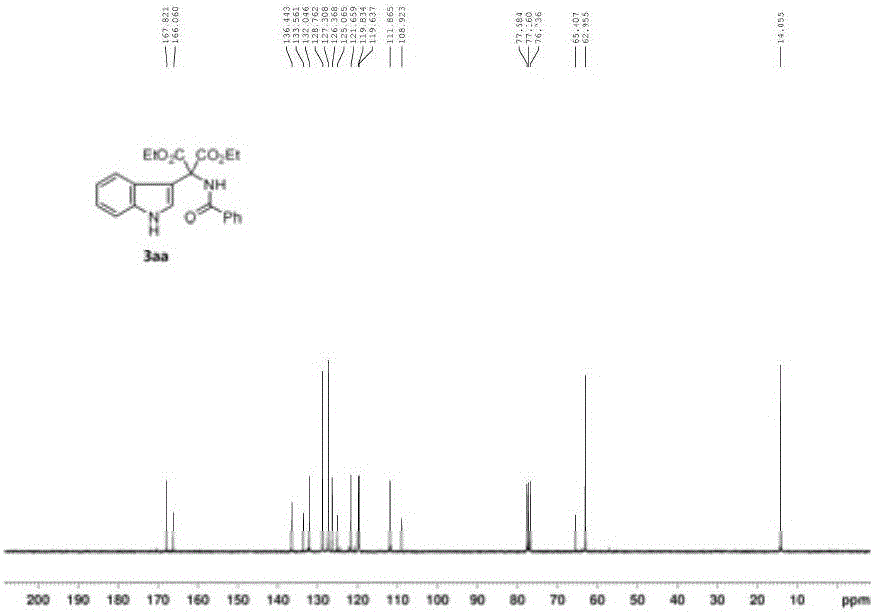
图1、图2为化合物3aa的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图3、图4为化合物3ab的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图5、图6为化合物3ac的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图7、图8为化合物3ad的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图9、图10为化合物3ae的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图11、图12为化合物3af的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图13、图14为化合物3ag的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图15、图16为化合物3ah的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图17、图18为化合物3ai的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图19、图20为化合物3aj的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图21、图22为化合物3ak的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图23、图24为化合物3ba的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图25、图26为化合物3ca的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图27、图28为化合物3da的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图29、图30为化合物3ea的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图;
图31、图32为化合物3fa的1H-NMR(500MHz,CDCl3)谱图和13C-NMR(125MHz,CDCl3)谱图。
具体实施方式
本发明下面结合实施例作进一步详述:
实施例1:
以吲哚、苯甲酰氨基丙二酸二乙酯为原料,按照吲哚:苯甲酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂DMSO用量为3mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3aa。
对所得产物进行测试,测试所用的仪器为:AVANCE 300MHz型核磁共振仪(Bruker公司,TMS为内标);日本岛津LCMS-2020型质谱仪;SGW X-4显微熔点仪(温度计未经校正)。其它实施例测试方法与本实施例相同。
3aa:白色固体,mp 147-148℃.1H NMR(300MHz,CDCl3)δ8.51br,1H),8.09(s,1H),7.85(d,J=7.0Hz,2H),7.77-7.81(m,1H),7.67(d,J=7.2Hz,1H),7.52(tt,J=7.3Hz,1.3Hz,1H),7.44(t,J=7.5Hz,2H),7.23-7.25(m,1H),7.02-7.14(m,2H),4.20-4.42(m,4H),1.24(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ167.8,166.1,136.4,133.6,132.0,128.8,127.3,126.4,125.1,121.7,119.8,119.6,111.9,108.9,65.4,63.0,14.1.
实施例2:
以5-甲氧基吲哚、苯甲酰氨基丙二酸二乙酯为原料,按照5-甲氧基吲哚:苯甲酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂乙腈用量为3mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3ab。
3ab:白色固体,mp 159-160℃.1H NMR(300MHz,CDCl3)δ8.42(br,1H),8.06(s,1H),7.86(d,J=6.9Hz,2H),7.74(d,J=2.8Hz,1H),7.52(tt,J=7.3Hz,1.3Hz,1H),7.44(t,J=7.5Hz,2H),7.09-7.15(m,2H),6.75(dd,J=8.9Hz,2.3Hz,1H),4.21-4.43(m,4H),3.78(s,3H),1.25(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ167.8,166.0,153.9,133.5,132.1,131.6,128.8,127.3,127.1,125.4,112.4,111.7,108.5,102.1,65.4,63.0,55.9,14.1.
实施例3:
以7-甲基吲哚、苯甲酰氨基丙二酸二乙酯为原料,按照7-甲基吲哚:苯甲酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂DMSO用量为3mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3ac。
3ac:白色固体,mp 193-194℃.1H NMR(300MHz,CDCl3)δ8.61(br,1H),8.14(s,1H),7.86(d,J=7.3Hz,3H),7.40-7.54(m,4H),6.95(t,J=7.2Hz,1H),6.84(d,J=7.1Hz,1H),4.20-4.40(m,4H),2.21(s,3H),1.23(t,J=7.1Hz,6H);13CNMR(75MHz,CDCl3)δ167.8,166.1,135.7,133.6,132.0,128.7,127.3,126.9,124.5,122.0,121.3,119.8,117.1,108.8,65.4,62.9,16.3,14.1.
实施例4
以4-甲基吲哚、苯甲酰氨基丙二酸二乙酯为原料,按照4-甲基吲哚:苯甲酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂DMSO用量为3mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3ad。
3ad:白色固体,mp 231-232℃.1H NMR(300MHz,CDCl3)δ8.89(br,1H),7.81(d,J=7.0Hz,2H),7.49(tt,J=7.4Hz,1.3Hz,1H),7.37-7.45(m,4H),7.18(d,J=8.0Hz,1H),7.04(t,J=7.2Hz,1H),6.87(d,J=7.1Hz,1H),4.22-4.43(m,4H),2.59(s,3H),1.24(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ168.9,166.3,137.4,134.0,131.9,128.8,128.7,127.20,127.16,124.0,122.5,122.1,110.20,110.16,67.1,63.0,21.9,14.0.
实施例5
以5-氯吲哚、苯甲酰氨基丙二酸二乙酯为原料,按照5-氯吲哚:苯甲酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂乙醇用量为4mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3ae。
3ae:黄色固体,mp 204-205℃.1H NMR(300MHz,CDCl3)δ8.80(br,1H),8.10(s,1H),7.87(d,J=7.0Hz,2H),7.62(s,1H),7.55(tt,J=7.3Hz,1.3Hz,1H),7.42-7.51(m,3H),6.87(d,J=1.2Hz,2H),4.20-4.41(m,4H),1.25(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ167.6,166.4,135.1,133.3,132.3,128.9,127.5,127.3,125.8,125.1,121.7,119.8,112.9,108.1,65.5,63.2,14.1.
实施例6
以5-溴吲哚、苯甲酰氨基丙二酸二乙酯为原料,按照5-溴吲哚:苯甲酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂乙醇用量为2mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3af。
3af:粉红色固体,mp 200-201℃.1H NMR(300MHz,CDCl3)δ8.67(s,br,1H),8.09(s,1H),7.87(d,J=7.0Hz,2H),7.80(d,J=1.8Hz,1H),7.51-7.58(m,2H),7.46(t,J=7.3Hz,2H),7.06(dd,J=8.7Hz,1.8Hz,1H),6.92(d,J=8.6Hz,1H),4.21-4.42(m,4H),1.27(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ167.6,166.4,135.3,133.3,132.3,129.0,127.4,127.3,126.5,124.3,122.9,113.3,112.9,108.1,65.5,63.2,14.1.
实施例7
以5-氰基吲哚、苯甲酰氨基丙二酸二乙酯为原料,按照吲哚:苯甲酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂乙醇用量为2mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3ag。
3ag:白色固体,mp 173-174℃.1H NMR(300MHz,CDCl3)δ9.27(s,br,1H),8.17(s,1H),8.0(s,1H),7.87(d,J=7.1Hz,2H),7.59(tt,J=7.3Hz,1.2Hz,1H),7.48(t,J=7.8Hz,2H),7.30-7.36(m,1H),6.99(dd,J=8.5Hz,1.5Hz,1H),6.77-6.84(m,1H),4.23-4.42(m,4H),1.26(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ167.4,166.7,138.5,132.8,132.7,129.1,128.5,127.2,126.6,124.5,124.0,121.2,112.7,109.1,102.2,65.4,63.4,14.1.
实施例8
以5-硝基吲哚、苯甲酰氨基丙二酸二乙酯为原料,按照吲哚:苯甲酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂DMSO用量为3mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3ah。
3ah:黄色固体,mp 181-182℃.1H NMR(300MHz,CDCl3)δ9.29(s,1H),8.70(d,J=2.2Hz,1H),8.19(s,1H),7.90(d,J=7.1Hz,2H),7.65(dd,J=9.0Hz,2.3Hz,1H),7.60(tt,J=7.4Hz,1.3Hz,1H),7.49(t,J=7.5Hz,2H),7.38(d,J=2.7Hz,1H),6.80(d,J=9.0Hz,1H),4.25-4.44(m,4H),1.29(t,J=7.1Hz,6H);13CNMR(75MHz,CDCl3)δ167.4,166.9,141.4,139.7,132.9,132.7,129.4,129.2,127.3,124.1,118.3,116.9,111.7,110.7,65.5,63.5,14.1.
实施例9
以吲哚-2-羧酸乙酯、苯甲酰氨基丙二酸二乙酯为原料,按照吲哚-2-羧酸乙酯:苯甲酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂乙腈用量为2mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3ai。
3ai:白色固体,mp 176-177℃.1H NMR(300MHz,CDCl3)δ9.24(s,br,NH),9.17(s,br,NH),7.91(d,J=6.9Hz,2H),7.80(d,J=8.4Hz,1H),7.48(tt,J=7.4Hz,1.3Hz,1H),7.37-7.45(m,2H),7.06-7.25(m,3H),4.23-4.44(m,6H),1.31(t,J=7.1Hz,3H),1.23(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ167.8,166.9,161.7,135.2,134.4,131.7,128.5,127.6,126.9,125.6,123.6,123.1,121.0,118.3,112.1,66.7,63.0,61.8,14.3,14.0.
实施例10
以N-甲基吲哚、苯甲酰氨基丙二酸二乙酯为原料,按照吲哚:苯甲酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂DMSO用量为3mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3aj。
3aj:白色固体,mp 139-140℃.1H NMR(300MHz,CDCl3)δ8.07(s,1H),7.84(d,J=6.8Hz,2H),7.78(s,1H),7.66(d,J=8.0Hz,1H),7.51(tt,J=7.4Hz,1.3Hz,1H),7.43(t,J=7.5Hz,2H),7.26-7.31(m,1H),7.19(td,J=7.0Hz,1.0Hz,1H),7.08(ddd,J=8.2Hz,7.0Hz,1.3Hz,1H),4.21-4.42(m,4H),3.76(s,3H),1.24(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ167.7,165.6,136.9,133.5,131.9,130.5,128.6,127.2,125.7,121.5,119.9,119.5,109.6,108.0,65.0,62.9,33.0,14.0.
实施例11
以1,2-二甲基吲哚、苯甲酰氨基丙二酸二乙酯为原料,按照吲哚:苯甲酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂DMSO用量为3mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3ak。
3ak:白色固体,mp 117-118℃.1H NMR(300MHz,CDCl3)δ7.82(t,J=9.2Hz,3H),7.34-7.55(m,4H),7.24(d,J=7.0Hz,1H),7.13(t,J=7.0Hz,1H),7.04(dd,J=8.1Hz,1.1Hz,1H),4.22-4.43(m,4H),3.60(s,3H),2.51(s,3H),1.24(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ168.0,166.1,136.3,136.2,134.0,131.7,128.6,127.2,125.8,120.9,119.7,118.4,109.2,105.4,66.4,62.9,29.6,14.0,12.6.
实施例12
以吲哚、乙酰氨基丙二酸二乙酯为原料,按照吲哚:乙酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂乙腈用量为2mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3ba。
3ba:白色固体,mp 159-160℃.1H NMR(300MHz,CDCl3)δ8.75(br,1H),7.62(s,1H),7.30-7.45(m,2H),6.99-7.14(m,3H),4.13-4.36(m,4H),2.03(s,3H),1.20(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ169.2,167.8,136.5,126.2,125.0,121.6,119.9,119.5,111.9,108.9,65.3,62.8,23.1,14.0.
实施例13
以吲哚、丙烯酰氨基丙二酸二乙酯为原料,按照吲哚:丙烯酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂乙醇用量为2mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3ca。
3ca:白色固体,mp 170-171℃.1H NMR(300MHz,CDCl3)δ8.71(br,1H),7.55-7.62(m,1H),7.54(d,J=2.7Hz,1H),7.50(s,1H),7.09-7.18(m,1H),6.98-7.08(m,2H),6.17-6.34(m,2H),5.68(dd,J=9.1Hz,2.5Hz,1H),4.16-4.40(m,4H),1.22(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ167.7,164.2,136.4,130.1,127.8,126.4,125.0,121.7,119.8,119.6,111.8,108.9,65.2,63.0,14.0.
实施例14
以吲哚、苯乙酰氨基丙二酸二乙酯为原料,按照吲哚:苯乙酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂DMSO用量为3mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3da。
3da:淡红色固体,mp 137-138℃.1H NMR(300MHz,CDCl3)δ8.71(s,1H),7.39-7.42(m,3H),7.21-7.36(m,5H),6.93-7.05(m,3H),4.07-4.31(m,4H),3.58(s,2H),1.14(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ169.9,167.5,136.3,134.5,129.5,129.0,127.4,126.1,124.8,121.5,119.8,119.4,111.9,108.7,65.1,62.8,43.5,13.9.
实施例15
以吲哚、氯乙酰氨基丙二酸二乙酯为原料,按照吲哚:氯乙酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂DMSO用量为3mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3ea。
3ea:黄色固体,mp 137-138℃.1H NMR(300MHz,CDCl3)δ8.56(br,1H),8.43(s,1H),7.62(t,J=4.6Hz,1H),7.52(d,J=2.8Hz,1H),7.03-7.16(m,3H),4.18-4.38(m,4H),4.03(s,2H),1.22(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ167.2,165.0,136.3,126.2,124.9,121.9,119.9,119.8,111.9,108.4,65.2,63.1,42.3,14.0.
实施例16
以吲哚、糠酰氨基丙二酸二乙酯为原料,按照吲哚:糠酰氨基丙二酸二乙酯:醋酸铜摩尔比为1:1.25:2.5,溶剂乙醇用量为2mL,在N2保护条件下加热至80℃,TLC检测反应进行,原料全部反应完全后,通过柱层析得到纯净产物3fa。
3fa:白色固体,mp 169-170℃.1H NMR(300MHz,CDCl3)δ8.76(s,br,1H),8.20(s,1H),7.62-7.68(m,1H),7.58(d,J=2.7Hz,1H),7.48(d,J=1.0Hz,1H),7.11-7.18(m,1H),7.07(dd,J=3.5Hz,0.6Hz,1H),6.98-7.05(m,2H),6.47(q,J=1.7Hz,1H),4.19-4.39(m,4H),1.22(t,J=7.1Hz,6H);13C NMR(75MHz,CDCl3)δ167.6,157.0,147.4,144.6,136.4,126.3,125.0,121.7,119.8,119.7,115.1,112.3,111.8,109.0,65.0,63.0,14.0。
对比实施例1
以吲哚、氯乙酰氨基丙二酸二乙酯为原料,按照吲哚:氯乙酰氨基丙二酸二乙酯:mCPBA摩尔比为1:1.25:2.5,溶剂乙醇用量为2mL,在N2保护条件下加热至80℃,TLC检测反应进行,得不到吲哚甘氨酸衍生物。
对比实施例2
以吲哚、糠酰氨基丙二酸二乙酯为原料,按照吲哚:糠酰氨基丙二酸二乙酯:mCPBA摩尔比为1:1.25:2.5,溶剂乙醇用量为2mL,在N2保护条件下加热至80℃,TLC检测反应进行,得不到吲哚甘氨酸衍生物。
对比实施例3
以吲哚、氯乙酰氨基丙二酸二乙酯为原料,按照吲哚:氯乙酰氨基丙二酸二乙酯:FeCl3摩尔比为1:1.25:2.5,溶剂乙醇用量为2mL,在N2保护条件下加热至80℃,TLC检测反应进行,得不到吲哚甘氨酸衍生物。
对比实施例4
以吲哚、糠酰氨基丙二酸二乙酯为原料,按照吲哚:糠酰氨基丙二酸二乙酯:FeCl3摩尔比为1:1.25:2.5,溶剂乙醇用量为2mL,在N2保护条件下加热至80℃,TLC检测反应进行,得不到吲哚甘氨酸衍生物。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种利用甘氨酸-硝酸盐燃烧法合成Li<sub>3</sub>V<sub>2</sub>(PO<sub>4</sub>)<sub>3</sub>/C的方法
- 甘氨酸的测定方法与甘氨酸测定试剂盒--9010的制作方法
- 甘氨酸的测定方法与甘氨酸测定试剂盒-9058的制作方法
- 甘氨酸的管道造粒干燥法的制作方法
- 对羟基苯甘氨酸合成过程含酚废水的处理技术的制作方法
- L-(+)-右旋对羟基苯甘氨酸合成过程含酚废水的处理技术的制作方法
- Dl-对羟基苯甘氨酸合成母液含酚污水处理技术的制作方法
- 氯乙酸法甘氨酸废水处理及综合利用方法
- 双氢苯甘氨酸离心水洗液回收系统的制作方法
- 编码新型的具有d-丝氨酸合成活性的酶的dna、该酶的制备方法、及利用该酶的d-丝氨 ...的制作方法