一种产二十碳五烯酸的菌株及其应用的制作方法
本发明涉及微生物领域,特别涉及一种产二十碳五烯酸的菌株及其应用。
背景技术:
EPA(Eicosapentaenoic Acid,二十碳五烯酸)对于人类健康具有重要意义,研究表明它具有预防心血管疾病、抑制乳腺癌和结肠癌的生理功能。此外,在人体内可转化为前列腺素、血栓素和白三烯等类二十烷酸活性物质。目前EPA的商业来源主要是深海鱼油,但鱼油的生产受鱼类、季节和地点限制,加工成本高且具有鱼腥味,特别是海洋生态环境的污染和渔业资源的日益匮乏,使鱼油很难满足人们对EPA的需求。
微生物具有生长速度快、营养需求低、代谢调控简单等优势。许多微生物菌株可以合成其他高附加值的代谢产物,如角鲨烯、植物甾醇和虾青素等。其中,高附加值的代谢产物EPA和DHA(Docosahexaenoic Acid,二十二碳六烯酸)均属于ω-3系列多不饱和脂肪酸。目前,富含DHA的微生物,如破囊壶菌(Thraustochytrium)和裂殖壶菌(Schizochytrium)均已经被用于商业化大规模生产DHA,其代表公司如美国的马泰克(Martek)和中国的嘉必优(Cabio)。然而,还没有发现可用于商业化生产EPA的野生型高产菌株。
在实现本发明的过程中,发明人发现现有技术至少存在以下问题:
EPA是人体不可缺少的重要营养素。虽然人体摄入必需脂肪酸亚麻酸后可被转化为EPA或DHA,但此反应在人体中的速度很慢且转化率很低,远远不能满足人体对EPA的需求,尤其是婴幼儿和中老年人。由于目前还没有发现可用于商业化生产EPA的野生型高产菌株,故获得符合商业需求的产EPA的野生型高产菌株迫在眉睫。
技术实现要素:
为了解决现有技术中没有可用于商业化生产EPA的野生型高产菌株的问题,本发明实施例提供了一种产二十碳五烯酸的菌株及其应用。所述技术方案如下:
一方面,本发明实施例提供了一种产二十碳五烯酸的菌株,所述菌株包括:Nocardioides plantarum、Compostimonas suwonensis、Flavobacteriu momnivorum、和Shewanella baltica,其中Nocardioides plantarum于2016年3月9日保藏于中国典型培养物保藏中心,保藏编号为CCTCC M2016309,Compostimonas suwonensis于2016年6月6日保藏于中国典型培养物保藏中心,保藏编号为CCTCC M2016311,Flavobacteriu momnivorum于2016年6月6日保藏于中国典型培养物保藏中心,保藏编号为CCTCC M2016310,Shewanella baltica于2016年6月6日保藏于中国典型培养物保藏中心,保藏编号为CCTCC M2016312。
具体地,所述保藏编号为CCTCC M2016309的菌株16Sr DNA序列如序列表中SEQ IN NO:1所示,所述保藏编号为CCTCC M2016311的菌株16Sr DNA序列如序列表中SEQ IN NO:2所示,所述保藏编号为CCTCC M2016310的菌株16Sr DNA序列如序列表中SEQ IN NO:3所示,所述保藏编号为CCTCC M2016312的菌株16Sr DNA序列如序列表中SEQ IN NO:4所示。
另一方面,本发明实施例提供了一种上述菌株在产二十碳五烯酸中的应用,所述应用包括以下步骤:
对所述菌株进行活化,活化条件为:0-15℃,摇床转速为180±10rpm;对活化后的所述菌株进行发酵,发酵条件为:0-15℃,摇床转速为180±10rpm。
具体地,采用液体培养基进行所述菌株的活化和发酵,所述液体培养基包括:酵母提取物、蛋白胨、酪蛋白水解物、葡萄糖、可溶性淀粉、丙酮酸钠、磷酸氢二钾、七水硫酸镁和水,其中,酵母提取物、蛋白胨、酪蛋白水解物、葡萄糖和可溶性淀粉的质量比为1:1:1:1:1,酵母提取物、丙酮酸钠、磷酸氢二钾、七水硫酸镁和水的质量比为5:3:3:180,酵母提取物与水的质量比为1:2000,所述液体培养基的pH值为7.3±0.2。
进一步地,所述液体培养基还包括3μg/mL的浅蓝菌素。
具体地,取活化后的所述菌株按照体积比为1%的接种量进行发酵。
进一步地,所述液体培养基经过121℃灭菌20min。
具体地,所述菌株的活化条件为:10℃。
具体地,所述菌株的发酵条件为:10℃。
具体地,所述菌株活化和发酵时摇床转速均为180rpm。
本发明实施例提供的技术方案带来的有益效果是:本发明实施例提供了一种产二十碳五烯酸的菌株及其应用,该四株产二十碳五烯酸的菌株均为野生型菌株,能够满足人体对EPA的需要,这四种野生型高产菌株丰富了微生物合成EPA的资源库,并可用于商业化生产,同时为PKS途径的研究提供材料,为高产ω-3VLCPUFAs工程菌株的构建奠定基础,此外,该应用方法可进一步提高菌株产二十碳五烯酸的能力,从而通过该菌株获得更多的二十碳五烯酸。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1是本发明实施例提供的菌株6-42的脂肪酸组分的百分比含量与EPA甲酯标品对比图;
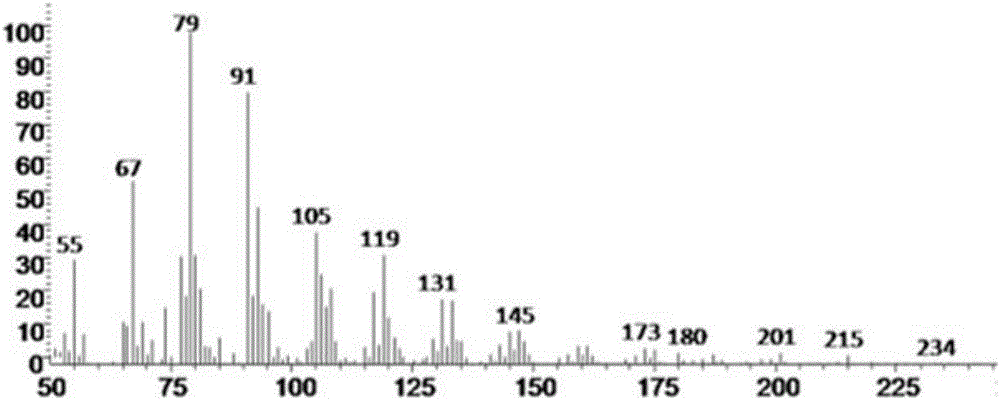
图2是本发明实施例提供的菌株6-42的气相色谱图;
图3是本发明实施例提供的EPA甲酯标品的气相色谱图;
图4是本发明实施例提供的琼脂糖凝胶电泳图。
本发明实施例提供的四种菌株均于2016年6月6日送往中国典型培养物保藏中心进行保藏,保藏地址:中国湖北省武汉市珞珈山武汉大学,四种菌株分类命名分别为:Nocardioides plantarum、Compostimona ssuwonensis、Flavobact eriu momnivorum和Shewanella baltica;保藏编号分别为:CCTCC M2016309、CCTCC M2016311、CCTCC M2016310和CCTCC M2016312。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明实施方式作进一步地详细描述。
实施例
本发明实施例提供了一种菌株在产二十碳五烯酸中的应用,该应用包括以下步骤:活化和发酵,菌株的活化条件为:0-15℃,摇床转速为180±10rpm;菌株的发酵条件为:0-15℃,摇床转速为180±10rpm。
本实施例选取6批菌株,6批菌株均由中国典型培养物保藏中心(China center for type culture collection,CCTCC)提供,6批菌株均采自挪威斯瓦尔巴群岛新奥尔松地区(Ny-Alesund,Svalbard Archipelago,Norway)。其中,第一批和第二批均采自该地区的冰川前端土壤,地理坐标分别为(78°54’N,12°06’E&78°53’N,12°10’E);第三批采自该地区的苔原冻土带土壤,位于(78°53’N,12°09’E);第四批和第五批均采自该地区的Stuphallet悬崖断层,分别位于(78°57.575’N,11°36.288’E&78°57.521’N,11°36.447’E);第六批采自该地区的MidtreLovenbreen冰川前端溶出区域,位于(78°53.704’N,12°5.262’E)。
活化:将培养在斜面培养基上的菌株接种到液体培养基(用于活化菌株)上进行活化,得到原始菌株,斜面培养基上的菌株来源于挪威斯瓦尔巴群岛新奥尔松地区提取的土壤样品中,具体地,挑取斜面培养基上保存的菌株接种至含有3ml新鲜的液体培养基的无菌具塞试管内,置于0-15℃转速为180±10rpm的摇床上进行活化。在本实施例中,活化的培养温度可以为10℃,转速可以为180rpm。
其中,采用液体培养基进行菌株的活化和发酵,液体培养基包括:酵母提取物、蛋白胨、酪蛋白水解物、葡萄糖、可溶性淀粉、丙酮酸钠、磷酸氢二钾、七水硫酸镁和水,其中,酵母提取物、蛋白胨、酪蛋白水解物、葡萄糖和可溶性淀粉的质量比为1:1:1:1:1,酵母提取物、丙酮酸钠、磷酸氢二钾、七水硫酸镁和水的质量比为5:3:3:180,酵母提取物与水的质量比为1:2000,液体培养基的pH值为7.3±0.2。具体地,在本实施例中,液体培养基具体包括:酵母提取物0.5g,蛋白胨0.5g,酪蛋白水解物0.5g,葡萄糖0.5g,可溶性淀粉0.5g,丙酮酸钠0.3g,磷酸氢二钾0.3g,七水硫酸镁0.049g,水1L,pH值为7.3±0.2,121℃灭菌20min。
此外,液体培养基还可以包括3μg/mL的浅蓝菌素(由美国Sigma-Aldrich公司提供)。3μg/mL的浅蓝菌素通过将浅蓝菌素溶解于无水乙醇中获得,置于-20℃保存。
发酵:将原始菌株接种至液体培养基上培养(用于发酵)至菌株生长到对数生长期,得到菌液。具体地,将活化好的菌液(原始菌株)按照1%(V/V)接种量转接至含100mL新鲜液体培养基的250mL摇瓶内。培养温度为0-15℃,转速为180±10rpm。在本实施例中,发酵的培养温度可以为10℃,转速可以为180rpm。
菌株筛选
将菌液经过脂肪酸组分测定,获得产二十碳五烯酸的菌株。具体方法包括:在与脂肪酸组分测定条件相同的情况下,以EPA(Eicosapentaenoic Acid,二十碳五烯酸)甲酯标品(购置于瑞典Larodan公司)作为对照,根据EPA甲酯标品在脂肪酸气相色谱上的出峰时间挑选出可能产EPA的菌株,再对可能产EPA的菌株进行气相色谱-质谱联用分析,根据EPA甲酯标品的质谱图判断该菌液中的菌体是否产EPA,当EPA甲酯标品的质谱图与菌液的质谱图相同时,则判断该菌液中的菌株产EPA。
脂肪酸组分测定:
将菌液真空干燥后研磨制成菌体干粉,将菌体干粉置于玻璃瓶内,向玻璃瓶内加入盐酸甲醇溶液和二十一烷酸并进行漩涡振荡,密封玻璃瓶并置于80℃水浴2h,冷却至室温后向玻璃瓶内加入氯化钠水溶液和正己烷并进行漩涡振荡,静置后取上清液,将上清液离心,获得含有甲酯化脂肪酸的上清液,将含有甲酯化脂肪酸的上清液用氮气吹干后加入硅烷化试剂,硅烷化试剂的体积与含有甲酯化脂肪酸的上清液的体积相等,于90℃反应1h,冷却至室温后可直接用于气相色谱分析。
本实施例采用安捷伦7890A气相色谱仪,氢离子火焰化检测器(Flame Ionization Detector,FID);HP-FFAP(30m×0.25mm×0.25m)色谱柱;载气为高纯氮气,进样口压力为25psi,进样量1L,分流比30:1;升温程序:初始温度150℃保持1min,然后以5℃/min升温至230℃并保持8min,进样口和检测器温度分别保持在250℃和280℃。采用面积归一法计算脂肪酸的相对百分含量。GC-MS(气相色谱-质谱联用)采用相同的仪器、分离柱和分离条件,质谱型号为安捷伦5975C。
本实施例采用上述方法共获得了四株产EPA的菌株,如表1所示,该四株菌株分别编号为1-1、2-37、2-42和6-42,其中,四株菌株16Sr DNA序列分别如序列表中SEQ IN NO:1、序列表中SEQ IN NO:2、序列表中SEQ IN NO:3和序列表中SEQ IN NO:4所示。其中,菌株6-42的脂肪酸组分的百分比含量如图1所示,菌株6-42的气相色谱图如图2所示,EPA甲酯标品的气相色谱图如3所示,由于菌株6-42的气相色谱和EPA甲酯标品的气相色谱的出峰时间,则认为菌株6-42产EPA,其他三株同理判断。
表1为产EPA的四株菌株
由表1可知,四株菌株1-1、2-37、2-42和6-42测定的EPA占总脂肪酸百分比依次为1.1%、2.3%、0.9%和4.9%。
菌株的分类地位
本实施例采用16S rDNA序列分析来鉴定所筛选的菌株的分类地位。
鉴定:提取原始菌株的总DNA,具体地,取活化后的菌株种子液(原始菌株)接种至新鲜的液体培养基内,置于10℃摇床180rpm培养。按照细菌基因组提取试剂盒(Minibest Bacterial Genomic DNA Extraction Kit,日本Takara公司)使用说明来提取菌液的总DNA。取3μL提取的总DNA进行琼脂糖凝胶电泳检测,剩余总DNA样品置于-20℃保存。
以总DNA为模版进行PCR扩增反应,得到扩增产物;具体地,反应体系为50μL,具体的反应体系和反应程序如表2所示:
表2为PCR扩增反应体系
其中,正向引物序列如表SEQ IN NO:5所示,反向引物序列如表SEQ IN NO:6所示。
表3为PCR扩增反应程序
反应程序参照Phusion High-Fidelity DNA Polymerase使用说明书。取3μL扩增产物按照表3所示的PCR扩增反应程序进行琼脂糖凝胶电泳检测。
将扩增产物进行回收,得到16S rDNA片段;待PCR扩增产物的琼脂糖凝胶电泳检测正确后,使用纯化回收试剂盒(Minibest DNA Fragment purification Kit,日本Takara公司)回收PCR扩增产物,具体操作步骤参照使用说明书。
将16S rDNA片段连接到质粒上,得到连接产物;采用PCR平末端克隆试剂盒(Zero Blunt PCR Cloning Kit,美国Life公司)将回收的16S rDNA片段连接到Top 0质粒(购置于美国Life公司)上。反应体系为6μL,具体如表4所示:
表4为连接体系的成分
将配置好的连接体系置于室温下连接10min,连接后反应液可直接用于转化实验。
将连接产物转入大肠杆菌感受态细胞内,离心后去除部分上清液并进行重悬,得到重悬液,将重悬液涂布在卡那霉素固体培养基上;具体方法如下:
(1)将-70℃保存的DH5α感受态细胞置于冰上溶解,将6μL连接反应液加入溶解后的感受态细胞内,轻轻混匀后冰上静置30min,得到混合产物;
(2)将混合产物加入离心管内置于42℃水浴锅中热击60s,注意操作过程中动作轻柔;
(3)热击完成后将离心管静置于冰上2min,随后加入500μL新鲜卡那霉素固体培养基(LB固体培养基),37℃恒温摇床中振荡培养1h;其中,卡那霉素固体培养基包括:酵母提取物、蛋白胨、氯化钠和琼脂,其中,酵母提取物、蛋白胨、氯化钠和琼脂的质量比为5:10:10:18,卡那霉素固体培养基的pH值为7.0。在本实施例中,酵母提取物5g,蛋白胨10g,氯化钠10g,琼脂18g,pH值为7.0,121℃灭菌20min,用于大肠杆菌的培养。
(4)将离心管取出于4000rpm离心1min,去除部分上清液后进行重悬,得到重悬液,将重悬液涂布于50μg/mL的LB固体平板培养基上,随后置于37℃恒温培养箱过夜培养。通过重悬的方式浓缩感受态细胞。
挑取LB固体平板培养基(其组分与LB固体培养基组分相同)上的单菌落进行菌落PCR检测,以M13F/M13R为引物(M13F的序列如表SEQ IN NO:7所示,M13R的序列如表SEQ IN NO:8所示),采用Taq酶进行PCR反应,反应体系及条件参照说明书。随后取3μL的PCR反应液用于琼脂糖凝胶电泳,检测目的条带大小是否正确,结果如图4所示,在图4中,M为DNA maker,1、2、3、4分别代表菌株1-1、2-37、2-42和6-42,其中,四个菌株的16S rDNA扩增产物大小均约为1.5Kb,可见本实施例提供的四种菌株的条带大小正确。
挑取阳性克隆进行测序(武汉擎科创新生物科技有限公司),确定测序结果的一致性后将获得的16S rDNA序列在NCBI(National Center of Biotechnology Information,美国国家生物技术信息中心)数据库上进行BLAST(Basic Local Alignment Search Tool,基本局部比对搜索工具)同源性比对,四个菌株分别和Nocardioidesplantarum、Compostimonassuwonensis、Flavobacteriumomnivorum和Shewanellabaltica同源性较高,从而认定四株菌株分别属于Nocardioidesplantarum、Compostimonassuwonensis、Flavobacteriumomnivorum和Shewanellabaltica,进而确定了四株菌株的分类地位。
温度对菌株
本发明实施例提供了温度对菌株6-42的影响,将活化的温度和培养至对数生长期的温度同时设置为0℃、5℃、10℃、15℃和20℃,其他培养条件相同,将所获得的产二十碳五烯酸的菌株分别进行脂肪酸组分测定,测定结果如表5所示:
表5为温度对菌株6-42产EPA含量的影响
注:表5中数据用mean±SD(n=3)表示;下同。
由表5可知,随着温度的降低EPA占总脂肪酸的百分比由20℃时的3.4%逐步升高到0℃时的8.8%,相应的菌体干重由2.2mg/g升到6.2mg/g。同时由于温度的降低其生物量也随之由初始的0.5g/L降到0.3g/L,可见EPA的产量(单位体积培养基含量)在10℃时最高达2.2mg/L,因此,本实施例将活化的温度和培养至对数生长期的温度均设置为10℃,从而提高四种菌体产EPA的能力。
进一步分析其脂肪酸各组分的变化,如表5所示。
表6为温度对菌株6-42的脂肪酸组分的影响
由表6可知,随着温度的降低直链饱和脂肪酸中短链脂肪酸C12:0和C14:0含量增加,中长链脂肪酸C16:0、C17:0和C18:0含量减少,直链饱和脂肪酸总量先增后减。各支链饱和脂肪酸随着温度的降低变化规律不一,且变化幅度不大,支链饱和脂肪酸总量先减后增。综合直链和支链饱和脂肪酸的含量变化,结果显示饱和脂肪酸总量随着温度的降低而减少。单不饱和脂肪酸C16:1含量随着温度降低而增加而C18:1变化趋势相反,总量变化趋势不明显;多不饱和脂肪酸EPA含量随着温度的降低呈现增长趋势。整体来看,随着温度的降低,不饱和脂肪酸总量增加而饱和脂肪酸总量减少。
浅蓝菌素对菌株的影响
本发明实施例中的液体培养基可以包括浅蓝菌素,浅蓝菌素的加入量分别设置为0、1、2、3、4、5μg/mL各浓度在10℃下进行摇瓶发酵。各浓度下EPA的产量如表7所示。
表7为浅蓝菌素对EPA的影响
由表7可知,浅蓝菌素处理后菌株产EPA的量均有所提高,其中浅蓝菌素浓度为3μg/mL时达到最大,EPA占总脂肪酸百分比、菌体干重和单位体积培养基含量分别达到7.6%、4.5mg/g和3.6mg/L。对比10℃时静置和振荡两种培养条件,可以看出静置时EPA占总脂肪酸百分比和菌体干重较高,但振荡培养生物量较高因此EPA单位体积培养基产量高于静置培养,因此,本实施例中的液体培养基中的浅蓝菌素为3μg/mL。
进一步分析浅蓝菌素对脂肪酸各组分的变化,如表8所示。
表8为浅蓝菌素对菌株6-42的脂肪酸组分的影响
由表8可以看出当加入浅蓝菌素后,碳链长度在15碳及其以下的直链饱和脂肪酸含量增加而15碳以上含量减少,支链饱和脂肪酸中C13:0含量增加而C15:0和C17:0含量减少,直链和支链饱和脂肪酸总量均增加但后者变化较小。羟基脂肪酸整体变化不大,而单不饱和脂肪酸含量均减少,相反EPA含量先增后减。整体来说,浅蓝菌素使菌株6-42的短链脂肪酸含量增加,单不饱和脂肪酸含量减少,羟基脂肪酸含量不变而EPA含量增加。
同时,结合温度与浅蓝菌素对菌株6-42进行综合实验,在0℃和10℃下分别加入3μg/mL的浅蓝菌素来培养菌体6-42。其结果如表9所示。
表9为温度和浅蓝菌素对菌株6-42产EPA含量的影响
注:表9中*表示振荡培养,其它为静置培养。
由表9可以看出0℃下加入3μg/mL的浅蓝菌素静置培养,EPA占总脂肪酸百分比和菌体干重含量达到最大,分别为11.5%和6.7mg/g,相比10℃振荡培养(不添加浅蓝菌素)的条件下分别提高到2.3和2.2倍;在10℃下加入3μg/mL的浅蓝菌素振荡培养,单位体积培养基中EPA含量最高,达到3.6mg/L,其EPA产量相比于0℃静置培养(不添加浅蓝菌素)增加到1.8倍。
本发明实施例提供了一种从极端环境筛选、鉴定、优化产二十碳五烯酸的细菌菌株及其应用,该四株产二十碳五烯酸的菌株均为野生型产生菌株,其中两株为首次发现能够合成EPA。这四种野生型产生菌株丰富了微生物合成EPA的菌株和基因资源库,并有潜力用于商业化生产,同时为PKS途径的研究提供材料,为高产ω-3VLCPUFAs工程菌株的构建奠定基础,此外,该应用方法可进一步提高菌株产二十碳五烯酸的能力,从而通过该菌株获得更多的二十碳五烯酸。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!