一种酶法水解制备大豆苷元的方法与流程
本发明涉及大豆提取物制备方法,具体涉及酶法水解制备大豆异黄酮苷元的方法,更具体是一种酶法水解制备大豆苷元的方法。
背景技术:
大豆异黄酮是黄酮类化合物,是大豆生长中形成的一类次级代谢产物,是一种生物活性物质。由于是从植物中提取,与雌激素有相似结构,因此大豆异黄酮又称植物雌激素,在延缓女性衰老、改善更年期症状、骨质疏松等方面展现出良好的药理活性。
迄今为止,从大豆中共分离出12种大豆异黄酮异构体,分为游离型苷元和结合型糖苷两类,其中苷元占总量2%-3%,包括染料木素、大豆苷元和黄豆黄素三种。结合型糖苷由三种苷元衍生而成,占总量97%-98%,主要以染料木苷、大豆苷和6-O-丙二酰基染料木苷等九种形式存在。研究发现,糖苷形式的大豆异黄酮不能直接被小肠壁吸收,必须经水解去除糖基转化为游离性的苷元才可被小肠吸收,因而大豆异黄酮的药理活性主要来源于苷元。但是由于大豆中苷元的含量极少,这使得大豆异黄酮苷的水解极具研究价值,如何高效地将糖苷型大豆异黄酮转换成生物活性更高的游离性苷元形式成为该领域的研究热点。
大豆苷(Daidzin),分子式C21H20O9,结构式:
大豆苷元(Daidzein),分子式C15H10O4,结构式:
目前,对于大豆苷的水解方法很多,如酸碱催化水解法、乙酰解法、smith降解等,但这些方法都存在着很明显的各种弊端:酸水解通常采用浓盐酸、硫酸作为催化剂,但强酸条件下水解的同时大豆异黄酮苷元的稳定性受到很大影响,且不利于工业化生产,安全性问题也有待提高;糖苷键的缩醛结构使其对碱较为稳定,但是异黄酮糖苷键具有酯苷的性质,可以采用碱水解,但是碱催化产物的苷元容易发生降解。酶专一性很强,酶水解条件温和,多采用弱酸性缓冲溶液,得到的大豆异黄酮苷元稳定性好、纯度高,但是由于酶的生产成本较高,且缓冲液中底物溶解度较低,因此期望能寻找到一类新型溶剂使得反应更加高效,成本更加低廉。
技术实现要素:
本发明的目的在于针对大豆苷元制备工艺的现有技术中存在的缺陷,提供一种简单廉价、高效环保的酶法水解制备大豆苷元的方法。
本发明采用新型绿色溶剂—低共熔溶剂(DES)与传统缓冲液组成混合反应体系,以β-D葡萄糖苷酶催化水解大豆苷制备高纯度大豆苷元,工艺操作简单,过程绿色且成本低廉。
本发明提供的一种酶法水解制备大豆苷元的方法,包括如下步骤:
(1)将氢键供体化合物和氢键受体化合物按摩尔比1:0.5-3均匀混合,在80-100℃加热搅拌至形成均一透明液体,P2O5干燥两周,制得DES;所述的氢键受体化合物为季铵盐或两性离子化合物,氢键供体化合物为多元醇。
(2)以pH 4.0-7.0缓冲液配制体积含量10-40%的DES水溶液,将大豆苷提取物超声溶解于DES溶液中,使其浓度达到0.5-1.0mg/mL,再按0.25-1.25U/mL加入45℃预先孵育的β-D葡萄糖苷酶,搅拌至混合均匀;将上述体系加热至40-70℃,保温、搅拌30-150min,取少量反应液置于90℃高温灭活,HPLC测定底物实际水解率;
(3)向上述体系中继续加入适量大豆苷提取物,重复5-10次,使反应平衡不断向右进行;结束后将反应体系置于低温条件,大豆苷元析出,过滤,沉淀物以去离子水冲洗,冷冻干燥即得产品。
所述步骤(1)中的季铵盐优选为氯化胆碱,多元醇优选为乙二醇或甘油。
所述步骤(2)中,缓冲液为乙酸-乙酸盐缓冲液、柠檬酸-磷酸盐缓冲液、柠檬酸-柠檬酸盐缓冲液中的任一种,优选为0.1M pH5.8柠檬酸-磷酸氢二钠缓冲液。
所述步骤(2)中,反应温度优选为50℃。
所述步骤(2)中,混合反应体系中DES的体积含量优选为30%。
所述步骤(2)中,所述反应体系中,β-D葡萄糖苷酶用量优选为1.0U/mL。
与现有技术相比本发明的技术优势:
本发明采用的低共熔溶剂(DES)是一类廉价易得、原子经济,可循环使用的新型绿色溶剂,具有低挥发性、无毒性、可设计性以及生物降解性高等优点,在β-D葡萄糖苷酶催化水解大豆苷反应中,DES对于糖苷底物的溶解度明显高于缓冲液,保持了酶的较高催化活性且稳定性显著提高,这些关键因素保障了水解反应的高效率。
相较于传统水解方法,本发明制备方法突破了产物不稳定,过程复杂,食用安全性低以及污染严重等缺点瓶颈,且产物提纯更加容易,体系可重复多次利用。在最佳工艺条件下,底物大豆苷水解率达97.5%,平行试验三次,RSD为0.62%,过程高效简便且重复性良好。
附图说明
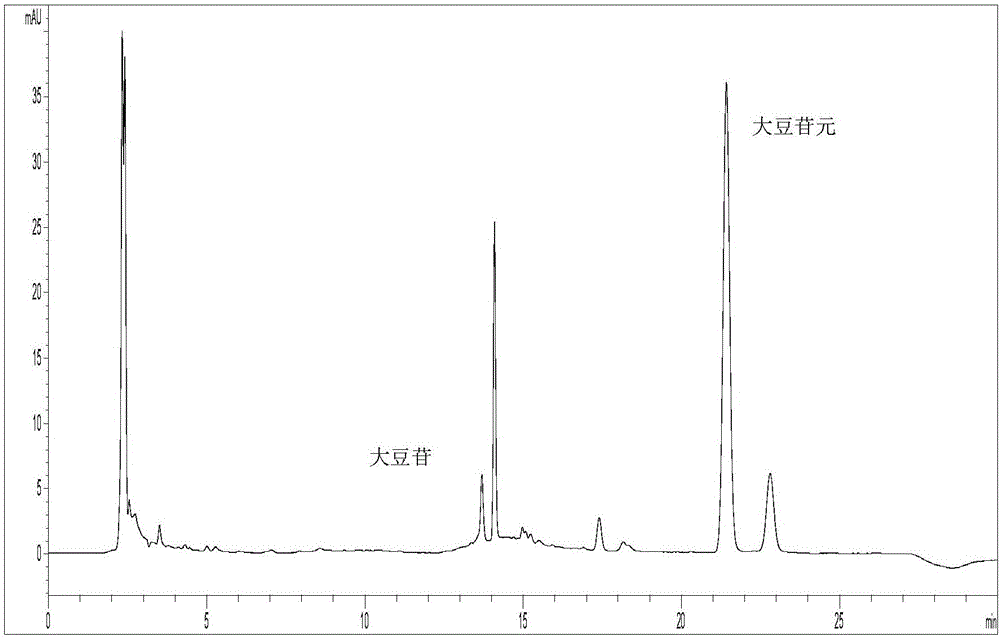
图1实施例1步骤(2)产物HPLC图谱
图2实施例2步骤(2)产物HPLC图谱
图3实施例1步骤(3)产物HPLC图谱
具体实施方式
为更好地理解本发明,下面结合实施例对本发明作进一步地说明,本发明要求保护的范围并不局限于实施例表述的范围。
以下实施例中所述的大豆苷提取物购自上海一基实业有限公司,经测定其纯度65%。
实施例1
A.准确称取27.93g氯化胆碱,量取5.56mL乙二醇,混合加入500mL圆底烧瓶中,加热搅拌,温度为80-100℃,转速为300rpm。反应10h后,形成均一透明液体,制得约30mL目标DES,P2O5干燥两周。
B.准确称取100mg 65%的大豆苷提取物超声充分溶解于60mL DES中,再依次加入45℃预先孵育的140mL pH 5.8柠檬酸-磷酸氢二钠缓冲液,250Uβ-D葡萄糖苷酶,搅拌使混合均匀。将上述体系加热至50℃,保温、搅拌反应120min,反应结束后,取少量反应液经HPLC测定大豆苷转化率达97.5%。
C.每隔2h向上述体系中继续加入100mg大豆苷提取物,重复5次,使反应平衡不断向右进行;结束后将反应体系置于低温条件,大豆苷元析出,过滤,沉淀物以去离子水冲洗,冷冻干燥得大豆苷元粗品0.3g,经HPLC检测纯度为68.5%。
实施例2
A.准确称取27.93g氯化胆碱,量取7.28mL甘油,混合加入500mL圆底烧瓶中,加热搅拌,温度为80-100℃,转速为300rpm。反应10h后,形成均一透明液体,制得约30mL目标DES,P2O5干燥两周。
B.准确称取100mg 65%的大豆苷提取物超声充分溶解于40mL DES中,再依次加入45℃预先孵育的160mL pH 5.8柠檬酸-磷酸氢二钠缓冲液,200Uβ-D葡萄糖苷酶,搅拌使混合均匀。将上述体系加热至55℃,保温、搅拌反应120min,反应结束后,取少量反应液经HPLC测定大豆苷转化率达96.5%。
C.每隔2h向上述体系中继续加入100mg大豆苷提取物,重复5次,使反应平衡不断向右进行;结束后将反应体系置于低温条件,大豆苷元析出,过滤,沉淀物以去离子水冲洗,冷冻干燥得大豆苷元粗品0.26g,经HPLC检测纯度为66.3%。
实施例3
A.准确称取27.93g氯化胆碱,量取29.12mL甘油,混合加入500mL圆底烧瓶中,加热搅拌,温度为80-100℃,转速为300rpm。反应10h后,形成均一透明液体,制得约50mL目标DES,P2O5干燥两周。
B.准确称取100mg 65%的大豆苷提取物超声充分溶解于40mL DES中,再依次加入45℃预先孵育的160mL pH 5.8柠檬酸-磷酸氢二钠缓冲液,150Uβ-D葡萄糖苷酶,搅拌使混合均匀。将上述体系加热至45℃,保温、搅拌反应120min,反应结束后,HPLC测定大豆苷转化率达95.8%。
C.每隔2h向上述体系中继续加入100mg大豆苷提取物,重复5次,使反应平衡不断向右进行;结束后将反应体系置于低温条件,大豆苷元析出,过滤,沉淀物以去离子水冲洗,冷冻干燥得大豆苷元粗品0.28g,经HPLC检测纯度为65.8%。
实施例4
A.准确称取27.93g氯化胆碱,量取22.24mL乙二醇,混合加入500mL圆底烧瓶中,加热搅拌,温度为80-100℃,转速为300rpm。反应10h后,形成均一透明液体,制得约50mL目标DES,P2O5干燥两周。
B.准确称取100mg 65%的大豆苷提取物超声充分溶解于80mL DES中,再依次45℃预先孵育的120mL pH 5.8柠檬酸-磷酸氢二钠缓冲液,250Uβ-D葡萄糖苷酶,搅拌使混合均匀。将上述体系加热至50℃,保温、搅拌反应120min,反应结束后,HPLC测定大豆苷转化率达94.9%。
C.每隔2h向上述体系中继续加入100mg大豆苷提取物,重复5次,使反应平衡不断向右进行;结束后将反应体系置于低温条件,大豆苷元析出,过滤,沉淀物以去离子水冲洗,冷冻干燥得大豆苷元粗品0.32g,经HPLC检测纯度为67.4%。
- 还没有人留言评论。精彩留言会获得点赞!