一种加速5‑氨基戊酸生物法生产的方法与流程
本发明涉及一种生物法生产5-氨基戊酸的方法,尤其涉及一种通过在工程菌中共表达赖氨酸专一性透性酶基因lysP和4-氨基丁酸转运蛋白基因pp2911,提高工程菌催化L-赖氨酸加速生产5-氨基戊酸的方法。
背景技术:
5-氨基戊酸是一种重要的C5类平台化合物,在药物和化工合成领域具有重要的应用价值。它可以用于生产1,5-戊二醇、戊二酸、5-羟基戊酸等一系列化合物【1】,也可以作为原料通过自身聚合或者和其他氨基酸类化合物聚合生成包括尼龙-5和尼龙5,5在内的多种聚酰胺(尼龙)类材料。
文献【1】和【2】分别报道了采用工程改造的大肠杆菌以葡萄糖为碳源发酵生产5-氨基戊酸,但是产量非常低。目前,L-赖氨酸的年产量达到220万吨。由于L-赖氨酸的产能过剩而导致其价格下降【3】,这使得以L-赖氨酸作为原料“绿色生产”5-氨基戊酸具备了经济可行性。已有研究者进行了催化L-赖氨酸生产5-氨基戊酸的研究,主要包括游离酶催化法和全细胞催化法。文献【4】实现了采用固定化的L-赖氨酸α-氧化酶催化L-赖氨酸生产5-氨基戊酸。文献【5】通过采用纯化的L-赖氨酸-2-单加氧酶(DavB)和δ-氨基戊酰胺水解酶(DavA),实现了游离酶催化L-赖氨酸生成5-氨基戊酸。文献【6】报道了共表达L-赖氨酸-2-单加氧酶基因davB和δ-氨基戊酰胺水解酶基因davA的工程改造大肠杆菌W3110,通过不断流加L-赖氨酸、葡萄糖和MgSO4混合液的方法实现了全细胞催化L-赖氨酸生产5-氨基戊酸。
相对于游离酶催化,全细胞催化剂由于有细胞膜的保护而更加稳定,因而也更具有工业应用价值。但是,细胞膜也会阻碍底物和酶的接触,从而减缓了催化速率;另一方面,催化产物的积累也会对酶的催化作用产生抑制。因此,通过过表达转运蛋白提高5-氨基戊酸的生产效率在工业生产应用中意义重大。
经检索,通过过表达转运蛋白实现加速5-氨基戊酸生物法生产的方法尚未有报道。
参考文献:
【1】Park,S.J.et al.Metabolic engineering of Escherichia coli for the production of 5-aminovalerate and glutarate as C5platform chemicals.Metab.Eng.16,42–47(2013).
【2】Adkins,J.,Jordan,J.&Nielsen,D.R.Engineering Escherichia coli for renewable production of the 5-carbon polyamide building-blocks 5-aminovalerate and glutarate.Biotechnol.Bioeng.110,1726–1734(2013).
【3】Eggeling,L.&Bott,M.A giant market and a powerful metabolism:L-lysine provided by Corynebacterium glutamicum.Appl.Microbiol.Biotechnol.99,3387–3394(2015).
【4】Pukin,A.V.,Boeriu,C.G.,Scott,E.L.,Sanders,J.P.&Franssen,M.C.An efficient enzymatic synthesis of 5-aminovaleric acid.J.Mol.Catal.B:Enzym.65,58–62(2010).
【5】Liu,P.et al.Enzymatic production of 5-aminovalerate from L-lysine using L-lysine monooxygenase and 5-aminovaleramide amidohydrolase.Sci.Rep.4,5657(2014).
【6】Park,S.J.et al.High-level conversion of L-lysine into 5-aminovalerate that can be used for nylon 6,5synthesis.Biotechnol.J.9,1322–1328(2014).
技术实现要素:
针对现有技术中全细胞催化5-氨基戊酸生产过程中由于底物和产物的转运受阻而导致的产量和得率低的不足,本发明要解决的问题是提供一种通过在工程菌中共表达赖氨酸专一性透性酶基因lysP和4-氨基丁酸转运蛋白基因pp2911,提高工程菌加速催化L-赖氨酸生产5-氨基戊酸的方法。
本发明所述加速5-氨基戊酸生物法生产的方法,步骤是:
(1)构建共表达赖氨酸专一性透性酶基因lysP和4-氨基丁酸转运蛋白基因pp2911的基因工程大肠杆菌,以其作为全细胞催化剂用于转化生产5-氨基戊酸;
(2)全细胞催化剂的培养和收集;
(3)利用生物催化剂转化制备含5-氨基戊酸的转化液;
其特征在于:
步骤(1)所述的基因工程大肠杆菌命名为大肠杆菌(Escherichia coli)BL21/pETDuet-DavAB-LysP/pACYCDuet-PP2911,该菌含有的4-氨基丁酸转运蛋白基因pp2911的核苷酸序列如SEQ ID NO.1所示,含有的赖氨酸专一性透性酶基因lysP的核苷酸序列如SEQ ID NO.2所示,含有L-赖氨酸-2-单加氧酶的基因davB和δ-氨基戊酰胺水解酶基因davA的核苷酸片段davAB的核苷酸序列如SEQ ID NO.3所示;其构建方法如下:
(a)从恶臭假单胞菌(Pseudomonas putida)KT2440基因组中通过PCR方法扩增获得含有L-赖氨酸-2-单加氧酶基因davB和δ-氨基戊酰胺水解酶基因davA的核苷酸片段davAB,并将davAB连接到质粒pETDuet-1的多克隆位点1(MCS1)上,构建重组质粒pETDuet-DavAB;
(b)从大肠杆菌K12(MG1655)基因组中通过PCR方法扩增获得赖氨酸专一性透性酶基因lysP,并将lysP连接到步骤(a)构建的质粒pETDuet-DavAB的多克隆位点2(MCS2)上,获得重组质粒pETDuet-DavAB-LysP;
(c)从恶臭假单胞菌KT2440基因组中通过PCR方法扩增获得4-氨基丁酸转运蛋白基因pp2911,并将pp2911连接到质粒pACYCDuet-1的多克隆位点1(MCS1)上,获得重组质粒pACYCDuet-PP2911;
(d)将步骤(b)构建的质粒pETDuet-DavAB-LysP和步骤(c)构建的质粒pACYCDuet-PP2911都转化导入到宿主大肠杆菌BL21(DE3)中,筛选获得基因工程大肠杆菌BL21/pETDuet-DavAB-LysP/pACYCDuet-PP2911;
步骤(2)所述全细胞催化剂的培养和收集方法是:
在无菌条件下,将基因工程大肠杆菌BL21/pETDuet-DavAB-LysP/pACYCDuet-PP2911菌液接种到含有100μg/mL的氨苄青霉素和40μg/mL的氯霉素的LB液体培养基中,37±1℃培养2~4小时使其OD600nm=0.6~0.8,然后加入终浓度为1mM的IPTG,25℃诱导10~12小时;其中所述LB培养基配方是:蛋白胨10g/L;酵母粉5g/L;NaCl 10g/L,pH 7.0;115℃灭菌20分钟;
将培养得到的培养物以6,000±500转/分钟离心8~10分钟,收集菌体并用pH 7.4、1/15M的磷酸盐缓冲液洗涤菌体2~3遍,然后将菌体置于4℃的冰箱中冷冻保存,即获得全细胞催化剂;
步骤(3)所述利用生物催化剂转化制备含5-氨基戊酸的转化液的方法是:
以细胞浓度为OD600nm=15~75的全细胞催化剂,在20~50℃、pH 7.0条件下转化浓度为10~60g/L的L-赖氨酸,经120±10转/分钟振荡反应24~48小时后,得到含5-氨基戊酸的转化液。
将制得的转化液,以13,000±500转/分钟离心10~15分钟,去除所加入的生物催化剂,使用PITC衍生后高效液相色谱分析测定转化产物中L-赖氨酸和5-氨基戊酸的浓度。
上述转化产物的检测方法:
PITC衍生:将样品煮沸10min,14680转/分钟离心15min;取400μL样品上清、200μL PITC-乙腈溶液(0.1mol/L)和200μL三乙胺-乙腈溶液(1mol/L)混匀,室温静置衍生1h;然后加入800μL正己烷,涡旋振荡1min,静置萃取10min;用1mL注射器吸取下层溶液,0.22μm滤膜过滤后进行HPLC检测分析。
HPLC检测:所用高效液相色谱仪的型号是Agilent 1100Hewlett-Packard,配备UV-Vis检测器,检测波长为254nm。色谱柱为ZORBAX SB-C18(5μm,4.6mm×150mm),柱温38℃。检测时间为40min,流动相A:0.1mol/L pH 6.5的乙酸铵-乙腈(v/v,97:3)溶液,B:乙腈。流速0.6mL/min,进样量10μL。线性梯度洗脱:0~20min内流动相A的比例由82%降至70%,在随后的20min维持70%。
上述加速5-氨基戊酸生物法生产的方法中:步骤(3)所述全细胞催化剂的细胞浓度优选为OD600nm=60。
上述加速5-氨基戊酸生物法生产的方法中:步骤(3)所述转化底物L-赖氨酸的浓度优选为40g/L。
上述加速5-氨基戊酸生物法生产的方法中:步骤(3)所述转化条件优选是:30℃、pH 7.0条件,120转/分钟振荡反应48小时。
本发明公开了一种加速5-氨基戊酸生物法生产的方法,该方法是通过构建工程菌并在该菌中过表达赖氨酸专一性透性酶基因lysP和4-氨基丁酸转运蛋白基因pp2911,提高工程菌催化L-赖氨酸生产5-氨基戊酸的生产速率和得率。从L-赖氨酸生物法生产5-氨基戊酸是通过在大肠杆菌中共表达L-赖氨酸-2-单加氧酶基因davB和δ-氨基戊酰胺水解酶基因davA实现的。该方法涉及的催化机理如图1所示。
本发明方法具有如下显著特点:
(1)通过使用基因工程大肠杆菌BL21/pETDuet-DavAB-LysP/pACYCDuet-PP2911作为生物催化剂催化L-赖氨酸生物法生产5-氨基戊酸,其中通过共表达L-赖氨酸2-单加氧酶基因davB和δ-氨基戊酰胺水解酶基因davA使得工程菌具备了催化L-赖氨酸生物法生产5-氨基戊酸的能力。
(2)通过过表达4-氨基丁酸转运蛋白基因pp2911,提高基因工程菌对催化产物5-氨基戊酸的转运能力,降低由于5-氨基戊酸的积累而导致的催化速率和得率的下降。
(3)构建的工程菌株中赖氨酸专一性透性酶基因lysP和4-氨基丁酸转运蛋白基因pp2911负责底物和产物跨膜定向转运,提高5-氨基戊酸的生产速率和得率。
(4)相比只表达L-赖氨酸-2-单加氧酶基因davB和δ-氨基戊酰胺水解酶基因davA的重组菌,过表达4-氨基丁酸转运蛋白基因pp2911和赖氨酸专一性透性酶基因lysP使得工程菌中5-氨基戊酸的产量提高了67.3%,转化率达到0.94mol/mol。
(5)利用本发明构建的生物催化剂催化L-赖氨酸生产5-氨基戊酸,产物分离纯化操作简单,耗费较低。
附图说明
图1:利用基因工程大肠杆菌BL21/pETDuet-DavAB-LysP/pACYCDuet-PP2911催化L-赖氨酸生产5-氨基戊酸作用机理示意图。
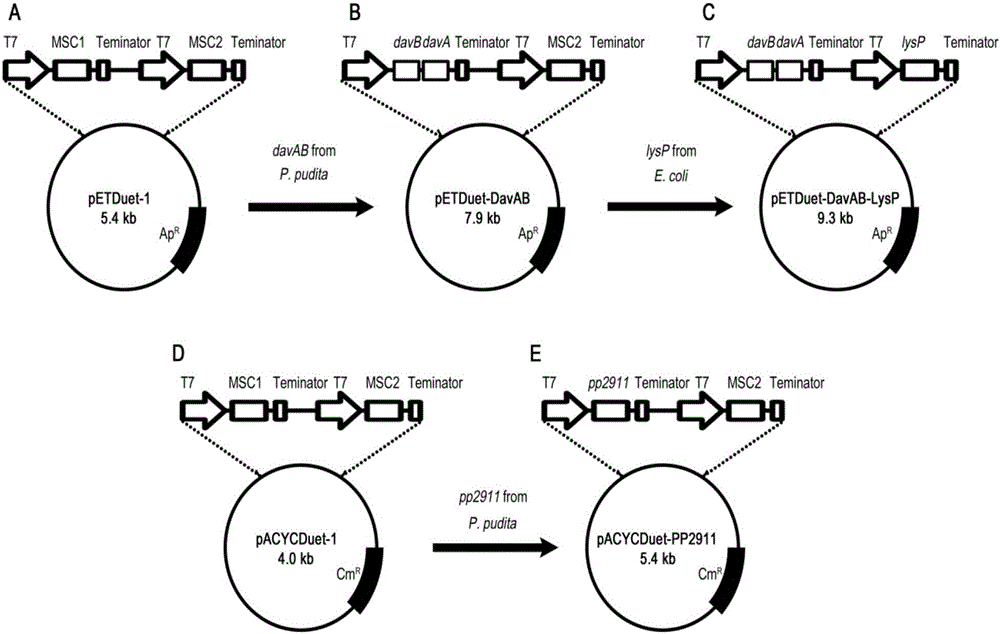
图2:基因工程大肠杆菌BL21/pETDuet-DavAB-LysP/pACYCDuet-PP2911构建过程中涉及的质粒构建过程示意图。
其中:A,pETDuet-1;B,pETDuet-DavAB;C,pETDuet-DavAB-LysP;D,pACYCDuet-1;E,pACYCDuet-PP2911。
图3:重组大肠杆菌BL21/pETDuet-DavAB-LysP/pACYCDuet-PP2911催化L-赖氨酸生产5-氨基戊酸过程曲线。
图4:3株重组大肠杆菌催化L-赖氨酸消耗和5-氨基戊酸生产过程曲线。
具体实施方式
本发明实施例中所采用的恶臭假单胞菌KT2440购自美国ATCC生物资源中心,菌株编号为:ATCC 47054;所采用的大肠杆菌K12(MG1655)购自美国ATCC生物资源中心,菌种编号为:ATCC 700926。本发明中所采用的蛋白表达宿主大肠杆菌BL21(DE3)购买于美国Novagen公司。
本发明实施例中所采用的质粒pETDuet-1和pACYCDuet-1购买于美国Novagen公司,所采用的pEASY-Blunt载体购买于北京全式金生物技术有限公司。
LB培养基配方是:蛋白胨10g/L;酵母粉5g/L;NaCl 10g/L,pH 7.0;115℃灭菌20分钟。
实施例1:共表达4-氨基丁酸转运蛋白基因pp2911和赖氨酸专一性透性酶基因lysP的5-氨基戊酸生产菌株的构建
(1)基因davAB的克隆:采用常规的方法制备菌株恶臭假单胞菌KT2440的基因组DNA,该过程参考科学出版社出版的《精编分子生物学指南》中基因组的小量制备的方法。使用合成的引物从恶臭假单胞菌KT2440的基因组DNA中PCR扩增获得基因davAB;
恶臭假单胞菌KT2440作为davAB基因的来源菌,根据已测序的该菌的基因组序列,设计引物,引入能插入质粒pETDute-1多克隆位点1(MCS1)的BamHI和HindIII限制性酶切位点,其中所述引物序列如下:
上游引物:5’-GGATCCGATGAACAAGAAGAACCGCCAC-3’,携带一个BamHI位点;
下游引物:5’-AAGCTTTCAGCCTTTACGCAGGTG-3’,携带一个HindIII位点。
将步骤(1)PCR扩增获得的片段和pETDuet-1质粒经BamHI、HindIII双酶切,回收片段davAB和pETDuet-1,使用T4DNA连接酶连接,获得重组质粒pETDuet-DavAB。质粒构建过程如图2所示。
(2)基因lysP的克隆:采用步骤(1)公开的方法制备大肠杆菌K12(MG1655)的基因组DNA,使用合成的引物从该基因组中PCR扩增获得赖氨酸专一性透性酶基因lysP;
大肠杆菌K12(MG1655)作为lysP基因的来源菌,根据已测序的该菌基因组序列,设计引物,引入能够插入到pETDuet-DavAB(步骤1)多克隆位点2(MCS2)的NdeI、KpnI限制性酶切位点,其中所述引物序列如下:
上游引物5’-CATATGATGGTTTCCGAAACTAAAAC-3’,携带一个NdeI位点;
下游引物5’-GGTACCTTATTTCTTATCGTTCTGCGG-3’,携带一个KpnI位点。
将步骤(2)PCR扩增获得的片段和pEASY-Blunt载体连接获得重组质粒pEASY-Blunt-LysP。将质粒pEASY-Blunt-LysP和pETDuet-DavAB使用NdeI和KpnI双酶切,回收片段lysP和pETDuet-DavAB,连接,得到重组质粒pETDuet-DavAB-LysP。质粒构建过程如图2所示。
(3)基因pp2911的克隆:采用步骤(1)中公开的方法制备恶臭假单胞菌KT2440的基因组DNA,使用合成的引物PCR扩增获得4-氨基丁酸转运蛋白基因pp2911;
引物设计时,引入能够插入到质粒pACYCDuet-1的BamHI和HindIII限制性酶切位点,其中所述引物序列如下:
上游引物5’-GGATCCGATGCAAACCCACAAGAACAAT-3’,携带一个BamHI位点;
下游引物5’-AAGCTTTCAGGCGCCCTGCCCTA-3’,携带一个HindIII位点。
将上述PCR扩增片段和pACYCDuet-1使用BamHI、HindIII双酶切,回收片段pp2911和pACYCDuet-1,连接,获得重组质粒pACYCDuet-PP2911。质粒构建过程如图2所示。
(4)将步骤(3)构建的质粒pACYCDuet-PP2911转化导入到宿主大肠杆菌BL21(DE3)中,采用含有40μg/mL氯霉素的LB培养基筛选获得重组大肠杆菌BL21/pACYCDuet-PP2911;将步骤(2)构建的质粒pETDuet-DavAB-LysP转化导入到宿主大肠杆菌BL21/pACYCDuet-PP2911中,采用含有100μg/mL的氨苄青霉素和40μg/mL的氯霉素的LB培养基筛选获得基因工程大肠杆菌,该菌命名为大肠杆菌BL21/pETDuet-DavAB-LysP/pACYCDuet-PP2911。其中,所述菌中含有的4-氨基丁酸转运蛋白基因pp2911的基因序列长度为1392个碱基,其核苷酸序列如SEQ ID NO.1所示;赖氨酸专一性透性酶基因lysP的基因序列长度为1470个碱基,其核苷酸序列如SEQ ID NO.2所示;含有L-赖氨酸-2-单加氧酶的基因davB和δ-氨基戊酰胺水解酶基因davA的核酸序列davAB长度为2492个碱基,其核苷酸序列如SEQ ID NO.3所示。
上述获得的基因工程大肠杆菌BL21/pETDuet-DavAB-LysP/pACYCDuet-PP2911为革兰氏阴性菌,需氧或兼性厌氧生长,较佳的培养温度为37±1℃,可以在含有100μg/mL的氨苄青霉素和40μg/mL的氯霉素的LB培养基中生长。
实施例2:全细胞催化剂的制备
(1)平板培养:将大肠杆菌BL21/pETDuet-DavAB-LysP/pACYCDuet-PP2911划线到含有质量体积比为1.5~1.8%琼脂并含有100μg/mL氨苄青霉素和40μg/mL氯霉素的LB平板上,37℃培养12小时;
(2)一级种子:在无菌的条件下,用无菌的牙签挑取步骤(1)平板上的一个单菌落,然后接种到5mL含有100μg/mL氨苄青霉素和40μg/mL氯霉素的的LB液体培养基中,37℃摇床振荡培养12小时;
(3)二级种子:在无菌条件下,取步骤(2)所培养的菌液以体积比为1%的接种量,接种到100mL的含有100μg/mL氨苄青霉素和40μg/mL氯霉素的LB液体培养基中,37℃摇床振荡培养12小时;
(4)摇瓶培养:在无菌条件下,取步骤(3)所得的菌液以体积比为20%的接种量接种到1L的含有100μg/mL氨苄青霉素和40μg/mL氯霉素的LB液体培养基中,37℃培养约2小时使其OD600nm=0.6~0.8,加入终浓度为1mM的IPTG,25℃诱导10~12小时;
(5)收集菌体:将步骤(4)培养得到的培养物以6,000±500转/分钟离心10分钟;并用pH 7.4、1/15M的磷酸盐缓冲液洗涤菌体2~3遍,然后将菌体置于4℃的冰箱中冷冻保存,即获得全细胞催化剂,待用。
实施例3:利用实施例2得到的生物催化剂制备5-氨基戊酸
转化实验:以细胞浓度为OD600nm=60的全细胞催化剂,在30℃、pH 7.0条件下转化浓度为40g/L的L-赖氨酸,经120转/分钟振荡反应48小时后,得到含5-氨基戊酸的转化液。
反应结束时收集转化液,以13,000±500转/分种离心10~15分钟,去除所加入的生物催化剂,上清采用PITC法衍生,测定转化液中L-赖氨酸和5-氨基戊酸的浓度。
转化结果如图3所示:最终消耗L-赖氨酸38.6g/L,产生5-氨基戊酸29.6g/L,转化率达到0.96mol/mol。
实施例4:验证4-氨基丁酸转运蛋白PP2911和赖氨酸专一性透性酶LysP在加速5-氨基戊酸生物法生产中的作用
将实施例1步骤(1)中构建的质粒pETDuet-DavAB转化导入大肠杆菌BL21(DE3)中获得重组菌株大肠杆菌BL21/pETDuet-DavAB;将实施例1步骤(3)中构建的质粒pACYCDuet-PP2911转化导入到大肠杆菌BL21/pETDuet-DavAB中获得重组菌株大肠杆菌BL21/pETDuet-DavAB/pACYCDuet-PP2911。
以实施例2公开的方法分别制备大肠杆菌BL21/pETDuet-DavAB、大肠杆菌BL21/pETDuet-DavAB/pACYCDuet-PP2911和大肠杆菌BL21/pETDuet-DavAB-LysP/pACYCDuet-PP2911作为生物催化剂。其中在培养大肠杆菌BL21/pETDuet-DavAB时采用LB培养基添加100μg/mL的氨苄青霉素。
分别使用上述制得的生物催化剂,其中催化剂的细胞浓度为OD600nm=30,在30℃,pH 7.0条件下转化浓度为20g/L的L-赖氨酸;经120转/分钟振荡反应24小时后,得到含5-氨基戊酸的转化液。
反应结束时收集转化液,以13,000±500转/分钟离心10~15分钟,去除所加入的生物催化剂,上清采用PITC法衍生,测定转化液中L-赖氨酸和5-氨基戊酸的浓度。
转化结果如表1所示。
表1:过表达转运蛋白对5-氨基戊酸生产及得率影响
结果显示:与只表达L-赖氨酸2-单加氧酶DavB和δ-氨基戊酰胺水解酶DavA的重组菌株相比,过表达4-氨基丁酸转运蛋白PP2911的工程菌株的5-氨基戊酸产量提升60.4%,转化率由0.86mol/mol升高到0.90mol/mol。采用共表达赖氨酸专一性透性酶基因lysP和4-氨基丁酸转运蛋白基因pp2911的工程菌株大肠杆菌BL21/pETDuet-DavAB-LysP/pACYCDuet-PP2911,使得5-氨基戊酸的产量、生产速率、得率都有进一步的提高。
3株重组菌催化L-赖氨酸生产5-氨基戊酸过程曲线如图4所示。
- 还没有人留言评论。精彩留言会获得点赞!