一种α‑L‑鼠李糖苷酶基因的克隆、表达及应用的制作方法
本发明涉及基因工程和酶工程的技术领域,尤其涉及一种α-L-鼠李糖苷酶基因的克隆、表达及应用。
背景技术:
α-L-鼠李糖苷酶(α-L-rhamnosidase)是一种能特异性水解许多物质末端的L-鼠李糖的糖苷水解酶,例如黄酮类、多糖、类固醇和糖脂等。在一些动物和植物组织、真菌以及细菌中可以产生α-L-鼠李糖苷酶。α-L-鼠李糖苷酶在食品、药物领域有重要的应用价值。主要的功能作用在于:
(1)脱苦作用:柑橘类果汁中过多的苦味物质如柚皮苷,阻碍了其市场发展,为了减少果汁中的柚皮苷含量以提高果汁口感,人们将α-L-鼠李糖苷酶作用于黄酮类苦味物质,使其脱去末端的L-鼠李糖,从而大大降低苦味,改进果汁品质。
(2)生物转化:α-L-鼠李糖苷酶还可以应用在黄酮类物质的转化,将黄酮类物质中的鼠李糖苷水解,从而便捷高效的获得应用价值更高转化产物,如用α-L-鼠李糖苷酶转化柚皮苷制备普鲁宁、转化芦丁制备异槲皮苷。
(3)增加果酒的芳香:酒中含有一些芳香类物质的前体单萜如香叶醇、橙花醇等,以带二糖苷的形式存在,包括鼠李糖等,因此在葡萄酒酿造业中加入α-L-鼠李糖苷酶,将这些前体物质中的糖基水解下来,成为具有香气的物质,具有显著增香的效果。
由于α-L-鼠李糖苷酶具有良好的应用前景,对于该酶的研究受到越来越多的关注。但是,直接通过原始菌株发酵生产α-L-鼠李糖苷酶,不仅产量不高,而且发酵液中常常存在分子量大小与α-L-鼠李糖苷酶类似的β-D-葡萄糖苷酶,使得α-L-鼠李糖苷酶的分离纯化更加困难和昂贵。本发明人研究和设计了一种α-L-鼠李糖苷酶基因的克隆、表达及应用,本案由此产生。
技术实现要素:
本发明针对现有技术的不足,提供一种来源于塔宾曲霉中α-L-鼠李糖苷酶基因的克隆和表达及应用。
为了实现上述目的,本发明解决其技术问题所采取的技术方案是:
一种编码α-L-鼠李糖苷酶的基因,其核苷酸序列如SEQ ID NO.1所示,该序列全长2667bp。
一种由所述α-L-鼠李糖苷酶基因编码的α-L-鼠李糖苷酶,其氨基酸序列如SEQ ID NO.2所示,该序列全长888个氨基酸。
一种含有SEQ ID NO.1所示α-L-鼠李糖苷酶基因的表达载体。
作为实施例的优选方式,所述表达载体为pPIC9k表达载体。
一种含有所述α-L-鼠李糖苷酶基因或含有所述表达载体的基因工程菌。
作为实施例的优选方式,所述基因工程菌为生产α-L-鼠李糖苷酶的毕赤酵母GS115。
一种所述表达载体的制备方法,包括以下步骤:
步骤一、按照真菌鼠李糖苷酶的同源性设计简并引物P1(SEQ ID NO.3)和P2(SEQ ID NO.4),以黑曲霉菌株(Aspergillus niger)的mRNA反转录的cDNA为模板,以P1和P2为引物进行PCR扩增,得到α-L-鼠李糖苷酶的基因的PCR扩增产物,所述引物为:
P1:5’-CGTCTGCCTGGACGGCSCNAARMGNGA-3’;
P2:5’-CTATAGTCGACGGCTTATT-3’;
步骤二、将步骤一所得PCR扩增产物与pMD-18T克隆载体在16℃下过夜连接;将连接产物转化大肠杆菌DH5α感受态细胞,菌落PCR筛选阳性克隆,进行序列分析;挑选序列正确的克隆提取质粒,获得含有α-L-鼠李糖苷酶基因的重组质粒pMD-18T-Rha;
步骤三、通过对鼠李糖苷酶Rha全序列分析,设计引物P3(SEQ ID NO.5)和P4(SEQ ID NO.6);
P3:5’-GAGACCCTAGGATGGCAGCGTTGGAGGA-3’,下划线表示AvrII酶切位点;
P4:5’-ATAGTTTAGCGGCCGCTCAACCTCTGACGGCA-3’,下划线表示NotI酶切位点;
以P3和P4为引物,以步骤二中所得的重组质粒为模板进行PCR,并将扩增产物回收与pPIC9k表达载体酶切,分别用Avr II和Not I酶切,并分别割胶回收,16℃过夜连接;将连接产物转化大肠杆菌DH5α感受态细胞,筛选阳性克隆,测序,获得含有α-L-鼠李糖苷酶基因的重组质粒pPIC9k-Rha。
一种编码α-L-鼠李糖苷酶的基因的真核表达方法,包括以下步骤:
步骤一:将所述表达载体,经Sal I线性化后,采用电转化法将其导入毕赤酵母GS115中,筛选出阳性克隆进行诱导表达;
步骤二:将含有重组表达载体的毕赤酵母GS115接种在YPD培养基中进行活化,转入BMGY培养基中继续活化,收集OD600为2.0-3.0的菌体,转入到BMMY培养基中,置于30℃,200rpm摇床进行α-L-鼠李糖苷酶的诱导表达;每隔24h按照体积比0.5%向培养基中补加无菌甲醇;同时将含有空白载体pPIC9K的菌株作为空白对照;通过SDS-PAGE分析,判断有无特异性条带出现。
一种所述基因工程菌所制备的α-L-鼠李糖苷酶在食品医药行业的应用,包括以下应用领域:1)柑橘类果汁脱苦;2)制备普鲁宁;3)制备鼠李糖;4)增加果汁、果酒的芳香味;5)去除橙子果汁中橙皮苷晶体;6)制备糖苷抗生素。
本发明有益效果如下:
本发明首次克隆并重组表达了塔宾曲霉中的α-L-鼠李糖苷酶的基因,重组酶Rha具有良好的底物特异性,该酶在酶用量为,pH4.0,60℃的条件下水解300μg/ml的柚皮苷20min,水解效率高达89.3%。本发明提供了新的α-L-鼠李糖苷酶基因来源,并可在短时间内获得大量的且不含其他酶活性的α-L-鼠李糖苷酶,降低了α-L-鼠李糖苷酶的生产成本。
附图说明
图1为本发明重组α-L-鼠李糖苷酶电泳图:A图中泳道1为粗酶液、泳道2为阴离子交换层析结果、泳道3为疏水层析结果、泳道4为凝胶层析结果;B图中泳道1、2均为N-糖苷酶处理结果;M为蛋白分子标准;
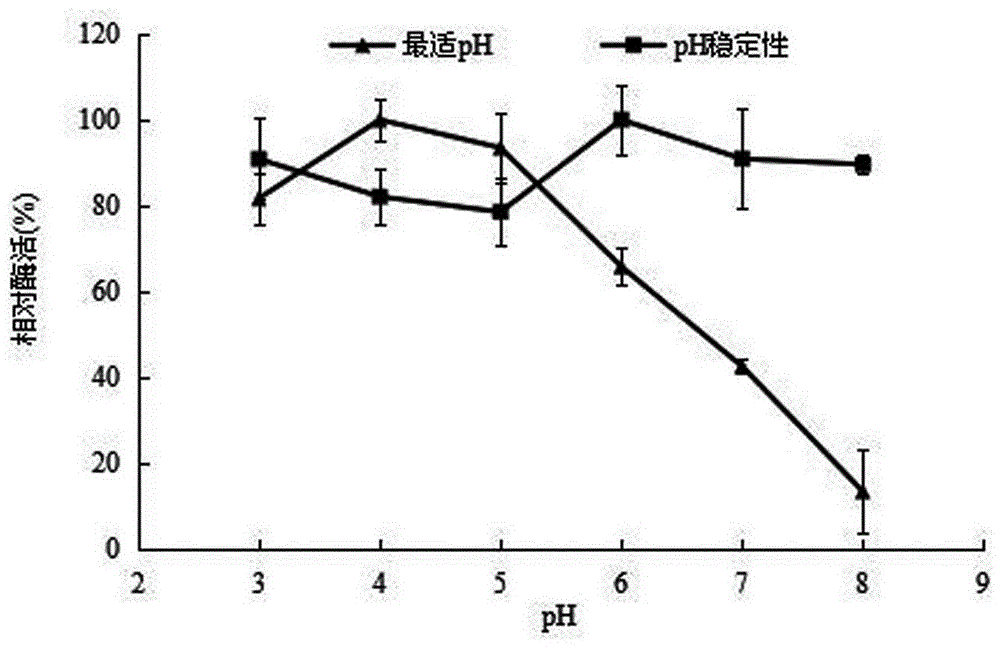
图2为本发明重组α-L-鼠李糖苷酶的最适pH和pH稳定性曲线图;
图3为本发明重组α-L-鼠李糖苷酶的最适温度和温度稳定性曲线图;
图4为本发明重组α-L-鼠李糖苷酶的底物动力学曲线。
具体实施方式
以下结合附图和具体实施方式以对本发明作进一步说明。
实施例一、基因的克隆表达
1.主要试剂
DNA聚合酶、T4DNA连接酶、DNA marker、克隆载体pMD-18T、限制性内切酶(Bln Ⅰ和Not Ⅰ)、感受态细胞制备试剂盒均购自Takara公司;PCR产物回收试剂盒、胶回收试剂盒、质粒快速提取试剂盒等购自上海生工;RNA提取试剂盒、cDNA逆转录试剂盒购自北京全式金。RCR引物由北京六合华大基因公司合成;IPTG、氨苄青霉素、十二烷基硫酸钠(SDS)购自上海生工;其它常规试剂均为化学分析纯。
2.质粒和菌株
塔宾曲霉、大肠杆菌DH5α、毕赤酵母GS115和pPIC9K均为常规生物材料。
3.方法
3.1塔宾曲霉接种于活化培养基上,28℃培养2天,转接于产酶发酵培养液,28℃培养2天,常温离心收集菌体。从此菌体中获得总RNA,逆转录成cDNA,通过P1、P2引物进行扩增,PCR反应条件:94℃预变性4min,94℃变性1min,56℃退火1min,72℃延伸1min,35个循环,72℃后延伸10min。通过1.0%琼脂糖凝胶电泳检测PCR扩增的产物,并进行割胶回收,标记为Rha1。
所述引物为:
P1:5’-CGTCTGCCTGGACGGCSCNAARMGNGA-3’;
P2:5’-CTATAGTCGACGGCTTATT-3’。
3.2将上述步骤3.1所得的扩增产物连接于pMD-18T克隆载体,导入大肠杆菌DH5α,挑取阳性克隆,测序。获得含有α-L-鼠李糖苷酶的重组质粒pMD-18T-Rha1。
3.3表达载体的构建
以提取的克隆载体为模板,用P3和P4引物进行PCR扩增,PCR扩增条件为:94℃预变性4min,94℃变性1min,58℃退火1min,72℃延伸1.5min,35个循环,72℃后延伸10min。将回收产物酶切连接到pPIC9K表达载体上,将连接产物导入DH5α感受态细胞,用氨苄青霉素的抗性平板和菌落PCR挑选阳性克隆,提取质粒测序。获得含有α-L-鼠李糖苷酶基因的重组质粒pPIC9K-Rha。
所述引物为:
P3:5’-GAGACCCTAGGATGGCAGCGTTGGAGGA-3’,下划线表示AvrII酶切位点;
P4:5’-ATAGTTTAGCGGCCGCTCAACCTCTGACGGCA-3’,下划线表示NotI酶切位点;
3.4α-L-鼠李糖苷酶的诱导表达
提取测序结果正确的上述阳性克隆质粒,Sal Ⅰ线性化后,电转入毕赤酵母GS115感受态细胞,转化液涂布MD筛选平板,20℃培养2-3天,挑选生长良好的单菌落在2mg/ml的YPD平板上筛选,然后采用菌落PCR的方法挑选阳性转化子。将挑选到的阳性克隆接种到BMGY培养基中,30℃培养至OD600达到2-6,3000rpm/min,4℃离心收集菌体,弃上清,用BMMY培养基重悬细胞,30℃甲醇诱导表达,每天补加甲醇至终浓度0.5%。同时将空白载体pPIC9k的菌株作为空白对照,并对表达产物进行SDS-PAGE分析,结果如图1所示。
实施例二、重组α-L-鼠李糖苷酶的酶学性质
2.1pH对重组α-L-鼠李糖苷酶的影响
在浓度为0.05mol/L的pH分别为3.0、4.0、5.0、6.0、7.0和8.0的Na2HPO4-C4H2O7的反应体系中测定酶活,以最高点酶活为100%,其余与之相比,由相对酶活对应pH作图,即得酶反应pH对酶活力影响图;将100μLα-L-鼠李糖苷酶与400μL上述不同pH缓冲液混合后在4℃放置24h测定剩余酶活力,以相对酶活对应pH作图,即得酶的pH稳定范围,结果如图2所示。
2.2温度对重组α-L-鼠李糖苷酶的影响
分别在30、40、50、60、70、80℃下测定酶活,以最高点酶活为100%,其余与之相比,由相对酶活对应温度作图,即得酶反应温度对酶活力影响图;将相同浓度的α-L-鼠李糖苷酶液在上述不同温度下保温1h后,测定不同温度下的酶活力,以相对酶活对应温度作图,即得酶的温度稳定范围,结果如图3所示。
2.3金属离子对重组α-L-鼠李糖苷酶的影响
将相同浓度的α-L-鼠李糖苷酶分别与终浓度为1mmol/L和10mmol/L的Na+、Ni+、K+、Ag+、Li+、Mn2+、Co2+、Fe2+、Mg2+、Pb2+、Hg2+、Ba2+、Zn2+、Ca2+、Cd2+、Al3+和Fe3+离子混匀,于30℃保温1h后测定剩余酶活,以未加金属离子的酶液为对照设酶活为100%,其余与之相比得相对酶活,结果如表1所示。
表1 金属离子对重组α-L-鼠李糖苷酶的影响
2.4重组α-L-鼠李糖苷酶的底物特异性
在标准反应体系下,α-L-鼠李糖苷酶分别与浓度为300μg/mL的pNPR、杨梅苷、芸香苷、柚皮苷和柴胡皂苷C反应,计算其转化率来研究α-L-鼠李糖苷酶的底物特异性,结果如表2所示。
表2 重组α-L-鼠李糖苷酶的底物特异性
2.5效应物和抑制剂对重组α-L-鼠李糖苷酶的影响
将同一重组α-L-鼠李糖苷酶等量分装后,与终浓度为1mM及10mM的不同效应物混匀,于4℃条件保存24h后测定相对酶活力来研究效应物对重组α-L-鼠李糖苷酶的影响,所选用的效应物为L-鼠李糖、葡萄糖、EDTA、SDS、DTT和β-巯基乙醇,结果如表3所示。
表3 效应物和抑制剂对重组α-L-鼠李糖苷酶的影响
2.6重组α-L-鼠李糖苷酶的动力学研究
将同一酶活力的重组α-L-鼠李糖苷酶与具有浓度梯度的柚皮苷反应,利用HPLC法测得各酶促反应中α-L-鼠李糖苷酶活力,以底物浓度为横坐标,以酶反应速度为纵坐标绘制Lineweaver-Burk双倒数曲线图,并计算重组α-L-鼠李糖苷酶Km,Vmax和Kcat等动力学参数,结果如图4所示。
综上,α-L-鼠李糖苷酶基因在毕赤酵母中表达的重组酶分子量为100±10kDa;酶对柚皮苷适宜的反应温度为50-60℃,适宜的反应pH为4.0-5.0;在30-60℃保温1h,能够保留80%以上的活性;在pH3.0-8.0的范围内4℃保存12h可以保留80%以上的活性;酶对柚皮苷的Km和Kcat分别为1.27μmol/mL和3445μM·min–1。
本领域的普通技术人员能从本发明公开内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!