植物PIP1;10基因及其应用的制作方法
本发明属于分子生物学与生物技术领域,涉及一种来源于植物的PIP1;10基因及其所编码的蛋白质与应用,尤其涉及一种来源于大豆的PIP1;10基因及其所编码的蛋白质与应用。
背景技术:
干旱、盐碱和低温等胁迫是限制植物生长的主要非生物胁迫类型,且都会限制植物水分的吸收和影响植物细胞中水分的分布,从而造成植物细胞的水分失衡,制约植物生长发育,最终导致农作物严重减产。土壤中高浓度的盐分通过渗透胁迫、离子毒害、活性氧等多个机制影响植物的生长,是严重影响农业生产的一个非生物胁迫因素(Zhu,2001)。
水通道蛋白(Aquaporins,AQPs)是一类高效特异转运水分子的整合膜蛋白,在植物水分转移过程中起着重要作用。高等植物AQPs按表达特性可分为3类:一类称为α类,在种子中特异表达,一类称为γ类,在根中特异表达,第三类称为Wsi(water-stress induced)类,受水分胁迫的诱导;根据其序列差异及不同的亚细胞定位可以分为5类:①质膜内在蛋白(PIPs:plasma membrane intrinsic proteins),②液泡膜内在蛋白(TIPs:tonoplast intrinsic proteins),③类NOD26内在蛋白(NIPs:NOD26-like intrinsic proteins),④小分子碱性膜内在蛋白(SIPs:small basic intrinsic proteins),⑤未鉴定的膜内在蛋白(XIPs:X intrinsic proteins)。根据序列差异,AQPs不同亚型被分为不同的亚家族,如PIPs分为PIP1和PIP2两个亚家族,TIPs可分为TIP1至TIP5共5个亚类。植物中的第一个水通道蛋白γ-TIP是由Maurel等于1993年从拟南芥液泡膜中分离出来的。到目前为止,在拟南芥、烟草、水稻、玉米、小麦、豌豆、菜豆、苜蓿、马铃薯、桃、郁金香等多种科(属)的植物中都发现了水通道蛋白,另外从蛋白数据库中发现了大量水通道蛋白的类似物(Maurel等,1993)。这些蛋白在调节细胞间水分运输过程中起重要的作用,它们在介导大部分土壤水分吸收的根部表达较丰富((Javot and Maurel,2002),在水分胁迫等非生物胁迫下的表达要么上调,要么下调(Aharon等,2003;Quist等,2004;Guerrero等,1990;Sakr等,2003)。与其他物种相比,植物拥有大量的、普遍表达的AQPs(Javot and Maurel,2002;Javot et al.,2003)。
AQPs在水分、小分子、不带电荷的溶质和二氧化碳通过植物细胞膜的运输过程中起着主要作用,AQP在调节根、茎和叶的水力传导性,尤其是对环境变化的响应过程中起着重要的作用,从而认为通过调节AQP的表达能用来调节植物的水分利用率(综述Menachem等,2014),水分子穿过细胞膜是由AQP通过改变其密度和活性来调节的,如翻译后修饰以及在执行(转运)Trafficking与(开闸)Gating过程中蛋白相互作用,在整个器官水平,AQP修饰水分传导率和梯度来影响整个植株的水分流动和水势(Chaumont和Tyerman,2014)。
至今已有许多关于模式或非模式植物中水通道基因表达水平与非生物胁迫关系的研究。Sakurai等(2005)分析了水稻水通道蛋白家族的表达特性,发现水稻的33个水通道基因中,有6个在根中特异性表达,14个在叶中特异性表达;有10个基因的表达水平在低温胁迫(chilling)时上升。Li等(2008)的研究进一步表明水稻的水通道蛋白对高盐胁迫、ABA、PEG模拟的干旱胁迫也均有响应,且不同成员对不同胁迫的响应方式不同。Yann Boursiac等(2005)的研究表明,拟南芥的水通道基因在盐胁迫时的根中表达水平先升高,然后下降到较低水平。Anderberg等(2011)研究发现,在100mmol/L NaCl胁迫下,大麦根部的导水率及AQPs基因表达并无明显变化,而200mmol/L NaCl引起大麦根部导水率及6个HvPIPs mRNA积累的显著下降,表明植物调控AQPs改变根部导水率应对高盐引起的渗透胁迫,另有AQPs定位的研究就发现,在盐胁迫处理拟南芥根部时质膜上的AtPIP2;1会迅速内化,作者推断这样可以防止植物在盐害初期渗透胁迫产生时大量失水(Li等,2011;Lu等,2011);但不能排除这种内化还波及到其他耐盐机制,如细胞需要AQPs定位在细胞内的其他膜系统上进行物质分泌、离子区隔等。此外,通过固氮螺菌接种大麦幼苗可以提高其抗盐能力(200mmol/L NaCl,18d),研究者发现对比未接种幼苗,推测接种固氮螺菌后,根部HvPIP2;1高效表达,并推测大麦根部HvPIP2;1的高效转录提高了大麦幼苗耐盐能力(Zawoznik等,2011)。
近年来关于水通道蛋白与盐胁迫的耐性关系的报道开始出现并陆续增多,但数量仍然比较有限,而且不同类型、不同来源的水通道蛋白对植物的非生物胁迫耐性有着不同的影响。Guo等(2006)分离了若干水稻PIP基因,超量表达水稻PIP基因的转基因拟南芥对干旱胁迫和中等强度的盐胁迫的耐性有所提高。Peng等(2007)克隆了人参的TIP基因,发现基因的超量表达促进了转基因烟草的种子萌发和植株生长;在盐胁迫下使地上部分积累Na+从而提高了植株对盐胁迫的耐性。在番茄中超表达具有CO2及水通透性的NtAQP1基因可以提高植物的光合作用效率、气孔导度、蒸腾作用,并维持盐胁迫下根部的导水率,提高番茄的抗盐能力(Sade等,2009);同样,从抗盐小麦突变株RH8706-49中克隆盐胁迫下根和叶中都高效表达的TaNIP,超表达TaNIP提高拟南芥的耐盐性(Gao等,2010)。这些结果都表明AQPs能增加转基因植株的盐胁迫耐受能力。植物TIPs定位在液泡膜,盐胁迫下参与调控细胞渗透压(Marty等,1999)。野生大豆受到盐胁迫后,GsTIP2;1在叶片上调表达,而在根系下调表达;超表达该基因降低了拟南芥的耐盐能力(Wang等,2011);而Peng等(2007)在拟南芥中超表达人参的PgTIP1基因提高了拟南芥的耐盐性,但转化株对干旱和冷害更敏感;Zhou等(2014)组成性过表达大豆质膜型水通道蛋白基因GmPIP1;6的转基因大豆植株显著提高了耐盐性,研究结果发现在盐胁迫下,转基因植株能较好地维持根部水力传导性和增加种子大小来提高产量;Yu等(2014)分离克隆了香蕉MaPIP1;1基因,过表达拟南芥发现转基因植株提高了干旱和盐胁迫的耐性;Qian等(2014)发现黄瓜幼苗在干旱和盐胁迫下,质膜型水通道蛋白基因的表达显示了随着处理时间变化的差异应答机制,表明水通道蛋白的调节是随着胁迫类型、胁迫时间和器官而变化的。Ma等(2014)发现增加二磷酸酯的膜含量可以增加烟草原生质体渗透水的渗透性,而后者是通过增加膜上活性水通道蛋白的丰度来实现的,因此作者提出磷酸肌醇是否通过增加AQP通路来调节烟草原生质体膜的水渗透性的疑问。Heinen等(2014)鉴定了玉米气孔复合体部位的质膜水通道蛋白,并进行了ZmPIP1;5和ZmPIP1;6的酵母异源表达分析,表明ZmPIPs在气孔复合体中有多种生理学功能。
植物体可以通过调控水孔蛋白等膜蛋白以加强细胞与环境的信息交流和物质交换,改变膜对水分的通透性,实现渗透调节,以增强植物的抗旱、耐盐能力。这说明盐和干旱胁迫植物在分子水平上通过影响水通道蛋白的性质和丰度,改变了细胞对水分的吸收能力。这些研究结果都表明植物通过水孔蛋白调节细胞对水分的吸收能力而适应高盐和干旱等不利的环境条件。
技术实现要素:
解决的技术问题:为了克服现有技术的不足,获得一种来源于植物的抗逆性基因,且能够提高转基因植物的抗逆性,本发明提供了植物PIP1;10基因及其应用。
技术方案:植物PIP1;10基因,所述基因的核苷酸序列为SEQ ID NO:1、SEQ ID NO:1限定的DNA序列杂交的核苷酸序列或编码与序列表中SEQ ID NO:1相同氨基酸残基序列的多核苷酸序列;所述基因的扩增引物为SEQ ID NO:3~4。
其中,SEQ ID NO:1限定的DNA序列杂交的核苷酸序列是在高严谨条件下获得,所述高严谨条件为0.1×SSPE(或0.1×SSC),0.1%SDS的溶液中,在65℃条件下杂交并洗膜。
所述PIP1;10基因由870个脱氧核苷酸组成,其编码序列为自5’端第1位至870位脱氧核苷酸,编码的氨基酸序列为SEQ ID NO:2。
此外,将SEQ ID NO:2的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加,且具有转录激活功能的调控植物抗逆性的氨基酸残基序列。
氨基酸序列由289个氨基酸残基组成,通过NCBI网站BLAST结果表明该蛋白自氨基端(N端)第47位左右至第277位左右的氨基酸残基为保守的MIP超家族蛋白特异保守结构域,如图1所示。通过SMART在线分析软件http://smart.embl-heidelberg.de/预测该蛋白含有6个保守的跨膜结构域。
所述一个或几个氨基酸残基的取代和/或缺失和/或添加是指不多于十个氨基酸残基的取代和/或缺失和/或添加。
上述植物PIP1;10基因在提高植物抗逆性中的应用。
优选的,所述PIP1;10基因的表达载体为双元农杆菌载体或可用于植物微弹轰击的载体等,如:pCambia1301、pCambia1300、pBI121、pCXSN或其他衍生植物表达载体。
优选的,所述PIP1;10基因的表达载体中,其转录起始核苷酸前引入组成型、组织特异型、诱导型或增强型启动子。
优选的,所述PIP1;10基因的表达载体中,引入具有抗性的抗生素标记基因(卡那霉素、潮霉素等)、抗化学试剂标记基因(如抗除草剂bar基因等)、产生颜色变化的蛋白和/或化学发光基因(GUS基因、GFP基因、LUC基因等)。
优选的,所述植物为单子叶植物或双子叶植物,优选为大豆。
优选的,所述抗逆性为耐干旱性。
携带有PIP1;10基因的植物表达载体可通过使用Ti质粒、Ri质粒、植物病毒载体、直接DNA转化、微注射、电导、农杆菌介导等常规生物学方法转化植物细胞或组织,并将转化的植物细胞或组织培育成植株。上述通过转基因调控植物抗逆性的方法对所有植物均适用,既可适用于单子叶植物(小麦、水稻、玉米等),也可以适用双子叶植物(大豆、棉花等)。
有益效果:(1)本发明所述基因能够提高转基因植物的抗逆性;(2)来源于大豆中的该基因能够提高转基因大豆的耐旱性。
附图说明
图1为来源于大豆的PIP1;10基因(GmPIP1;10)的蛋白的保守结构域图;
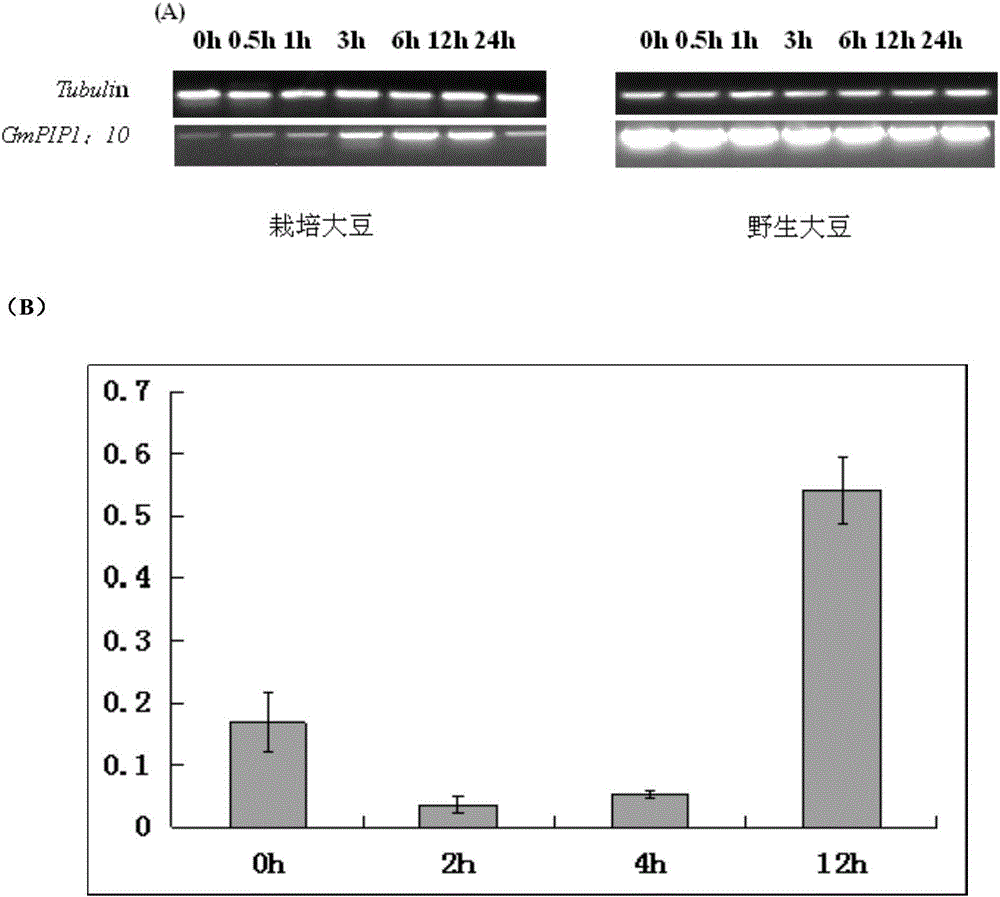
图2为GmPIP1;10基因在栽培大豆和野生大豆根组织受到盐/干旱胁迫的表达丰度的半定量PCR和定量检测结果图;
图3为GmPIP1;10基因的mRNA在不同组织器官中表达丰度的半定量PCR检测结果图;
图4为GmPIP1;10蛋白的氨基酸与其他植物的PIP1;10蛋白的氨基酸多重序列比对图;
图5为pCXSN植物过表达载体物理图谱;
图6为为pCXSN::Gm PIP1;10转基因组合植株抗旱鉴定结果图。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改和替换,均属于本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1 基因的克隆
1、材料 菌株 试剂
大豆材料为普通大豆、大肠杆菌菌株DH5α为本实验室保存;pGEM-T Easy Vector T克隆试剂盒、Taq酶、DNA marker购自TaKaRa公司;Trizol reagent、T4 DNA连接酶购自Fermentas公司;反转录试剂盒购于上海捷瑞生物工程有限公司;引物由上海英俊生物技术有限责任公司合成,DNA纯化回收试剂盒购于Promega公司,其它生物学试剂购自上海皓嘉科技发展有限公司。
2、总RNA提取和c DNA合成
样品在液氮中研磨后用Trizol TM(Invitrogen)提取,经DNase1消化去除DNA,并经1.2%的琼脂糖凝胶电泳检测总RNA的浓度和完整性。cDNA合成采用上海捷瑞生物工程有限公司反转录试剂盒。
3、基因克隆
利用RT-PCR方法从大豆幼苗根部组织cDNA中扩增全长ORF(开放阅读框),所用正向引物为SEQ ID NO:3,5’-ATGGAGGGAAAAGAGGAAGATGT-3’和反向引物SEQ ID NO:4,5’-TTAACTGGATTTGAAGGGAATGGC-3’,扩增体系为:cDNA稀释样,适量;10×PCR Buffer,2.5μL;dNTP(10mM),0.5μL;MgCl2(25mM),1.5μL;Primer F(10mM),1μL;Primer R(10mM),1μL;Taq polymerase(5UmL-1),0.2μL;ddH2O补足至25μL。反应程序为:94℃预变性3min;94℃变性45秒,55℃复性45秒,72℃延伸1min,35个循环;72℃延伸10min。PCR产物连入pGEM-T Easy Vector T克隆试剂盒载体中,送给南京金斯瑞生物科技有限公司测序,重复3次,获得基因序列SEQ ID NO:1。
实施例2 基因表达分析
采用半定量RT-PCR分析法,根据cDNA序列设计引物,所用引物序列如下,内参引物TubμLin-F(SEQ ID NO:5):5'-AACCTCCTCCTCATCGTACT-3';TubμLin-R(SEQ ID NO:6):5'-GACAGCATCAGCCATGTTCA-3',基因引物(SEQ ID NO:7):5’-TCATGGGTGTCAATAGGTCCAGCT-3’;反向引物(SEQ ID NO:8)5’-TGTAACCAGGGGCAACAAAGTTGGC-3’(对大豆基因组进行BLAST结果发现没有其他同源基因,表明基因的特异性);利用提取的幼苗根、茎、叶组织和花以及豆荚的cDNA为模板来进行基因的组织表达分析。利用200mM的氯化钠溶液处理野生和栽培大豆根部组织不同时间点(0h、0.5h、1h、3h、6h、12h、24h)的cDNA为模板,通过半定量PCR方法进行诱导表达分析;以20%PEG6000处理不同时间点(0h,2h,4h,12h)的根部组织为模板,进行干旱胁迫诱导表达分析,其中大豆组成型表达的ActinII作为内参基因,引物序列为SEQ ID NO:9,F:5’-ATCTTGACTGAGCGTGGTTATTCC-3’;SEQ ID NO:10,R:5’-GCTGGTCCTGGCTGTCTCC-3’。按照TaKaRa试剂盒SYBR Premix ExtaqTM说明设定反应体系,扩增条件为:95℃5min,95℃15s,45个循环,58℃1min。荧光定量PCR所用的仪器为ROCHE96实时荧光定量PCR仪。
结果如图2和3所示:图2中(A)显示在栽培大豆根组织中,GmPIP1;10表达受盐胁迫诱导,而在野生大豆根组织中始终保持较高的表达水平;图2中(B)显示在干旱处理下,GmPIP1;10表达显示先下调后上升的趋势;图3显示半定量PCR检测结果表明在GmPIP1;10大豆的根、茎、叶中均有表达,花和豆荚中表达较弱。
实施例3 序列分析
采用BLAST X和BLAST P搜索NCBI的核苷酸和蛋白质数据库,进行序列相似性分析及氨基酸保守性预测;用Clustal X进行氨基酸序列比对及功能结构域查找与相似序列分析;结果表明,该蛋白氨基酸序列与绿豆(Vigna radiata)、小豆(Vigna angμLaris)、菜豆(Phaseolus vμLgaris)、花生(Arachis ipaensis)、木豆(Cajanus cajan)等的水通道PIP蛋白均有较高的相似性,都在氨基酸47-277之间具有一个保守的MIP家族结构域,如图4所示。
实施例4 耐旱性检验
1、载体构建
利用Xcm1酶单切载体pCXSN形成T/A克隆位点,然后利用PCR扩增基因全长ORF,所用引物为正向引物5’-ATGGAGGGAAAAGAGGAAGATGT-3’;反向引物5’-TTAACTGGATTTGAAGGGAATGGC-3’。然后T4连接酶把扩增产物连入酶切后的空载体内,然后用35F(SEQ ID NO:11)正向引物5'-ACTCGCCGTAAAGACTGG-3'和基因的反向引物扩增获得方向正确的阳性克隆通过冻融法转入发根农杆菌K599和根癌农杆菌EHA105中,以备后续转化所用,重组载体图谱如图5所示。
2、植物材料
植物材料为大豆幼苗,将大豆种子点播于蛭石:沙子为3:1的基质中,浇水并在光照培养箱(宁波海曙赛福实验仪器厂)中培养,培养条件为25-28℃,每日光照12小时,光照强度为2000lux,待苗长至4-5厘米时以备后续注射所用。
3、菌液培养与注射
从平板上挑取单菌落K599(含GmPIP1;10基因表达载体)置于加有1mL液体LB(附加Kan50mg/L)的15mL管中,28℃摇床上200rpm摇1-2d,然后吸取2mL离心,沉淀用10m M硫酸镁溶液重旋,再离心一次,然后用硫酸镁稀释至OD600约0.8-1.0;用0.025mL量程微型注射器吸取菌液,在大豆子叶节部位注射,注射大约3-4个孔,然后放置在加有水的小烧杯内,用塑料膜封口,在光照培养箱中(12h光照/12h黑暗)28℃培养。
4、组合苗生长管理
大致培养5-7天时,注射的孔部长出根之后,随后揭掉塑料膜,剪掉原有的根系,确保转基因根系为阳性,在Hoagland营养液中培养至根部足够健壮时为后续研究所用。
5、组合苗阳性植株鉴定
DNA采用CTAB法提取,0.8%琼脂糖凝胶电泳检测DNA质量。PCR反应总体积为20μL,模板DNA(20ng/μL)1μL,正反向引物(10μM)各0.4μL,10xPCR Buffer 2μL,MgCl2(25mM)1.6μL,dNTP(10mM)1.6μL,rTaq(5U/μL)0.2μL,ddH2O 12.8μL。反应程序94℃预变性4min,35个循环:94℃变性30s,55℃退火30s,72℃延伸50s,72终延伸10min。所用引物为35F正向引物5'-ACTCGCCGTAAAGACTGG-3';基因反向引物5’-TTAACTGGATTTGAAGGGAATGGC-3’
组合扩增来进行验证(前期已经验证)。
运用Hairy Root实验体系,包括离体和在体两类,一类是豆瓣体外菌液注射发根验证;另一类是在体注射菌液发根然后再生苗,获得转基因组合植株后,经PCR验证为阳性的植株对它们进行抗或耐旱鉴定(图6A);植物过表达载体通过冻融法转入发根农杆菌K599,通过注射的方法获得转基因组合植株(根为转基因,其它为非转基因),结果发现:与空对照和过表达该基因的植株相比,该基因的过表达植株对PEG(20%m/v)溶液具有较强的耐受性,表明该基因在植物的抗旱耐盐胁迫过程中起着重要作用(图6B)。
综上所述,本发明人提供的GmPIP1;10基因是首次从大豆中分离的新基因,其功能参了大豆的抗、耐旱和耐盐等逆境胁迫的应答。本发明的GmPIP1;10基因来自普通大豆,具有适合于双子叶植物表达的优化密码子,其基因工程受体植物除了单子叶植物水稻、玉米、小麦外,更加适合于双子叶植物,如大豆、棉花、烟草等。
- 还没有人留言评论。精彩留言会获得点赞!