引起耳聋的猪KIT突变基因及其应用的制作方法
本发明涉及生物技术领域,具体涉及一种引起耳聋的猪KIT突变基因及其应用。
背景技术:
KIT基因是一种原癌基因,属于血小板衍化生长因子(PDGF)和集落刺激因子(CSF-1)受体家族,编码肥大/干细胞生长因子受体(mast/stem cell growth factor receptor),该受体属于酪氨酸激酶受体(PTKs)家族,是神经嵴细胞衍生的黑色素细胞前体物,它的正常迁移、存活依赖于KIT。KIT基因对正常造血细胞、肥大细胞、黑色素细胞的增值分化以及肿瘤细胞的增值,恶性演化,凋亡等方面有重要作用。KIT基因在物种之间高度保守。KIT常表达于内耳血管纹中间细胞及螺旋神经节,而KIT基因突变导致耳聋的机理目前并不清楚。
耳聋是一种严重影响人类生活质量最常见的感觉障碍疾病。据WHO 2014年2月资料(http://www.who.int/mediacentre/factsheets/fs300/zh/),全世界人口的5%,也就是3.6亿人,患有残疾性听力损失(3.28亿成人、3200万儿童)。世界各国通过流行病学调查先天性耳聋在新生儿中发生的总比例达到1/1000-3/1000。耳聋是我国第二大致残疾病,我国也是世界上听力障碍人数最多的国家,据2006年第二次全国残疾人抽样调查显示,全国有听力残疾人2780万,且每年新增3万多聋儿,其中一半以上属于遗传性耳聋。遗传因素导致的耳聋称为遗传性聋,临床上根据是否伴有其他症状和体征分为非综合征型耳聋(Nonsyndromic hearing loss,NSHL)和综合征型耳聋(Syndromic hearing loss,SHL)。所占比例分别为70%和30%。几十年来,国内外的研究小组对非综合征型耳聋的遗传基础、发病机制及治疗干预进行了大量研究,取得了巨大的研究进展,大量的非综合征性耳聋致病基因被定位和克隆(已成功定位134个NSHL基因位点,克隆了63个NSHL致病基因http://hereditaryhearingloss.org/),初步建立了相应的基因诊断技术并推广到临床。而大多数综合征型耳聋发病率相对较低,全身病变的临床表现变化多样,除了听力障碍,同时伴有眼、骨、肾、皮肤、神经系统、代谢内分泌系统等其他器官或系统的异常,种类繁多且较复杂,对病患的生存质量影响更大。目前已报道的SHL有400多种,大多数发病率低,临床上较常见的有Waardenburg综合征(Waardenburg syndrome,WS)、先天性小耳畸形综合征、前庭导水管扩大综合征(Large vestibular aquduct syndrome,LVAS)等。由于SHL临床和遗传异质性极强,涉及的致病基因繁多,对其遗传基础及发病机制的系统研究变得十分困难。因此一个好的遗传性耳聋动物模型对耳聋的研究至关重要。
目前已有400余种遗传性耳聋动物模型报道,包括遗传工程动物模型、ENU化学诱变动物模型、自发突变动物模型三类。遗传工程耳聋动物模型最多,目前发现的几乎每一个耳聋基因均制备了基因敲除、敲入或敲低的遗传工程小鼠。此外,利用ENU诱变动物基因组发生高通量随机诱变也是制备耳聋动物新模型、发现致聋新基因并揭示耳聋新机制的有效途径,但大多以小型啮齿类哺乳动物(小鼠、大鼠等)为研究材料。除基因修饰耳聋动物模型外,已有5-6个自发突变耳聋动物模型报道,涉及牛、犬、马、猫等不同动物种属,主要突变基因为MITF。截止目前,还未见到有关KIT基因突变的大动物模型的报道。
技术实现要素:
为弥补上述领域存在的不足,本发明提供一种引起耳聋的猪KIT突变基因,可引起猪耳聋并呈显性遗传,能够用于制备耳聋动物模型,研究耳聋的发病机理,为预防、诊断和治疗耳聋提供理论依据。
请求保护的技术方案如下:
一种引起耳聋的猪KIT突变基因,其特征在于,与野生型猪KIT基因相比,具有c.2418T>A突变。
一种构建体,其特征在于,包含权利要求1所述的猪KIT突变基因。
一种重组细胞,其特征在于,是由权利要求2所述的构建体转化受体细胞而得。
一种制备耳聋动物模型的方法,其特征在于,改变正常猪的KIT基因,使KIT基因的第2418位碱基由T变为A。
一种筛选KIT基因突变耳聋猪的方法,其特征在于,包括如下步骤:
(1)提取待测生物样品的核酸;
(2)确定所述核酸的序列;
(3)所述核酸的序列或其互补序列,与野生型KIT基因相比具有c.2418T>A突变,是猪耳聋的指示;
所述生物样品选自血液、皮肤、毛发和肌肉中的至少一种。
优选地,所述核酸为mRNA,确定所述核酸的序列包括如下步骤:
(1)对mRNA进行反转录反应,获得cDNA;
(2)以cDNA为模板,采用猪KIT基因的特异性引物进行PCR,得到扩增产物;
(3)对扩增产物进行测序;
所述特异性引物的核苷酸序列如SEQ ID NO:1和SEQ ID NO:2所示。
优选地,所述PCR的反应体系为:模板DNA 1μl,正向引物Fi 1μl,反向引物Ri 1μl,10mM dNTP 1μl,5U/μl Taq聚合酶0.5μl,Taq聚合酶缓冲液5μl,25mM MgCl2 5μl,ddH2O35.5μl。
优选地,所述PCR的反应程序为:95℃预变性3min;94℃变性30s,55℃退火35s,72℃延伸40s,35个循环;72℃修复延伸8min。
用于筛选KIT基因突变耳聋猪的引物,其特征在于,其核苷酸序列如SEQ ID NO:1和SEQ ID NO:2所示。
一种筛选KIT基因突变耳聋猪的试剂盒,其特征在于,包含液态的或粉末状的猪KIT基因的特异性引物,所述引物的核苷酸序列如SEQ ID NO:1和SEQ ID NO:2所示。
为获得大型耳聋动物模型,本发明对巴马香猪进行ENU化学诱变,然后使其与野生型母猪交配获得G1后代,经过大规模表型筛选获得1头呈重度耳聋及色素分布异常的公猪,利用该G1公猪与10头正常母猪交配,得到了63头G2代个体,其中具耳聋突变表型的个体36头,正常表型个体27头。卡方检验表明G2代耳聋与正常个体数量符合1︰1的分配比例,且性状在不同性别间无差异分布。表明该家系耳聋性状遗传模式符合常染色体单基因显性遗传的孟德尔遗传定律。
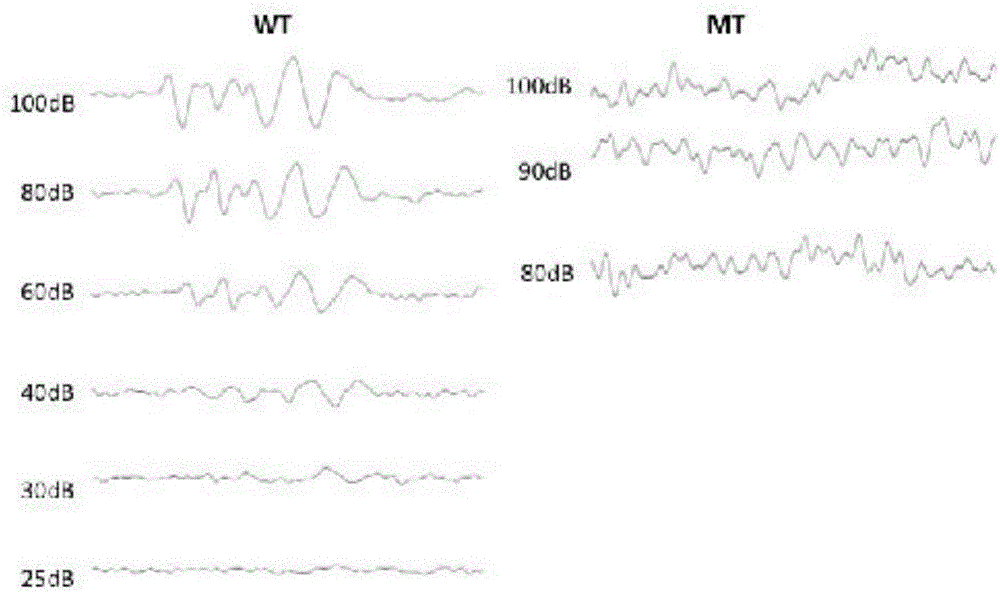
表型分析结果显示,(1)从外形上看,正常巴马香猪的头部和臀部为黑色,其它部位为白色;而突变个体表现为除头部有少量黑色斑块外,其它部位为全白色,并且虹膜变浅,其角膜瞳孔外区域较普通巴马香猪的棕色明显变淡,呈浅蓝色(图1)。(2)听力检测结果表明,正常巴马香猪能引出正常ABR峰,听力阈值在30dB SPL左右,听力正常;而突变巴马香猪个体在各频率的仪器最大输出均不能引出ABR峰,表现出重度耳聋(图2)。(3)耳蜗组织学结果显示,正常巴马香猪耳蜗形态学正常,与人类相似程度极高。突变巴马香猪耳蜗中前庭膜塌陷紧贴于血管纹和螺旋器,中阶基本消失,内淋巴液减少。螺旋器退化,感觉细胞基本消失,支持细胞发育严重异常,基底膜上只有一层上皮样组织。血管纹也出现明显变薄(图4和5)。
通过全基因组关联分析,确定了突变个体的致病基因为KIT基因,对KIT基因的20个外显子及外显子边界全测序,结果显示,KIT第16号外显子上,c.2418T>A表现为与白化耳聋性状完全共分离,该突变引起猪KIT基因编码蛋白的806位氨基酸由天冬氨酸变为谷氨酸(p.D806E)。该突变位点对应于人KIT基因17号外显子上c.2517位点和810位氨基酸残基,位于KIT的蛋白酪氨酸激酶编码区,理论上推测该突变能够影响KIT与DNA结合的功能特性,导致基因转录发生改变,进而影响人的听力。从图8可以看出,该突变位点的氨基酸在人类、猴、猪、牛、羊、马、猫、狗、兔、小鼠、大鼠等哺乳动物中十分保守,因此,利用本发明提供的KIT突变基因制备大型耳聋猪模型,研究耳聋的发病机理,对于临床预防、诊断和治疗耳聋具有重大的指导意义。
在本发明的一些实施例中,根据实际需要,利用基因工程技术,改变正常猪的KIT基因,使第2418位碱基由T变为A,获得耳聋猪模型。在另一些实施例中,也可以利用基因工程技术改变除猪以外的其它动物的KIT基因的相应位点,从而获得所需的大型或小型耳聋动物模型,例如耳聋猴模型,耳聋小鼠模型,等等。
本发明还提供一种筛选KIT基因突变耳聋猪的方法,只需提取待测生物样品的核酸并确定所述核酸的序列,如果所述核酸的序列或其互补序列与野生型KIT基因相比具有c.2418T>A突变,则该样品对应的猪会表现出耳聋的症状。所述生物样品可以是血液、皮肤、毛发和肌肉中的一种或多种。所述核酸优选为mRNA,对其进行反转录PCR,获得cDNA后,利用KIT基因特异性引物进行PCR,对PCR产物进行测序并与野生型KIT基因序列比对,确定该样品对应的个体是否耳聋。在一些实施例中,所述核酸也可以是基因组DNA,无需反转录,直接进行PCR。
本发明还提供一种筛选KIT基因突变耳聋猪的试剂盒,包括液态的或粉末状的猪KIT基因的特异性引物。所述试剂盒可以包括PCR所需的其它试剂,如缓冲液、dNTP、聚合酶;还可以包括回收PCR产物所需的试剂和耗材,如溶胶液、收集管、洗涤液等。以待测样品的DNA为模板,利用所述试剂盒和本发明提供的筛选KIT基因突变耳聋猪的方法进行检测,操作简便,能快速鉴别大量样品。
综上,本发明定位了可引起耳聋并呈显性遗传的猪KIT基因c.2418T>A点突变,利用该突变制备耳聋动物模型,研究耳聋的发病机理,对于耳聋疾病的预防、诊断和治疗具有重大的临床指导意义。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,提供如下附图:
图1显示了野生型巴马香猪与突变巴马香猪的毛色和虹膜颜色,
其中,A为正常巴马香猪毛色;B为突变巴马香猪毛色;C为正常巴马香猪虹膜颜色;D为突变巴马香猪虹膜颜色。
图2为KIT基因突变耳聋猪的听力ABR检测结果,
其中,WT为正常巴马香猪ABR波形;MT为突变巴马香猪ABR波形。
图3为KIT突变基因家系系谱图。
图4为成年突变猪耳蜗组织学结构观察结果,
其中,WT为正常猪耳蜗组织学结构(HE);MT为耳聋猪耳蜗组织学结构(HE)。
图5为成年突变猪耳蜗扫描电镜观察结果,
其中,WT为正常猪耳蜗扫描电镜结果;MT为耳聋猪耳蜗扫描电镜结果。
图6为全基因组SNP关联分析结果,
其中,横坐标表示染色体,纵坐标表示log P值。
图7为基因连锁分析结果,
其中,横坐标表示置信区间位置,纵坐标表示LOD值。
图8为KIT突变(c.2418T>A)Sanger测序结果,
其中,Wide-type为正常猪的测序结果,Mutant为耳聋猪的测序结果。
图9为免疫荧光试验证明KIT蛋白在猪耳蜗的表达位置,
其中,WT为正常猪耳蜗中KIT蛋白的表达情况,绿色荧光显示了KIT蛋白在正常猪耳蜗中的表达位置;MT为突变猪耳蜗中KIT蛋白的表达情况,在突变猪耳蜗中未观察到KIT蛋白的表达。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述,需要声明的是,下述实施例仅作为解释和说明,不以任何方式限制本发明的保护范围。
实验动物:巴马香猪,第三军医大学实验动物学教研室饲养。
主要仪器与试剂:
Smart EP听觉诱发电位仪,美国爱声Intelligent Hearing Systems;
冰冻切片机,德国Leica CM1900;
IB-5型真空离子溅射仪,日本EIKO;
JEOL JSM-35C扫描电镜,日本电子株式会社;
共聚焦显微镜镜,德国Zeiss LSM780;
乙烷亚硝基脲,美国Sigma公司,货号N8509;
Tissue-Tek OCT冰冻切片包埋剂,日本Tissue-Tek;
c-Kit goat polyclonal(sc-1494),购自santa cruz;
驴抗羊IgG抗体488,美国Molecular Probes;
实施例中未注明具体条件的实验方法,通常按照常规方法中所述的条件,或按照制造厂商所建议的条件;未特别说明的生物化学试剂,均为本领域常规试剂,可以通过常规方法配制而得或商购获得,规格为实验室纯级即可。
实施例1、耳聋猪遗传家系的建立
以我国巴马香猪为模式动物,利用强化学诱变剂乙烷亚硝基脲(ENU)开展了猪基因组的高通量随机诱变,获得了呈高度稳定显性遗传的、毛色白化的耳聋猪遗传家系。
具体过程如下:
(1)通过对G0代巴马香猪公猪进行ENU化学诱变,通过静脉注射ENU,浓度为75mg/kg,间隔一周注射一次,共3次,使其能够产生携带基因突变的精子;
(2)待公猪恢复一个月以后与野生型母猪交配获得G1后代,通过对G1代的大规模表型筛选,获得1头呈重度耳聋及色素分布异常公猪;
(3)利用该G1公猪与10头正常母猪交配,目前已产生63头G2代个体,其中具耳聋突变表型的个体36头,正常表型个体27头。
该家系目前共包括76头个体,包括ENU处理的G0诱变公猪1头,G1首建公猪1头,G2代猪63头,及参与家系配种的野生型猪11头,系谱图见图3。
将所有耳聋家系产生的G2代进行显性遗传卡方适合度检验,结果如表1所示。
表1、耳聋家系G2代产仔记录
卡方检验表明耳聋家系产生的G2代耳聋与正常个体数量符合1︰1的分配比例,同时性状在不同性别间无差异分布。表明该家系耳聋性状遗传模式符合常染色体单基因显性遗传的孟德尔遗传定律,故可确定该小型猪家系是一个呈单基因显性遗传的遗传性耳聋家系。
实施例2、耳聋猪遗传家系的特征分析
(一)突变猪白化表型观察
图1为正常巴马猪和突变巴马猪的外观表型。结果显示,正常巴马猪呈典型“两头乌”特征,即头部和臀部为黑色,其它部位为白色;而突变个体表现为除头部有少量黑色斑块外,其它部位为全白色,另外还表现出虹膜变浅的特征,其角膜瞳孔外区域较普通巴马香猪的棕色明显变淡,呈浅蓝色。
(二)突变猪听力表型检测
突变巴马香猪个体均表现出先天性的听力缺失,对声音刺激没有反应。将1月龄巴马香猪和正常巴马香猪分别通过5%戊巴比妥钠溶液静脉注射麻醉后在隔音屏蔽室内采用美国Smart EP Intelligent Hearing system进行脑干听觉诱发电位(ABR)检测,颅顶为纪录极,测试耳为参考极,鼻尖处为地线,刺激声用短声(click声)。结果如图2所示,参测的所有突变巴马香猪在各频率的仪器最大输出均不能引出ABR峰,表现出重度耳聋。而正常巴马香猪能引出正常ABR峰,听力阈值在30dB SPL左右,听力正常。
(三)耳聋猪耳蜗形态学研究
对耳聋猪和正常猪分别进行了耳蜗组织学和耳蜗扫描电镜结果检测。
1.耳蜗组织学试验具体方法如下:
1)将巴马香猪快速断头处死,迅速从颞骨中取出耳蜗并在蜗尖和卵圆窗开孔,将4%多聚甲醛灌入,室温放置过夜。
2)耳蜗经过1%PBS洗涤3遍,然后放入10%EDTA溶液中脱钙,每天换EDTA溶液,脱钙大概一个月直到耳蜗骨组织变软。
3)50%酒精脱水1天、75%酒精脱水1天、85%酒精脱水1天、95%酒精脱水1天、100%酒精脱水1天,经梯度酒精脱水后,2.5%、5%火棉胶各浸透2周左右、12%火棉胶浸透2周左右。
4)用12%火棉胶混合液包埋,把包埋好的组织放入带盖的圆形小标本缸。
5)火棉胶组织块的固定,平行于耳蜗蜗轴切取一个平面,将火棉胶包埋块修成长方体。
6)用冰冻切片包埋剂(OCT)将火棉胶组织块固定在冰冻切片机上的样品托上,进行连续切片,片厚15μm。将切好的每张切片快速放入70%的酒精中进行保存。
7)耳蜗火棉胶切片HE染色。
8)中性树胶封片,用铅块压片3-5天后观察。
2.耳蜗扫描电镜试验具体方法如下:
1)将巴马香猪快速断头处死,迅速从颞骨中取出耳蜗并在蜗尖和卵圆窗开孔,经2.5%戊二醛灌注,室温放置过夜。
2)耳蜗经过1%PBS洗涤3遍,然后放入10%EDTA溶液中脱钙,每天换EDTA溶液,脱到骨组织用针刺无阻力为止。
3)在解剖显微镜下仔细解剖和分离耳蜗骨壳,去除螺旋韧带和前庭膜,充分暴露耳蜗各圈Corti器(螺旋器)。
4)用1%的锇酸固定2.5h,乙醇逐级梯度脱水(50%酒精脱水1天、75%酒精脱水1天、85%酒精脱水1天、95%酒精脱水1天、100%酒精脱水1天),并用临界点液态CO2干燥。
5)IB-5型真空离子溅射仪进行镀膜后,用JEOL JSM-35C扫描电镜在加速电压25kv下观察。
结果如图4~5所示。
耳蜗组织学结果显示,正常巴马香猪耳蜗形态学正常,与人类相似程度极高。耳蜗由前庭阶(SVE)、中阶(SM)和鼓阶(ST)三个充满液体的腔隙组成。中阶含有内淋巴液,螺旋器的网状板、前庭膜(RM)、血管纹(SV)的侧壁,螺旋韧带和螺旋凸为其内淋巴液的分界线。螺旋器位于中阶,有感觉细胞核支持细胞组成。盖膜(TM)覆盖感觉细胞核支持细胞的顶表面。而突变巴马香猪耳蜗中前庭膜塌陷紧贴于血管纹和Corti器,中阶基本消失,内淋巴液减少。Corti器退化,感觉细胞基本消失,支持细胞发育严重异常,基底膜上只有一层上皮样组织。血管纹也出现明显变薄。
耳蜗扫描电镜结果显示,正常巴马香猪耳蜗网状板上排列3排外毛细胞和1排内毛细胞,在中回和底回上,外毛细胞的纤毛呈“V”字形排列,而在顶回上,外毛细胞纤毛呈簇状。并且我们能观察到一个完整的毛细胞胞体。而在突变巴马香猪耳蜗上,外毛细胞和内毛细胞全部消失,网状板上不能观测到纤毛,并且支持细胞消失留下一个空洞结构。
实施例3、耳聋猪遗传家系的致病基因定位
全基因组关联分析确定致病基因及突变位点:
G1代首建公猪与3头野生型母猪交配,获得29头G2后代,将上述G1公猪、野生型母猪和G2后代共33个体(其中16头异常,17头正常)采集DNA样本用于家系连锁分析,并用PorcineSNP60v2Genotyping BeadChip进行全基因组SNP分型,同时通过Merlin和PLINK软件进行分析。在芯片上62163个SNP中,call rate(检出率)大于95%的有61565个SNP,结果显示8号染色体31M-48M存在最显著SNP位点关联(图6,7),而与猪白化相关的KIT基因正好位于这个区域,因此我们将KIT基因作为致病候选基因进行20个外显子及外显子边界全测序。外显子测序的4个家系个体中,2个异常个体,2个正常个体,测序结果显示,KIT第16号外显子上,c.2418T>A表现为与白化耳聋性状完全共分离(在患病猪中为杂合子TA,正常猪中为纯合子TT),该突变引起猪KIT基因编码蛋白的806位氨基酸由天冬氨酸(Arp)变为谷氨酸(Glu)(p.D806E)。
然后,我们对该家系剩下的63个个体进行该位点突变验证,步骤如下:
(1)采用天根DNA提取试剂盒,按照试剂盒说明书中的方法,分别提取63头G2代个体耳组织的DNA并测量DNA浓度。
(2)以DNA为模板,采用猪KIT基因的特异性引物(核苷酸序列如SEQ ID NO:1和SEQ ID NO:2所示),按照下列反应体系和程序进行PCR,得到扩增产物。
(3)回收片段大小为404bp的扩增产物并送生工公司进行测序,然后与野生型KIT基因序列进行比对。
结果表明,36头突变个体均在c.2418位点表现出相同的TA杂合突变,而27头正常个体表现为TT纯合(图8)。因此,确定KIT基因的第16外显子突变(c.2418T>A)导致氨基酸改变(p.D806E),并与白化耳聋性状表现为完全共分离,为该猪家系耳聋表型的显性遗传致病突变位点。从图8可以看出,该突变位点的氨基酸在人类、猴、猪、牛、羊、马、猫、狗、兔、小鼠、大鼠等哺乳动物中十分保守。
序列对比与结构分析表明,本发明定位的KIT基因的第16外显子点突变(c.2418T>A,p.D806E)对应于人KIT基因17号外显子上c.2517位点和810位氨基酸残基,位于KIT的蛋白酪氨酸激酶(Protein tyrosine kinase)编码区,理论上推测该突变影响KIT与DNA结合的功能特性,进而导致基因转录发生改变。
实施例4、KIT蛋白在耳蜗的表达
KIT蛋白表达免疫荧光试验具体方法如下:
1)将巴马香猪快速断头处死,迅速从颞骨中取出耳蜗并在蜗尖和卵圆窗开孔,将4%多聚甲醛灌入,室温放置过夜。
2)耳蜗经过1%PBS洗涤3遍,然后放入10%EDTA溶液中脱钙,每天换EDTA溶液,脱钙大概一个月直到耳蜗骨组织变软。
3)将脱好钙的耳蜗放入20%蔗糖溶液中过夜。
4)将耳蜗放入Tissue-Tek OCT(冷冻包埋剂)中8小时,然后置于-20℃冰冻。
5)用冰冻切片机对耳蜗进行连续切片,片厚10μm,切片方向为平行于耳蜗蜗轴。
6)耳蜗冰冻切片标本用0.01M PBS洗3遍。
7)30%胎牛血清(0.01%Triton-PBS)室温封闭1小时。
8)倾去血清封闭液,勿洗。
9)加入一抗c-Kit goat polyclonal(sc-1494)1:200,4℃冰箱过夜。
10)0.1%Triton-PBS洗三次,每次10分钟。
11)加入二抗(驴抗羊IgG抗体488)1:400,室温下避光孵育1小时。加入DAPI染核15分钟。
12)PBS洗3×10分钟。
13)防淬灭剂封片。
14)共聚焦显微镜镜下观察。
免疫荧光结果如图9所示,在正常巴马香猪耳蜗中,KIT蛋白在血管纹和螺旋神经节等部位表达(绿色荧光),而突变巴马香猪耳蜗中未观察到KIT蛋白的表达。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!