一种水稻胚乳特异性表达启动子pEnd1及其应用的制作方法
本发明涉及生物技术和植物基因工程技术领域,具体而言,本发明涉及一种水稻胚乳特异性表达启动子及其应用,该启动子能够在水稻转基因调控体系中驱动目标基因在胚乳中表达。
背景技术:
植物种子胚乳不仅是贮存对人类和动物碳水化合物主要来源的主要场所,还可以作为生物反应器,用来生产在医疗和工业领域中具有重要价值的蛋白质。如维生素A,具有刺激胰岛素分泌预防糖尿病发生功能的GLP,具有降血糖作用的大豆球蛋白,乙肝疫苗和花粉过敏症疫苗等均成功的在水稻中表达并高水平积累(Goto et al.,Nature Biotech 1999,17:282-286;Ye et al.,Science 2000,287:303-305;Katsube et al.,Plant Physiol 1999,120:1063-1073;Zheng et al.,Plant Physiol 1995,109:777-786)。然而缺少控制外源基因理想表达(理想表达部位,表达方式,表达时期和表达水平)的启动子成为生物技术应用的限制因子。为了控制外源基因在转基因植物种子中高效专一表达,寻找具有种子胚乳特异表达特性的启动子或相关调控序列具有重要意义。
启动子是指基因中一段能准确有效起始转录的DNA序列,通常位于基因的上游。启动子是基因表达调控的重要元件,高等植物启动子一般由两部分组成:一部分是形成普遍性转录结果所需要的,通常称为核心转录区,包括转录起始点和邻近的TATA框;另一部分是觉得基因转录特异性和活性的区域,由多个保守序列组成。启动子参与调控目标基因在特定组织,发育阶段以及环境条件下的表达。组织特异性启动子是指除具有一般启动子的结构以外,通常还有增强子和沉默子的一般特性,在该种启动子的调控下,基因的表达常常只发生在特定的组织或器官部位,并表达出发育调节的特性。近年来,随着人们对特异性启动子结构和功能的深入研究,发现了一系列的种子特异性启动子。如水稻醇溶蛋白4a基因启动子;谷蛋白基因启动子;26kDa的球蛋白启动子;水稻醇溶谷蛋白基因Os12g16890;水稻胚乳pENP1启动子;水稻糊粉层p-NF-YB1启动子;拟南芥α-L-阿拉伯糖苷酶基因启动子;过敏蛋白RA5基因Os07g11510等。
水稻是世界上最主要的粮食作物之一,胚乳是淀粉合成和积累的主要器官。胚乳的形成和发育直接影响着水稻的产量的品质,同时胚乳也是一个优良的重组蛋白表达系统。通过胚乳特异性表达启动子将外源基因导入胚乳对改善稻米品质具有重要的实际意义。
在利用基因工程技术改良稻米品质的研究中,选用具有胚乳特异性、表达水平高的启动子是使外源基因能在水稻种子尤其是胚乳中高效特异地表达并积累基因产物的重要决定因素。尽管到目前为止已经发明了一些组织特异性启动子,但这些启动子还远远不能满足基因工程改良稻米品质的需求,因此本发明分离到的胚乳特异性表达的启动子对植物品质的改良有重要意义。
技术实现要素:
本发明的目的在于克服现有可用于水稻基因工程研究的组织特异表达启动子数目的不足,因此提供一种驱动外源基因在水稻胚乳中特异性表达的启动子,获得含有该启动子转化序列及该启动子的应用。
为实现上述目的,本发明采用的技术方案是:一种水稻胚乳特异性表达启动子pEnd1,序列为来源于日本晴水稻(Oryza sativa L cv.Nipponbare),可以是以下序列之一:
1)启动子的核苷酸序列如SEQ ID No:1所示;
2)与SEQ ID No:1核苷酸序列具有70%以上同源性;
3)在SEQ ID No:1序列中添加、取代、插入或缺失一个或一个以上核苷酸生成的突变体或等位基因或衍生物。
本发明提供一种水稻胚乳特异性表达启动子的重组载体,重组载体包含根据本发明提供的上述植物胚乳特异性表达启动子。
进一步的,重组载体为重组表达载体,在重组表达载体中本发明提供的上述植物胚乳特异性表达启动子可操作地连接与待表达的基因序列的上游,重组表达载体为将SEQ ID No:1所示序列即pEnd1或启动子pEnd1构建到pCAMBIA1305.1中得到重组表达载体。
本发明还提供一种水稻胚乳特异性表达启动子的表达盒。
本发明还提供一种水稻胚乳特异性表达启动子的转基因细胞系。
本发明还提供一种水稻胚乳特异性表达启动子的重组菌。
本文提供一种转化子,转化子包含本发明提供的上述植物胚乳特异性表达启动子、上述表达盒、上述重组载体或上述重组菌;
优选地,所述转化子为转基因细胞系、愈伤组织或植株。
本发明还提供一种水稻胚乳特异性表达启动子pEnd1在培育转基因植物中的应用,所述转基因植物中的外源基因是在胚乳中特异性表达的。
进一步的:所述培育转基因植物,是将所述外源基因连接于所述植物胚乳特异性表达启动子下游,通过植物表达载体转入植物中,筛选得到在胚乳中特异性表达所述外源基因的转基因植物。
进一步的,所述胚乳特异性表达启动子下游还连接有调控基因表达的调控元件;所述外源基因为蛋白编码基因和/或非蛋白编码基因;所述蛋白编码基因为品质改良基因;所述非蛋白编码基因为正义RNA基因和/或反义RNA基因。
本发明的有益技术效果是:本发明的植物胚乳特异性表达启动子是通过设计引物,以水稻基因组DNA为模板,利用PCR方法从水稻中分离得到pEnd1启动子。通过其在水稻中的表达特异性实验表明本发明的启动子使β-葡糖苷酸酶(GUS)报告基因只在水稻种子胚乳中特异性表达。说明本发明的启动子可以启动外源基因在植物的胚乳中特异性的表达,适用于任何种子具有胚乳的植物,即单子叶植物或胚乳型双子叶植物。
利用本发明的启动子可提高外源基因在植物胚乳中的表达和累积水平,可改良种子品质、将具有生理活性的蛋白或短肽导入种子中创制保健型功能新品种、利用种子作生物反应器生产有用外源蛋白或可食性疫苗,增加农产品科技附加值等。本发明的启动子及其应用为利用生物技术改良种子品质、分子医药农场等研究奠定了基础,具有极大的应用前景。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1:是本发明的技术路线图;
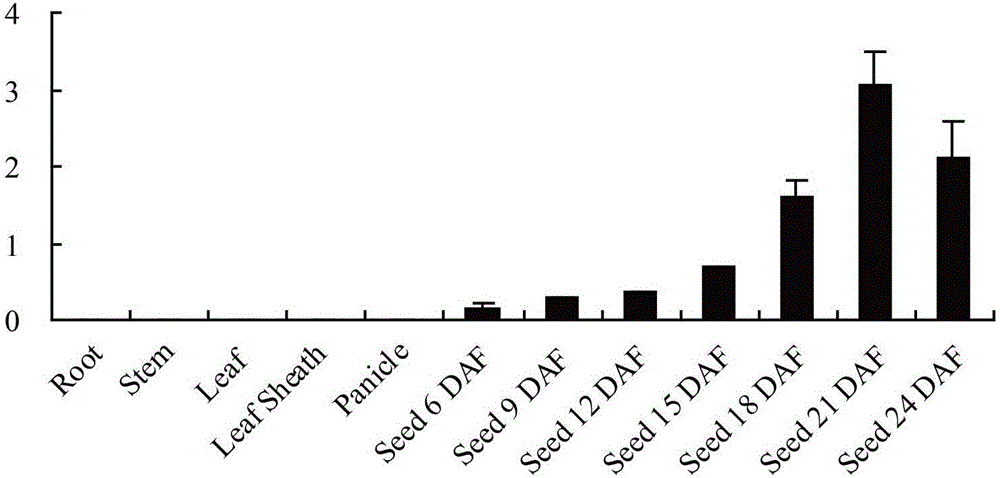
图2:利用qRT-PCR的方法来分析pEnd1在基因组中所驱动的基因(基因号:Os02g0202400)的时空表达模式,以玉米UBQ作为内参基因;
图3:表示双元载体pCAMBIA1305.1结构示意图;
图4:切掉35S启动子后的pCAMBIA1305.1载体(35S-free-GUS);LB、RB分别为pCAMBIA1305.1中T-DNA的左边界和右边界;hyg为潮霉素抗性筛选基因;gus为报告基因GUS;MCS表示多克隆位点;箭头方向表示基因或启动子表达的方向;
图5:构建好的以pCAMBIA1305.1为骨架的pEnd1-GUS表达载体简图;LB、RB分别为pCAMBIA1305.1中T-DNA的左边界和右边界;hyg为潮霉素抗性筛选基因;gus为报告基因GUS;pEnd1表示启动子;箭头方向表示基因或启动子表达的方向;
图6:35S-free-GUS转化植株的各个组织的GUS染色;A为根;B为茎秆;C为叶片;D为叶鞘;E为幼穗;F为花;G为种子(含胚和胚乳);
图7:由pEnd1驱动GUS基因转化植株的各个组织的GUS染色;A为根;B为茎秆;C为叶片;D为叶鞘;E为幼穗;F为花;G为种子(含胚和胚乳)。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
如图1所示,首先从华中农业大学作物遗传改良国家重点实验室水稻全生育期表达谱芯片数据库CREP(http://crep.ncpgr.cn)(Wang et al.,2010)上发现了一个可能是胚乳特异表达的候选基因,在美国国立生物研究所网站NCBI(http://www.ncbi.nlm.nih.gov/)上获得该基因的序列,如SEQ ID No:2所示,共1278bp,以这1278bp序列设计引物来做qRT-PCR反应从而进一步确定其表达谱,qRT-PCR结果显示(图2):该基因仅在胚乳中表达。在此基础上用特异性引物以PCR的方法从水稻日本晴基因组中扩增得到一个被命名为pEnd1的启动子候选片段,将该启动子候选片段pEnd1装载到双元载体pCAMBIA1305.1(图3)上,装配成pEnd1-GUS载体(图5),将切掉35S启动子后的pCAMBIA1305.1载体命名为35S-free-GUS,作为阴性对照(图4),再通过农杆菌介导的遗传转化方法,将pEnd1-GUS和35S-free-GUS转入水稻受体Kitaake中。获得转基因植株后通过GUS组织化学染色分析,考察该启动子在水稻各个组织中的表达变化,进而验证和克隆该启动子。检测结果表明:在转35S-free-GUS的阳性植株中水稻各个组织均无GUS表达(图6),而在转pEnd1-GUS的阳性植株中GUS基因仅在转化植株的胚乳中大量表达,在其他组织如叶片、叶鞘、茎秆、根、幼穗中均不表达(图7)。
实施例2启动子的获得
(1)水稻种子胚乳特异性表达基因的筛选
荧光定量PCR筛选在水稻种子胚乳特异性表达的基因
选取日本晴水稻根、茎、叶片、叶鞘、幼穗及不同发育时期的水稻种子胚乳(6、9、12、15、18、21、24天),分别提取mRNA,反转录合成cDNA,通过荧光定量PCR鉴定水稻胚乳特异性表达基因(基因号:Os02g0202400)在不同组织及发育时期的表达谱,确定该基因在水稻胚乳中特异性表达。
(2)水稻种子胚乳特异性表达启动子片段的克隆
提取水稻日本晴(Oryza sativa L.公众可从中国水稻研究所获得)叶片基因组DNA作为模板,用引物1:5'-CCATGATTACGAATTCGACGATGAGCCGGTAACAAT-3'(下划线部分为接头)和引物2:5'-CTCAGATCTACCATGGCGATCACACCAAAATTAAAA-3'(下划线部分为接头)进行PCR扩增,得到2141bp的PCR产物。
PCR扩增的体系:KOD FX buffer 25μl、dNTP 6μl、基因组DNA(Nipponbare)4μl、Forward primer 2μl、Reverse primer 2μl、KOD FX 1μl、ddH2O 10μl,PCR扩增程序如下:95℃2min,98℃30s,58℃30s,68℃2.5min,35个循环,68℃5min。
产物经过测序,该PCR具有序列表中SEQ ID No:1所示的核苷酸,将其命名为pEnd1。
实施例3启动子的功能验证
1、转pEnd1水稻的获得
(1)重组载体的获得
将由实施例1得到的2141bp的PCR产物pEnd1与表达载体pCAMBIA1305.1(公众可从中国水稻研究所获得,在载体的结构示意图如图3所示)的连接是依赖于In-fusion重组的方法:先用EcoR I和NcoI双酶切载体pCAMBIA1305.1,将35S启动子切掉,再用带接头的PCR产物和经EcoR I和NcoI酶切过的载体在50℃进行In-fusion重组即可获得重组载体,将其命名为pEnd1-GUS(图5)。用EcoR I和Spe I双酶切表达载体pCAMBIA1305.1,将载体上的35S和catalase intron片段一起切掉,再用带EcoR I和Spe I接头的引物把catalase intron片段扩增出来,重新和EcoR I和Spe I酶切后的载体在50℃进行In-fusion重组即可获得不含35S的重组载体,将其命名为35S-free-GUS(图4)。
具体方法如下:
1)pCAMBIA1305.1载体用EcoR I和NcoI酶切
EcoR I和NcoI酶切体系(50μl):pCAMBIA1305.1质粒2μg、buffer 10μl、EcoR I 2μl、Nco I 2μl、ddH2O补足到50μl,37℃酶切2小时,回收11846bp的线性化pCAMBIA1305.1。
2)带接头的启动子pEnd1PCR产物扩增
以叶片基因组DNA作为模板,用带接头的引物进行PCR扩增出带EcoR I和NcoI接头的启动子pEnd1片段。
扩增体系(50μl)及PCR程序同上所述。
3)In-fusion重组
重组体系如下(2.5μl):线性化的pCAMBIA1305.1载体1μl、带接头的启动子pEnd1PCR产物1μl、In-fusion酶0.5μl,50℃重组30min,得到重组产物。
4)pCAMBIA1305.1载体用EcoR I和Spe I酶切
EcoR I和Spe I酶切体系(50μl):pCAMBIA1305.1质粒2μg、Buffer 10μl、EcoR I 2μl、Spe I 2μl,ddH2O补足到50μl,37℃酶切2h,回收线性化pCAMBIA1305.1。
5)带接头的catalase intron PCR产物扩增
以空pCAMBIA1305.1作为模板,用带接头的引物进行PCR扩增出带EcoR I和Spe I接头的catalase intron片段。
扩增体系(50μl)及PCR程序同上所述。
6)In-fusion重组
重组体系如下(2.5μl):线性化的pCAMBIA1305.1载体1μl、带接头的catalase intron PCR产物1μl,In-fusion酶0.5μl,50℃重组30min,得到重组产物。
将上述测序正确的pEnd1-GUS及35S-free-GUS质粒热激转化入Trans10大肠杆菌感受态细胞,得到克隆。
提取克隆质粒,酶切检测阳性克隆,结果表明pEnd1-GUS质粒为序列表中的SEQ ID No:1所示的pEnd1插入表达载体pCAMBIA1305.1中得到的载体,且插入的位置为GUS基因的前面(替换原来GUS基因前面的35S启动子),即为重组载体。
(2)、重组菌的获得
将重组载体pEnd1-GUS和35S-free-GUS热激转化根癌农杆菌EHA105菌株,得到重组菌。
提取重组菌的质粒,经过测序,该质粒分别为pEnd1-GUS和35S-free-GUS,说明含有该质粒的重组菌为阳性,命名为EHA105/pEnd1-GUS和EHA105/35S-free-GUS。
农杆菌热激转化法的具体方法如下:
1)将从-80℃冰箱中取出的农杆菌感受态放置于冰上,待其自然融化;
2)加入2μl质粒,轻轻弹匀,冰上放置30min;
3)放入液氮中5min;
4)37℃热激5min;
5)取出迅速插入冰上2min,加入无抗YEP液体培养基,28℃,150rpm摇4h;
6)吸取100μl菌液均匀涂布在含有卡纳霉素,利福平的YEP平板上,28℃倒置培养3-4天。
7)挑取单克隆于加入卡纳霉素,利福平的YEP液体培养基中,28℃,200rpm摇床中培养1天。
8)从中取0.2ml转接到20ml(1/100比例稀释)同样YEP抗性培养基中,同样条件下培养到OD600=0.5便可进行转化愈伤组织。
(3)、转pEnd1-GUS和35S-free-GUS水稻的获得及分子鉴定
1)转化
a)转化受体的选择
将成熟的水稻品种“Kitaake”种子去壳,经过一系列消毒后进行愈伤诱导和继代培养,挑选生长旺盛的愈伤用作转化的受体。
b)遗传转化
采用农杆菌介导的遗传转化方法(Hiei Y,Ohta S,Komari T,Kumashiro(1994),Efficient transformation of rice(Oryza sativa L.)mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA.The plant Journal,6:271-282),将含35S-free-GUS和重组载体pEnd1-GUS的EHA105菌株侵染水稻愈伤,在黑暗,25℃条件下共培养3天,在含有120mg/L G418的筛选培养基上培养,筛选抗性愈伤。将筛选到的抗性愈伤在预分化培养基上培养10天,再将预分化的愈伤转至分化培养基上在光照条件下培养。1个月后得到抗性转基因植株。
待根系生长良好,小苗长至8cm时打开盖炼苗5天,取出转基因苗并洗掉根上残留的培养基,移栽到土壤中,放到无阳光直射的温室中适当培养,然后移入室外栽培。得到T0代转基因水稻。
2)转基因阳性植株的鉴定
将T0代转基因水稻移入温室后,待其返青,然后分单株取一小段幼嫩叶片,提取其基因组DNA为模板,用PCR的方法检测转基因阳性植株。扩增片段为载体pCAMBIA1305.1上的部分片段加上启动子pEnd1的部分片段,大小为1074bp。引物序列为pEnd1-F:CCCAGGCTTTACACTTTATGCT,pEnd1-R:TTCACGGCTAGTCAATGGTTTT。
PCR扩增程序如下:95℃ 2min,98℃ 30s,58℃ 30s,68℃ 1min,35个循环,68℃ 5min。PCR产物经0.8%琼脂糖胶电泳检测。通过此方法,可剔除假阳性植株。
实施例4
转pEnd1-GUS和35S-free-GUS水稻GUS组织化学染色法验证启动子功能
分别取阳性T0代转pEnd1-GUS和35S-free-GUS水稻的根、茎秆、叶片、叶鞘、幼穗、小花、以及灌浆中期(开花后10到15天)的种子,分别将以上各组织切成适当大小并对种子进行横切或纵切。将切好的各个组织侵入GUS染液,抽真空10min,然后放入37℃培养箱中反应1h,观察是否出现GUS信号并拍照。
以T0代转35S-free-GUS水稻为阴性对照。
T0代转35S-free-GUS水稻的GUS组织化学染色结果如图6所示,可以看出,GUS基因在各个组织中均不表达。
T0代转pEnd1-GUS水稻的GUS组织化学染色结果如图7所示,可以看出,T0代转pEnd1-GUS水稻的GUS基因在种子的胚乳中具有表达活性(蓝色),而在其他部位均不表达。
因此,pEnd1为启动子,其可以启动目标基因如GUS在种子的胚乳中特异表达。
本技术领域技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域中的普通技术人员的一般理解相同的意义。还应该理解的是,诸如通用字典中定义的那些术语应该被理解为具有与现有技术的上下文中的意义一致的意义,并且除非像这里一样定义,不会用理想化或过于正式的含义来解释。
最后所应说明的是:以上实施例仅用以说明而非限制本发明的技术方案,尽管参照上述实施例对本发明进行了详细说明,本领域的普通技术人员应该理解:依然可以对本发明进行修改或者等同替换,而不脱离本发明的精神和范围的任何修改或局部替换,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺