具有功能失调的T3SS蛋白的抗菌性转基因植物的制作方法
本申请是申请号为201280021463.5、申请日为2012年3月1日、发明名称为“具有功能失调的t3ss蛋白的抗菌性转基因植物”的中国发明专利申请的分案申请,原申请为国际申请号为pct/il2012/050069的国家阶段申请,该国际申请要求申请日为2011年3月2日,申请号为61/448,223的美国申请的优先权。
本发明,在其些实施方式中,涉及抗菌性植物及制备所述植物的方法。
发明背景
青枯雷尔氏菌(rs),是一种分布广泛的革兰氏阴性的土壤传播性病原体,它属于β-亚门的蛋白菌,能导致超过200种植物的致死性萎蔫疾病,这些植物包括重要的经济作物,例如番茄,马铃薯和香蕉。细菌通过伤口进入植物根部,侵入木质部并通过脉管系统迅速蔓延至植物的气生部位。茎上很快可以发现超过1010每厘米的细胞群。rs的主要毒力因子是表多糖(eps),一种长的(超过106da)糖聚合物。表多糖能堵塞木质部并导致萎蔫症状,并最终导致植物死亡。
rs具有突出的蛋白分泌能力,其能分泌超过100种蛋白质。例如,ii型分泌系统(t2ss)分泌因子,包括植物细胞壁降解果胶酶,内切葡聚糖酶,以及最近发现的,毒力eps(图1a-c)。iii型分泌系统(t3ss)分泌促感染效应蛋白(t3e)进入宿主细胞,以优化宿主环境,并抑制入侵后的植物防御反应(图1a-c)。
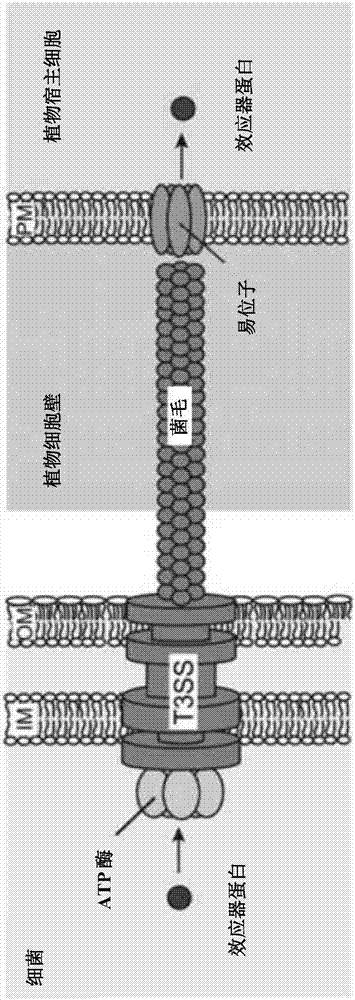
iii型分泌系统(t3ss)是革兰氏阴性菌的一个复杂的分子机器,其能将细菌蛋白(效应器)“注入”(转移入)真核细胞。为此,t3ss必须组装成一个多蛋白复合物,它由不同的部分组成:跨越两个细菌细胞膜与细胞质茎相连接的基体;连接在基体上的类似于分子注射器(注射体(injectisome)/菌毛)的针状结构;和能够重组成易位子的远端针尖结构。易位子是一种蛋白质复合物结构,其能插入宿主细胞的膜。菌毛仅由一种蛋白亚基组成。多个亚基寡聚成菌毛结构。所述针状结构,使细菌蛋白能通过所述针的内部通道(导管)被输送至宿主细胞(图1a-c)。
因此,t3ss的主要胞外成分是从所述装置的外膜部分延伸的针,并且通过该针形成
如前所述,虽然iii型效应器的主要功能是促进植物的易感性,一些效应器被能触发防御反应的植物抗性蛋白所识别,防御反应包括过敏性反应。所提供的一种克服革兰氏阴性菌所导致的植物致死性感染的方法,包括增强植物对此类病原体的免疫力。
美国专利申请号20090258825(he等)公开了用于增强植物抵御病原体(如细菌病原体)的组合物和方法。根据其教导,通过增加atmin相关的植物保护蛋白,如atmin7的活性,可有效增强植物针对丁香假单胞菌毒力蛋白hopm1的免疫力。
美国专利申请号20090044296(beer等)公开了增加植物生长或赋予植物抗病性的方法,所述方法通过使用适于增加或减少核酸分子表达的核酸分子,所述核酸分子编码hrpn相互作用蛋白(例如hipm)。其中所公开的缺失分析显示了解淀粉欧文氏菌hrpn(harpin)的198个氨基酸的n-末端区为与hipm相互作用所必需。这一hrpn的n-末端区为首次发现的无细胞过敏性反应激发剂,其在所述病原体的毒性中起着关键作用。
此外,由于其病原体所具有土壤传播的性质,细菌性萎蔫病较难控制。在rs感染的植物中,疾病的发展取决于ii型和iii型蛋白质分泌系统的作用,并且这些系统中的一个突变将产生非致病性细菌[poueymiro等,curr.opin.microbiol.(2009)12:44-52]。
roine等[roine等,febsletters(1997)417(2):168-172]表明,一旦纯化,hrpa,即丁香假单胞菌蕃茄致病变种(pseudomonassyringaepv.tomota)dc3000菌毛的结构蛋白,其本身就足以通过自组装形成丝结构。
taira等[taira等,molmicrobiol.(1999)34(4):737-44]在hrpa基因处产生插入突变(例如,插入五肽),并产生相应表达的突变细菌。根据其教导,hrpa的羧基末端区对于菌毛组装以及细菌与受影响的植物间相互作用是至关重要的。此外,wei等[wei等,pnas(2000)97(5):2247-2252]鉴定了在hrpa羧基端影响hrpa蛋白分泌或调节功能的三个单氨基酸突变。这些结果证明了hrp菌毛结构基因在蛋白分泌和丁香假单胞菌的iii型分泌系统的协同调节中的关键作用。此外,lee等[lee等,j.bio.chem.(2005):21409-17]公开了一些五肽诱导的非功能hrpa蛋白,当其在细菌中表达时,对野生型hrpa蛋白的功能产生强大的显性负性作用,从而阻断丁香假单胞菌诱导宿主反应并导致体内疾病的能力。显性负性hrpa突变体也能干扰野生型hrpa在体外自组装成菌毛。
weber等[weber和koebnik,j.bacteriology(2005)187(17):6175-6186]描述了若干hrp菌毛蛋白的疏水性绘图分析,所述hrp菌毛蛋白例如野油菜黄单胞菌疮痂病菌的hrpe和hrpa,以及青枯雷尔氏菌的hrpy,并发现了一个共同的结构域组织。这些结果表明,植物致病细菌,为了克服植物细胞壁的障碍,独立地进化出结构上类似的蛋白。weber等进一步公开了hrpec-端区域的五肽插入突变体能抑制hrp菌毛在野油菜黄单胞菌疮痂病菌中的组装。形态学研究揭示了这些插入突变体具有缩短的hrp菌毛。此显性负性作用表明,该突变体可能干扰了hrp菌毛的组装。美国专利申请号20100249234(yang等)公开了降低细菌毒力的方法,如hrpx/hrpy型系统或t3ss型系统。该方法包括将细菌与有效量的苯丙烷型抑制化合物相接触。
美国专利申请号20100099674(elofsson等)公开了在植物中降低细菌毒力的方法,其通过n-取代的7-喹啉基甲基胺抑制iii型分泌系统,特别地,其中一个是喹啉环上5-和8-位进一步被取代。
其它
背景技术:
包括美国专利申请号20050076406。
发明概述
本发明实施方式的一方面,提供了一种核酸表达载体,所述核酸表达载体包含核酸序列和顺式作用调控元件,所述核酸序列编码显性负性t3ss蛋白,所述顺式作用调控元件能够驱动所述核酸序列在植物细胞中转录,所述显性负性t3ss蛋白介导功能失调的针状复合物的组装。
本发明实施方式的一方面,提供了包含核酸序列的分离的多核苷酸,所述核酸序列编码如seqidno:2,4,6,8,10或12所示的序列。
本发明实施方式的一方面,提供了包含分离的多核苷酸的核酸表达载体,所述多核苷酸包含核酸序列,所述核酸序列编码如seqidno:2,4,6,8,10或12所示的序列。
本发明实施方式的一方面,提供了包含所述核酸表达载体的宿主细胞。
本发明实施方式的一方面,提供了包含所述核酸表达载体的基因修饰植物。
本发明实施方式的一方面,提供了表达外源多核苷酸的基因修饰植物,所述外源多核苷酸编码如seqidno:2,4,6,8,10或12所示的显性负性t3ss蛋白。
本发明实施方式的一方面,提供了生成植物的方法,所述植物与未修饰的植物相比,包含针对细菌病原体的增强的抗性,所述方法包括将所述核酸表达载体引入植物或植物细胞,由此生成的植物与未修饰的植物相比,包含针对细菌病原体的增强的抗性。
评价植物针对细菌病原体的抗性的方法,所述方法包括:(a)在植物中表达外源核酸序列和顺式作用调控元件,所述外源核酸序列编码显性负性t3ss蛋白,所述顺式作用调控元件能够驱动所述核酸序列在植物细胞中转录;(b)使细菌病原体作用于所述植物;和(c)比较所述植物和野生型植物的疾病,所述野生型植物被培养于相同条件下并被所述细菌病原体感染,由此评价所述植物针对所述细菌病原体的抗性。
根据本发明的一些实施方式,所述核酸序列包含seqidno:1,3,5,7,9或11。
根据本发明的一些实施方式,所述核酸序列包含seqidno:20-65。
根据本发明的一些实施方式,所述核酸序列编码如seqidno:2,4,6,8,10或12所示的多肽。
根据本发明的一些实施方式,所述核酸表达载体还包含附加核酸序列,所述附加核酸序列编码位于所述核酸序列上游的内质网信号肽。
根据本发明的一些实施方式,所述顺式作用调控元件包含启动子序列。
根据本发明的一些实施方式,所述启动子序列是组成型启动子。
根据本发明的一些实施方式,所述组成型启动子是camv35s启动子。
根据本发明的一些实施方式,所述显性负性t3ss蛋白通过引入突变而产生,所述突变选自插入突变、缺失突变和取代突变。
根据本发明的一些实施方式,所述插入突变包含嵌入闭锁元件。
根据本发明的一些实施方式,所述t3ss蛋白是t3ss结构蛋白。
根据本发明的一些实施方式,所述t3ss结构蛋白是hrp蛋白。
根据本发明的一些实施方式,所述t3ss蛋白选自青枯雷尔氏菌hrpy蛋白,丁香假单胞菌hrpa蛋白,解淀粉欧文氏菌hrpa蛋白,野油菜黄单胞菌hrpe蛋白,亚洲梨火欧文氏菌hrpa蛋白和白叶枯黄单胞菌hrpe蛋白。
根据本发明的一些实施方式,所述t3ss蛋白是青枯雷尔氏菌易位子蛋白。
根据本发明的一些实施方式,所述青枯雷尔氏菌易位子蛋白选自popf1和popf2。
根据本发明的一些实施方式,所述宿主细胞是植物细胞。
根据本发明的一些实施方式,所述植物与未修饰的植物相比,包含针对细菌病原体的增强的抗性。
根据本发明的一些实施方式,所述细菌病原体是革兰氏阴性菌。
根据本发明的一些实施方式,所述革兰氏阴性菌选自青枯雷尔氏菌,丁香假单胞菌,解淀粉欧文氏菌,野油菜黄单胞菌和白叶枯黄单胞菌。
根据本发明的一些实施方式,所述革兰氏阴性菌是变形菌种。
根据本发明的一些实施方式,所述变形菌是青枯雷尔氏菌。
根据本发明的一些实施方式,所述植物选自作物植物,装饰植物和树。
根据本发明的一些实施方式,所述植物选自番茄植物,马铃薯植物,茄植物,香蕉植物,甜椒植物,橄榄植物,苹果植物,梨植物,火棘植物,海棠植物,山楂植物,栒子植物,榲桲植物,花楸植物,拟南芥植物,天竺葵,姜植物,烟草植物及桉树植物。
根据本发明的一些实施方式,所述植物是番茄植物。
除非特别定义,本文所使用的所有技术和/或科学术语的含义与本发明所属领域内普通技术人员通常理解的含义相同。下文描述了实施本发明的示例性的方法和/或材料,但是在实施或测试本发明的实施方式时,可以使用与本文所述相似或等同的方法和材料。万一有冲突时,以本发明的说明书,包括定义,为准。此外,所述材料、方法和实施例仅用于举例说明,并不一定为了限制。
附图简述
仅通过举例,并且参考所附附图,本文描述了本发明的一些实施方式。在具体参考附图时,需要特别注意的是,通过例子显示的细节仅仅是为了举例讨论本发明的实施方式。在这方面,说明书和附图一起向本领域技术人员清楚地展示了可以怎样实施本发明的实施方式。
附图中:
图1a说明了革兰氏阴性菌的ii型分泌系统(t2ss)、iii型分泌系统(t3ss)和iv型菌毛。该图摘自donnenbergm.s.,nature(2000)406:768-774。
图1b-c摘自buttner和he,plantphysiology(2009)150:1656-64,说明了植物病原菌(图1b)和动物病原菌(图1c)的t3ss复合物。分泌装置跨越细菌细胞膜并与细胞质atp酶相联。植物病原菌具有理论上能跨越植物细胞壁的菌毛。动物病原菌具有短的针状结构,其通过所谓尖端复合物(在植物病原体中则缺失)与易位子相连接。易位子在宿主质膜中形成通道,并允许效应器蛋白转运进所述宿主细胞的胞液中。
图2a-f的图显示了青枯雷尔氏菌(rs)hrpy蛋白(seqidno:14)与志贺氏菌t3ss针状单体mxih(seqidno:15,图2a),志贺氏菌mxih的结构模型(图2b-e)和整体针状结构(图2f)的比对。mxih和针状结构的图摘自deane等,pnas2006103:12529-33。
图3a-e的图片显示了显性负性蛋白t3ss嵌入闭锁元件1(t3ssibe1)(图3a,seqidno:2)和2(t3ssibe2)(图3c,seqidno:4),t3ssibe1和2的结构的预测模型(分别为图3b和3d),针和针状导管相互作用的模型(图3e)和来自sp|q56yt0|lac3_at漆酶或tr|q6tds6|q6tds6_gosar分泌漆酶棉属arboreum的植物分泌信号(分别为seqidno:16和17)。图3b,3d和3e摘自deane等,pnas2006103:12529-33。
图4a-c的图片显示了显性负性蛋白t3ss嵌入闭锁元件3(图4a,seqidno:6),t3ssibe3结构的预测模型(图4b)和与针的相互作用模型(图4c)。图4b和4c摘自deane等,pnas2006103:12529-33。
图5a-c的图片显示了显性负性蛋白t3ss嵌入闭锁元件4(图5a,seqidno:8),闭锁元件的预测模型(图5c),和针(图5b)。图5b和5c摘自deane等,pnas2006103:12529-33。值得注意的是,重复的尾部可能会与不同单体相互作用,干扰和阻断所述针通道。
图6a-d的图片显示了显性负性蛋白t3ss嵌入闭锁元件5(图6a,seqidno:10)和6(图6c,seqidno:12)和t3ss嵌入闭锁元件5和6的结构的预测模型(图6b和6d)。值得注意的是,hrpy的头部和尾部α-螺旋被脯氨酸破坏,这样的形变可能会阻断针的通道并干扰针的功能。图6b和6d摘自deane等,pnas2006103:12529-33。
图7a-c的图片显示了不同的青枯雷尔氏菌(rs)hrpy显性负性蛋白。图7a显示了t-dna克隆图。通过xbai和saci位点,每个嵌入闭锁元件(ibe)被克隆至camv35s启动子的下游和nos终止子的上游。图7b显示了与针状结构相互作用的模型,图7c显示了不同的hrpy突变(seqidno:2,4,6,8,10和12)。图7b摘自deane等,pnas2006103:12529-33。
图8的图片摘自taira等,molmicrobiol.(1999)34(4):737-44,其显示了插入突变以及它们在hrpa基因(seqidno:18)中的位置。简单的说,496bpbamhi±ecori片段编码hrpa菌毛,片段中的突变插入位点用棒糖形标记表示,标记上的数字表示突变号。每个插入包括10个来自转座子的碱基对,在其上游的5个碱基对在所述10个碱基对的下游向远端重复。氨基酸序列(seqidno:19)写在核苷酸序列下面。启动子中的hrp盒用方框表示;假设的核糖体结合位点以下划线表示。氨基末端蛋白的加工位点用氨基酸序列下方的箭头标记。带箭头的方框突变号表示四个缺失突变的起始和终点。
图9是青枯雷尔氏菌hrpy多肽变体(即菌株间微小的序列变化,seqidno:14和70-86)的比对。
10a-c的图片显示了番茄植物的pcr和sqrt-pcr分析,所述番茄植物表达萎蔫抗性(wiltr)hrpy突变6。用构建体转化番茄植物,所述构建体携带hrpy突变6,并且用基因组pcr和半定量rt-pcr对植物进行进一步分析。检测到这些hrpy突变的表达。
图11a-c的图片显示了表达萎蔫抗性(wiltr)hrpy突变1的番茄植物的pcr和sqrt-pcr分析。用携带hrpy突变1的构建体转化番茄植物,并用基因组pcr和半定量rt-pcr对植物进行进一步分析。检测到这些hrpy突变的表达。
图12a-c的图片显示了番茄植物的pcr和sqrt-pcr分析,番茄植物表达萎蔫抗性(wiltr)hrpy突变2。用携带hrpy突变2的构建体转化番茄植物,并且用基因组pcr和半定量rt-pcr对植物进行进一步分析。检测到这些hrpy突变的表达。
本发明具体实施方式的说明
本发明,在一些实施方式中,涉及抗菌性植物及制备所述植物的方法。
通过参考附图和所附描述可以更好的理解本发明的原理和操作。
在对本发明的至少一个实施方式进行详细说明前,应当理解,本发明的应用并不一定限于如下文描述或由实施例所举例说明的细节。本发明可以有其它实施方式或以各种方式来实施或执行。同样地,也应理解,本文所用的措辞和术语是用于描述的目的,不应该被理解为用于限制。
在完成本发明的一些实施方式时,本发明的发明人制备了显性负性细菌iii型蛋白质分泌系统(t3ss)蛋白,它在植物细胞中表达并从中分泌。本发明的所述新型显性负性t3ss蛋白在其组装过程中嵌入t3ss针状结构中,并阻断细菌针状结构通道,从而保护植物不受细菌感染。
本发明的显性负性t3ss蛋白的设计是基于保留并利用了天然t3ss蛋白(例如hrpy)亚单位-亚单位间的相互作用位点,并整合了通过蛋白翻译形成的融合的通道阻断肽或t3ss蛋白的变形结构(例如hrpyα-螺旋),从而阻止细菌效应器从细菌分泌到植物细胞中。加入其中的植物分泌信号允许植物细胞中表达显性负性蛋白并从植物细胞中分泌出来。当细菌菌毛在靠近植物细胞壁处组装时,分泌的显性负性t3ss蛋白能接近正在组装的菌毛。因此,如下文实施例部分中所示,本发明的发明人制备了革兰氏阴性菌t3ss针通道(t3ss-ibe)的嵌入闭锁元件。通过hrpy蛋白(seqidno:14)的结构修饰,产生青枯雷尔氏菌的t3ss-ibe(seqidno:2,4,6,8,10和12),所述hrpy蛋白为rs针状结构的结构单元。本发明进一步产生了表达载体,所述表达载体包含这些用于转化植物细胞的t3ss-ibe。此外,本发明的发明人已经示出用青枯雷尔氏菌hrpy突变体1,2或6转化番茄植物,及其表达(分别参见图11a-c,图12a-c和图10a-c)。此外,本发明构思转基因植物中修饰的rs易位子蛋白(popf1)的过表达。这些蛋白的过表达能阻断t3ss的组装,这是由于这些蛋白能与不成熟的针状结构相互作用,并因此导致其失活。因此,修饰的popf1蛋白被整合入易位子门并将其阻断。总而言之,本发明的教导可以在用于产生抗菌性植物的农业领域中作为有力工具。
因此,根据本发明的一个方面,提供了一种制备植物的方法,所述植物与未修饰的植物相比,包含针对细菌病原体的增强的抗性,该方法包括将所述核酸表达载体引入植物或植物细胞,由此制备的植物,与未修饰的植物相比,包含针对细菌病原体的增强的抗性。
本文所用的术语“植物”包括整个植物,所述植物的先代和后代和植物部分,包括种子,芽,茎,根(包括块茎),植物细胞,组织和器官。植物可以是任何形式的,包括悬浮培养物,胚胎,分生组织区,愈伤组织,叶,配子体,孢子体,花粉和小孢子。在本发明所述方法中特别有用的植物包括所有属于超家族植物界的植物,特别是单子叶和双子叶植物,包括草料或饲料豆科,观赏植物,粮食作物,树,或灌木植物,其选自相思树属,宏基属,猕猴桃属,七叶树属,贝壳杉芦苇,合欢阿马拉,桫三色,须芒草属,花生属,槟榔,阿斯特瑞雅(astelia)桂花,黄芪鹰嘴豆,多小叶红苏木,桦属,芸苔属,艳紫铆木榄,伯克苏森,灰树花,伞形科植物(cadabafarinose),朱樱花属,茶树,美人蕉,辣椒属,槐属,距瓣豆属毛竹,木瓜属,肉桂,小果咖啡,可乐豆木,绣球小冠花,栒子黑樱桃,山楂属,黄瓜属,柏木属,桫椤荆,榅桲,柳杉,香茅属,银白树蕨(cyntheadealbata),榅椁,黄檀属(dalbergiamonetaria),骨碎补属,蚂蝗属,粗糙蚌壳蕨,拢双黄茅(dibeteropogonamplectens),镰扁豆属,扁豆属,dorycniumrectum,金字塔稗,ehraffia属,穇,麸属,刺桐属,桉树属,施氏假乌木属,金茅红丁香属,荞麦属,费约果属,草莓属,千斤拔属,河岸藤露兜树(freycinetiabanksli),天竺葵,银杏属,罗德毛豆属,南洋樱属,陆地棉,银桦属,鞘籽古夷苏木属,岩黄芪属,hemaffhiaaltissima,黄茅属,大麦,红苞茅属,连翘,hypeffheliadissolute,靓蓝水俣,鸢尾属,虎耳草,胡枝子属,莴苣属,银合欢属,loudetiasimplex,lotonusbainesli,莲花属,阿切尔扁豆,平邑属,木薯,苜蓿,水杉,大蕉,烟草属,红豆属,鸟足豆属,水稻属,巴西盾,非洲狼尾草属,酪梨,矮牵牛属,菜豆,加拿利海枣,红叶石楠属,新西兰剑麻,云杉青冈,松属,豌豆属,罗汉松托塔拉,pogonarthriafleckii,pogonaffhriasquarrosa,杨属,牧豆瓜叶菊,花旗松,老虎刺属,西洋梨,栎属,厚叶石斑木,尼卡香棕,火炬纳塔尔,醋栗属,香茶属,刺槐,蔷薇属,悬钩子属,柳属,红裂稃草(schyzachyriumsanguineum),sciadopitysvefficillata,红杉,巨杉,高粱,菠菜属,鼠尾粟,stiburusalopecuroides,矮柱花草(stylosanthoshumilis),葫芦茶属,落羽杉,菅草,红三叶属,小麦属,铁杉属太子参,越桔属,蚕豆属,葡萄,锥穗沃森花(watsoniapyramidata),马蹄莲,玉米,苋菜,朝鲜蓟,芦笋,花椰菜,抱子甘蓝,白菜,油菜,胡萝卜,菜花,芹菜,亚麻,羽衣甘蓝(flax),羽衣甘蓝(kale),扁豆,油菜,秋葵,洋葱,马铃薯,水稻,大豆,秸秆,甜菜,甘蔗,向日葵,番茄,南瓜茶,树木。或者,藻类和其他非植物界可用于本发明的方法。
根据具体的实施方式,所述植物是茄科植物。
根据具体的实施方式,所述植物是茄属植物。
根据另一具体的实施方式,所述茄属植物是番茄(番茄(lycopersicumesculentum))。
根据另一具体的实施方式,所述植物包括:马铃薯(马铃薯(solanumtuberosum));番茄(蕃茄(lycopersicumesculentum));茄子(茄植物)(茄子(solanummelongena));香蕉(芭蕉科属);天竺葵(通用名)(天竺葵(pelargonium));姜(姜(zingiberofficinale));烟草(烟草(nicotianatabacum));甜椒(辣椒属);橄榄(oleaeuropea)拟南芥植物,桉树,苹果,海棠,梨,火棘,山楂,栒子,榅桲或花揪植物。
如本文所用的术语“细菌病原体”是指任何类型的毒力细菌菌种或菌株,其能感染植物,包括,但不限于,假单胞菌属,欧文氏菌相关的菌株,青枯雷尔氏菌和野油菜黄单胞菌。所述细菌可以是假单胞菌属,包括金色假单胞菌,绿针假单胞菌,荧光假单胞菌,边缘假单胞菌,丁香假单胞菌,托拉氏假单胞菌,蘑菇假单胞菌和绿黄假单胞菌。所述细菌可能是欧文氏菌相关的菌株,包括达旦迪基氏菌(菊欧文氏菌),软腐欧文氏菌,黑腐欧文氏菌和解淀粉欧文氏菌。这种细菌可能是野油菜黄单胞菌相关的菌株,包括十字花科黑腐病菌(xcc)和白叶枯黄单胞菌。
根据本发明的实施方式,所述细菌是革兰氏阴性菌。
根据具体的实施方式,所述革兰氏阴性菌是变形菌种。
根据另一个具体的实施方式,所述变形菌是青枯雷尔氏菌。
根据另一个具体的实施方式,所述革兰氏阴性菌选自青枯雷尔氏菌,丁香假单胞菌,解淀粉欧文氏菌,欧文氏psidii,亚洲梨火欧文氏菌,野油菜黄单胞菌和白叶枯黄单胞菌。
如本文使用的短语“增强的抗性”是指,减少细菌的毒力,从而与非修饰植物相比,降低宿主植物的易感性,所述未修饰植物被相同的细菌病原体感染。根据本发明的教导,降低细菌的毒力是通过表达与细菌毒力相关的显性负性蛋白(例如针状复合物,如下文进一步详细描述)来起作用,并可影响与宿主相关的细菌的生命周期中的任何一步,包括但不限于,粘附,侵入,复制,逃避宿主防御及传送到新宿主。
针对细菌病原体的抗性增强可表现为宿主中的症状减少,因此,可以通过监测宿主中与细菌相关的反应的减少来检测。增强的抗性可以表现为,相对于适当的对照(例如在相同条件下的非修饰的植物),至少减少了约1%,至少减少了约5%,至少减少了约10%,至少减少了约20%,至少减少了约30%,至少减少了约40%,至少减少了约50%,至少减少了约60%,至少减少了约70%,至少减少了约80%,至少减少了约90%,或至少减少了约100%的与细菌病原体相关的症状,这可以通过本领域技术人员公知的任何测定法测量。
本发明的方法可以通过将核酸表达载体引入植物起作用,所述核酸表达载体包含核酸序列和顺式作用调控元件,所述核酸序列编码显性负性t3ss蛋白,所述顺式作用调控元件能够驱动所述核酸序列在植物细胞中转录,所述显性负性t3ss蛋白介导功能失调的针状复合物的组装。
本文使用的术语“t3ss”是指细菌(例如革兰阴性菌)的iii型分泌系统(也称为ttss),其通常以针状结构起作用,可直接从细菌细胞分泌蛋白质。t3ss针状复合物通常始于该细菌的细胞质中,穿过两层膜并伸出细胞(参见,例如图1a)。固定在膜上的部分是t3ss的底座(或基体)。胞外部分是针(也命名为菌毛)。作为通向宿主细胞细胞质的门的最后一个结构是易位子。(参见图1b-c)。所谓的内杆将针与底座连接。
如本文使用的术语“t3ss蛋白”指的是一种蛋白质,其构成t3ss分泌系统复合物。这包括结构蛋白,即构建底座的蛋白,内杆,针,尖端或易位子。针本身通常由单一t3ss蛋白的许多单位构成。因此,t3ss蛋白的差异大多数是那些构建底座以及那些被分泌进宿主的蛋白。
根据本发明的实施方式,t3ss蛋白是一种蛋白质,如hrp(过敏性反应和致病性的)蛋白,其组成t3ss针状结构。示例性的hrp蛋白包括,但不限于,青枯雷尔氏菌hrpy蛋白,丁香假单胞菌hrpa蛋白,解淀粉欧文氏菌hrpa蛋白,亚洲梨火欧文氏菌hrpa蛋白和野油菜黄单胞菌hrpe蛋白(示例性的蛋白质,参见下表1,其引自buttner和he,plantphysiology(2009)150:1656-1664并且并入本文]。
表1:示例性的t3ss蛋白
注:xcv-野油菜黄单胞菌辣椒斑点病致.病变种,xoo-水稻黄单胞菌水稻致病变种根据一具体的实施方式,野生型青枯雷尔氏菌hrpy多肽如seqidno:14所示。根据另一实施方式,青枯雷尔氏菌hrpy多肽包含如seqidno:70-86所示的变体。根据一具体的实施方式,野生型丁香假单胞菌hrpa多肽如seqidno:19所示。根据一具体的实施方式,野生型解淀粉欧文氏菌hrpa多肽如seqidno:88所示。根据一具体的实施方式,野生型野油菜黄单胞菌hrpe多肽如seqidno:90所示。根据一具体的实施方式,野生型白叶枯黄单孢菌hrpe多肽如seqidno:92所示。
根据另一实施方式,t3ss蛋白是易位子蛋白,如青枯雷尔氏菌易位子蛋白popf1或popf2(分别为seqidno:67和69)。
根据一具体的实施方式,野生型亚洲梨火欧文氏菌hrpa多肽如seqidno:100所示。
本文使用的短语“显性负性t3ss蛋白”是指具有结构改变的基因产物的t3ss蛋白,所述基因产物能与细菌分泌的野生型t3ss蛋白相互作用,但介导功能失调的针状复合物的形成(例如,不能穿透宿主细胞,无法转运效应器蛋白进入宿主细胞,或与野生型蛋白相比,能力下降)。细菌功能失调的针状复合物可以是结构变形(例如,部分或完全被阻断或变形,从而使得它不能转运效应蛋白至宿主细胞),或可部分组装或根本没组装。通常情况下,本发明的显性负性t3ss蛋白能降低细胞的感染性和致病性。测定感染性的方法为本领域所熟知。
因此,显性负性t3ss蛋白降低了针状复合形物组装和/或功能,因此,与具有由野生型t3ss蛋白组成的针状结构的细菌相比,致病性细菌的感染性降低约5%,约10%,约20%,约30%,约40%,约50%,约60%,约70%,约80%,约90%或约100%。
值得注意的是,根据一个具体的实施方式,显性负性蛋白由植物细胞外源地表达至细菌。
通常情况下,显性负性t3ss蛋白由基因编码,所述基因在野生型蛋白编码序列中包含一个或多个突变,如插入突变,缺失突变或取代突变。这些突变可包含野生型t3ss蛋白的单个核酸的改变(例如,包括β阻断氨基酸,如脯氨酸或其合成类似物),或者可以包含2,3,4,5,6,7,8,9,10,15,20,25或更多的核酸改变。另外,突变可以包括在t3ss蛋白中,单一肽的插入(3,4,5,10个氨基酸长),或若干肽的插入(例如,五肽插入)。
可实施于本发明肽的示例性单氨基酸突变,包括在hrpa基因23位的甘氨酸被丙氨酸取代,hrpa基因54位的丙氨酸被谷氨酸取代,hrpa基因93位的赖氨酸被异亮氨酸取代,hrpa基因95位的门冬氨酸被丝氨酸取代,hrpa基因101位的异亮氨酸被苏氨酸取代,hrpa基因111位的异亮氨酸被脯氨酸取代。
可插入本发明所述肽的示例性的五肽插入如seqidno:20-65所示(参见下表2)。
可以理解的是,t3ss基因中任何位点的突变都可能生成显性负性蛋白。对于hrpa基因,描述了核酸插入和缺失的示例性位点,参见下文的图8和表2[来自taira等,molmicrobiol.(1999)34(4):737-44,并且并入本文]。
如前所述,根据具体的实施方式,本发明的显性负性t3ss蛋白保留了蛋白-蛋白相互作用位点,这使得它能够以高亲和力与同源的野生型细菌蛋白结合并形成针状结构,但是,由于显性负性蛋白中的突变,所得到的针状结构功能失调。
因此,本发明考虑了能使针状复合物功能失调的t3ss基因中或对t3ss基因的任何突变。
根据本发明的一个实施方式,插入突变包括嵌入闭锁元件(ibe)。包含ibe的显性负性t3ss蛋白通常与同源蛋白形成亚基-亚基相互作用,同时整合入翻译水平上融合的通道-闭锁元件(例如,肽)或使t3ss蛋白结构变形(例如hrpyα-螺旋),从而阻止细菌效应器从细菌分泌至植物细胞中(参见,下文实施例部分的实施例1)。
根据本发明这方面的一个实施方式,所述核酸序列编码如seqidno:2,4,6,8,10或12所示的肽。
根据另一实施方式,通过与不成熟的针相互作用,显性负性t3ss蛋白能够阻断t3ss组装(例如,显性负性易位子蛋白提前与针相互作用,从而干扰t3ss组装并使其失活(参见下文实施例部分的实施例3)。
表2:示例性五肽插入和hrpa基因中核酸插入和缺失的位点
根据本发明的这方面的核酸序列可以是互补多核苷酸序列(cdna),基因组多核苷酸序列和/或复合多核苷酸序列(例如,上述的组合)。
本文使用的短语“互补多核苷酸序列”是由信使rna通过逆转录酶或任何其它rna依赖性dna聚合酶反转录而形成。这样的序列随后可在体内或体外用dna依赖性dna聚合酶进行扩增。
本文使用的短语“基因组多核苷酸序列”是指这样的序列,其来源(分离)于染色体,因此其代表了染色体连续的部分。
本文使用的短语“复合多核苷酸序列”是指这样的序列,其至少部分地互补并且至少部分为基因组序列。复合序列可以包括一些外显子序列,这些序列为编码本发明所述多肽所必需,也包括一些相互间隔的内含子序列。内含子序列可以是任何来源,包括其它基因,并且通常包括保守的剪接信号序列。这样的内含子序列可以进一步包括顺式作用表达调控元件,如下文中将进一步详细描述的。
根据一个具体的实施方式,所述核酸序列包含如seqidno:1,3,5,7,9和11所示的插入。
在本发明所述方法中有用的构建体可以使用本领域技术人员熟知的重组dna技术来构建。基因构建体可被插入到商业可获得的载体中,该载体适于转化入植物,并适于在转化细胞中表达目标基因。基因构建体可以是表达载体,其中所述异源核酸序列可操作地连接至能在植物细胞中表达的顺式作用调控元件。
本文使用的短语“顺式作用调控元件”是指多核苷酸序列,优选启动子,其与反式作用调控子结合,并调控位于其下游的编码序列的转录。
本文使用的短语“可操作地连接”是指功能性地放置顺式调控元件(如启动子)使其能调控所选择的核酸序列的表达。例如,按照转录和翻译的方向,启动子序列可能位于所选择的核酸序列的上游。
优选地,本发明所述核酸构建体中的启动子是植物启动子,其用于指导异源核酸分子在植物细胞内的表达。
可以理解的是,编码嵌入元件(如seqidno:2,4,6,8,10或12所示)的新型核酸序列是一种用于在细菌或植物细胞中表达的核酸表达载体或其一部分。
本文使用的短语“植物启动子”是指至少能够诱导,赋予,激活或增强在植物(优选单子叶或双子叶植物)细胞、组织或器官中表达的启动子序列,其包括加入其中或包含其中的任何其它调控元件。这样的启动子可以来自于植物,细菌,病毒,真菌或动物来源。这样的启动子可以是组成型的,即,能够在多种植物组织中指导高水平的基因表达,组织特异性的,即,能够在一个或多个特定的植物组织中指导基因表达,诱导型的,即,能够在刺激下指导基因表达,或嵌合型的,即,由至少两个不同的启动子的一部分形成。
组成型植物启动子的例子包括,但不限于,camv35s启动子和camv19s启动子,fmv34s启动子,甘蔗杆状病毒启动子,csvmv启动子,拟南芥act2/act8肌动蛋白启动子,拟南芥泛素ubq1启动子,大麦叶硫堇bth6启动子,和水稻肌动蛋白启动子。
根据一个具体的实施方式,启动子是组成型启动子,例如camv35s启动子。
可用于本发明一些实施方式的其他示例性启动子如表3,4,5和6所示。
表3
用于实施本发明的一些实施方式的示例性组成型启动子
表4
用于实施本发明的一些实施方式的示例性种子首选启动子
表5
用于实施本发明的示例性花特异性启动子
表6
用于实施本发明的备选稻谷启动子
本发明的核酸构建体还可以包含其它核酸序列,所述核酸序列编码内质网信号肽,其允许显性负性t3ss前肽转运至内质网,并通过分泌途径。这样的信号肽通常在框内与多肽的氨基末端(即其上游)相连接,并将编码的多肽导向细胞分泌途径,并最终分泌(例如,分泌至质外体)。
通过er将多肽直接导向胞外的示例性分泌信号序列包括sp|q56yt0|lac3_at漆酶(seqidno:16)的植物分泌前导肽,和tr|q6tds6|q6tds6_gosar(seqidno:17)的植物分泌前导肽。
可用于本文的其它示例性信号肽包括烟草致病相关蛋白(pr-s)信号序列(sijmons等,1990,bio/technology,8:217-221),凝集素信号序列(boehn等,2000年,transgenicres,9(6):477-86),菜豆富含羟脯氨酸糖蛋白的信号序列(yan等,1997,plantphyiol.115(3):915–24和corbin等,1987,molcellbiol7(12):4337-44),马铃薯糖蛋白(patatin)信号序列(iturriaga,g.等,1989,plantcell1:381-390和bevan等,1986,nuc.acidsres.41:4625-4638)和大麦α-淀粉酶信号序列(rasmussen和johansson,1992,plantmol.biol.18(2):423-7)。
根据本发明的实施方式,本发明的核酸构建体可进一步包含翻译增强子,如ω-翻译增强子。
本发明一些实施方式中的多肽的核酸序列可以优化用于植物表达。这样的序列修饰的例子包括,但不限于,将g/c含量改为更接近在目标植物种中通常发现的含量,常被称为密码子优化的将植物物种中非典型的密码子除去。
短语“密码子优化”指的是选择适当的dna核苷酸以用于结构基因或其片段内,其接近于目标植物中密码子使用。因此,优化的基因或核酸序列是指这样的基因,其中天然或天然存在的基因的核苷酸序列已被改变,以便在植物内使用统计学首选或统计学优选的密码子。核苷酸序列通常在dna水平检测,并且用任何适当的方法确定植物种类中优化用于表达的编码区,例如sardana等所述(1996,plantcellreports:15:677-681)。在该方法中,密码子使用的标准偏差,密码子使用偏好的检测的计算,可通过先找到天然基因每个密码子使用相对于高表达植物基因中每个密码子使用的平方比偏差,然后计算平均方差。所使用的公式为:1sdcu=n=1n[(xn–yn)/yn]2/n,其中xn是指在高表达植物基因中密码子n的使用频率,而yn是指在目标基因中密码子n的使用频率,n是指目标基因中密码子的总数。双子叶植物高表达基因使用的密码子的表符合murray等的数据(1989,nucacidsres.17:477-498)。
根据针对特定植物细胞类型使用的优选密码子优化核酸序列的一种方法,是基于直接使用密码子优化表,例如在密码子使用数据库通过日本nias(国家农业生物资源研究所(nationalinstituteofagrobiologicalsciences))dna库(www.kazusa.or.jp/codon/)在线提供的那些,而无需进行任何额外的统计计算。密码子数据库包含用于许多不同物种的密码子使用表,每个密码子使用表均基于genbank中的数据经统计确定。
通过使用上述的表来确定特定物种(例如,稻谷)中对于每个氨基酸的最优选或最偏好的密码子,编码目标蛋白质的天然存在的核苷酸序列可以根据特定植物物种进行密码子优化。这是通过将特定物种基因组中统计学上的出现率可能低的密码子,替换为对于某一氨基酸的相应的统计学上更偏好的密码子。然而,可以选择一个或多个较不偏好的密码子,以删除存在的酶切位点,以在潜在有用的接头处(5'和3'端添加信号肽或终止盒,内部位点,其可以用来将片段切割和剪接在一起,以产生正确的全长序列)创建新的酶切位点,或用来消除可能会对mrna的稳定性或表达产生负面影响核苷酸序列。
在进行任何修饰前,天然存在的编码核苷酸序列可能已经包含许多对应于特定植物物种中统计学上偏爱的密码子。因此,天然核苷酸序列的密码子优化可能包括在天然核苷酸序列里确定那些对于特定植物并不是统计学上偏爱的密码子,并根据特定植物的密码子使用表修改这些密码子,以产生密码子优化的衍生物。对于植物密码子的使用,修饰的核苷酸序列可完全或部分被优化,只要与相应的自然存在的或天然基因编码的蛋白相比,由修饰的核苷酸序列所编码的蛋白质产生的水平更高。在例如pct专利申请93/07278中描述了通过改变密码子使用来构建合成基因。
因此,本发明的一些实施方式,包括上文所述的核酸序列,其片段,与其杂交的序列,与其同源的(homologous)序列,与其直系同源的(orthologous)序列,用不同的密码子编码类似多肽的序列,具有突变特征的改变的序列。所述突变包括一个或多个核苷酸的缺失,插入或取代,无论是天然存在的或人为诱导,无论是随机的或有针对性的方式形成。
可以用本发明的一些实施方式的核酸构建体对植物细胞进行稳定或瞬时转化。在稳定转化中,本发明一些实施方式的核酸分子被整合入植物基因组中,因此它代表了稳定且遗传的特性。对于瞬时转化,由转化细胞表达核酸分子,但核酸分子并没有整合到基因组中,因此具有短暂表达的特性。
有各种不同的方法将外源基因引入单子叶和双子叶植物(potrykus,i.,annu.rev.plant.physiol.,plant.mol.biol.(1991)42:205-225;shimamoto等,nature(1989)338:274-276)。
将外源dna稳定整合入植物基因组dna的原理方法包括两个主要的途径:
(i)农杆菌介导的基因转移:klee等(1987)annu.rev.plantphysiol.38:467-486;klee和rogers,cellcultureandsomaticcellgeneticsofplants,vol.6,molecularbiologyofplantnucleargenes,编辑schell,j.,和vasil,l.k.,academicpublishers,圣地亚哥,加利福尼亚州(1989)p.2-25;gatenby,plantbiotechnology,编辑kung,s.和arntzen,c.j.,butterworthpublishers,波士顿,马萨诸塞州(1989)p.93-112。
(ii)直接dna摄取:paszkowski等,cellcultureandsomaticcellgeneticsofplants,vol.6,molecularbiologyofplantnucleargenes编辑schell,j.,和vasil,l.k.,academicpublishers,圣地亚哥,加利福尼亚州(1989)p.52-68;包括直接摄取dna进入原生质体的方法,toriyama,k.等,(1988)bio/technology6:1072-1074。通过短暂电休克植物细胞诱导的dna摄取:zhang等plantcellrep.(1988)7:379-384.fromm等nature(1986)319:791-793。通过粒子轰击注射dna进入植物细胞或组织,klein等.bio/technology(1988)6:559-563;mccabe等bio/technology(1988)6:923-926;sanford,physiol.plant.(1990)79:206-209;通过使用微量移液器系统:neuhaus等,theor.appl.genet.(1987)75:30-36;neuhaus和spangenberg,physiol.plant.(1990)79:213-217;玻璃纤维或硅碳化物颈须转化细胞培养物、胚胎或胼胝组织,美国专利号5,464,765或通过dna直接与正在发育的花粉孵育,dewet等,experimentalmanipulationofovuletissue,eds.chapman,g.p.和mantell,s.h.和daniels,w.朗曼,伦敦(1985)p.197-209;以及ohta,proc.natl.acad.sci.usa(1986)83:715-719。
农杆菌系统包括使用质粒载体,所述质粒载体包含确定的dna片段,其被整合入植物基因组dna。植物组织接种的方法根据植物物种和农杆菌递送系统的不同而不同。广泛使用的方法是叶盘(leafdisc)方法,其可以通过能为整个植物分化提供良好来源的任何组织外植块来进行。horsch等,plantmolecularbiologymanuala5,kluweracademicpublishers,多德雷赫特(1988)p.1-9。补充的方法采用农杆菌与真空渗透相结合。农杆菌系统对于产生转基因双子叶植物方面是特别可行的。
有各种方法将dna直接转移至植物细胞中。电穿孔法将原生质体与强电场短暂接触。显微注射法用非常小的微量移液器将dna机械地直接注射进入细胞。微粒轰击法则将吸附dna的微发射体,如硫酸镁晶体或钨颗粒,用物理加速打入植物细胞或组织。
稳定转化后的植物可以进行繁殖。植物繁殖最常用的方法是用种子。但是,通过种子繁殖再生有不足之处,因为种子是由植物根据孟德尔法则决定的遗传变异而产生的,由于杂合现象作物间缺乏统一性。基本上,每个种子基因不同,并且将各自带着其自身的具体特征成长。因此,产生的转化植物优选具有与亲代转基因植物相同的特征和特性。因此,转化植物优选通过微繁殖再生,所述微繁殖提供快速,一致的转化植物的再生。
微繁殖是从单个组织中生长出新一代植物的过程,所述单个组织切除自选定的亲代植物或栽培种。这个过程允许植物的大量繁殖,所述植物具有表达融合蛋白的优选组织。产生的新一代植物基因上与原植物完全相同,并具有原植物的所有特征。微繁殖允许优质的植物材料在很短的时间内大量产生,以及使选定的栽培种能快速成倍成长,并保留原转基因或转化植物的特性。克隆植物的优点为植物繁殖的速度以及其产生的植物的质量和均一性。
微繁殖是一个多阶段的过程,需要改变各阶段间的培养基或生长条件。因此,微繁殖过程涉及四个基本阶段:第一阶段,最初的组织培养;第二阶段,组织培养倍增;第三阶段,分化和植物的形成;以及第四阶段,温室培养和硬化。在第一阶段,最初的组织培养,建立组织培养并确认无污染。在第二阶段,初始的组织培养倍增直至产生足够数量的组织样本,以满足制备目标。在第三阶段,第二阶段生长的组织样本分开成并生成为单个小植株。在第四阶段,转化的植物被转移到温室中硬化,其中植物对光的耐受性逐渐增加,以便它可以在自然环境中生长。
虽然目前优选稳定的换化,本发明的一些实施方式还构想了叶细胞、分生组织细胞或整个植物的瞬时转化。
可以通过上述任何直接dna转移方法进行瞬时转化,或使用改性植物病毒通过病毒感染进行。
已证明病毒可用于植物宿主的转化,病毒包括,camv,tmv和bv。用植物病毒转化植物的描述见美国专利号4,855,237(bgv),ep-a67,553(tmv),日本公开申请号63-14693(tmv),epa194,809(bv),epa278,667(bv)和gluzman,y.等,communicationsinmolecularbiology:viralvectors,冷泉港实验室,纽约,pp.172-189(1988)。wo87/06261描述了用于在许多宿主,包括植物,中表达外源dna的假病毒颗粒。
上述参考文献,以及dawson,w.o.等,virology(1989)172:285-292;takamatsu等emboj.(1987)6:307-311;french等science(1986)231:1294-1297;和takamatsu等febsletters(1990)269:73-76证明了植物rna病毒的构建,所述rna病毒用于在植物中引入并表达非病毒外源核酸序列。
当病毒是dna病毒时,可对病毒本身作适当修饰。或者,可将该病毒首先克隆到细菌质粒,以便于构建带有外源dna的所需病毒载体。然后,可从质粒上切下该病毒。如果病毒是dna病毒,可以将细菌复制起点与病毒dna连接,然后由细菌对其进行复制。该dna的转录和翻译将产生外壳蛋白,所述外壳蛋白会将病毒dna包装。如果病毒是rna病毒,通常将该病毒的cdna克隆插入质粒。然后用所述质粒进行所有的构建。然后通过转录质粒的病毒序列产生rna病毒,通过翻译病毒基因产生外壳蛋白,并用外壳蛋白包装病毒rna。
上述参考文献,以及美国专利号5,316,931描述了植物rna病毒的构建,所述植物rna病毒用于在植物中引入并表达非病毒外源核酸序列,所述核酸序列如本发明一些实施方式中所包括的那些。
本发明的一个实施方式提供了一种植物病毒核酸,所述病毒核酸中删除了天然外壳蛋白编码序列,插入了非天然植物病毒外壳蛋白编码序列和非天然启动子,优选使用非天然外壳蛋白编码序列的亚基因组启动子,所述非天然植物病毒外壳蛋白编码序列能在植物宿主中表达,包装重组植物病毒核酸,并确保重组植物病毒核酸系统地感染宿主。或者,可以通过在所述病毒核酸中插入非天然核酸序列使外壳蛋白基因失活,从而不产生蛋白质。重组植物病毒核酸可以含有一种或多种其它非天然亚基因组启动子。每个非天然亚基启动子能够在植物宿主中转录或者表达邻近的基因或核酸序列,并能够互相重组以及与天然亚基因组启动子重组。如果包括一个以上核酸序列,可以在邻近天然植物病毒亚基因组启动子或天然和非天然植物病毒亚基因组启动子处插入非天然(外源)核酸序列。在亚基因组启动子的控制下,在宿主植物中转录或表达非天然核酸序列,从而产生所需产物。
在第二个实施方式中,提供了与第一个实施方式相同的重组植物病毒核酸,不同的是天然外壳蛋白编码序列被置于与非天然外壳蛋白亚基因组启动子中的一个相邻,而不是与非天然外壳蛋白编码序列相邻。
在第三个实施方式中,提供了重组植物病毒核酸,其中天然外壳蛋白基因与其亚基因组启动子相邻,并且一个或多个非天然亚基因组启动子都已经被插入到病毒核酸中。插入的非天然亚基因组启动子能够在植物宿主中转录或表达相邻的基因,但不能互相重组以及与天然亚基因组启动子重组。可以插入非天然核酸序列使其与非天然亚基因组植物病毒启动子相邻,使得所述序列在亚基因组启动子的控制下,在宿主植物中转录或表达,以产生所需产物。
在第四个实施方式中,提供了与第三个实施方式相同的重组植物病毒核酸,不同的是用非天然外壳蛋白编码序列替换天然外壳蛋白编码序列。
用由重组植物病毒核酸编码的外壳蛋白包装病毒载体,以产生重组植物病毒。所述重组植物病毒核酸或重组植物病毒能感染适当的宿主植物。所述重组植物病毒核酸能够在宿主中复制,在宿主中系统性扩散,并且在宿主中转录或表达外源基因(分离的核酸),以产生所需的蛋白质。
除上述外,本发明一些实施方式所述的核酸分子也可以被引入到叶绿体基因组中,从而使叶绿体表达。
将外源核酸序列引入到叶绿体基因组中的技术是已知的。所述技术涉及以下步骤。首先,化学处理植物细胞,使每个细胞的叶绿体数量减少到1左右。然后,通过粒子轰击将外源核酸引入细胞中,目的是在叶绿体中引入至少一个外源核酸分子。选择外源核酸,从而通过同源重组将其整入叶绿体基因组中,同源重组可以容易地通过叶绿体固有的酶进行。为此,除了目标基因外,外源核酸包括至少一段来自于叶绿体基因组的核酸序列。此外,外源核酸包括可用于筛选的标记,通过筛选,所述标记可以确保全部或几乎全部的叶绿体在其基因组中包括外源核酸。有关该技术的更详细的描述见美国专利号4,945,050和5,693,507,其通过参考并入本文。因此,可以通过叶绿体蛋白表达系统产生多肽,并整合入叶绿体的内膜。
根据本发明的其他方面,提供了宿主细胞,所述宿主细胞包含本发明所述的核酸表达载体。
本发明中的“宿主细胞”是指新的单个细胞,其通过将核酸表达载体引入细胞而产生,所述核酸表达载体包含编码显性负性t3ss蛋白的核酸序列。根据具体的实施方式,宿主细胞是植物细胞。宿主细胞可以包含作为染色体外(游离的)复制分子的核酸构建体,或可选地,可包含被整合在宿主细胞的细胞核或质体基因组中的嵌合基因。
根据本发明的再一个方面,提供了一种基因修饰植物,所述基因修饰植物包含本发明的核酸表达载体。
根据本发明的再一个方面,提供了一种表达外源多核苷酸的基因修饰植物,所述外源多核苷酸编码显性负性t3ss蛋白,如seqidno:2,4,6,8,10或12所示。
根据具体的实施方式,与未修饰的植物相比,表达显性负性t3ss蛋白的基因修饰植物对细菌病原体的抗性增强(如上文中详细描述)。
可以理解的是,当指一个基因修饰植物或植物细胞,本发明人还指由此产生的后代。
可以通过核酸或蛋白质的探针(例如抗体)验证外源mrna和/或多肽的存在,来选择繁殖产生的后代或从转化植物得到的后代。或者,可以通过检测对细菌病原体抗性的增强,来验证本发明的显性负性t3ss蛋白的表达,所述检测是通过感染基因修饰植物和野生型(即非修饰的相同类型的植物),并比较所述植物的疾病(例如,观察植物萎蔫)。
本发明还提供了评价植物对细菌病原体的抗性的方法,所述方法包括:(a)在植物内表达外源核酸序列和顺式作用调控元件,所述外源核酸序列编码显性负性t3ss蛋白质,所述顺式作用调控元件能够驱动核酸序列在植物细胞中的转录;(b)使细菌病原体作用于所述植物,以及(c)比较所述植物和野生型植物的疾病,所述野生型植物被培养于相同条件下并被所述细菌病原体感染。
本文所述的细菌病原体可能会在植物中引起各种疾病。因此,例如,青枯雷尔氏菌可能会引起青枯萎蔫病,蘑菇假单胞菌可能导致滴落性烂鳃病(例如,对于栽培蘑菇),托拉氏假单胞菌可能引起细菌斑(例如,对于栽培蘑菇),野油菜黄单胞菌可能引起黑腐病(例如,十字花科蔬菜,如甘蓝型油菜和拟南芥),白叶枯黄单胞菌可能引起细菌枯萎病(如稻谷),解淀粉欧文氏菌可能导致火疫病(例如,对于苹果和梨),软腐欧文氏菌可能会导致细菌软腐病。
因此,例如,对于萎蔫病,通常由认定者(不知治疗情况)在2
本文使用的术语“约”是指±10%。
术语“包含(comprises)”,“包含(comprising)”,“包括(includes)”,“包括(including)”,“具有(having)”及它们的组合是指“包括但不限于”。
术语“由……组成”是指“包括并且限于”。
术语“基本由……组成”是指组合物,方法或结构,其可以包括其他组分,步骤和/或部分,但只有当其他组分,步骤和/或部分不实质性地改变所要求保护的组合物,方法或结构的基本和新颖的特性时。
除非上下文清楚地另有规定,本文所用单数形式的“一(a)”,“一个(an)”和“所述”包括复数指代。例如,术语“化合物”或“至少一种化合物”可包括多种化合物,包括其混合物。
在本申请中,本发明的各种实施方式可以以范围的形式呈现。应当理解,范围形式中的描述仅仅是为了方便和简洁起见,不应该被解释为对本发明范围的硬性限制。因此,范围的描述应当被理解为具体地公开了所有可能的子范围,以及该范围内的各个数值。例如,范围的描述如1至6应被视为已具体公开了以下子范围,例如1至3,1至4,1至5,2至4,2至6,3至6等,以及在该范围内的各个数值,例如,1,2,3,4,5和6。这适用于无论多广的范围。
每当本文指出一个数值范围时,所指的是包括在所指出范围内的任何引用的数字(分数或整数)。本文互换使用的短语“介于”第一个指示的数和第二个指示数间或“在”第一个指示的数和第二个指示的数“的范围间”,“从(ranging)/从(rangesfrom)”第一个指示的数“至”第二个指示的数,是指包括所述第一个和第二个指示的数以及它们之间的所有分数和整数。
本文使用的术语“方法”是指为完成给定任务的方式,手段,技术和程序,包括,但不限于,方式,手段,技术和程序,它们或者是化学,药学,生物学,生物化学和医学领域已知的,或可容易地通过上述领域的从业人员从公知的方式,手段,技术和程序得到。
可以理解,为清楚起见,描述于各个实施方式的上下文中的本发明的某些特征,也可以被组合在一个实施方式中。反之,为简洁起见,在单个实施方式的上下文中描述的本发明的不同特征,也可以单独地或以任何合适的子组合或适用于任何其他的本发明的实施方式中提供。各种实施方式的上下文中描述的某些特征不被认为是这些实施方式的必要特征,除非所述实施方式没有这些元素是不起作用的。
如上文所述以及如本发明的权利要求所要求的本方面的各个实施方式和方面,可以在下文的实施例中找到实验性支持。
实施例
现在参考下面的实施例,其与上文的描述一同以非限制的方式对本发明进行说明。
一般来说,本文所使用的术语,以及在本发明中使用的实验程序,包括分子生物学,生物化学,微生物学和重组dna技术。这些技术在文献中已有详细解释。参见,例如,“molecularcloning:alaboratorymanual”sambrook等,(1989),“currentprotocolsinmolecularbiology”卷i–iii,ausubel,r.m.编辑(1994);ausubel等,“currentprotocolsinmolecularbiology”,johnwiley和sons,巴尔的摩,马里兰州(1989);perbal,“apracticalguidetomolecularcloning”,johnwiley和sons,纽约州(1988)watson等,“recombinantdna”,scientificamericanbooks,纽约;birren等(eds)“genomeanalysis:alaboratorymanualseries”卷1-4,coldspringharborlaboratorypress,纽约(1998年);如美国专利号4,666,828,4,683,202,4,801,531,5,192,659,和5,272,057,“cellbiology:alaboratoryhandbook”,卷i-iiicellis,j.e.编辑(1994),“currentprotocolsinimmunology”卷i-iiicoliganj.e.编辑(1994);stites等(eds),“basicandclinicalimmunology”(第8版),appleton&lange,诺沃克,康涅狄格州(1994);mishell和shiigi(eds),“selectedmethodsincellularimmunology”,w.h.freemanandco.,纽约(1980)描述的方法;可用的免疫测定法,其被广泛描述于专利和科学文献中,参见,例如,美国专利号3,791,932;3,839,153;3,850,752;3,850,578;3,853,987;3,867,517;3,879,262;3,901,654;3,935,074;3,984,533;3,996,345;4,034,074;4,098,876;4,879,219;5,011,771和5,281,521;“oligonucleotidesynthesis”gaitm.j.编辑(1984);“nucleicacidhybridization”hames,b.d.,和higginss.j.,编辑(1985),“transcriptionandtranslation”hames,b.d.,和higginss.j.,编辑(1984),"animalcellculture"freshney,r.i.,编辑(1986);"immobilizedcellsandenzymes"irlpress,(1986);"apracticalguidetomolecularcloning"perbal,b.,(1984)以及"methodsinenzymology"vol.1-317,academicpress;"pcrprotocols:aguidetomethodsandapplications",academicpress,圣地亚哥,加利福尼亚州(1990);marshak等,"strategiesforproteinpurificationandcharacterization-alaboratorycoursemanual"cshlpress(1996);上述所有通过参考完整并入本文。本文件提供了其它一般参考文献。其中的过程相信为本领域所公知,将其提供以方便读者。其中包含的所有信息通过参考并入本文。
实施例1
在植物中制备并表达青枯雷尔氏菌iii型分泌系统(t3ss)针通道的嵌入闭锁元件
材料及实验程序
基因合成,密码子使用的表达:
根据如前所述[deane等,pnas2006103:12529-33]的弗氏志贺菌(mxih)的t3ss针的三维模板设计t3ss-ibe变体,所述模板代表假设的hrpy的自然结构模型(图2a-f)。
系统地合成青枯雷尔氏菌(rs)hrpy嵌入闭锁元件(hy-ibe)基因,并将其优化用于目标植物密码子使用。植物特异分泌前导肽被融合至hy–ibe的5’端,从而将成熟蛋白转运和定位于质外体或细胞壁内。
双载体中克隆并转化:
通过xbai和saci限制性位点,合成片段被克隆至基于pbi121质粒(ncbigenebank编号af485783)的转化载体中camv35s组成型启动子的下游和nos终止子的上游,所述合成片段由具有5’未翻译的增强子的ibe1-6编码区组成(图7a)。
如之前对烟草植物所述[参见,例如,svab,z.,p.hajdukiewicz和p.maliga(1975)transgenictobaccoplantsbyco-cultivationofleafdiskswithppzpagrobacteriumbinaryvectors.in“methodsinplantmolecularbiology-alaboratorymanual”,p.maliga,d.klessig,a.cashmore,w.gruissem和j.varner,编辑,coldspringharborpress:55-77],对于番茄植物,拟南芥植物和桉树植物,以及桉树植物[spokeviciusav.,vanbeverenk.,leitchma和bossingerg.(2005)agrobacterium-mediatedinvitrotransformationofwood-producingstemsegmentsineucalypts.plantcellreports,volume23(9),617-624]作用土壤杆菌-转化方法。
番茄植物转化
如前所述转化番茄植物[qiu等,scientiahorticulturae112(2007)172-175]。简言之:
植物材料
对番茄种子,蕃茄(l.esculentum)m82在70%酒精里进行表面消毒30秒,并用无菌水洗10秒,然后在1%次氯酸钠溶液中灭菌10分钟,并用无菌水洗两次共30分钟,随后播种于培养基a中(如表7所示)。种子播种在品红盒里,在24℃光照16小时和黑暗8小时使其发芽。播种的半直立苗的子叶在萌芽后4-5使用。
培养基,抗生素和激素
培养基msb5(m0404)获取自sigmachemicalco.,并存储在2-8℃。蔗糖和葡萄糖室温下保存。植物培养基中还使用了卡那霉素,羧苄青霉素,头孢噻肟,利福平,zr,iaa,iba(如下面的表7中描述)。
表7:在番茄转化方法中使用的植物培养基
(摘自qiu等,scientiahorticulturae112(2007)172-175并入本文)
不同培养基的成分
菌株和质粒
对于转化实验,使用含有目标基因的土壤杆菌。在本研究中所用的双载体是包含作为选择标记的nptii基因的pbi121;本研究中所用的土壤杆菌菌株载有利福平选择标记。细菌在lb培养基中生长过夜,培养基中含抗生素(利福平30mg/l,卡那霉素100mg/l),稀释至od600=0.2,并在无抗生素的lb中生长至希望od600。细菌悬浮液在50毫升隼(falcon)管中于4000rpm下离心15分钟。细菌重悬于b1培养基中,并用于共培养实验。
转化方法
子叶的制备如下:从幼苗中非常小心地切除子叶,以防止擦伤。分离的子叶仅在基底和侧面切割,并倒置到培养基b(如表7所示)上。约50个外植块被置于单个有盖培养皿(petridish)中培养过夜。次日在有盖培养皿(petridish)中将外植体小心的浸入土壤杆菌接种物中20分钟。将其在无菌纸上印干,并转移到新的培养基b中。72小时后,将外植体转移到含有培养基c(如表7所示)的盘中。每3周将外植体传代至相同的培养基中。在约6-8周后,切除芽,并转移到培养基e(如表7所示)中。转化频率表示为从中回收芽的子叶数量对培育的外植体总数的百分比。
表达和克隆确认:
使用常规的分子方法,如pcr,rt-pcr,以及western分析法分析t3ss-ibe在植物基因组中的整合及表达[如前所述,参见,例如sambrookj.和russelldw.,molecularcloning:alaboratorymanual,coldspringharborlaboratorypress;第3版(2001年1月15日)],所述分子方法中使用ibe1-6特异性引物,所述western分析使用抗ibe的多克隆抗体。具体而言,用于hrpy1突变体的pcr引物为正向引物:
tctctttgctctcctttatagccctac和反向引物:
tcgcagcgtctaacatatcttgttgtc(分别为seqidno:95-96);用于hrpy2突变体的引物为正向引物:gtcacatggttcgttggtgtactcttc和反向引物:
catctgggttctattcagcgcattttg(分别为seqidno:97-98);并且用于hrpy突变体6的引物为正向引物:gtcttgttcctgtctaccttgctcc和反向引物:
gagattaggtctttcgcagctttgg(分别为seqidno:93-94)。
生物测定:
用生物测定测试转基因植物的每个转基因株相对于野生型(即,不表达ibe基因)的抗性水平。使用了三种生物测定方法:
1.浸泡土壤-接种无创伤的19至20天的植物:所述接种通过将细菌悬液倒入土壤中直至终密度约1×108cfu/g土,然后在28℃保温。用无菌水模拟接种对照植物。由评价者每天对症状以0至4的疾病指数进行评分,评价者并不知晓治疗,其中0表示没有疾病,1表示1
2.带柄接种–切割下叶未创伤的19至21天植物,将2微升细菌悬液,以终密度约1×108cfu/ml滴到开叶柄上。用无菌水模拟接种对照植物。由评价者每天对症状以0至4的疾病指数进行评分,评价者并不知晓治疗,其中0表示没有疾病,1表示1
3.茎接种–接种未创伤的19至21天的植物,所述接种通过用无菌刀垂直切割茎。向1厘米长和0.5厘米深的伤口注射100μl终密度约1×108cfu/ml的细菌悬液。用无菌水模拟接种对照植物。由评价者每天对症状以0至4的疾病指数进行评分,评价者并不知晓治疗,其中0表示没有疾病,1表示1
结果
本发明通过对hrpy蛋白的结构修饰,生成了青枯雷尔氏菌(rs)iii型分泌系统(t3ss)针通道的植物表达闭锁元件(t3ss或t3ss-ibe的嵌入闭锁元件),用于保护植物不得萎蔫病,所述hrpy蛋白为所述针的构建单体。将转基因植物(作物和木本)中结构修饰的hrpy(seqidno:2,4,6,8,10和12和在图2a-f,图3a-d,图4a-c,5a-c和6a-d中详细描述)整合入rs的天然菌毛,使其功能失活,并且与野生型植物相比,阻止或减少rs对转基因植物的细菌感染。设计表达t3ss-ibe的转基因植物,使其分泌t3ss-ibe至细胞外,t3ss-ibe在细胞外组装成进行攻击的rs的菌毛,从而使所述菌毛无功能或功能失调。具有嵌入在细菌菌毛中的结构修饰的植物源性蛋白的细菌,能使t3ss无功能,并因此无法克服植物的天然防御。这样的转基因抗性植物是能够抵御rs感染的。
根据如前所述的shigelaflexneri(mxih)t3ss针的三维模型[deane等,pnas2006103:12529-33],设计t3ss-ibe的变体。基于这个模型,预计结构修改的rshrpy能产生修饰的t3ss针单体,所述针单体能嵌入针结构内,并阻断针通道和导管。植物细胞壁降解果胶酶,内切葡聚糖酶,和毒力eps和效应蛋白质都通过所述导管转运进入或通过宿主细胞壁(图1a-c)。因此,修饰后的菌毛含有位于菌毛导管内的结构变化了的蛋白质结构域,并因此可理解为可以在功能上和物理上阻断导管。该菌毛由于结构不稳定将终止其早期组装,这导致相对短的菌毛,并将进一步损害其功能及将蛋白转移至植物的能力。这种合理的设计基于在保护和利用天然hrpy的亚单位-亚单位相互作用位点的同时,在翻译水平上整合融合的通道阻断肽和/或使α-螺旋结构变形。这些t3ss-ibe包含植物分泌信号,从而能从植物细胞分泌至细胞外的空间。
如上文中“材料和实验方法”部分中所述,通过用构建子转化蕃茄,从而产生萎蔫抗性(wiltr)的番茄植物,所述构建子载有青枯雷尔氏菌hrpy突变1,2或6(分别为seqidno:1,3和11)。通过基因组pcr和半定量rt-pcr进一步分析这些植物,所述分析使用特异于hrpy突变1的引物(seqidno:95-96),特异于hrpy突变2的引用(seqidno:97-98)或特异于hrpy突变6的引物(seqidno:93-94)。测定转化的蕃茄植物中hrpy突变1,2或6的表达(分别参见图11a-c,图12a-c和图10a-c)。
实施例2
在植物中制备和表达不同细菌的t3ss-ibe
除了上文实施例1中描述的ibe外,正通过上述方法开发和识别针对其它革兰氏阴性菌的其它ibe。例如,通过下述方法开发ibe:通过绘制菌毛构建蛋白的结合区域,确定在天然菌毛在体内形成时,结合并整合入天然菌毛的候选肽,对候选肽进行修饰,从而使导管不能分泌效应蛋白和产生修饰的候选ibe。
修饰可包括任何基于以下原则的那些修饰:
在概念上而言,天然蛋白质可以根据许多不同方法中的一种或多种来进行修饰,所述不同方法包括:
1.将翻译融合体加入天然蛋白的n-末端区域,天然蛋白如ibe1,2和3,其带有(ibe1&3)或不带有(ibe2)天然n-末端结构域,以及在天然n-末端结构域之前(ibe1)或之后(ibe3)(参见图3a-d,4a-c和7c)。
2.将翻译融合体加入天然蛋白的c-末端区域,天然蛋白如ibe4,其带有或不带有氨基酸桥,所述氨基酸桥使得翻译融合片段能够旋转运动(参见图5a-c和7c)。这样的桥可以是,例如,一个或多个甘氨酸或丙氨酸残基。
3.将脯氨酸氨基酸加入沿天然结构单元序列的随机点,如ibe5或6中(参见图6a-d和7c)。
4.插入五肽。
实施例3
在植物中制备和表达修饰的青枯雷尔氏菌易位子蛋白(popf1)
本发明采用的另一种方法是在转基因植物中过表达野生型(wt)和修饰rs易位子蛋白(如popf1或popf2)。popf1popf2是针门的结构单元,并在毒力和植物过敏性反应(hr)中发挥重要作用。过表达的野生型和修饰的popf1/f2蛋白通过与不成熟的针的相互作用能阻止t3ss组装。在该过程的最后阶段,通常会出现细菌控制的针延伸以及易位子蛋白。转基因易位子蛋白过早地与针相互作用,干扰受控制的连续的t3ss组装并使其失活。因此,修饰的popf1/f2蛋白被整合入易位子门,并阻止它或使其结构变形从而引起功能失调。综上所述,本发明的教导能允许野生型和修饰的popf1蛋白被转基因植物输出至质外体/细胞壁。
虽然本发明已结合其具体的实施方式进行了描述,显而易见的是,许多替换,修改和变化对于本领域技术人员将是显而易见的。因此,其意在包括落入本发明权利要求书精神和范围之内的所有这些替换,修改和变化。
在本说明书中提到的所有公开文献、专利和专利申请全文并入本文的说明书中,其并入的程度相当于每个单独的公开文献、专利或专利申请被具体地和单独地指出从而通过引用并入本文。此外,本申请中对任何参考文献的引用或标识并不应解释为承认这些参考文献是本发明的现有技术。本文中各章节使用的标题不应该被解释为限制性的。
- 还没有人留言评论。精彩留言会获得点赞!