无抗生素表达外源基因的蓝藻工程菌系统及其制备和应用的制作方法
本发明涉及一种蓝藻工程菌系统的制备方法和应用,具体涉及一种无抗生素筛选并持续高效表达外源基因的聚球藻(Synechococcus sp.)PCC7002工程菌系统的制备方法和应用,为蓝藻在发酵工业化中低成本更安全大规模表达外源基因提供了一条途径。
背景技术:
由于蓝藻光合自养、易于基因操作、生长速度快等特点,目前文献上和工业中已有很多利用蓝藻作为生物反应器来表达外源基因的例子,比如:蚊幼毒蛋白基因、脂肪酸不饱和酶基因、羟丁酸聚合酶基因、催化二十碳五烯酸(EPA)合成的脱氢基因、纤维素基因。目前主要通过两种方式将外源基因转入蓝藻:(1)通过穿梭表达载体,定位在染色体基因组外,独立自主进行复制和表达;(2)整合载体,含有蓝藻基因组同源片段,可以选择性地将外源基因嵌合在染色体特定位点上。由于第一种方法穿梭载体的拷贝数低,基因表达量少,所以目前普遍应用的技术是第二种整合载体的方法:在聚球藻PCC7002中,应用pAQ1-Ex整合载体,将外源基因嵌合在聚球藻内源性质粒pAQ1上,并进行表达。
但是这些技术都是利用抗生素去筛选阳性菌株,并为了防止今后发酵培养中工程菌丢失外源基因,在培养液中要持续加入抗生素。使用抗生素有许多缺点:(1)而抗生素的培养压力,会导致工程菌的生长速度降低,增加蓝藻的培养时间,增加发酵成本;(2)使用抗生素本身也需要一定的成本;(3)抗生素会造成对环境的污染;(4)抗生素还会影响产品的安全性。所以抗生素的使用,不仅增加了发酵工业的成本,也造成了对环境的污染以及不可靠的产品安全性。
技术实现要素:
本发明的目的是提供一种无抗生素表达外源基因的蓝藻工程菌系统的制备方法和应用,用以解决蓝藻反应器需要依赖抗生素的培养压力来表达外源基因的技术问题。
本发明利用编码光系统Ⅱ组成蛋白CP43的psbC基因缺失和回复作为选择标记,来筛选阳性克隆,并作为选择压力使得外源基因能在无抗生素的培养条件下持续表达,从而构建了一种无抗生素筛选并持续高效表达外源基因的聚球藻(Synechococcus sp.)PCC7002工程菌系统的制备方法。
本发明的第一方面,提供了一种蓝藻工程菌表达系统,包括:聚球藻PCC7002的psbC基因缺失突变体△psbC和用于表达外源基因的整合载体,所述整合载体具有核心元件FlanKA—P1—MCS—P2—psbC—FlanKB,其中:FlanKA和FlanKB代表聚球藻PCC7002内源质粒pAQ3的两段同源片段,交换区域在C0006和C0007基因间区;MCS是用于插入外源基因的多克隆位点;P1代表一种蓝细菌启动子,能够调控插入到MCS中的外源基因的表达;P2代表用于启动psbC基因表达的启动子;psbC代表psbC基因序列。
野生型聚球藻PCC7002能够在无甘油的培养基上生长,例如无甘油的普通A+培养基,而聚球藻PCC7002的△psbC突变体必须用含有甘油的培养基培养,例如含甘油的A+培养基。
外源基因通过基因工程手段插入到MCS中。将携带了外源基因的整合载体导入聚球藻PCC7002的△psbC突变体中后,同源片段FlanKA和FlanKB能将整合载体上的“P1—MCS—P2—psbC”片段整合到聚球藻PCC7002内源质粒pAQ3的C0006和C0007的基因间区,其中“P2—psbC”能够回复聚球藻PCC7002的△psbC突变体的psbC基因缺失。
上述P1启动子可以是任何一种能够在蓝细菌中调控基因表达的启动子,可以是增强型、组成型或诱导型启动子,例如蓝细菌的强启动子PcpcBA、Cu2+浓度诱导型启动子PpetE。
上述P2启动子优选为psbC基因的启动子PpsbDC。
在本发明的一个实施例中,所构建的整合载体pAQ3-Ex包含核心元件“FlanKA—PcpcBA—MCS—PpsbDC—psbC—FlanKB”,该核心元件的序列如序列表中SEQ ID No:25所示。其中第1~1007位核苷酸序列是FlanKA,第1014~1604位核苷酸序列是PcpcBA,第1611~1808位核苷酸序列是MCS,第1815~2126位核苷酸序列是PpsbDC,第2133~3589位核苷酸序列是psbC,3596~4617位核苷酸序列是FlanKB。
本发明的第二方面,提供了上述蓝藻工程菌表达系统的构建方法,包括:
A.聚球藻PCC7002的psbC基因缺失突变体△psbC的构建:通过PCR和酶切连接技术获得“psbC基因上游同源臂T1—选择性标记基因—psbC基因下游同源臂T2”的DNA片段,将该DNA片段转入野生型聚球藻PCC7002中,利用同源双交换,使选择性标记基因替换预期灭活的psbC基因,得到聚球藻PCC7002的△psbC突变体;
B.整合载体的构建:PCR扩增聚球藻PCC7002内源质粒pAQ3的两段同源片段FlanKA和FlanKB、蓝细菌启动子P1、多克隆位点MCS、启动子P2、psbC基因,然后用酶切连接的方式构建“FlanKA—P1—MCS—P2—psbC—FlanKB”这一排列顺序的DNA片段,将该DNA片段连入一质粒载体中,得到整合载体。
在聚球藻PCC7002的△psbC突变体的构建中,所述选择性标记基因常用的是抗生素抗性基因,例如kan抗性基因。
在整合载体的构建中,所述“FlanKA—P1—MCS—P2—psbC—FlanKB”DNA片段连入的质粒载体可以是各种系列的原核表达载体,例如质粒pGEM-7zf。
本发明的第三方面,提供了一种利用上述蓝藻工程菌表达系统表达外源基因的方法,包括以下步骤:
1)将外源基因插入整合载体的多克隆位点区,得到表达载体;
2)用表达载体转化聚球藻PCC7002的△psbC突变体,在无甘油培养基上筛选出阳性菌株,然后利用无甘油培养基培养阳性菌株并检测外源基因的表达,实现无抗生素培养来表达外源基因的目的。
上述步骤2)所述无甘油培养基通常是无甘油的普通A+培养基,培养条件一般是在25℃、1%CO2空气、50μE/m2.s的光强下。
在本发明的实施例中,将这种方法应用在表达GFP蛋白上,发现利用这种方法得到的工程菌能在无抗生素的培养条件下高效持续表达GFP蛋白并且其生长速度与野生型菌株相近。这些结果证明了本发明具有实际可行性。
本发明可以让蓝藻不用依赖抗生素培养压力来高效表达外源基因,这不仅可以缩短培养时间并大大降低利用蓝藻做生物反应器的成本,更可以减少因抗生素造成的环境污染和不安全性。
附图说明
图1.聚球藻(Synechococcus sp.)PCC 7002的psbC基因缺失突变体△psbC构建的原理图(A)及Southern鉴定结果(B)。
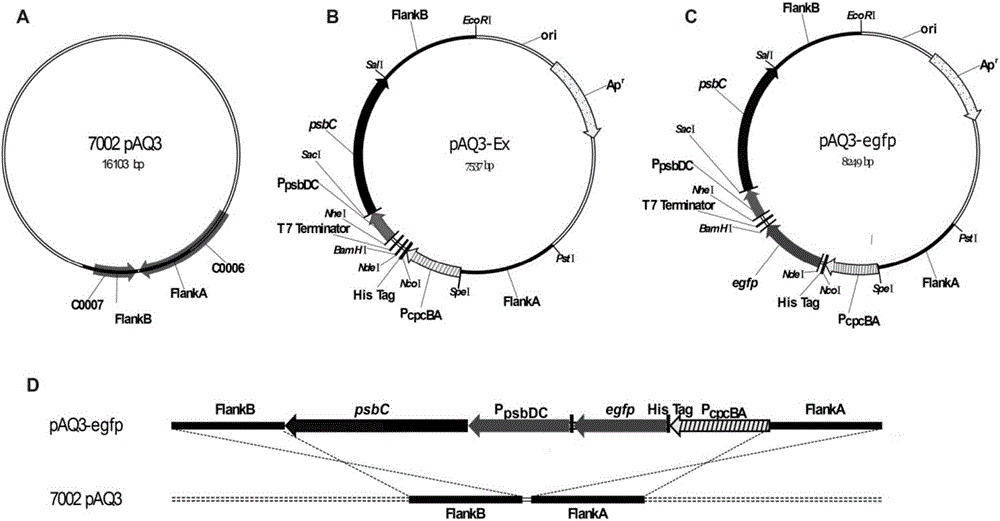
图2.外源基因表达整合载体pAQ3-Ex和试验表达载体pAQ3-egfp的构建示意图,其中:A为聚球藻PCC7002内源质粒pAQ3示意图:FlanKA和FlanKB指两个同源片段,交换区域在C0006和C0007基因间区;B为整合载体pAQ3-Ex的构建示意图,其中所示的酶切位点均为单一酶切位点;C为外源试验基因egfp插入整合载体后得到表达载体pAQ3-egfp示意图;D为试验表达载体pAQ3-egfp与聚球藻PCC7002内源质粒pAQ3发生双交换同源重组示意图。
图3.pAQ3-EGFP阳性菌株的纯合验证、GFP蛋白表达验证、荧光显微镜观察、生长速度的测定结果。其中,A为PCR检测pAQ3-EGFP阳性纯合菌株实验结果,M:DNA marker,WT:野生型,△psbC:psbC基因缺失突变体,1:没有纯合的pAQ3-EGFP阳性菌株,2:已经纯合的pAQ3-EGFP阳性菌株;B显示Western blotting检测pAQ3-EGFP纯合阳性菌株有GFP蛋白的表达,采用GFP蛋白单克隆抗体;C为荧光显微镜显示pAQ3-EGFP纯合阳性菌株有GFP荧光,表示其有GFP蛋白表达,WT表示野生型,BF表示显微镜明场,PF表示藻胆体色素荧光,GFP表示绿色荧光;D为野生型(圆形)、△psbC(正方形)、纯合阳性菌株(三角形)的生长曲线,每个点均为三个独立样品的平均值。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。下述实施例中的%,如无特殊说明,均为质量百分含量。
pBS载体:购自Stratagene公司,产品目录号:ST212207。大肠杆菌HB101:购自takara公司,产品目录号:D9051。蓝细菌Synechococcus sp.PCC 7002及其衍生的突变体,生长于A+液体或者固体培养基中。A+固体培养基:在A+液体培养基中加入琼脂,使其终浓度为1.2%(质量百分含量)。液体培养时,以照明日光灯光源,光强为100uE/m2·s,温度30℃,并通以含1%CO2(v/v)的空气。用于选择生长所用的卡那霉素Kan+抗生素浓度为:100μg/mL,甘油浓度为:1mg/mL。
实验用的大肠杆菌菌株DH5α生长于常规的LB培养基,选择生长所用的抗生素浓度分别为:100μg/mL Amp+,50μg/mLKan+。实验所用其他原始质粒pet-15b、PUC-19、pGEM-7zf均购买于生物技术公司,常见于市面。
A+培养基:每升培养基含
另加维生素VB12(4μg/mL)。
上述Trace metal mix含有H3BO3 2.860mg/L,MnCl2·4H2O 1.810mg/L,ZnSO4·7H2O0.222mg/L,Na2MoO4·2H2O 0.390mg/L,CuSO4·5H2O 0.079mg/L,Co(NO3)2·6H2O 0.0494mg/L。
实施例1、工程菌系统的制备
(1)构建纯合pbsC基因缺失突变体△psbC
psbC基因缺失突变体△psbC构建的过程原理和流程如图1中A所示。以蓝细菌野生型聚球藻Synechococcus sp.PCC 7002(2003年6月由美国宾夕法尼亚州立大学生化和分子生物系教授Donald A.Bryant教授赠送,其来源于法国巴黎的巴斯德研究所蓝藻保藏库(Pasteur Culture Collection),1962年由C.Van Baalen在海洋污垢中分离得到)的基因组DNA为模板,用特异性引物对P1/P2进行PCR扩增,得到psbC(A1559)基因的上游片段T1;用特异性引物对P3/P4进行PCR扩增,得到psbC(A1559)基因的下游片段T2;以pBS质粒为模版,用引物P5/P6扩增出1kb左右大小的kan基因片段;然后将三个片段同时用限制性内切酶EcoRI和BamHI酶切并回收连接,最终以回收产物作为模版,以P1/P4扩增出上游同源片段T1-kan抗性基因-下游同源片段T2约3Kb左右的大片段;后将整个3Kb左右的大片段转化已经能在含甘油A+平板上适应生长的野生型聚球藻PCC 7002。在含kan+抗性和甘油的A+平板上筛选阳性突变体,连续划线传代使得突变体纯合。将阳性菌株进行Southern鉴定(探针如序列表的序列2所示;探针匹配的是psbC基因上游的约700bp片段,由预期灭活基因和要替换的卡那基因的大小来进行区别是否已完全由卡那基因替换预期灭活基因)鉴定结果表明,阳性菌株已经完全看不到野生菌的特异条带(即该突变体已经纯合,不含有psbC基因),将其命名为△psbC,鉴定图见图1中B。
(2)外源基因表达整合载体pAQ3-Ex的构建
外源基因表达整合载体pAQ3-Ex的构建如图2中B所示,其中FlankA和FlankB分别表示聚球藻PCC 7002内源质粒pAQ3上的同源片段(见图2中A)。以野生型聚球藻PCC 7002基因组总DNA为模板,利用引物对P7/P8、P9/P10扩增出FlanKA和FlanKB片段,利用引物对P11/P12、P13/P14扩增出PpsbDC和psbC片段;以野生型集胞藻(Synechocystissp.)PCC 6803(2003年6月由美国宾夕法尼亚州立大学生化和分子生物系教授Donald A.Bryant教授赠送,其来源于法国巴黎的巴斯德研究所蓝藻保藏库(Pasteur Culture Collection),1968年由R.Kunisawa在淡水中分离得到)基因组总DNA为模版,引物P15/P16扩增出启动子PcpcBA;以质粒pet-15b为模版,引物P17/P18扩增出His-Tag到T7终止子这一片段多克隆位点(MCS);然后将FlanKA、PcpcBA、MCS、PpsbDC四个片段同时用SpeⅠ、NcoⅠ、NheⅠ酶切回收连接,以最终回收产物作为模版,以P7/P12扩增出FlanKA-PcpcBA-MCS-PpsbDC这约2.1kb的片段,然后用PstⅠ和SalⅠ连入pUC19质粒得到中间质粒pUC19-1;psbC、FlanKB两个片段同时用SalⅠ酶切回收连接,以最终回收产物作为模版,P13/P10扩增出psbC-FlanKB约2.4kb的片段,然后用SaCⅠ和EcoRⅠ连入pUC19-1质粒得到中间质粒pUC19-2;以质粒pUC19-2为模版,引物对P7/P10扩增出片段1(FlanKA—PcpcBA—MCS—PpsbDC—psbC—FlanKB),以质粒pGEM-7zf为模版引物对P19/P20扩增出片段2,片段1、2利用EcoRⅠ和PstⅠ酶切连接得到最终整合载体pAQ3-Ex(质粒示意见如图2中B所示)。
(3)无抗生素表达外源基因的蓝藻工程菌的制备
将想要表达的外源基因x,利用NdeⅠ和BamHⅠ连入到整合载体pAQ3-Ex最终得到载体pAQ3-x;然后再将载体pAQ3-x转化△psbC,然后在无抗性的A+培养基上筛选阳性菌株;划线传代培养3-4代,利用引物PCR验证载体pAQ3-x是否已经完全整合到△psbC的内源质粒pAQ3上,将已完全整合的菌株命名为pAQ3-X。而pAQ3-X即是我们制备的能在无抗生素培养压力下持续表达外源基因的蓝藻工程菌株。
实施例2、利用egfp基因来鉴定本发明工程菌的可行性
用引物对P21/P22,扩增出egfp基因。用NdeⅠ和BamHⅠ将egfp基因连入pAQ3-Ex整合载体得到试验载体pAQ3-egfp(质粒示意图如图2中C所示),pAQ3-egfp(试验载体与pAQ3双交换的示意图如图2中D。将试验载体pAQ3-egfp转化psbC缺失突变株△psbC,在无抗性无甘油的A+平板上筛选阳性克隆。阳性克隆在A+平板划线3代后,经PCR验证纯合(见图3中A,验证引物对P23/P24),将纯合的突变株命名为pAQ3-EGFP。
pAQ3-EGFP菌株在无抗性培养基中连续培养后,经蛋白质纯化后经SDS-PAGE和Westren blotting检测(图3中B),可以证明此纯化的蛋白质为GFP蛋白,而对照组WT、△psbC均没有。通过显微镜观察发现(图3中C),pAQ3-EGFP突变株有绿色荧光,而对照组没有。这些结果都能证明GFP蛋白在pAQ3-EGFP突变株里能高效表达。
为了验证本平台表达外源基因是否会影响菌体的生长速度,我们分别测WT、△psbC和pAQ3-EGFP生长曲线(图3中D),在25℃、1%CO2空气、50μE/m2.s的光强下,野生型聚球藻PCC7002的代时为9h,而突变株pAQ3-EGFP代时为10.2h,△psbC代时为21.3h。pAQ3-EGFP和野生型的生长速度相近,说明psbC基因回复取得效果,而外源基因的表达并没有影响菌体的生长速率。通过显微镜观察发现(图3中C),pAQ3-EGFP菌株在外形上并没有和野生型有不同的地方。因此,pAQ3-EGFP突变株不仅能表达外源基因,并且外源egfp基因的表达对藻的生长速度和生长状态没有太大的影响。
通过本试验载体结果证明:本整合载体能够在蓝藻中无抗性培养高效表达外源基因,并且生长速度与野生型相近;这也为蓝藻在发酵工业化中低成本更安全大规模表达外源基因提供了一条途径。
表1本发明所用的引物序列
- 还没有人留言评论。精彩留言会获得点赞!