沙门菌H抗原鉴定用引物的制作方法
本发明涉及一种用分子方法来鉴定沙门菌h抗原的引物。
背景技术:
沙门菌的血清型别与其致病性、耐药性、宿主范围等密切相关,对分离到的沙门菌进行血清学分型,是沙门菌监测中必不可少的工作。传统的沙门菌血清学分型方法是血清凝集试验,先根据其菌体抗原(o抗原)分群,再根据鞭毛抗原(h抗原)分型。因h抗原的特性及血清凝集试验本身的局限性,在实际工作中存在诸多问题:(1)h抗原与相应抗血清呈絮状反应,其反应结果不如o抗原的颗粒状凝集明显,结果判断受个人经验和主观影响较大;(2)部分沙门菌的h抗原需经1次或数次位相诱导后才能凝集,操作繁琐耗时;(3)不同h抗原间常存在交叉凝集反应。随着分子生物学技术的发展,基于dna分析的沙门菌检测及血清分型方法相继出现,如普通pcr法、荧光pcr法、测序分析等,此类方法均以沙门菌相关特异基因序列为目标,为沙门菌的血清型别鉴定提供了新思路,但大多局限于单个或少数几个血清型的鉴别,难以实现多株菌、多种血清型别的同时鉴定。
基于luminexxmap(flexiblemulti-analyteprofiling)技术的液态悬浮芯片技术,以其高通量、高效率、高灵敏度和高特异性等优点,近年来受到越来越多的关注和青睐,其在沙门菌血清型鉴别中的应用,也逐渐见诸报道。基于美国cdc的研究成果,luminex公司于近年推出了基于直接杂交法的沙门菌血清分型试剂盒(xmapsalmonellaserotypingassay,ssa),即在上、下游引物扩增范围内,设计1条特异性探针并将之耦联于各荧光编码的普通微珠(不含反tag序列)上,成为标记微珠,样品经不对称pcr扩增并生物素标记后,与耦联有特异性探针的各标记微珠混合液杂交分型。但该试剂盒所用微珠不带磁性,仅适用于基于流式细胞原理的luminex100/200流式荧光检测仪,不能用于基于磁珠捕获与ccd成像的magpix检测平台。
技术实现要素:
本发明所要解决的技术问题是提供一种沙门菌h抗原鉴定用引物,无需另外设计探针,并避免了直接杂交法中pcr产物因自我复性而影响杂交的问题,且同时适用于magpix和luminex100/200检测平台。
本发明解决技术问题所采用的技术方案是:
沙门菌h抗原鉴定用引物,其特征在于:包括6条上游引物f1-f6以及31条下游引物r1-r31,其序列如表1所示;其中f1为r1~r20的共同上游引物;f2为r21~r24的共同上游引物;f3为r25~r28的共同上游引物,f4为r29的上游引物,f5为r30的上游引物,f6为r31的上游引物。
f1-f7的序列分别为序列表中的seqno.1-seqno.7,r1-r31的序列分别是序列表中的seqno.8-seqno.37。
进一步地,所述上游引物和下游引物共计37条,被分为2个pcr反应体系,其中,f1、r1~r20为反应体系1中引物,其余均为反应体系2中引物。
进一步地,上述的沙门菌h抗原鉴定用引物采用以下方法进行设计和合成:
(1)以沙门菌编码h抗原的flic基因和fljb基因为目标基因,从genbank中下载各h抗原的基因序列;
(2)在保守片段上设计通用的上游引物,在可变片段上设计特异的下游引物;
(3)为每条特异的下游引物选择合适的tag序列(与luminex公司提供的特定编号magplex⁃xtag磁珠上的anti⁃tag序列互补);
(4)引物合成:上游引物的5’端用生物素标记,特异性下游引物的5’端连接特定的tag序列,tag序列与各特异性引物之间用c12间隔。
进一步地,应用上述沙门菌h抗原鉴定用引物的进行检测,具体包括以下步骤:
(1)根据权利要求3的步骤设计合成37条引物;
(2)提取沙门菌菌株dna;
(3)将37条引物分为2个pcr反应体系,在一定条件下进行扩增反应;
(4)将magplex⁃xtag磁珠混合,取磁珠混合液与pcr产物混合,再加入sape报告液75μl,吹吸混匀后,放入pcr仪进行核酸杂交;
(5)采用magpix液态悬浮芯片系统,检测各孔中磁珠编码及其荧光信号强度,当平均荧光强度(mfi)的信噪比≥5时判定为阳性。
所述检测方法还包括血清凝集对照试验,所述血清凝集对照试验采用丹麦ssi沙门菌血清型鉴定用诊断血清对沙门菌株进行h抗原分型,并将结果与权利要求4的检测结果进行比较。
本发明基于luminexxtag液态悬浮芯片技术,利用magplex-xtag磁珠,以编码沙门菌h抗原的flic和fljb基因为目标基因,选取其保守片段设计上游通用引物,选取可变片段设计下游特异性引物,建立能高通量鉴别沙门菌h抗原的xtag磁珠悬浮芯片法,用于沙门菌的血清型别鉴定。除上、下游引物外,无需另外设计探针,并避免了直接杂交法中pcr产物因自我复性而影响杂交的问题,且同时适用于magpix和luminex100/200检测平台。
flic和fljb是沙门菌h抗原的编码基因,经多序列比对,可分成4个聚类,即α聚类、g复合抗原聚类、z4复合抗原聚类及z29聚类;各聚类中不同h抗原的编码序列两端相对保守,中间则呈现高度的h抗原特异性,这为本发明中引物的设计提供了较理想的基因区。在保守区域设计通用的上游或下游引物序列,在可变区域设计针对各h抗原的特异性引物序列,这可大大减少多重pcr体系中引物序列的数量。pcr体系1共可检测20种h抗原(α聚类),仅用了1条上游引物;pcr体系2共可检测11种待测物,因g复合抗原聚类、z4复合抗原聚类及z29聚类h抗原间的高度变异,无法共用一条通用引物,但4种g复合抗原、4种z4复合抗原均分别共用1条上游引物。因肠炎沙门菌h:g,m抗原与其它g复合抗原高度相似,难以通过flic和fljb基因的序列差异进行区分,且肠炎血清型在日常分离菌株中占较大比例,因此,本发明以肠炎血清型特异基因sdfⅰ为目标序列,专门设计1对针对肠炎血清型的特异性引物。h:d抗原虽属α聚类,但其引物序列与体系1的其它序列产生较严重的二聚体,故将其调整至体系2。h:5抗原的基因序列呈现高度的多态性,无法为其设计一对或两对特异引物,故采用排除法,通过h:1通用引物和其它2相h抗原特异性引物的配合,来确定h:5抗原。h:g,t和h:g,s,t虽共用1条引物,但结合菌株o抗原和2相h抗原的构成情况,仍可明确判定血清型别。为保证多重pcr反应的顺利进行,对各引物的二聚体(包括自身与相互间的)、发夹结构、错配情况及gc含量、tm值、特异性等进行评价与验证是非常必要的。
luminexxtag技术是在不同荧光编码的微珠表面预先连接含24个碱基的序列,每种编码微珠连接一种序列,该序列不含c碱基,仅含t、a、g三种碱基,故名tag序列(习惯上称反tag序列或反标签序列),连接有反tag序列且有磁性的微珠即为xtag磁珠。本发明利用xtag技术,根据xtag磁珠清单及其反tag序列,为设计的每条特异性下游引物选择合适的与反tag序列互补的tag序列;引物合成时,在各特异性下游引物的5’端连接tag序列,对应的上游引物的5’端标记生物素,为避免pcr过程中tag序列被屏敝而影响后续与磁珠上反tag序列的杂交,合成时tag序列与特异性引物之间用12碳桥间隔。标本经pcr扩增并生物素标记及tag序列标记后,与xtag磁珠混合液杂交,扩增子通过其带有的tag序列与特定编码磁珠上的反tag序列杂交而连接于磁珠上,并通过1分子生物素与6分子链霉亲和素藻红蛋白的结合,放大杂交信号。用magpix液态悬浮芯片系统检测时,通过激发磁珠基质上的红色分类荧光,对磁珠编码即h抗原的种类进行识别;通过激发特异性杂交于磁珠表面的扩增子上所结合的藻红蛋白,对各h抗原基因的存在与否及含量高低进行分析。因xtag技术能保证相同的复性温度和杂交效率,且将交叉反应降到最低,与普通微珠相比,xtag磁珠杂交效率高、背景信号弱,易于进行结果判断。本发明实验结果也显示,pcr产物经磁珠杂交后,背景信号mfi通常小于100,而阳性结果的mfi通常大于1000,信噪比大,结果判断明确。
附图说明
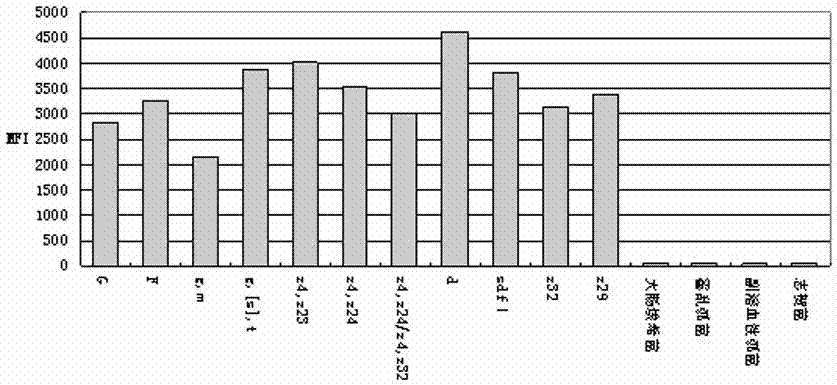
图1是本发明体系1的沙门菌h抗原xtag法特异性试验及阴性对照磁珠杂交结果。
图2是本发明体系2的沙门菌h抗原xtag法特异性试验及阴性对照磁珠杂交结果。
具体实施方式
以下结合具体实施例来对本发明的技术方案作进一步详细说明,其目的是为了使本领域技术人员更好地理解本发明的技术方案,因此不应将实施例理解为对本发明所要求保护的技术内容作进一步的限定。
1.引物设计与合成。
(1)序列下载与比对:以沙门菌编码h抗原的flic基因和fljb基因为目标基因,从genbank中下载各h抗原的基因序列,并用bioedit软件进行多序列比对。
(2)引物设计:用primerpremier6软件在保守片段上设计通用的上游引物,在可变片段上设计特异的下游引物;用oligo7软件对各引物的二聚体、发夹结构、错配情况及gc含量、tm值等进行评价,并经blast验证各引物对的特异性。
(3)tag序列选择:根据luminex公司提供的magplex⁃xtag磁珠清单及其anti⁃tag序列,为每条特异性引物选择合适的tag序列;再次用oligo7软件对各引物的二聚体、发夹结构、错配情况及gc含量、tm值等进行评价,并经blast验证各引物对的特异性。
(4)引物确定与合成:共筛选出37条引物,其中f1为r1~r20共20条特异引物的共同上游引物,f2、f3分别为r21~r24、r25~r28特异引物的共同上游引物(详见表1)。合成时上游引物的5’端用生物素标记,各特异性下游引物的5’端连接特定的tag序列(与luminex公司提供的特定编号magplex⁃xtag磁珠上的anti⁃tag序列互补),tag序列与各特异性下游引物之间用c12间隔。
表1检测所用引物及磁珠
注:f1为r1~r20的共同上游引物;f2为r21~r24的共同上游引物;f3为r25~r28的共同上游引物,f4为r29的上游引物,f5为r30的上游引物,f6为r31的上游引物。f1、r1~r20为反应体系1中引物,其余均为反应体系2中引物。
(1)主要试剂和仪器:hotstartversionextaq聚合酶及缓冲液(takara,大连);magplex⁃xtagmicrosphere(luminex,美国);链霉亲和素-藻红蛋白(streptavidin⁃r⁃phycoerythrin,sape)(invitrogen,美国);引物及其标记由上海生工生物技术有限公司合成;菌液比浊仪(梅里埃,法国);s1000pcr扩增仪(bio-rad,美国);luminexmagpix液态悬浮芯片系统(luminex,美国)。
(2)菌株dna提取:分离的菌株经营养肉汤培养18~24小时后,调节菌液浓度至106cfu/ml,取1.0ml经10000rpm离心4min,弃上清后加200μl灭菌纯水混悬,100℃加热10min,再10000rpm离心4min,取上清液作为pcr模板。
(3)pcr反应体系及条件:将37条引物分成2个pcr反应体系(见表1),25μl的反应体系中加10×buffer2.5μl,dntps(各2.5mmol/l)2.0μl,体系1中上游通用引物1条(10μmol/l)0.75μl,下游特异性tag引物混合液(共20条,各5μmol/l)1.0μl,体系2中上游通用引物(共2条,各10μmol/l)0.75μl,其余引物混合液(共14条,各5μmol/l)1.0μl,hsextaq酶(5u/μl)0.125μl,模板2.0μl,不足部分用双蒸水补足。pcr扩增条件:94℃预变性1min,94℃变性30sec,54℃退火30sec,72℃延伸30sec,35个循环,最后在72℃延伸5min。
(4)磁珠杂交及信号检测:临用前将各种编码的magplex⁃xtag磁珠混合,使每种磁珠的浓度为125个/μl;取20μl磁珠混合液与5μl多重pcr产物混合,再加入5μg/mlsape报告液75μl,吹吸混匀后,放入pcr仪进行核酸杂交;40℃杂交25min。启动magpix液态悬浮芯片系统,调节针高并校准、验证仪器后,检测各孔中磁珠编码及其荧光信号强度。当平均荧光强度(mfi)的信噪比≥5时判定为阳性。
(5)血清凝集试验:采用丹麦ssi沙门菌血清型鉴定用诊断血清对沙门菌株进行h抗原分型,操作严格按说明书进行,以与经xtag分型法结果进行比较。
3.效果验证。
(1)xtag分型法的特异性和敏感性:31种沙门菌h抗原经多重pcr扩增后产物为94~245bp(详见表1),与xtag磁珠杂交后可鉴别分型,各h抗原间无交叉反应。大肠埃希菌、霍乱弧菌、副溶血性弧菌及志贺菌dna经多重pcr扩增及xtag磁珠杂交后,亦无交叉反应。见图1。
(2)xtag分型法的检出限和重复性:以101~108cfu/ml的沙门菌液作检出限分析,除h:l,v的检出限为104cfu/ml外,其它各h抗原的检出限均可达到103cfu/ml,且杂交信号强度与pcr模板浓度呈现一定的相关性,在103~107cfu/ml范围内,菌液浓度越高,mfi越强,当菌液浓度达到108cfu/ml时,mfi趋于平稳,甚至反而降低,这可能是反应达到和所致。
方法重复性良好,104cfu/ml鼠伤寒沙门菌h:i抗原和肠炎沙门菌h:g,m6次重复测定,mfi变异系数分别为4.27%和5.93%;同一菌株不同批次实验分型结果一致。
(3)沙门菌株h抗原检测:对145株日常分离的沙门菌进行血清分型,共分为38种血清型,其中鼠伤寒55株,肠炎26株,共占55.9%。1株斯坦利沙门菌(d:1,2)和1株鸡沙门菌(h抗原阴性),用xtag法分别鉴定为圣保罗沙门菌(e,h:1,2)和肠炎沙门菌(g,m:-),经位相诱导后用血清凝集试验进一步证实,支持xtag法结果;5株血清凝集试验只鉴定到群而未能分型的菌株(分别为1株b群、1株c1群、2株c2群和1株e1群),其中3株经xtag法明确分型,并经血清凝集试验证实,分别是1株c1群鉴定为汤卜逊血清型(k:1,5),1株c2群鉴定为哈达尔血清型(z10:e,n,x),1株e1群鉴定为伦敦血清型(l,v:1,6)。上述结果表明,正如背景中所述,因血清凝集试验存在交叉凝集、絮状反应不明显等原因,常给结果判断带来困难,而基于核酸分析的xtag法较好地弥补了这一不足。7株两法分型结果确实不一致的菌株,其中4株为鼠伤寒沙门菌,血清凝集试验h抗原为“i:1,2”,xtag法鉴定为“i:-”,但这并不影响其血清型别的最终判定;2株阿贡纳沙门菌h抗原为“f,g,s:-”,xtag法鉴定为“f,g:-”,1株蒙得维的亚沙门菌h抗原为“g,m,s:-”,xtag法鉴定为“g,m:-”,两者均是因为h:s特异性引物与本发明中其它引物序列产生较严重的引物二聚体,故暂未将其放入反应体系中,现已将其列入随后建立的沙门菌o抗原反应体系中,取得良好结果。与金标准血清凝集试验比较,沙门菌h抗原xtag分型法的敏感度为95.1%,特异度为100%,youden指数为0.951,两法的符合率为95.2%(见表2)。
表2沙门菌h抗原分型结果比较
备注:5株初次鉴定结果不一致、后经血清凝集试验重新证实的菌株,视为两法结果一致菌株。
本发明涵盖的31种h抗原,为沙门菌常见1相h抗原和2相抗原,涉及沙门菌属诊断抗原表中近2000个血清型。利用xtag技术鉴定沙门菌h抗原,特异、准确、快速,可在4~5个小时内完成90多株常见血清型沙门菌的h抗原鉴定,具有传统血清凝集试验无法比拟的优势,可极大地改进沙门菌的日常监测工作。
<110>郑,之北
<120>沙门菌h抗原鉴定用引物
<160>37
<170>patentinversion3.3
<210>1
<211>21
<212>dna
<213>人工序列
<400>1
tgaagcagatcaactctcaga21
<210>2
<211>22
<212>dna
<213>人工序列
<400>2
taarggtggtaaggaaggagat22
<210>3
<211>22
<212>dna
<213>人工序列
<400>3
gctgggcttagataaattagat22
<210>4
<211>22
<212>dna
<213>人工序列
<400>4
gatggtagtattacgacaacag22
<210>5
<211>24
<212>dna
<213>人工序列
<400>5
tttctcagattcagggagtatatc24
<210>6
<211>21
<212>dna
<213>人工序列
<400>6
aaacactgggacttgataagc21
<210>7
<211>18
<212>dna
<213>人工序列
<400>7
gaggccagcaccatcaag18
<210>8
<211>22
<212>dna
<213>人工序列
<400>8
gctgtaagagtagtaccaccat22
<210>9
<211>21
<212>dna
<213>人工序列
<400>9
cggaataggaagcagctacag21
<210>10
<211>19
<212>dna
<213>人工序列
<400>10
gcatcaggcgctgtaagat19
<210>11
<211>18
<212>dna
<213>人工序列
<400>11
accaccaagaccagtagc18
<210>12
<211>22
<212>dna
<213>人工序列
<400>12
gcagtaagagcactagtatcca22
<210>13
<211>23
<212>dna
<213>人工序列
<400>13
cgtagatttgtcaatagcagtag23
<210>14
<211>18
<212>dna
<213>人工序列
<400>14
ccgcagtaggcatcgtag18
<210>15
<211>23
<212>dna
<213>人工序列
<400>15
ccagtaagacctgtagtatccaa23
<210>16
<211>20
<212>dna
<213>人工序列
<400>16
gcaccagtaattccagcagt20
<210>17
<211>22
<212>dna
<213>人工序列
<400>17
gcatccagtgtagtaccattat22
<210>18
<211>20
<212>dna
<213>人工序列
<400>18
ttacagaagccgtaccattc20
<210>19
<211>19
<212>dna
<213>人工序列
<400>19
ttacagaagccgtgccaag19
<210>20
<211>21
<212>dna
<213>人工序列
<400>20
accgcactacctgttacacta21
<210>21
<211>18
<212>dna
<213>人工序列
<400>21
atttaaccgcactaccag18
<210>22
<211>18
<212>dna
<213>人工序列
<400>22
cgcatcggtataaccact18
<210>23
<211>21
<212>dna
<213>人工序列
<400>23
cgcatcggtataaccacctac21
<210>24
<211>18
<212>dna
<213>人工序列
<400>24
ttgcaccaccaacacccg18
<210>25
<211>18
<212>dna
<213>人工序列
<400>25
tgcatcattaagaccagt18
<210>26
<211>19
<212>dna
<213>人工序列
<400>26
ctgtatcattaagaccagc19
<210>27
<211>20
<212>dna
<213>人工序列
<400>27
actgaccgttcactacagat20
<210>28
<211>20
<212>dna
<213>人工序列
<400>28
gtagcagcatcaacattcgc20
<210>29
<211>21
<212>dna
<213>人工序列
<400>29
gtagcagcattaacatccgtc21
<210>30
<211>19
<212>dna
<213>人工序列
<400>30
ggcatcattaacattcgct19
<210>31
<211>20
<212>dna
<213>人工序列
<400>31
ttttgcgttatcgaaatcag20
<210>32
<211>18
<212>dna
<213>人工序列
<400>32
ggcataatatttaggagt18
<210>33
<211>18
<212>dna
<213>人工序列
<400>33
gcctttatcatcttgtgt18
<210>34
<211>20
<212>dna
<213>人工序列
<400>34
agcttctttgatcttaacat20
<210>35
<211>24
<212>dna
<213>人工序列
<400>35
gcattaacattataggtagcaccg24
<210>36
<211>23
<212>dna
<213>人工序列
<400>36
ctggtacttacgatgacaacttc23
<210>37
<211>20
<212>dna
<213>人工序列
<400>37
agtattgctctgggctgtaa20
- 还没有人留言评论。精彩留言会获得点赞!