基于hemin‑石墨烯复合材料的端粒酶活性检测方法与流程
本发明属于一种定量检测端粒酶活性的技术,具体是指端粒酶引物吸附到hemin-石墨烯复合材料(H-GNs)后,在一定盐浓度下会发生团聚。端粒酶加入后,扩增的引物会引起H-GNs的分散,继而在TMB和H2O2下观测紫外信号的改变。
背景技术:
端粒酶在细胞中负责端粒的延长的一种酶,是基本的核蛋白逆转录酶,可将端粒DNA加至真核细胞染色体末端。端粒由上千6碱基重复序列(TTAGGG)组成,在不同物种细胞中对于保持染色体稳定性和细胞活性有重要作用,端粒酶能延长缩短端粒(缩短的端粒其细胞复制能力受限),从而增强体外细胞的增殖能力。但是大量资料表明端粒酶在正常人体组织中的活性被抑制,而在一些恶性肿瘤中的表达高达85%,由于端粒酶特异地表达于各种肿瘤细胞,并且是大多数肿瘤细胞持续分裂所必需的。因此,端粒酶活性是诊断多数恶性肿瘤、判断愈后的良好指标。
最常用的端粒酶活性检测方法主要是端粒重复序列扩增法(TRAP)以及与它相关的一系列修饰检测。此方法系最早建立的方法,稳定性好,特异性高;缺点是需要样品量较大,灵敏性差,检测时间长,不适合临床标本的大量检测。TRAP分析法能够实现高通量高灵敏度的检测,但PCR技术仍有一些缺点。此外,TRAP法需要使用昂贵的设备和试剂,相当耗时。再加上抑制端粒酶活性已被提议作为人类癌症治疗的潜在方法,而TRAP在筛选有效的端粒酶抑制剂如G-四联体配体时易受PCR派生产物的影响,因此,该方法存在很多局限性。
近年来,为解决TRAP分析方法的弊端,研究者们已经开发了许多PCR-free分析方法并将之应用到端粒酶活性的检测中,例如表面等离子共振、电致化学发光、比色检测、荧光检测、电化学检测等,然而,上述大多数策略因为端粒酶引物的固定化、成本高、灵敏度低和操作复杂等问题在应用时或多或少受到了限制。此外,当前的大多数检测方法都使用细胞提取物来分析端粒酶活性,于临床应用较为不符,而能够实现原位分析和动态监测细胞内端粒酶活性的检测方法则凤毛麟角。端粒酶活性的检测对癌症的早期诊断具有重要的生物学意义,对临床上癌症的预警和治疗这一复杂科学问题的研究起到促进作用。因此,对端粒酶活性分析的简单、灵敏、低成本的原位实时监测和抑制剂筛查技术仍然是当前亟待解决的问题。
技术实现要素:
发明目的:本发明所要解决的技术问题是提供了一种基于hemin-石墨烯复合材料(H-GNs)进行比色测定端粒酶活性的方法。本发明中针对端粒酶作用于端粒产生重复扩增序列(TTAGGG)n而引起端粒酶引物链长的变化,从而使H-GNs在盐溶液中分散程度发生变化,在TMB和H2O2存在下,通过得到的显色程度不同的变化来测定端粒酶活性。它具有灵敏度高、准确性好、无标记等优点。
技术方案:为了解决上述技术问题,本发明所采用的技术方案为:一种基于hemin-石墨烯复合材料的端粒酶活性检测方法,包括以下步骤:
1)合成hemin-石墨烯复合材料H-GNs;
2)细胞的培养以及端粒酶的提取得到裂解后的细胞溶液;
3)将裂解后的细胞溶液加入含有端粒酶扩增引物的端粒酶缓冲溶液,对端粒酶引物进行扩增,得到重复的富G序列的产物溶液;
4)将hemin-石墨烯复合材料H-GNs与得到重复的富G序列的产物溶液作用,加入盐溶液,观察H-GNs的团聚变化得到产物,并利用紫外–可见光谱仪对产物进行检测。
其中,本发明所述的hemin是氯化血红素。
其中,上述步骤1)的合成hemin-石墨烯复合材料H-GNs具体步骤如下:称取氧化石墨溶于二次水中,超声分散进行机械剥离,离心,除去未剥离的氧化石墨,取上清液在透析袋中透析除去杂质小分子得分散均匀的氧化石墨烯溶液;将所得氧化石墨烯溶液与溶于NaOH溶液的hemin在烧瓶中充分混合;完成之后,缓慢加入氨溶液,最后加入水合肼,剧烈搅拌混合溶液,把烧瓶置于水浴中反应,得到稳定分散的黑色溶液;将所得黑色溶液离心得黑色沉淀物,水洗得到H-GNs。
其中,所述步骤2)中的细胞培养和端粒酶提取步骤是将A549细胞在含有10%胎牛血清,青霉素和链霉素的DMEM培养基中,并在5%CO2,37℃培养箱中培养。所有细胞都是收集于指数生长时期。将100万个细胞分装于1.5mL的EP管中,用冰冷的磷酸盐缓冲溶液(pH=7.4)洗涤两次,并重新分散在200μL冰冷的CHAPS裂解缓冲液中。将细胞在冰上孵育30分钟,然后在4℃,12000rpm的转速下离心20分钟。离心后将澄清的裂解液小心地转移到新的EP管中得到裂解后的细胞。上述步骤2)中的细胞为A549细胞。所述CHAPS裂解缓冲液包括10mM Tris-HCl,,pH 7.5,1mM MgCl2,1mM EGTA(乙二醇双(2-氨基乙基醚)四乙酸),0.5%(w/v)CHAPS(3-[3-(胆酰氨丙基)二甲氨基]丙磺酸内盐),10%(v/v)glycerol(甘油),0.1mM PMSF(苯甲基磺酰氟)。
其中,上步骤3)具体步骤如下:用端粒酶缓冲溶液将裂解后的细胞溶液配置成不同的浓度,在含有dNTPs、端粒酶扩增引物的端粒酶扩增缓冲溶液中滴加不同浓度的裂解后的细胞对其引物进行扩增延伸,30~38℃反应1~2h得到扩增好的产物。
其中,上述dNTPs浓度为0.5~2mM。
其中,上述端粒酶扩增缓冲溶液为含有MgCl2、EGTA、Tween 20的pH 8~9的20~100mM Tris-HCl,所述MgCl2初始浓度为1~5mM,EGTA初始浓度为0.05~5mM,Tween 20初始体积为0.005%~1%。
其中,上述步骤4)具体如下:取hemin-石墨烯复合材料加入到已扩增好的产物中,加入NaCl溶液,在20~30℃反应30~50mins后,离心,取上层清液加入到磷酸缓冲溶液中,在TMB和H2O2存在下,对其溶液进行记录和紫外–可见光谱检测。
其中,上述磷酸缓冲溶液为pH5~6的25~50mmol/L的磷酸缓冲溶液。
其中,上述NaCl的浓度为0.01~1.0moll/L。
其中,上述TMB和H2O2的最终浓度分别为0.1~0.8mM和5~30mM。
上述步骤1)的具体步骤如下:称取10mg氧化石墨溶于20mL二次水中(0.5mg/mL),超声分散2~4h进行机械剥离,2000~4000rpm离心20~30min,除去未剥离的氧化石墨,取上清液在透析袋(8000~12000)中透析一周除去杂质小分子得分散均匀的氧化石墨烯溶液;将所得氧化石墨烯溶液与20mL溶于0.1M NaOH溶液的hemin(0.5mg/mL)在烧瓶中充分混合。完成之后,缓慢加入150~200μL氨溶液,最后加入20~50μL水合肼;剧烈搅拌混合溶液30~60分钟,把烧瓶置于水浴中(60℃)反应3~24h,得到稳定分散的黑色溶液。将所得黑色溶液在12000~13000rpm离心30~60分钟得黑色沉淀物,水洗3~5次得到H-GNs。得到的H-GNs能很容易地重新分散在水中。
有益效果:与现有技术相比,本发明具有如下的特色及优点:
(1)本发明无需标记,可避免现有技术中对PCR体系汇总加入荧光基团进行标记而导致检测成本高、准确性差的缺点。
(2)本发明利用端粒酶对其引物的特异性识别进行扩增延伸来提高其特异性。
(3)本发明利用hemin-石墨烯复合材料在盐溶液中具有可调控的分散性,而且具有内在的类过氧化氢酶活性,可催化过氧化氢酶底物,是一种具有很大潜力的检测材料。
(4)本发明有效利用了纳米材料的特性,不需要借助精密仪器检测,简化了检测方法,极大地降低了病毒检测成本,本发明具有成本低、快速、简便、敏感且特异性好的优点。
(5)本方法可成功应用于实际样品尿液的检测,具有一定的临床意义。
附图说明
图1基于hemin-石墨烯复合材料(H-GNs)比色检测端粒酶活性的流程图;
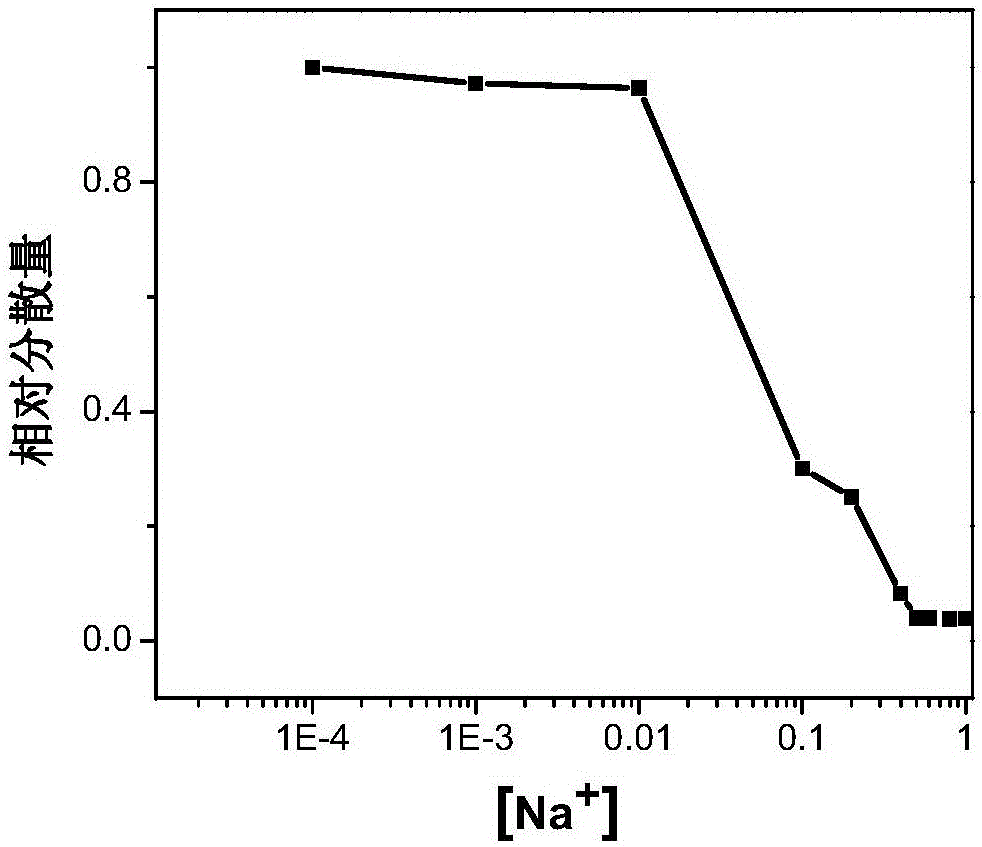
图2 H-GNs的溶解度与NaCl溶液浓度的关系图;
图3显示了端粒酶活性检测实验验证图:a:端粒酶引物(TS primer)与hemin-石墨烯复合材料(H-GNs)的紫外吸收强度;b:在端粒酶引物(TS primer)与hemin-石墨烯复合材料(H-GNs)存在下,加入A549细胞提取物的紫外吸收强度;c:A549细胞提取物与hemin-石墨烯复合材料(H-GNs)的紫外吸收强度;d:端粒酶引物(TS primer)与A549细胞提取物的紫外吸收强度;
图4显示了检测端粒酶活性的紫外吸收值变化图:A:在不同的A549细胞浓度下,得到的紫外-可见光曲线图(A549细胞浓度:(a)0(b)100(c)225(d)450(e)900(f)1350(g)2300cells/mL);B:紫外吸收强度与A549细胞浓度的标准曲线;插图:紫外吸收强度与A549细胞浓度之间的线性关系;从图中可以看出A549细胞在100U/mL到2300cells/mL呈良好的线性关系;
具体实施方式
下面通过具体的实施例和附图对本发明进一步说明,应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干变型和改进,这些也应视为属于本发明的保护范围。
本实验中用到的试剂和仪器:
端粒酶引物购自上海生物工程技术服务有限公司,H2O2、3,3',5,5'-四甲基联苯胺(TMB)、氯化血红素(hemin)购自美国sigma公司,水合肼购自上海林峰试剂生物公司,氧化石墨烯、石墨粉购自南京XFNANO材料技术公司,傅立叶-红外光谱仪(FTIR,Bruker Tensor 27,Germany),A549细胞购买于上海复祥生物科技公司。
端粒酶引物序列:5′-AATCCGTCGAGCAGAGTT-3′
实施例1:基于hemin-石墨烯复合材料(H-GNs)比色测定端粒酶活性的分析方法,检测步骤是:
1)hemin-石墨烯复合材料(H-GNs)合成步骤:称取10mg氧化石墨烯溶于20mL二次水中(0.5mg/mL),超声分散2h进行机械剥离,3000rpm离心30min,除去未剥离的氧化石墨,取上清液在透析袋(8000-12000)中透析一周除去杂质小分子得分散均匀的氧化石墨烯溶液;将所得氧化石墨烯溶液与20mL溶于0.1M NaOH溶液的hemin(0.5mg/mL)在烧瓶中充分混合。完成之后,缓慢加入200μL氨溶液,最后加入30μL水合肼。剧烈搅拌混合溶液60分钟,把烧瓶置于水浴中(60℃)反应24h,得到稳定分散的黑色溶液。将所得黑色溶液在13000rpm离心30分钟得黑色沉淀物,水洗三次得到H-GNs。得到的H-GNs能很容易地重新分散在水中。
2)细胞培养和端粒酶提取步骤:A549细胞在含有10%胎牛血清,青霉素和链霉素的DMEM培养基中,并在5%CO2,37℃培养箱中培养。所有细胞都是收集于指数生长时期。将100万个细胞分装于1.5mL的EP管中,用冰冷的磷酸盐缓冲溶液(pH=7.4)洗涤两次,并重新分散在200μL冰冷的CHAPS裂解缓冲液(10mM Tris-HCl,,pH 7.5,1mM MgCl2,1mM EGTA(乙二醇双(2-氨基乙基醚)四乙酸),0.5%(w/v)CHAPS(3-[3-(胆酰氨丙基)二甲氨基]丙磺酸内盐),10%(v/v)glycerol(甘油),0.1mM PMSF(苯甲基磺酰氟))中。将细胞在冰上孵育30分钟,然后在4℃,12000rpm的转速下离心20分钟。离心后将澄清的裂解液小心地转移到新的EP管中得到裂解后的A549细胞,快速冷冻并储存在-80℃的冰箱中。
3)端粒酶对端粒酶引物进行扩增步骤:用端粒酶缓冲溶液将裂解后的A549细胞配置成不同的浓度(A549细胞浓度:0,100,225,450,900,1350,2300cells/mL),在含有1mM dNTPs,1μM端粒酶扩增引物(TS primer)的20μL端粒酶扩增缓冲溶液(20mM Tris-HCl,pH 8.3,1.5mM MgCl2,0.05mM EGTA、0.005%(v/v)Tween 20)中滴加100mL/cells裂解后的A549细胞对其引物进行扩增延伸,38℃反应1h得到扩增好的产物。
4)端粒酶活性检测步骤:取200μL 20μg/mL hemin-石墨烯复合材料(H-GNs)加入到已扩增好的的产物中,加入0.5M NaCl溶液,在28℃反应40min。反应结束后,离心,取上层清液加入到磷酸缓冲溶液(25mM pH 5.0)中,在0.6mM TMB和10mM H2O2存在下,对其溶液进行记录和紫外–可见光谱检测。实验结果如图4显示,端粒酶在100~2300cells/mL呈良好的线性关系,检测限时60cells/mL。
实施例2:
基于hemin-石墨烯复合材料(H-GNs)比色测定端粒酶活性的分析方法,检测步骤是:
1)hemin-石墨烯复合材料(H-GNs)合成步骤:称取10mg氧化石墨烯溶于20mL二次水中(0.5mg/mL),超声分散2h进行机械剥离,3000rpm离心30min,除去未剥离的氧化石墨,取上清液在透析袋(8000-12000)中透析一周除去杂质小分子得分散均匀的氧化石墨烯。将所得氧化石墨烯溶液与20mL溶于0.1M NaOH溶液的hemin(0.5mg/mL)在烧瓶中充分混合。完成之后,缓慢加入150μL氨溶液,最后加入20μL水合肼。剧烈搅拌混合溶液30分钟,把烧瓶置于水浴中(60℃)反应20h,得到稳定分散的黑色溶液。将所得黑色溶液在12000rpm离心60分钟得黑色沉淀物,水洗三次得到H-GNs。得到的H-GNs能很容易地重新分散在水中。
2)细胞培养和端粒酶提取步骤:A549细胞接种在含有10%胎牛血清,青霉素和链霉素的DMEM培养基中,并在5%CO2,37℃培养箱中培养。所有细胞都是收集于指数生长时期。将100万个细胞分装于1.5mL的EP管中,用冰冷的磷酸盐缓冲溶液(pH=7.4)洗涤两次,并重新分散在200μL冰冷的CHAPS裂解缓冲液(10mM Tris-HCl,,pH 7.5,1mM MgCl2,1mM EGTA(乙二醇双(2-氨基乙基醚)四乙酸),0.5%(w/v)CHAPS(3-[3-(胆酰氨丙基)二甲氨基]丙磺酸内盐)中。将细胞在冰上孵育30分钟,然后在4℃,12000rpm的转速下离心20分钟。离心后将澄清的裂解液小心地转移到新的EP管中得到裂解后的A549细胞,快速冷冻并储存在-80℃的冰箱中。
3)端粒酶对端粒酶引物进行扩增步骤:用端粒酶缓冲溶液将裂解后的A549细胞配置成不同的浓度(A549细胞浓度:0,100,225,450,900,1350,2300cells/mL),在含有0.5mM dNTPs,1μM端粒酶扩增引物(TS primer)的20μL端粒酶扩增缓冲溶液(100mM Tris-HCl,pH 8.3,5mM MgCl2,5mM EGTA,1%(v/v)Tween 20)中滴加900mL/cells裂解后的A549细胞对其引物进行扩增延伸,30℃反应2h得到扩增好的产物。
4)端粒酶活性检测步骤:取200μL 20μg/mL hemin-石墨烯复合材料(H-GNs)加入到已扩增好的产物中,加入0.01M NaCl溶液,在20℃反应50mins。反应结束后,离心,取上层清液加入到磷酸缓冲溶液(50mM pH 6.0)中,在0.1mM TMB和5mM H2O2存在下,对其溶液进行记录和紫外–可见光谱检测。实验结果显示,端粒酶在100~2300cells/mL呈良好的线性关系,检测限时60cells/mL。
实施例3
1)hemin-石墨烯复合材料(H-GNs)合成步骤:称取10mg氧化石墨烯溶于20mL二次水中(0.5mg/mL),超声分散2h进行机械剥离,3000rpm离心30min,除去未剥离的氧化石墨,取上清液在透析袋(8000-12000)中透析一周除去杂质小分子得分散均匀的氧化石墨烯。将所得氧化石墨烯溶液与20mL溶于0.1M NaOH溶液的hemin(0.5mg/mL)在烧瓶中充分混合。完成之后,缓慢加入加入200μL氨溶液,最后加入50μL水合肼。剧烈搅拌混合溶液60分钟,把烧瓶置于水浴中(60℃)反应20h,得到稳定分散的黑色溶液。将所得黑色溶液在13000rpm离心30分钟得黑色沉淀物,水洗三次得到H-GNs。得到的H-GNs能很容易地重新分散在水中。
2)细胞培养和端粒酶提取步骤:A549细胞接种在含有10%胎牛血清,青霉素和链霉素的DMEM培养基中,并在5%CO2,37℃培养箱中培养。所有细胞都是收集于指数生长时期。将100万个细胞分装于1.5mL的EP管中,用冰冷的磷酸盐缓冲溶液(pH=7.4)洗涤两次,并重新分散在200μL冰冷的CHAPS裂解缓冲液(10mM Tris-HCl,,pH 7.5,1mM MgCl2,1mM EGTA(乙二醇双(2-氨基乙基醚)四乙酸),0.5%(w/v)CHAPS(3-[3-(胆酰氨丙基)二甲氨基]丙磺酸内盐)中。将细胞在冰上孵育30分钟,然后在4℃12000rpm的转速下离心20分钟。离心后将澄清的裂解液小心地转移到新的EP管中得到裂解后的A549细胞,快速冷冻并储存在-80℃的冰箱中。
3)端粒酶对端粒酶引物进行扩增步骤:用端粒酶缓冲溶液将裂解后的A549细胞配置成不同的浓度(A549细胞浓度:0,100,225,450,900,1350,2300cells/mL),在含有2mM dNTPs,1μM端粒酶扩增引物(TS primer)的20μL端粒酶扩增缓冲溶液(60mM Tris-HCl,pH 8.3,1.5mM MgCl2,0.05mM EGTA,0.5%(v/v)Tween 20)中滴加2300mL/cells裂解后的A549细胞对其引物进行扩增延伸,35℃反应1h得到扩增好的产物。
4)端粒酶活性检测步骤:取200μL 20μg/mL hemin-石墨烯复合材料(H-GNs)加入到已扩增好的产物中,加入1.0M NaCl溶液,在30℃反应40mins。反应结束后,离心,取上层清液加入到磷酸缓冲溶液(35mM pH 5.5)中,在0.45mM TMB和30mM H2O2存在下,对其溶液进行记录和紫外–可见光谱检测。实验结果显示,端粒酶在100~2300cells/mL呈良好的线性关系,检测限时60cells/mL。
上述仅为本发明优选的实施例,并不限制于本发明。对于所属领域的技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动。这里无需也无法对所有的实施例来举例说明。而由此方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!