控制水稻叶绿素合成的基因YL‑1及其应用的制作方法
本发明涉及分子生物技术领域,具体来说是一种控制水稻叶绿素合成的基因YL-1及其应用。
背景技术:
叶片是植物进行光合作用的主要器官,水稻籽粒中2/3以上的干物质是开花后通过光合作用获得的(王旭军,徐庆国,杨知建(2005)水稻叶片衰老生理的研究进展.中国农学通报21:187-190)。光合作用的效率与叶绿体结构和功能是否完整、光合作用复合体的稳定性、叶绿素含量的高低都有着复杂的关系。近年来,水稻叶色的应用价值备受关注,叶色变异可以作为标记性状,在水稻杂交育种和良种繁育中发挥重要作用,不但可以用于苗期剔除受外源花粉污染的种子和假杂种,还可以用于快速测定种子纯度(章志兴,陈善福(2001)叶色标记技术在杂交水稻种子生产中的应用.种子科技19:33-34)。另外,叶色突变体的研究对于利用基因工程有效提高水稻的光合能力,培育高光效水稻品种,增加水稻产量具有重要的理论意义和应用价值。
目前,利用水稻叶色突变体,已经克隆出多个参与或调控叶绿素代谢和叶绿体发育的基因,通过分析基因功能、表达模式、基因间互作以及核-质信号传导,初步了解了水稻叶色形成及调控机理。截止目前,在拟南芥中叶绿素合成过程的关键酶都已鉴定出来(Nagata N(2005)Identification of a Vinyl Reductase Gene for Chlorophyll Synthesis in Arabidopsis thaliana and Implications for the Evolution of Prochlorococcus Species.The Plant Cell Online 17:233-240),但在水稻中只有部分基因被鉴定出来,其他基因还有待进一步发掘。此外,叶绿素降解的调控机制尚未明朗,核-质互作的机理尚不清晰,都有待深入进一步研究。
植物镁原卟啉IX单甲脂环化酶基因(Magnesium protoporphyrin IX monomethyl ester cyclase)是植物叶绿素合成过程中的关键酶,其功能是将镁原卟啉IX单甲脂转化成二乙烯基原叶绿素酸脂。该酶复合体是由催化亚基,辅因子调节亚基,降解亚基组合而成。在细菌和海藻类生物体内,其同源基因编码起催化作用的亚基已被鉴定。在单子叶模式植物水稻中,该基因的克隆及其功能研究还未见报道。
技术实现要素:
本发明要解决的问题是提供一种从水稻黄叶突变体中克隆新基因YL-1,该基因编码一个镁原卟啉IX单甲脂环化酶,调控叶绿素的合成。
为实现上述目的,本发明采用的技术方案是:一种控制水稻叶绿素合成的基因YL-1,所述基因YL-1的核苷酸序列如SEQ ID NO:1所示。
进一步的是:所述基因YL-1的核苷酸序列还包括在SEQ ID NO:1所示的核苷酸序列中添加、取代,插入或缺失一个或多个核苷酸而生成的突变体、等位基因或衍生物。
本发明还提供一种由控制水稻叶绿素合成的基因YL-1编码的蛋白,所述蛋白质的氨基酸序列如SEQ ID NO:3所示。
进一步的是:所述蛋白氨基酸序列还包括在SEQ ID NO:3所示的氨基酸序列中添加、取代、插入或缺失一个或多个氨基酸或其他物种的同源序列而生成的氨基酸序列或衍生物。
本发明还提供一种含有植物叶绿素合成相关蛋白编码基因的转基因细胞系。
本发明还提供一种含有植物叶绿素合成相关蛋白编码基因的转基因重组菌。
本发明的另一个目的是提供一种用YL-1基因进行高效的植物转化方法,具体地说,本发明提供了具有SEQ ID NO:1所示的序列片段载体。
本发明的有益技术效果是:本发明利用水稻黄叶突变体,通过图位克隆法克隆到了YL-1基因,该基因编码叶绿素合成相关镁原卟啉IX单甲脂环化酶蛋白,通过转基因过表达验证实验鉴定了YL-1基因的功能,因而本发明能调节水稻叶绿素的合成,进而获得苗期黄化表型,为该基因的进一步利用打下基础。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1野生型YK17和突变体yl-1幼苗期叶片和抽穗期剑叶,稻穗叶绿素a、叶绿素b、叶绿素a/b对比分析;
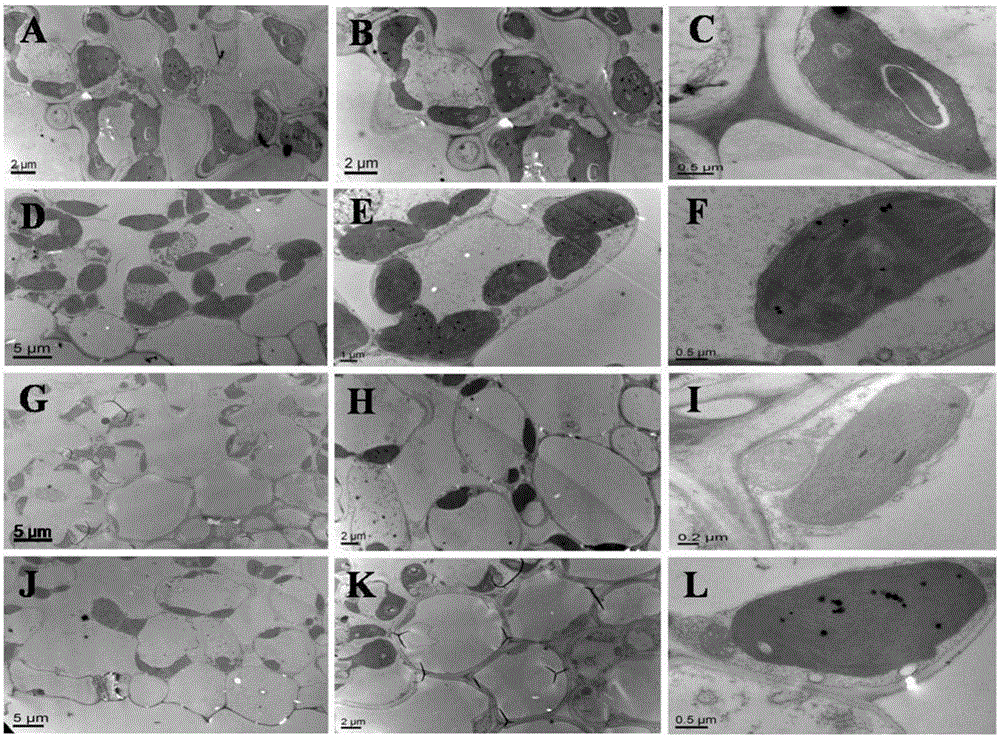
图2苗期和抽穗期yl-1突变体和野生型中嘉早17叶片透射电镜叶绿体亚显微结构观察,A、B、C苗期野生型中嘉早17叶片叶绿体亚显微结构,D、E、F、抽穗期野生型中嘉早17叶片叶绿体亚显微结构,G、H、I苗期yl-1叶片叶绿体亚显微结构,J、K、L抽穗期yl-1叶片叶绿体亚显微结构;
图3 YL-1在水稻第1染色体上的精细定位;
图4野生型YK17(左),突变体yl-1(中),T0转基因过表达植株(右)整体植株,剑叶,稻穗表型;
图5野生型YK17,突变体yl-1,转基因过表达植株YL-1基因(LOC_OS01g17170)相对表达量分析。YK17,野生型中嘉早17;yl-1,突变体;YL-1E,转基因过表达植株。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
一、水稻黄叶突变体yl-1的分离和遗传分析
本研究突变体yl-1来源于超级早稻品种中嘉早17(YK17)的EMS诱变突变体库,田间表型观察发现该突变体的主要特征是:该突变体从苗期至成熟期叶片、茎秆、稻穗均表现为黄色;其它农艺性状方面:株高,yl-1(72.88cm)略矮于YK17(84.80cm);分蘖数,yl-1(12.5)远高于YK17(7.00);每穗粒数,yl-1(118.50)低于YK17(209.20);结实率,yl-1(85%)高于YK17(75%);净光合速率,yl-1(25.31)低于YK17(32.96)。叶绿素测定结果表明yl-1主要表现为叶绿素b较野生型严重缺乏(图1)。利用透射电镜(TEM)观察幼苗期和抽穗期野生型YK17和yl-1的叶片叶绿体超微结构,发现在幼苗期和抽穗期野生型的叶肉细胞含有较多的叶绿体,且叶绿体含有正常的片层结构;而yl-1含有较少的叶绿体,且叶绿体片层堆积较少,模糊,含有较多的嗜锇小体(图2)。用突变体分别与水稻品种D50,Dular和02428进行正反交,得到的F1后代均表现为正常绿化,在其自交F2群体中正常植株与突变植株分离比接近3:1(表2),表明此性状由一对隐性核基因控制。
表1.突变体yl-1与野生型中嘉早17(YK17)农艺性状比较
表2.突变植株与正常植株在不同F2群体中的分离
二、图位克隆YL-1基因
1.YL-1基因的分子定位:
为了分离YL-1基因,本发明首先建立了一个大的多态性高的F2定位群体,由热带粳稻品种D50为父本,突变体yl-1为母本,挂牌收获F2单株鉴定后代基因型,对获得的F2群体中有表型分离的群体选取其中的隐性黄叶极端个体进行基因定位,利用SSR分子标记对YL-1位点进行初步定位,将其初步定位在第1染色体的短臂上,并介于RM10551和RM10748两SSR标记之间。然后通过对RM10622和RM10644两标记之间的BAC序列进行分析,发展了新的Indel标记,将YL-1精细定位于PAC克隆P0025D05的RM10622和Indel8之间44.8kb的范围之内(图3),通过分析此区段开放阅读框(ORF)推测候选基因并基因测序分析,寻找突变位点。
2.YL-1基因的鉴定和功能分析
根据精细定位的结果,在44.8kb范围内根据RiceGAAS(Rice Automat ed Systrm,http://ricegaas.dna.affrc.go.jp/)和TIGR(http://rice.plantbiology.msu.edu/)的预测,发现在此区间内共有4个候选基因,我们设计了各基因的测序引物,采用PCR的方法分别从yl-1突变体和野生型YK17基因组中扩增出所有候选基因进行测序分析。发现其中1个基因的DNA片段中,突变体扩增的产物与野生型品种比较发生了单碱基突变,造成氨基酸的突变。野生型品种YK17扩增的基因序列为SEQ ID NO.1,命名为YL-1基因。为了确证突变体表型是由YL-1基因突变引起的,我们对突变体进行了转基因恢复验证实验。转基因恢复验证主要是将野生型YL-1基因全长基因组序列克隆并构建到双元植物转基因载体pUbi-1390的多克隆位点KpnI/BamHI处,得到过量表达载体。将构建好的过量表达载体通过农杆菌介导的遗传转化系统转化突变体愈伤,经过抗性愈伤诱导进而分化成转基因苗。转化了外源YL-1基因的突变体(即转基因阳性株系)幼苗颜色复绿,YL-1表达量明显增高,图4为野生型、突变体以及T0转基因过表达植株的表型。图5为野生型、突变体、转基因过表达植株的YL-1表达量分析。转基因过表达恢复试验确证了突变体表型是由YL-1基因突变引起的,表明本发明获得了使突变体恢复正常功能的转基因水稻。
实施例2YL-1基因的克隆
a)水稻材料
水稻(Oryza sativa L)突变体yl-1(yellow leaves 1),原始野生型材料为超级早稻品种中嘉早17(YK17).
b)电镜观察
利用透射电镜(TEM)观察苗期和抽穗期野生型和yl-1叶片的叶绿体超微结构,发现野生型的叶绿体含有正常的片层结构和淀粉粒,而yl-1的叶肉细胞含有较少的叶绿体,且叶绿体片层堆积疏松较模糊,嗜锇小体较多(图3)。
c)遗传分析和定位群体
利用正反杂交确定yl-1为隐性突变体,选取突变体和D50进行杂交,F1代自交,单株收种种植F2群体,从有分离的群体中选出1500个隐性个体(幼苗黄色)作为定位群体。在四叶期每株取1克左右的嫩叶,用来提取总DNA进行基因定位。
d)YL-1基因的初步定位和精细定位
采用水稻微量DNA的快速提取方法从水稻叶片中提取用于基因定位的基
组DNA,该DNA抽提的方法为SDS法(Dellaporta SL,Wood J,Hicks JB(1983)A plant DNA minipreparation:version II.Plant Mol Biol Rep 1:19-21)。取大约100mg水稻叶片剪碎后放入2ml离心管,加入钢珠经液氮冷冻后,在磨样机上粉碎,然后提取DNA,获得的DNA沉淀溶解于400μL超纯水中,每一个PCR反应用1μLDNA样品。在YL-1基因的初步定位中,采用由30个具有突变表型的F2极端个体进行SSR分析。首先根据公布的粳稻和籼稻创建的分子遗传图谱,选取近似均匀分布于各染色体上的SSR引物进行PCR扩增(反应体系如下)。通过8%的聚丙烯酰胺凝胶(凝胶配置方法如下)电泳分离,通过检测条带的多态性,将基因初步定位到第1染色体的短臂上,并介于RM10551和RM10748两SSR标记之间。
PCR反应体系:
8%聚丙烯酰胺凝胶配方:
聚丙烯酰胺凝胶显色液配方:
注:甲醛是临用前现加,其他三个按相应量提前配好。
然后通过对RM10622和RM10644两标记之间的BAC序列进行分析,发展了新的Indel标记,最后将F2定位群体扩大到1500个进行精细定位,将YL-1精确定位于BAC克隆P0481E12的RM10622和Indel8之间44.8kb的范围之内,(图3),通过分析此区段开放阅读框(ORF)推测候选基因并基因测序分析,寻找突变位点。
Indel标记引物序列:
Indel4-F ACAATCAACTCTAAATGGATAACTAC(SEQ ID NO.6)
Indel4-R GCCTATGCTTTGCTACGGA(SEQ ID NO.7)
Indel8-F CCATTAGGTCTTTCTTGTGCC(SEQ ID NO.8)
Indel8-R GTCCGTAGGTGGTGTTGG(SEQ ID NO.9)
e)基因预测和比较分析
根据精细定位的结果,在44.8kb范围内根据RiceGAAS(Rice Automat ed Systrm,http://ricegaas.dna.affrc.go.jp/)和TIGR(http://rice.plantbiology.msu.edu/)的预测,发现在此区间内共有4个候选基因,我们设计了各基因的测序引物,采用PCR的方法分别从yl-1突变体和野生型品种基因组中扩增出所有候选基因进行测序分析。发现其中1个基因(LOC-Os01g17170)的DNA片段中,突变体扩增的产物与野生型品种比较发生了单碱基突变(CDS 515位碱基C突变成T),造成氨基酸的突变(丝氨酸Ser突变成苯丙氨酸Phe)。野生型品种扩增的基因序列为SEQ ID NO.1,命名为YL-1基因,其编码的蛋白质测序得到的核苷酸序列为SEQ ID NO.2.
实施例3转基因实验
1、载体构建
设计一对完全覆盖整个YL-1基因ORF的引物,并在引物上分别设计酶切位点KpnI和BamHI位点,PCR扩增野生型基因组DNA,电泳检测切胶回收,回收产物用KpnI和BamHI酶切,连接至同样酶切的pUbi-1390载体上,测序确认没有发生碱基突变,构建后的载体结构图为pUbi1390-YL-1,把构建好的载体通过电击的方法转入农杆菌(A grobacterium tumefaciens)菌株中。
扩增ORF序列的引物序列为:
OG2-KpnI:5’-TTACTTCTGCACTAGGTACCTCTCGCCACCTTATCTCATC-3’(SEQ ID NO.4)
OG2-BamHI:5’-GAATTCCCGGGGATCCTAACCACCCATCATCTCACC-3’(SEQ ID NO.5)
2、遗传转化:
(1)转化受体的选择
将yl-1种子成熟胚诱导愈伤组织,经过诱导培养基诱导2周后将胚芽剪下,继续培养1周,挑选生长旺盛的愈伤用作转化的受体。
(2)遗传转化
采用农杆菌介导的遗传转化方法(Hiei Y,Ohta S,Komari T,Kumashiro T(1994)Efficient transformation of rice(Oryza sativa L.)mediated by Agrobacterium and sequence analysis of the boundaries of the T‐DNA.The Plant Journal 6:271-282),将pUbi-1390空载体和pUbi1390-YL-1载体的EHA105菌株侵染水稻愈伤,在黑暗、25℃条件下共培养3天后,在含有120mg/L G418的筛选培养基上培养。筛选抗性愈伤在含有120mg/L预分化培养基上培养10-13天。将预分化的愈伤转至分化培养基上在光照条件下培养。一个月左右得到抗性转基因植株。对植株进行鉴定和连续的观察,发现转空载体的转基因植株表型与yl-1相比不发生变化,即苗期黄化,而pUbi1390-YL-1载体的阳性转基因植株与野生型表现一致,表现为绿色,即恢复了yl-1的突变表型,见图4。
本技术领域技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域中的普通技术人员的一般理解相同的意义。还应该理解的是,诸如通用字典中定义的那些术语应该被理解为具有与现有技术的上下文中的意义一致的意义,并且除非像这里一样定义,不会用理想化或过于正式的含义来解释。
最后所应说明的是:以上实施例仅用以说明而非限制本发明的技术方案,尽管参照上述实施例对本发明进行了详细说明,本领域的普通技术人员应该理解:依然可以对本发明进行修改或者等同替换,而不脱离本发明的精神和范围的任何修改或局部替换,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!