糖基β‑榄香烯衍生物及其制备方法和应用与流程
本发明涉及医药技术领域,尤其涉及糖基β-榄香烯衍生物及其制备方法和应用。
背景技术:
β-榄香烯是我国研究人员首次从姜科植物温郁金根茎中提取出来的国家二类抗癌药物,其通过抑制癌细胞增殖、诱导癌细胞凋亡、抑制癌细胞血管生成、遏制癌细胞转移、影响端粒酶活性以及逆转癌细胞耐药性等发挥抗肿瘤作用,其抗癌作用疗效确切、毒副作用小、可以通过多条途径改善和提高机体免疫功能、且对一些容易产生耐药性的恶性肿瘤也有较好的疗效、具有广谱的抗癌活性和良好的抗肿瘤应用前景。但是,由于β-榄香烯难溶于水、生物利用度低、不能实时监控治疗肿瘤等缺点,使其在浓度和时间上呈现出较强的依赖性,严重限制了其临床应用。因此,对其化合物进行改造以提高β-榄香烯水溶性和生物兼容性具有重要的科学意义。
β-榄香烯的结构如下:
技术实现要素:
本发明要解决的技术问题是提供糖基β-榄香烯衍生物及其制备方法和应用,具体是三类可实时监控治疗肿瘤的糖基β-榄香烯衍生物以及其合成方法和在抗肿瘤方面的应用。
为解决上述技术问题,本发明采用以下技术方案:
糖基β-榄香烯衍生物,具有以下通式:
通式I、II、III中,为多羟基糖基。
通式I、II、III中,
通式I的化合物为:
通式II的化合物为:
通式III的化合物为:
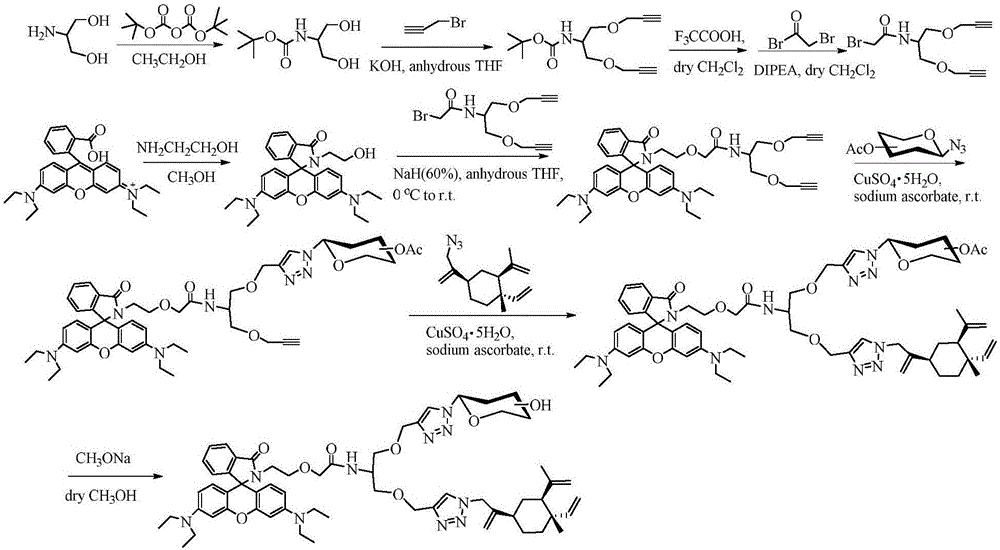
上述糖基β-榄香烯衍生物的制备方法,首先通过环化反应将罗丹明B关环得到荧光猝灭的罗丹明衍生物,然后在氢化钠催化下分别与不同末端炔基化合物进行亲核取代反应得到含有不同末端炔基的罗丹明衍生物,该类化合物再分别与全乙酰糖基叠氮、叠氮化β-榄香烯的经过铜(I)催化点击化学反应以及脱乙酰化反应得到目标化合物。
全乙酰糖基叠氮为乙酰化保护后的多羟基糖基叠氮。
上述糖基β-榄香烯衍生物在制备实时监控治疗肿瘤的抗癌药物方面的应用。
多羟基的糖类物质是人类重要的营养物质,具有较强的亲水性,而且绿色环保。因此,在β-榄香烯引入亲水性的糖类物质,是提高β-榄香烯水溶性很好的设计思路。而罗丹明类化合物具有高量子产率、高消光系数、极好的光稳定性、激发波长较长、检测灵敏度高、价格便宜等诸多优点,而且在不同pH条件下表现出荧光“开-关”效应(碱性条件下闭环后猝灭荧光,酸性条件下开环后发出荧光);另外,已有研究表明,肿瘤细胞呈偏酸性(胞外pH 6.2-6.9,胞内pH 4.5-5.5),闭环的罗丹明化合物可在肿瘤细胞内开环释放出强烈的荧光。因此,在β-榄香烯引入罗丹明将有望实现实时监控治疗肿瘤的目的。
为此,针对β-榄香烯难溶于水、生物利用度低、不能实时监控治疗肿瘤等缺点,发明人根据肿瘤细胞偏酸性的性质将亲水性的糖类物质和具有强荧光性质的罗丹明引入β-榄香烯结构中,设计合成了具有通式I、II、III的糖基β-榄香烯衍生物。研究表明,所得的糖基β-榄香烯衍生物水溶性较好、抗癌活性好,可作为实现实时监控治疗肿瘤的抗癌药物应用于恶性肿瘤的治疗,对β-榄香烯在医药领域的研究与应用具有重要的科学意义。同时,发明人建立了相应化合物的制备方法,该法运用点击化学反应技术,合成简单、科学。
与现有技术相比,本发明的突出优点在于:
(1)本发明在β-榄香烯同时引入糖基1,2,3-三唑和罗丹明B,合成了糖基1,2,3-三唑罗丹明β-榄香烯衍生物,合成出一类水溶性好、可实现实时监控治疗肿瘤的β-榄香烯衍生物;
(2)本发明引入的基团为糖基1,2,3-三唑,糖类物质是人类重要的营养物质,具有较强的亲水性,而且绿色环保;
(3)本发明引入的罗丹明荧光染料价格便宜、量子产率高、光稳定性好、激发波长较长,可减少内源性荧光的干扰;
(4)本发明糖基1,2,3-三唑罗丹明β-榄香烯衍生物能应用于医药技术领域恶性肿瘤的治疗。
附图说明
图1是本发明糖基β-榄香烯衍生物pH响应的荧光测试曲线图,图中:从上至下各曲线分别表示不同pH值条件下化合物的荧光强度。
图2是本发明糖基β-榄香烯衍生物的合成线路图一。
图3是本发明糖基β-榄香烯衍生物的合成线路图二。
具体实施方式
本发明的糖基β-榄香烯衍生物可按图1和图2所示反应路线合成,具体制备方法为:首先通过环化反应将罗丹明B关环得到荧光猝灭的罗丹明衍生物,然后在氢化钠催化下分别与不同末端炔基化合物进行亲核取代反应得到含有不同末端炔基的罗丹明衍生物,该类化合物再分别与全乙酰糖基叠氮、叠氮化β-榄香烯的经过铜(I)催化点击化学反应以及脱乙酰化反应得到目标化合物。
为了更好地理解本发明,下面结合实施例进一步阐明本发明β-榄香烯衍生物及其制备方法的内容。
实施例1
将罗丹明B(10g)溶于甲醇(20mL)后加入乙醇胺(25mL),Ar保护,放置75℃油浴下回流至红色消失,冷切至室温,加入100mL去离子水,CH2Cl2萃取,饱和食盐水洗涤,无水Na2SO4干燥,过滤,浓缩,硅胶柱纯化(PE/EA=4∶1),得到灰白色固体1(3.84g,35%)。1H NMR(600MHz,CDCl3)δ7.92(dd,J=5.6,3.0Hz,1H),7.46(dd,J=5.6,3.1Hz,2H),7.09(dd,J=5.2,3.2Hz,1H),6.51(d,J=8.9Hz,2H),6.40(d,J=2.4Hz,2H),6.31(dd,J=8.9,2.4Hz,2H),3.51-3.47(m,2H),3.36(q,J=7.0Hz,8H),3.32-3.29(m,2H),1.19(t,J=7.1Hz,12H).13C NMR(151MHz,CDCl3)δ170.10,153.92,153.28,148.90,132.69,130.45,128.51,128.14,123.81,122.90,108.24,104.80,97.80,65.87,62.68,62.66,44.65,44.37,12.61.
将丝氨醇(5g)溶于150mL的无水乙醇,加入100mL BOC酸酐(12g)无水乙醇溶液,室温反应6h,旋除溶剂,再用正庚烷重结晶得白色固体2(9.6g,91%)。1H NMR(600MHz,DMSO)δ4.51(t,J=5.3Hz,2H),3.35(m,5H),1.38(s,9H).
将粉状的KOH(3.05g)和无水THF(15mL)悬浮液冷却至0℃,Ar保护。将化合物2(2.06g)溶于无水THF(10mL)后,逐滴加入反应液中,加完后0℃反应15min,逐滴加入4.7mL的溴丙炔,0℃反应5min后升温至35℃反应过夜,加入去离子水(100mL),CH2Cl2萃取,饱和食盐水洗涤,无水Na2SO4干燥,过滤,浓缩,过柱分离,得到黄色液体3(2.467g,88%)。1H NMR(600MHz,CDCl3)δ4.18(d,J=2.3Hz,4H),3.94(s,1H),3.65(dd,J=9.3,4.4Hz,2H),3.59(dd,J=8.9,6.1Hz,2H),2.45(t,J=2.4Hz,2H),1.46(s,9H).ESI-MS(m/z)268.2[M+H+].
化合物3(2.4g)溶于30mL干燥的CH2Cl2,0℃下逐滴加入三氟乙酸(15mL),Ar保护下室温反应3h,旋除溶剂,加入甲苯(6×10mL)带除多余的三氟乙酸后,加入15mL干燥的CH2Cl2和4.5mL的N,N-二异丙基乙胺,Ar保护,冷却至0℃后逐滴加入30mL混合液(1.2mL溴乙酰溴+30mL干燥的CH2Cl2),加完后自然升温至室温反应过夜,加入30mL CH2Cl2稀释,去离子水洗涤,无水Na2SO4干燥,浓缩,过柱分离(PE/EA=7∶1),得到淡黄色液体4(1.78g,68%)。1H NMR(600MHz,CDCl3)δ6.81(d,J=8.5Hz,1H),4.26(dtt,J=8.7,5.6,4.5Hz,1H),4.19(dd,J=2.4,0.9Hz,4H),3.89(s,2H),3.69(dd,J=9.4,4.5Hz,2H),3.62(dd,J=9.5,5.6Hz,2H),2.47(t,J=2.4Hz,2H).
将NaH(60%,0.407g)和无水THF(10mL)悬浮液冷却至0℃,Ar保护。将化合物1(1.31g)溶于无水THF(15mL)后,搅拌下逐滴加入反应液中,加完后0℃反应30min,再将预先配置的溶液(1.04g化合物4+5mL无水THF)逐滴加入反应体系中,加完后放置室温反应过夜。加入去离子水猝灭反应,CH2Cl2萃取,饱和食盐水洗涤,无水Na2SO4干燥,过滤,浓缩,柱层析纯化(PE/EA=4∶1),得到灰白色固体5(1.3g,68%)。
1H NMR(600MHz,CDCl3)δ7.95-7.91(m,1H),7.48-7.44(m,2H),7.13-7.07(m,2H),6.46(d,J=8.9Hz,2H),6.39(d,J=2.5Hz,2H),6.29(dd,J=8.9,2.5Hz,2H),4.30(dt,J=8.8,5.4Hz,1H),4.10(d,J=2.4Hz,4H),3.68-3.62(m,6H),3.42(t,J=6.2Hz,2H),3.35(q,J=7.1Hz,8H),3.07(t,J=6.2Hz,2H),2.40(t,J=2.3Hz,2H),1.18(t,J=7.1Hz,12H).ESI-MS(m/z)693.4[M+H+].
将化合物5(0.28g)溶于THF(2.5mL),Ar保护,室温下将预先用去离子水(2.5mL)溶解的抗坏血酸钠(13.5mg)和CuSO4·5H2O(1.6mg)溶液加入反应液中,少量多次分批加入全乙酰半乳糖叠氮(0.15g),TCL监控反应至产物点最浓时结束反应(总共约24h),加入去离子水,CH2Cl2萃取,饱和食盐水洗涤,无水Na2SO4干燥,过滤,浓缩,过柱分离,得到淡红色固体6(0.19g,44%)。1H NMR(600MHz,CDCl3)δ7.93(ddd,J=10.2,8.5,3.7Hz,2H),7.46(dd,J=5.6,3.1Hz,2H),7.15-7.09(m,2H),6.47-6.44(m,2H),6.39(t,J=2.4Hz,2H),6.30-6.27(m,2H),5.87(dd,J=9.3,3.4Hz,1H),5.62(td,J=9.8,4.4Hz,1H),5.56(d,J=3.2Hz,1H),5.29-5.25(m,1H),4.67(d,J=3.9Hz,2H),4.34-4.28(m,1H),4.26-4.20(m,2H),4.17-4.12(m,1H),4.07-4.04(m,2H),3.69-3.58(m,6H),3.49(dddd,J=13.0,9.5,6.4,3.2Hz,1H),3.39-3.33(m,9H),3.12(dt,J=9.5,6.0Hz,1H),3.05-2.99(m,1H),2.43-2.41(m,1H),2.24(s,3H),2.06(s,3H),2.03(d,J=0.9Hz,3H),1.90(d,J=4.2Hz,3H),1.18(t,J=7.0Hz,12H).
将2.58mL的β-榄香烯和2mL的混合液放置冰浴冷却至5℃以下,磁力搅拌下逐滴加入13.5mL的次氯酸钠溶液(滴加时长4h以上),加完后放置室温反应2h,加入CH2Cl2萃取,去离子水洗涤,无水Na2SO4干燥,过滤,浓缩,硅胶柱小心分离(石油醚),得到1.1g的7-1和7-2混合液(7-1为主)。
将得到的7-1和7-2的混合液(0.85g)溶于5mL DMSO,室温下分批加入NaN3(0.36g),室温反应3h,将反应液倾入40mL的去离子水中,CH2Cl2萃取(4×15mL),饱和食盐水洗涤,无水Na2SO4干燥,过滤,浓缩,过柱分离(石油醚),得到较纯的油状液体8(仍然有微量14位取代的β-榄香烯,0.44g,50%)。
将化合物6(0.19g)和化合物8(56mg)溶于THF(3mL),Ar保护,室温下将预先用去离子水(3mL)溶解的抗坏血酸钠(13.5mg)和CuSO4·5H2O(1.6mg)溶液加入反应液中,室温反应过夜,加入去离子水,CH2Cl2萃取,饱和食盐水洗涤,无水Na2SO4干燥,过滤,浓缩,过柱分离,得到淡红色固体9(0.18g,77%)。
将化合物9(0.18g)溶于5mL的干燥甲醇溶液中,加入甲醇钠溶液调节pH至9-10,室温反应过夜,加入氢离子交换树脂调节pH至中性,过滤,浓缩,过柱分离,得到白色固体10(0.12g,76%)。1H NMR(600MHz,CD3OD)δ8.21(d,J=15.3Hz,1H),7.91(dd,J=7.5,3.9Hz,1H),7.80(d,J=1.2Hz,1H),7.59-7.51(m,2H),7.08-7.04(m,1H),6.44(s,2H),6.40-6.32(m,3H),6.31-6.27(m,1H),5.80(dd,J=17.5,10.8Hz,1H),5.59(dd,J=9.1,3.0Hz,1H),5.07(d,J=2.3Hz,1H),5.00(dd,J=12.8,9.3Hz,2H),4.90(d,J=3.0Hz,2H),4.86(s,1H),4.80(s,2H),4.57(dd,J=5.2,3.2Hz,3H),4.52(s,1H),4.24(dd,J=5.6,2.2Hz,1H),4.20(t,J=9.3Hz,1H),4.02(d,J=2.8Hz,1H),3.86(t,J=5.8Hz,1H),3.76(ddd,J=21.9,13.0,6.3Hz,3H),3.67-3.54(m,6H),3.49-3.34(m,10H),3.10-2.97(m,2H),1.96(dt,J=12.7,3.5Hz,1H),1.92(d,J=3.4Hz,1H),1.68(s,3H),1.61-1.48(m,3H),1.42(ddd,J=13.7,11.6,6.8Hz,3H),1.20-1.12(m,11H),1.05(t,J=7.0Hz,1H),1.00(s,3H).13C NMR(151MHz,CD3OD)δ170.75,169.10,153.74,153.38,153.35,149.89,149.09,148.66,148.65,147.20,144.66,144.59,132.89,130.59,130.56,128.29,123.99,123.97,123.67,122.56,122.52,112.08,112.03,111.57,109.23,108.23,108.13,104.66,104.54,97.65,88.86,78.52,73.95,70.07,69.47,68.98,68.74,68.39,65.54,63.68,61.03,53.67,52.41,48.50,44.01,42.07,39.57,39.37,39.13,32.81,26.78,23.98,15.72,11.58,11.57.ESI-MS(m/z)1143.6[M+H+].HRMS(MALDI)calcd for C62H83N10O11:[M+H+]1143.6237,found 1143.6245.
实施例2
用类似于化合物6的合成方法得到化合物12。1H NMR(600MHz,CDCl3)δ7.92-7.89(m,1H),7.87(s,1H),7.48-7.43(m,2H),7.16-7.08(m,2H),6.45(ddd,J=8.6,5.9,2.6Hz,2H),6.39(t,J=2.6Hz,2H),6.29(ddd,J=8.2,5.5,2.6Hz,2H),5.86(dd,J=9.3,2.7Hz,1H),5.49(q,J=9.4Hz,1H),5.44-5.40(m,1H),5.38(d,J=2.8Hz,1H),5.15(dd,J=10.4,7.9Hz,1H),4.99(dd,J=10.4,3.5Hz,1H),4.65(d,J=2.9Hz,2H),4.55(dd,J=7.9,2.1Hz,1H),4.49(d,J=12.2Hz,1H),4.32-4.27(m,1H),4.18-4.12(m,3H),4.06-4.03(m,2H),4.03-3.98(m,1H),3.93(dt,J=10.5,6.1Hz,2H),3.69(dd,J=14.8,3.5Hz,1H),3.65-3.61(m,3H),3.61-3.57(m,2H),3.48(dd,J=14.0,6.9Hz,1H),3.39-3.32(m,10H),3.11(dt,J=9.4,6.0Hz,1H),3.03-2.98(m,1H),2.41(dd,J=2.3,1.7Hz,1H),2.18(s,3H),2.11(s,3H),2.09(d,J=0.6Hz,3H),2.08(s,3H),2.07(s,3H),1.99(s,3H),1.87(d,J=4.5Hz,3H),1.18(td,J=7.0,1.3Hz,12H).
用类似于化合物9的合成方法得到化合物13,直接进行下一步反应。
用类似于化合物10的合成方法得到化合物14。1H NMR(600MHz,CD3OD)δ8.20(d,J=19.2Hz,1H),7.91-7.85(m,1H),7.76(d,J=1.6Hz,1H),7.57-7.50(m,2H),7.06(dd,J=5.3,1.5Hz,1H),6.54-6.21(m,6H),5.79(dd,J=17.5,10.8Hz,1H),5.64(dd,J=9.2,2.2Hz,1H),5.06(d,J=3.9Hz,1H),5.01-4.92(m,2H),4.88(t,J=1.1Hz,1H),4.85(s,2H),4.81-4.76(m,2H),4.59-4.53(m,3H),4.50(d,J=2.9Hz,2H),4.42(dd,J=7.7,3.6Hz,1H),4.21(dt,J=10.9,5.4Hz,1H),4.00(t,J=9.0Hz,1H),3.89(d,J=2.4Hz,2H),3.84(d,J=3.0Hz,1H),3.82-3.70(m,5H),3.63-3.54(m,7H),3.53-3.48(m,2H),3.46-3.32(m,9H),3.08-2.92(m,2H),1.98-1.87(m,2H),1.67(t,J=6.2Hz,3H),1.60-1.46(m,3H),1.46-1.37(m,3H),1.15(td,J=7.0,2.8Hz,11H),1.05-1.01(m,1H),0.98(d,J=1.0Hz,3H).ESI-MS(m/z)1305.7[M+H+].HRMS calcd for C68H93N10O16:[M+H+]1305.67655,found 1305.67712.
实施例3
将5g三羟甲基氨基甲烷溶于30mL甲醇和30mL叔丁醇组成的混合溶液,搅拌下加入BOC酸酐(11.75g)叔丁醇(50mL)溶液,室温反应过夜,旋除溶剂,加入乙酸乙酯冷藏过夜,过滤得到白色固体15(8.5g,93%)。1H NMR(600MHz,DMSO-d6)δ4.49(s,3H),3.52(s,6H),1.37(s,9H).
将粉状的KOH(2.3g)和干燥的DMF(10mL)悬浮液冷却至0℃,Ar保护。将化合物15(1.5g)溶于无水THF(10mL)后,逐滴加入反应液中,加完后0℃反应10min,逐滴加入3.3mL的溴丙炔,0℃反应5min后升温至35℃反应过夜,加入去离子水(100mL),CH2Cl2萃取,饱和食盐水洗涤,无水Na2SO4干燥,过滤,浓缩,过柱分离(PE∶EA=15∶1-8∶1),得到黄色液体16(1.4g,61%)。1H NMR(600MHz,CDCl3)δ5.32(s,1H),4.17(d,J=2.3Hz,6H),3.81(s,6H),2.45(t,J=2.3Hz,3H),1.44(s,9H).
化合物16(1.27g)溶于15mL干燥的CH2Cl2,0℃下逐滴加入三氟乙酸(6mL),Ar保护下室温反应3h,旋除溶剂,加入甲苯(6×10mL)带除多余的三氟乙酸后,加入10mL干燥的CH2Cl2和1.7mL的N,N-二异丙基乙胺,Ar保护,冷却至0℃后逐滴加入20mL混合液(0.41mL溴乙酰溴+20mL干燥的CH2Cl2),加完后自然升温至室温反应过夜,加入30mL CH2Cl2稀释,去离子水洗涤,无水Na2SO4干燥,浓缩,过柱分离(PE/EA=7∶1),得到淡黄色液体17(0.92g,68%)。1H NMR(600MHz,CDCl3)δ6.70(s,1H),4.18(d,J=2.4Hz,6H),3.87(s,6H),3.82(s,2H),2.47(t,J=2.3Hz,3H).13C NMR(151MHz,CDCl3)δ165.39,79.40,74.81,68.14,59.76,58.70,29.47.
将NaH(60%,0.2175g)和无水THF(5mL)悬浮液冷却至0℃,Ar保护。将化合物1(0.643g)溶于无水THF(5mL)后,逐滴加入反应液中,加完后0℃反应30min,再将预先配置的溶液(0.592g化合物17+5mL无水THF)逐滴加入反应体系中,加完后放置室温反应过夜。加入去离子水猝灭反应,CH2Cl2萃取,饱和食盐水洗涤,无水Na2SO4干燥,过滤,浓缩,过柱分离(PE/EA=1∶4),得到淡红色固体18(0.733g,72.8%)。1H NMR(600MHz,CDCl3)δ7.94-7.91(m,1H),7.47-7.42(m,2H),7.11-7.06(m,1H),6.82(s,1H),6.46(d,J=8.9Hz,2H),6.39(d,J=2.3Hz,2H),6.29(dd,J=8.9,2.5Hz,2H),4.11(d,J=2.4Hz,6H),3.85(s,6H),3.55(s,2H),3.42(t,J=6.6Hz,2H),3.35(q,J=7.1Hz,8H),3.06(t,J=6.6Hz,2H),2.40(t,J=2.3Hz,3H),1.18(t,J=7.1Hz,12H).13C NMR(151MHz,CDCl3)6169.47,168.35,153.67,153.20,148.83,132.41,130.94,128.88,128.01,123.76,122.89,108.13,105.44,97.69,79.74,74.54,70.39,68.27,68.12,64.62,59.17,58.58,44.38,39.06,12.61.ESI-MS(m/z)761.4[M+H+].
将化合物18(1.04g)溶于THF(10mL),Ar保护,室温下将预先用去离子水(10mL)溶解的抗坏血酸钠(1.1g)和CuSO4·5H2O(12.6mg)溶液加入反应液中,少量多次分批加入全乙酰半乳糖叠氮(1.5g),TCL监控反应至产物点较浓时结束反应(总共约30h),加入去离子水,CH2Cl2萃取,饱和食盐水洗涤,无水Na2SO4干燥,过滤,浓缩,过柱分离得到淡红色固体19(0.23g,15%)以及淡红色固体20(0.395g,19%)。
将化合物19(0.23g)和化合物8(0.125g)溶于THF(4mL),Ar保护,室温下将预先用去离子水(4mL)溶解的抗坏血酸钠(32mg)和CuSO4·5H2O(20mg)溶液加入反应液中,室温反应过夜,加入去离子水,CH2Cl2萃取,饱和食盐水洗涤,无水Na2SO4干燥,过滤,浓缩,过柱分离,得到淡红色固体21(0.22g,67%)。
将化合物21(0.2g)溶于5mL的干燥甲醇溶液中,加入甲醇钠溶液调节pH至9-10,室温反应过夜,加入氢离子交换树脂调节pH至中性,过滤,浓缩,过柱分离,得到白色固体22(0.13g,72.5%)。1H NMR(600MHz,CD3OD)δ8.16(s,1H),7.93-7.76(m,3H),7.58-7.43(m,2H),7.11-7.00(m,1H),6.60-6.19(m,6H),5.79(dd,J=17.5,10.9Hz,2H),5.57(d,J=9.1Hz,1H),5.05(s,2H),5.01(d,J=6.2Hz,4H),4.88(s,2H),4.84(s,2H),4.79(s,4H),4.55(dd,J=25.4,12.2Hz,8H),4.18(t,J=9.3Hz,1H),4.00(d,J=2.8Hz,1H),3.84(t,J=5.9Hz,1H),3.80-3.69(m,9H),3.42(s,2H),3.35(dd,J=13.4,6.5Hz,8H),2.99(d,J=5.2Hz,2H),2.02-1.88(m,4H),1.67(s,6H),1.55(dt,J=17.6,12.6Hz,6H),1.48-1.37(m,6H),1.14(t,J=7.0Hz,10H),1.03(t,J=7.0Hz,2H),0.98(s,6H).13C NMR(151MHz,CD3OD)δ170.27,168.89,153.84,153.30,149.92,149.02,148.75,147.21,144.73,144.68,132.74,130.57,128.38,128.18,124.00,123.64,122.48,111.91,111.60,109.24,108.16,104.80,97.62,88.92,78.60,73.94,70.12,69.70,68.96,67.93,67.88,67.67,65.23,64.02,63.87,61.03,59.68,53.66,52.40,44.02,42.06,39.58,39.39,32.79,26.81,24.03,15.73,11.62.ESI-MS(m/z)1456.8[M+].HRMS(MALDI)calcd for C81H110N13O12:[M+H+]1456.8391,found 1456.8391.
实施例4
将化合物20(0.35g)和化合物8(0.086g)溶于THF(4mL),Ar保护,室温下将预先用去离子水(4mL)溶解的抗坏血酸钠(20mg)和CuSO4·5H2O(12mg),溶液加入反应液中,室温反应过夜,加入去离子水,CH2Cl2萃取,饱和食盐水洗涤,无水Na2SO4干燥,过滤,浓缩,过柱分离,得到淡红色固体23(0.29g,71%)。
将化合物23(0.25g)溶于6mL的干燥甲醇溶液中,加入甲醇钠溶液调节pH至9-10,室温反应过夜,加入氢离子交换树脂调节pH至中性,过滤,浓缩,过柱分离,得到白色固体24(0.15g,74%)。1H NMR(600MHz,CD3OD)δ8.19(d,J=4.4Hz,2H),7.92-7.87(m,1H),7.84(s,1H),7.56-7.50(m,2H),7.06(tt,J=5.5,2.8Hz,1H),6.44(d,J=2.4Hz,2H),6.41(dd,J=8.9,3.8Hz,2H),6.37-6.31(m,2H),5.80(dd,J=17.5,10.8Hz,1H),5.62(d,J=9.2Hz,2H),5.06(s,1H),5.02(d,J=8.3Hz,2H),4.90(d,J=1.1Hz,1H),4.80(d,J=1.3Hz,2H),4.56(dd,J=33.8,16.4Hz,8H),4.23(t,J=9.3Hz,2H),4.03(d,J=3.1Hz,2H),3.88(t,J=5.9Hz,2H),3.77(ddd,J=17.8,12.2,5.0Hz,12H),3.47(s,2H),3.42-3.34(m,10H),3.02(dd,J=8.2,5.7Hz,2H),2.02-1.88(m,2H),1.68(s,3H),1.62-1.52(m,3H),1.48-1.38(m,3H),1.16(t,J=7.1Hz,11H),1.04(dd,J=8.2,5.9Hz,1H),1.00(s,3H).13C NMR(151MHz,CD3OD)δ170.41,169.02,153.83,153.31,149.94,149.04,148.72,147.23,144.70,144.57,132.81,130.51,128.38,128.22,124.05,123.64,122.67,122.51,111.93,111.58,109.22,108.21,104.73,97.62,88.82,78.54,73.92,70.08,69.64,69.00,68.02,67.84,67.60,65.35,63.97,63.78,61.04,59.73,53.68,52.39,44.02,42.03,39.57,39.39,39.00,32.79,26.80,24.01,15.71,13.38,11.60.ESI-MS(m/z)1416.7[M+H+].HRMS(MALDI)calcd for C72H98N13O17:[M+H+]1416.7198,found 1416.7196.
实施例5
用类似于化合物19和20的合成方法得到化合物25和26。化合物26的1H NMR和13C NMR为:1H NMR(600MHz,CDCl3)δ7.90-7.86(m,2H),7.84(s,1H),7.45(dd,J=5.3,3.3Hz,2H),7.09(dd,J=5.7,2.6Hz,1H),6.83(s,1H),6.45(d,J=8.7Hz,2H),6.38(s,2H),6.28(d,J=8.4Hz,2H),5.91(dd,J=9.3,1.8Hz,2H),5.52(t,J=9.4Hz,2H),5.43(t,J=9.1Hz,2H),5.37(d,J=3.2Hz,2H),5.14(dd,J=10.0,8.3Hz,2H),4.99(dd,J=10.4,3.3Hz,2H),4.65-4.61(m,4H),4.56(d,J=7.9Hz,2H),4.50(d,J=12.9Hz,2H),4.19-4.14(m,3H),4.14-4.09(m,3H),4.06-4.02(m,2H),4.01-3.97(m,4H),3.92(dd,J=12.6,5.8Hz,2H),3.84-3.80(m,2H),3.80-3.75(m,4H),3.51(q,J=14.7Hz,2H),3.46-3.37(m,2H),3.34(q,J=6.9Hz,8H),3.07-2.98(m,2H),2.39(t,J=2.3Hz,1H),2.17(s,6H),2.09(s,6H),2.08-2.06(m,18H),1.98(s,6H),1.83(s,3H),1.81(s,3H),1.16(t,J=7.0Hz,12H).13C NMR(151MHz,CDCl3)δ170.40,170.33,170.17,170.09,169.68,169.66,169.60,169.18,169.05,169.02,168.46,153.62,153.19,148.87,145.66,132.57,130.81,128.80,128.14,123.83,122.79,121.89,121.76,108.15,101.12,97.69,85.28,85.26,79.75,75.76,75.69,74.82,72.84,70.97,70.79,70.51,70.35,69.09,68.73,68.69,68.22,68.11,66.66,64.81,64.78,64.76,61.89,60.84,59.43,58.38,56.81,44.37,39.09,21.79,20.80,20.74,20.65,20.64,20.62,20.51,20.20,20.16,12.57.ESI-MS(m/z)2084.8[M+H+].
用类似于化合物21的合成方法得到化合物27。1H NMR(600MHz,CDCl3)δ7.89-7.81(m,2H),7.61(d,J=11.2Hz,2H),7.44(ddd,J=5.7,4.9,3.6Hz,2H),7.10(dd,J=5.6,2.5Hz,1H),6.81(s,1H),6.44(d,J=8.9Hz,2H),6.39(d,J=2.5Hz,2H),6.30-6.24(m,2H),5.90(d,J=9.4Hz,1H),5.82-5.76(m,2H),5.56(t,J=9.5Hz,1H),5.43(t,J=9.3Hz,1H),5.38(d,J=3.3Hz,1H),5.16(dd,J=10.3,7.9Hz,1H),5.08(s,2H),5.01-4.96(m,5H),4.91(d,J=2.4Hz,2H),4.89(d,J=2.4Hz,2H),4.83(d,J=3.9Hz,4H),4.61-4.56(m,8H),4.18(dd,J=12.2,5.4Hz,1H),4.14(q,J=7.1Hz,5H),4.08(t,J=9.5Hz,1H),4.00-3.96(m,1H),3.93(d,J=6.7Hz,1H),3.80(dd,J=9.0,2.8Hz,3H),3.76(dd,J=9.7,6.3Hz,2H),3.51(s,2H),3.40(t,J=6.5Hz,2H),3.34(q,J=7.0Hz,8H),3.03(t,J=6.5Hz,2H),2.18(s,3H),2.10(s,3H),2.08(s,6H),2.07(s,3H),2.06(s,3H),1.98(d,J=5.9Hz,4H),1.96(d,J=3.9Hz,1H),1.91(s,2H),1.82(s,3H),1.69(s,6H),1.65(d,J=8.9Hz,2H),1.58(dd,J=24.0,12.8Hz,4H),1.48-1.40(m,6H),1.17(t,J=7.1Hz,12H),1.00(s,6H).ESI-MS(m/z)1914.0[M+H+].
用类似于化合物22的合成方法得到化合物28。1H NMR(600MHz,CD3OD)δ8.17(s,1H),7.87(dd,J=20.0,4.5Hz,3H),7.54(tt,J=13.0,6.7Hz,2H),7.08(dd,J=6.4,1.1Hz,1H),6.41(ddd,J=14.9,11.3,2.0Hz,4H),6.36-6.31(m,2H),5.81(dd,J=17.5,10.8Hz,2H),5.67(d,J=9.2Hz,1H),5.07(s,2H),5.03(s,4H),4.90(d,J=1.0Hz,2H),4.87(s,2H),4.81(s,4H),4.63-4.55(m,6H),4.53(s,3H),4.45(d,J=7.7Hz,1H),4.02(t,J=9.1Hz,1H),3.92(d,J=2.5Hz,2H),3.86(d,J=3.1Hz,1H),3.84-3.80(m,2H),3.78(s,2H),3.75(t,J=10.5Hz,6H),3.65-3.59(m,2H),3.53(dd,J=9.7,3.2Hz,1H),3.45(s,2H),3.38(dd,J=13.8,6.8Hz,10H),3.01(t,J=5.9Hz,2H),2.02-1.91(m,4H),1.69(s,6H),1.64-1.57(m,4H),1.54(t,J=10.0Hz,2H),1.44(ddd,J=14.3,13.5,7.7Hz,6H),1.16(t,J=7.0Hz,11H),1.01(s,6H),0.92(t,J=7.0Hz,1H).13C NMR(151MHz,CD3OD)6170.33,168.94,153.85,153.31,149.92,149.04,148.74,147.21,132.76,130.54,128.35,128.19,123.99,123.63,122.95,122.46,111.91,111.57,109.21,108.16,104.74,103.73,97.61,88.00,78.33,78.19,75.74,75.44,73.45,72.30,71.16,68.91,67.88,65.28,64.00,61.12,60.15,59.69,53.66,52.40,44.01,42.07,39.57,39.38,32.79,26.80,24.00,15.70,11.58.ESI-MS(m/z)1618.9[M+H+].HRMS(MALDI)calcd for C87H120N13O17:[M+H+]1618.8920,found 1618.8917.
实施例6
用类似于化合物23的合成方法得到化合物29,直接进行下一步的反应。1H NMR(600MHz,CDCl3)δ7.92-7.82(m,3H),7.60(s,1H),7.44(dd,J=8.7,5.3Hz,2H),7.10(d,J=6.0Hz,1H),6.82(d,J=9.3Hz,1H),6.47(dd,J=24.2,14.1Hz,2H),6.40-6.24(m,3H),5.92(dd,J=9.2,4.6Hz,2H),5.79(dd,J=17.7,10.6Hz,1H),5.58-5.51(m,2H),5.44(t,J=9.1Hz,2H),5.38(d,J=2.2Hz,2H),5.18-5.12(m,2H),5.08(s,1H),5.03-4.95(m,4H),4.90(dd,J=14.1,1.9Hz,2H),4.82(s,2H),4.65-4.54(m,10H),4.52(d,J=12.3Hz,2H),4.16(ddd,J=22.6,15.0,8.1Hz,7H),4.07(t,J=9.4Hz,2H),4.01(d,J=4.3Hz,2H),3.93(t,J=6.5Hz,2H),3.78(ddd,J=23.1,15.5,9.1Hz,6H),3.50(dd,J=13.9,4.3Hz,2H),3.38(ddd,J=19.9,13.6,6.8Hz,8H),3.20-3.12(m,1H),3.07-2.95(m,2H),2.18(s,6H),2.08(d,J=8.0Hz,24H),1.99(s,6H),1.82(s,3H),1.79(s,3H),1.69(s,3H),1.61-1.57(m,4H),1.44(s,3H),1.17(t,J=6.9Hz,11H),1.04(t,J=7.0Hz,1H),1.00(s,3H).ESI-MS(m/z)2351.9[M+Na+].
用类似于化合物24的合成方法得到化合物30。1H NMR(600MHz,CD3OD)δ8.16(s,2H),7.89(dd,J=10.5,5.8Hz,1H),7.81(s,1H),7.55-7.48(m,2H),7.06-7.01(m,1H),6.56-6.23(m,6H),5.78(dd,J=17.5,10.8Hz,1H),5.69(d,J=9.2Hz,2H),5.04(s,1H),4.99(d,J=7.9Hz,2H),4.88(s,2H),4.84(d,J=1.1Hz,1H),4.78(d,J=5.2Hz,2H),4.60(s,1H),4.55(s,1H),4.51(d,J=20.7Hz,6H),4.46(d,J=7.6Hz,2H),4.05(t,J=8.9Hz,2H),3.91(s,4H),3.87(d,J=3.0Hz,2H),3.84-3.81(m,3H),3.80(s,1H),3.78(d,J=8.6Hz,3H),3.74(dd,J=15.4,7.6Hz,9H),3.67-3.64(m,2H),3.63-3.60(m,2H),3.55(dd,J=9.7,3.1Hz,2H),3.46(s,2H),3.35(dd,J=13.6,6.6Hz,8H),2.99(s,2H),1.98-1.92(m,2H),1.66(s,3H),1.60-1.49(m,3H),1.46-1.36(m,3H),1.14(t,J=7.1Hz,11H),1.03(t,J=7.1Hz,1H),0.98(s,3H).13C NMR(151MHz,CD3OD)δ170.47,169.04,153.84,153.31,149.93,149.06,148.71,147.22,144.69,144.48,132.86,130.46,128.37,128.26,124.04,123.64,123.17,123.12,122.56,111.95,111.62,109.26,108.20,104.65,103.75,97.63,87.87,78.49,78.13,75.69,75.44,73.41,72.26,71.18,69.67,68.96,68.12,67.69,65.39,63.97,63.79,61.19,60.22,59.76,53.68,52.38,46.07,44.03,42.04,39.58,39.39,32.79,26.80,24.04,15.74,11.63.ESI-MS(m/z)1740.8[M+H+].HRMS(MALDI)calcd for C84H118N13O27:[M+H+]1740.8255,found 1740.8255.
荧光测试
将目标化合物配成2.5×10-4mol/L的溶液,进行荧光测试。
Britton-Robinson缓冲溶液的配制:在磷酸、硼酸、醋酸各样品浓度均为0.04mol/L的100mL混合液中,加入不同体积0.2mol/L的NaOH溶液,分别配成pH为:2.31、3.25、3.93、4.35、4.81、5.15、5.74、6.25、6.40、6.82、7.19、7.5的Britton-Robinson缓冲溶液。
pH响应的荧光测试:先荧光光谱仪的参数设置为:激发波长为565nm,扫描范围是575-700nm,扫描速度为中速,采样间隔为1.0,激发波长的狭缝为3nm,发射波长的狭缝为1.5nm,响应时间为自动。然后将配好的测试溶液再次摇匀后,取4mL放入荧光池中开始测试。
如图1所示,本发明的目标化合物为罗丹明衍生物,具有类似的荧光性能。在pH为4.5-5.5的范围内pH越小荧光强度越强,说明本发明合成的荧光探针是潜在的肿瘤细胞内响应pH的荧光开关探针,可用于监测细胞pH的变化。
生物活性测试
应用presto blue试剂测定本发明糖基1,2,3-三唑β-榄香烯衍生物对肝癌细胞生长的抑制作用进行初步评价。具体实验步骤如下:
(1)细胞培养基的配制:DMEM培养基含10%灭活胎牛血清和1%青霉素/链霉素。
(2)细胞的培养:分别将HepG2细胞接种于细胞培养基中,于37℃,5%CO2培养箱中培养。
(3)化合物样品的配制:将化合物用DMSO溶解,使其浓度为10mM。用细胞培养基稀释到合适浓度进行细胞活性测试。
(4)测定化合物样品对肿瘤细胞生长的抑制作用
将人肝癌细胞株HepG2用胰酶消化,用培养基稀释到5×104/mL,加到96孔板中,每孔100μL,放置于37℃、5%CO2培养箱中培养24小时。弃去原培养基,每孔加入含化合物样品的培养基每孔100μL,放置于37℃、5%CO2培养箱中培养48小时。在细胞培养板中每孔加入10μL presto blue,在37℃、5%CO2培养箱孵育2小时,用酶标仪在570nm和600nm处测定吸光度,计算化合物样品的IC50,其中榄香烯作为阳性对照,IC即测定结果如表1所示:
表1化合物生物活性测试结果
由上表可见,本发明的化合物10、14、24和30具有优良的抗肝癌活性,其效果优于榄香烯,具有较好的应用前景。
综上所述,本发明提供了三类可实时监控治疗肿瘤的糖基1,2,3-三唑β-榄香烯衍生物,该类化合物在医药技术领域实现实时监控治疗肿瘤的研究与应用具有重要的科学意义。
- 还没有人留言评论。精彩留言会获得点赞!