抑制Tau蛋白聚集的抗体型分子伴侣的制作方法
本发明属于生物技术领域,具体涉及抑制Tau蛋白聚集的抗体型分子伴侣。
背景技术:
蛋白质折叠问题的研究是当前生物学的研究前沿之一,蛋白质折叠机制的阐明将揭示生命体内一维信息如何转化为三维信息,并通过蛋白质与其配体的相互作用决定蛋白质功能与生命进程的奥秘,这是它的理论意义。同时对蛋白质折叠的研究还存在重要的应用价值,例如蛋白质异常的空间结构以及蛋白质的错误聚集可以引发疾病,这些疾病称为“折叠病”,包括疯牛病、克-雅二氏症、老年痴呆症和帕金森症等,深入了解蛋白质折叠与错误折叠和聚集的关系对于这些疾病致病机理的阐明以及治疗方法的寻找将大有帮助。
阿尔茨海默病(又称老年性痴呆)是对老年人威胁巨大的一种疾病,它是一种神经退行性疾病,也是一种折叠病,其病理学特征主要表现为细胞外老年斑和细胞内神经纤维缠结(neurofibrillary tangles,NFT)的形成,老年斑沉积中的主要成分是β淀粉样肽,神经纤维缠结的主要成分是异常磷酸化的Tau蛋白(以下简称Tau)。因此,针对阿尔茨海默病的治疗位点主要是β淀粉样肽和Tau。Tau是一种与微管组装密切相关的蛋白质,主要生理作用是促进微管的聚集并稳定微管。在病理状态下,Tau过磷酸化,过磷酸化的Tau从微管上解离并聚集,沉积在神经细胞中形成聚集体,这些聚集体可通过多种途径损伤神经元和神经胶质细胞,影响细胞代谢,导致神经毒性与神经退行性病变。
以Tau为靶点的药物主要包括Tau过磷酸化抑制剂与Tau蛋白聚集抑制剂两类,前者主要是相关蛋白激酶的抑制剂,然而开发专一性强的激酶抑制剂非常困难,激酶抑制剂会产生各种副作用,主要原因在于一种激酶抑制剂会同时抑制生物体内多种激酶的活性。与之相比,开发Tau蛋白聚集抑制剂更容易一些,利用一定的手段防止Tau聚沉,就有可能缓解乃至治疗疾病。
在可以使用的生物分子中,抗体是一个很好的选择,其优点是专一性强、稳定性好、免疫原性与毒性可控、易于制备或筛选,现在各种治疗型抗体正在如火如荼地开发中,前景十分看好。抗体型分子伴侣是一类可以与目标蛋白质特异结合的抗体,该抗体具有分子伴侣功能,能抑制目标蛋白质的错误折叠与聚沉。近年来一些国外的研究者纷纷发现抗体可具有分子伴侣的功能。
技术实现要素:
本发明要解决的技术问题是如何抑制Tau蛋白的聚集。
为了解决上述技术问题,本发明首先提供了一种单链抗体。
本发明提供的单链抗体包括重链可变区和轻链可变区,
所述轻链可变区的氨基酸序列为如下(1)或(2):
(1)序列3第23-133位所示的氨基酸序列;
(2)将序列3第23-133位所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的氨基酸序列;
所述重链可变区的氨基酸序列为如下(3)或(4):
(3)序列3第155-273位所示的氨基酸序列;
(4)将序列3第155-273位所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的氨基酸序列。
上述单链抗体中,
所述单链抗体的氨基酸序列为如下(5)或(6):
(5)序列3所示的氨基酸序列;
(6)将序列3所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的氨基酸序列。
为了解决上述技术问题,本发明又提供了与上述单链抗体相关的生物材料,
本发明提供的与上述单链抗体相关的生物材料为下述A或B或C:
A、下述A1)至A12)中的任一种:
A1)编码上述轻链可变区的核酸分子;
A2)含有A1)所述核酸分子的表达盒;
A3)含有A1)所述核酸分子的重组载体;
A4)含有A2)所述表达盒的重组载体;
A5)含有A1)所述核酸分子的重组微生物;
A6)含有A2)所述表达盒的重组微生物;
A7)含有A3)所述重组载体的重组微生物;
A8)含有A4)所述重组载体的重组微生物;
A9)含有A1)所述核酸分子的转基因植物细胞系;
A10)含有A2)所述表达盒的转基因植物细胞系;
A11)含有A3)所述重组载体的转基因植物细胞系;
A12)含有A4)所述重组载体的转基因植物细胞系;
B、下述B1)至B12)中的任一种:
B1)编码上述重链可变区的核酸分子;
B2)含有B1)所述核酸分子的表达盒;
B3)含有B1)所述核酸分子的重组载体;
B4)含有B2)所述表达盒的重组载体;
B5)含有B1)所述核酸分子的重组微生物;
B6)含有B2)所述表达盒的重组微生物;
B7)含有B3)所述重组载体的重组微生物;
B8)含有B4)所述重组载体的重组微生物;
B9)含有B1)所述核酸分子的转基因植物细胞系;
B10)含有B2)所述表达盒的转基因植物细胞系;
B11)含有B3)所述重组载体的转基因植物细胞系;
B12)含有B4)所述重组载体的转基因植物细胞系;
C、下述C1)至C12)中的任一种:
C1)编码上述单链抗体的核酸分子;
C2)含有C1)所述核酸分子的表达盒;
C3)含有C1)所述核酸分子的重组载体;
C4)含有C2)所述表达盒的重组载体;
C5)含有C1)所述核酸分子的重组微生物;
C6)含有C2)所述表达盒的重组微生物;
C7)含有C3)所述重组载体的重组微生物;
C8)含有C4)所述重组载体的重组微生物;
C9)含有C1)所述核酸分子的转基因植物细胞系;
C10)含有C2)所述表达盒的转基因植物细胞系;
C11)含有C3)所述重组载体的转基因植物细胞系;
C12)含有C4)所述重组载体的转基因植物细胞系。
上述生物材料中,
所述轻链可变区的编码序列为如下a1)-a3)所示的基因:
a1)序列2第67-399位所示的DNA分子;
a2)与a1)限定的核苷酸序列具有75%或75%以上同一性,且编码上述轻链可变区的cDNA分子或基因组DNA分子;
a3)在严格条件下与a1)或a2)限定的核苷酸序列杂交,且编码上述轻链可变区的cDNA分子或基因组DNA分子;
所述重链可变区的编码序列为如下b1)-b3)所示的基因:
b1)序列2第463-819位所示的DNA分子;
b2)与b1)限定的核苷酸序列具有75%或75%以上同一性,且编码上述重链可变区的cDNA分子或基因组DNA分子;
b3)在严格条件下与b1)或b2)限定的核苷酸序列杂交,且编码上述重链可变区的cDNA分子或基因组DNA分子;
所述单链抗体的编码序列为如下c1)-c3)所示的基因:
c1)序列2所示的DNA分子;
c2)与c1)限定的核苷酸序列具有75%或75%以上同一性,且编码上述单链抗体的cDNA分子或基因组DNA分子;
c3)在严格条件下与c1)或c2)限定的核苷酸序列杂交,且编码上述单链抗体的cDNA分子或基因组DNA分子。
为了解决上述技术问题,本发明还提供了上述单链抗体的衍生物。
本发明提供的上述单链抗体的衍生物为下述X)或Y)或Z):
X)含有上述单链抗体的融合抗体;
Y)含有上述重链可变区和上述轻链可变区的Fab;
Z)含有上述重链可变区和上述轻链可变区的完整抗体。
为了解决上述技术问题,本发明还提供了上述单链抗体的新用途。
本发明提供了上述单链抗体在作为分子伴侣中的应用。
为了解决上述技术问题,本发明还提供了上述单链抗体或上述生物材料或上述衍生物的新用途。
本发明提供了上述单链抗体或上述生物材料或上述衍生物在如下(m1)-(m6)中任一种中的应用:
(m1)抑制Tau蛋白的聚集;
(m2)制备抑制Tau蛋白的聚集的产品;
(m3)抑制或降低Tau蛋白聚集导致的细胞毒性;
(m4)制备抑制或降低Tau蛋白聚集导致的细胞毒性的产品;
(m5)治疗或辅助治疗阿尔茨海默病;
(m6)制备治疗或辅助治疗阿尔茨海默病的产品。
上述应用中,所述Tau蛋白为磷酸化的Tau蛋白。
为了解决上述技术问题,本发明最后提供了一种产品。
本发明提供的产品的活性成分为上述单链抗体或上述生物材料或上述衍生物;
所述产品的功能为如下(m1)-(m6)中任一种:
(m1)抑制Tau蛋白的聚集;
(m2)制备抑制Tau蛋白的聚集的产品;
(m3)抑制或降低Tau蛋白聚集导致的细胞毒性;
(m4)制备抑制或降低Tau蛋白聚集导致的细胞毒性的产品;
(m5)治疗或辅助治疗阿尔茨海默病;
(m6)制备治疗或辅助治疗阿尔茨海默病的产品。
上述产品中,所述Tau蛋白为磷酸化的Tau蛋白。
本发明以磷酸化Tau蛋白为抗原,利用大容量的人源噬菌体抗体库,筛选获得具有伴侣功能、抑制磷酸化Tau聚集的scFv单链抗体,并进一步通过体外与体内实验研究抗体与Tau的相互作用及其分子机制,为阿尔茨海默病的治疗提供新的依据与突破口。实验证明:无论是在稀溶液还是拥挤的环境中,scFv T1皆可有效抑制磷酸化Tau蛋白聚集;构建的共表达hTauR406W(一种高毒性的Tau突变体)与scFv T1的转基因果蝇中,发现hTauR406W的单独表达可使果蝇的眼睛粗糙变形,hTauR406W和scFv T1的共表达可有效抑制hTauR406W对果蝇眼睛的毒性,进一步表明scFv T1在生物体内也可有效抑制Tau蛋白聚集并降低其毒性。通过上述体外实验与体内实验的研究结果表明,本发明的抗体型分子伴侣scFv T1可以有效抑制Tau蛋白聚集,且专一性强、高效低毒,在体内易清除,相比于用传统方法制备的单克隆或多克隆抗体,具有人源化、抗体筛选方便、容易制备等优点,这种单链抗体比普通的免疫球蛋白分子更小、更容易在模式生物体内或体外培养的动物细胞内表达、可以突破血脑屏障、毒副作用低、不易引起目标的免疫反应,可方便地进行细胞与动物水平的研究及阿尔茨海默病的临床治疗与应用,为阿尔茨海默病的治疗提供了新的方向,具有用于治疗阿尔茨海默病的潜在应用价值和很好的医学应用前景。
附图说明
图1为SDS-PAGE检测Tau蛋白分离纯化效果。其中,1泳道为蛋白质marker,2泳道为菌体总蛋白,3泳道为超声破碎离心上清,4泳道为蛋白煮沸后离心上清,5泳道为穿透峰,6泳道为含10mM咪唑的洗杂液洗脱峰,7泳道为含40mM咪唑的磷酸盐缓冲液洗脱峰,8-10泳道为含100mM咪唑的磷酸盐缓冲液洗脱峰。
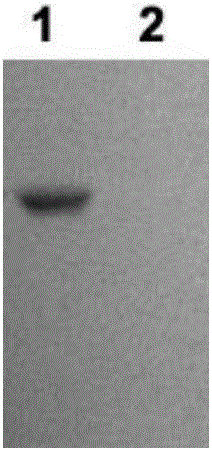
图2为Western Blotting鉴定Tau磷酸化结果。其中,左侧(1)为磷酸化的Tau蛋白,右侧(2)为非磷酸化的Tau蛋白。
图3为单链抗体scFv T1分离纯化结果。其中,1泳道为蛋白质marker,2泳道为scFv T1培养基上清全蛋白,3泳道为穿透样品,4泳道为10mM咪唑的洗脱样品,5泳道为40mM咪唑的洗脱样品,6-9泳道为100mM咪唑的洗脱样品。
图4为Western Blotting法鉴定单链抗体scFv T1与磷酸化Tau的结合。其中,左侧为Marker,右侧为磷酸化Tau+scFv T1。
图5为三种单链抗体对磷酸化Tau聚集的影响。其中,组1:(对照组,■),组2:(scFv T1,),组3:(scFv T2,●),组4:(scFv T3,▲),单链抗体与磷酸化Tau的浓度均为5μM。
图6为不同浓度的单链抗体scFv T1以及对照蛋白对磷酸化Tau聚集的影响。其中,scFv T1的浓度分别是1.25μM(●),2.5μM(▲),5μM与10μM(◆),Tris-HCl对照:(■),BSA对照:scFv A4对照:(Δ),磷酸化Tau、BSA与scFv A4的浓度均为5μM。
图7为用透射电镜法检测单链抗体T1对磷酸化Tau蛋白聚集的影响作用。其中,A:不含单链抗体T1的体系;B:含10μM单链抗体T1的体系。磷酸化Tau蛋白的浓度为5μM。
图8为用SDS-PAGE法检测不同浓度的scFv T1对磷酸化Tau蛋白聚集的影响作用。其中,自左至右,scFv T1的浓度分别是0μM(1)、1.25μM(2)、2.5μM(3)、5μM(4)与10μM(5)。磷酸化Tau蛋白的浓度为5μM。
图9为拥挤环境中,不同浓度的scFv T1对磷酸化Tau聚集的影响。其中,scFv T1的浓度分别是1.25μM(●)、2.5μM5μM与10μM(◆),Tris-HCl对照为(■),磷酸化Tau的浓度为5μM。
图10为用透射电镜法检测拥挤环境中,scFv T1对磷酸化Tau蛋白聚集的影响作用。其中,A:不含scFv T1的体系;B:含10μM scFv T1的体系。磷酸化Tau的浓度为5μM。
图11为不同浓度的单链抗体scFv T1对磷酸化Tau蛋白构象变化的影响作用。其中,scFv T1的浓度分别是1.25μM(●)、2.5μM5μM与10μM(◆),Tris-HCl对照为(■),磷酸化Tau蛋白的浓度是5μM。
图12为单链抗体的共表达对Tau突变体(hTauR406W)细胞毒性的影响作用。其中,A:不表达hTauR406W的果蝇wl118(购自美国印第安纳大学Bloomington果蝇品系库中心,产品目录号3605);B:单独表达hTauR406W的果蝇模型;C:共表达hTauR406W与scFv T1的果蝇模型。♀代表雌性果蝇,♂代表雄性果蝇。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的定量试验,均设置三次重复实验,结果取平均值。
实施例1、Tau蛋白的原核表达与分离纯化
一、Tau蛋白的原核表达与分离纯化
1、构建pET21a-Tau质粒
以pGEX-6p-1-Tau质粒为模板进行PCR扩增,得到PCR产物,即Tau基因片段;利用限制性内切酶NdeⅠ和XhoⅠ分别对PCR产物和pET21a质粒进行双酶切,分别得到酶切后的Tau基因和pET21a质粒骨架载体;连接酶切后的Tau基因和pET21a质粒骨架载体,得到pET21a-Tau质粒并对其进行测序验证。
测序结果表明:pET21a-Tau质粒为将序列1所示的DNA片段插入pET21a质粒(购自Merck Millipore,产品目录号69740-3CN)的NdeⅠ和XhoⅠ酶切位点间,且保持pET21a质粒的其他序列不变得到的质粒。
2、构建重组菌
将步骤1构建的pET21a-Tau质粒转化大肠杆菌BL21(DE 3)感受态细胞(购自中科瑞泰生物科技有限公司,产品目录号RTX304-03)中,得到重组菌pET21a-Tau/BL21。
3、重组菌的诱导表达
挑取重组菌pET21a-Tau/BL21的单菌落接入含50μg/mL Amp的LB液体培养基中,于37℃下200rpm振荡培养,至OD600值达到0.6左右,加入IPTG(终浓度0.5mM),16℃诱导表达16个小时。诱导结束后,离心,弃上清,收集菌体;经过超声波破碎(超声3s,间隔15s,功率600W,超声60次)后,离心,收集上清液即为含有目的蛋白Tau蛋白的粗提取液。
4、Tau蛋白的纯化
对Tau蛋白的粗提取液进行纯化,得到纯化后的Tau蛋白溶液。具体步骤如下:
(1)首先对Tau蛋白的粗提取液采用如下热变性方法进行变性:100℃下加热30分钟,12000rpm离心30分钟,收集上清液。
(2)对上清液进行Ni介质亲和层析,使用的层析柱为HisTrap FF(购自GE Healthcare Life Sciences,产品目录号17-5255-01),具体操作如下:
①连接纯化体系(恒流泵-Ni亲和层析柱-紫外检测仪-收集器);
②平衡:用含10mM咪唑的磷酸盐缓冲液(pH7.5)平衡层析柱约5个柱体积,并将紫外检测仪示数调为零;
③上样:接入含Tau蛋白的上清液,并收集穿透峰;
④洗杂:用含10mM咪唑的磷酸盐缓冲液洗杂至紫外检测仪示数接近零,收集洗杂液;
⑤洗脱:分别用含40mM与100mM咪唑的磷酸盐缓冲液洗脱目的蛋白,收集洗脱峰;
⑥对穿透峰、洗杂液和洗脱峰中的样品进行SDS-PAGE电泳检测。
电泳检测的结果如图1所示:经分析可知,热变性可除去大多数杂蛋白,亲和层析实验中,5泳道穿透下来的蛋白都是目的条带之外的杂蛋白,说明介质承载力较好。6泳道有比较少的杂带出现,说明一些掺杂在介质中的杂蛋白可以被10mM咪唑的PBS洗脱下来,7泳道中含40mM咪唑的磷酸盐缓冲液已经可以洗脱下来部分Tau蛋白,8-10泳道为含100mM咪唑的磷酸盐缓冲液洗脱峰,含100mM咪唑的磷酸盐缓冲液可以将几乎所有Tau蛋白洗脱下来,并且蛋白纯度相对较高,进行超滤浓缩后可用于后续实验。
根据电泳检测结果,合并含100mM咪唑的磷酸盐缓冲液的洗脱样品,用10mM Tris-HCl缓冲液(pH 7.5)透析过夜,用超滤管浓缩,得到纯化后的Tau蛋白溶液。用考马斯亮蓝G-250法测定纯化后的Tau蛋白溶液的浓度为26μM。
二、Tau蛋白磷酸化及其验证
1、Tau蛋白磷酸化
选择GSK-3β(购自New England BioLabs,产品目录号P6040L)对步骤一获得的Tau蛋白进行磷酸化,得到磷酸化的Tau蛋白。磷酸化方法如下:根据GSK-3β说明书,将Tau蛋白(步骤一获得的纯化后的Tau蛋白)、GSK-3β、ATP、MgCl2、DTT和Tris-HCl(pH7.5)混匀,得到磷酸化体系(200μl),各组分在磷酸化体系中的浓度为20μM Tau蛋白,500U GSK-3β,10mM Tris-HCl,2mM ATP,10mM MgCl2,1mM DTT。将磷酸化体系在30℃条件下磷酸化处理20小时,然后95℃处理5分钟终止反应,得到磷酸化的Tau蛋白。
2、磷酸化状态验证
采用鼠源Tau(Phospho-ser396)抗体(购自Thermo Fischer Scientific,产品目录号44-752G)和AP-羊抗鼠二抗(购自Sigma-aldrich,产品目录号A3562)进行Western Blotting验证Tau蛋白的磷酸化。实验步骤如下:
①电泳:取磷酸化的Tau蛋白样品和非磷酸化的Tau蛋白(步骤一获得的纯化后的Tau蛋白)进行SDS-PAGE电泳;
②平衡:将裁剪好的凝胶和滤纸放入转膜缓冲液中平衡30分钟,同时,用甲醇处理与凝胶等大的PVDF膜2分钟,随后立即转移至转膜缓冲液中平衡;
③转膜:干式转膜装置由上到下依次为阳极碳板—3层滤纸—PVDF膜—蛋白凝胶—3层滤纸—阴极碳板,恒流200mA-1.5小时;
④封闭:用0.01M磷酸盐缓冲液清洗PVDF膜,5分钟×4次,用5%脱脂奶粉封闭,37℃培养箱中放置1小时;
⑤孵育一抗:磷酸盐缓冲液清洗5分钟×4次,按1:2000比例加入Tau(Phospho-ser396)抗体,37℃-60rpm-1小时;
⑥孵育二抗:磷酸盐缓冲液清洗5分钟×4次,按1:5000比例加入AP-羊抗鼠二抗,37℃-60rpm-1小时;
⑦显色:磷酸盐缓冲液清洗PVDF膜,放入显色液中显色。
Western Blotting鉴定结果如图2所示:实验结果表明,仅磷酸化的Tau蛋白被识别,非磷酸化的Tau蛋白未被识别,由此可验证磷酸化的Tau蛋白中的Tau蛋白为磷酸化状态。
实施例2、单链抗体的制备与分离纯化
一、噬菌体抗体的筛选与鉴定
1、噬菌体抗体的筛选
以实施例1中制备的磷酸化的Tau蛋白为抗原,利用大容量的人源噬菌体抗体库,筛选获得具有伴侣功能、抑制磷酸化的Tau蛋白聚集的scFv单链抗体。具体步骤如下:
(1)包被:用实施例1中制备的磷酸化的Tau蛋白包被免疫管,4℃过夜;
(2)封闭:用30g/L脱脂奶粉封闭1小时;
(3)孵育:用含0.05%Tween-20的磷酸盐缓冲液洗涤两次,加入1mL噬菌体抗体库(委托海军总医院中心实验科制备,滴度为3×1013CFU/mL),37℃孵育2小时;
(4)洗杂:反复洗涤清除未结合的噬菌体抗体;
(5)洗脱:加入新鲜培养的XL1-Blue菌(购自北京华越洋生物,产品目录号GX123-100)进行直接感染,37℃孵育15分钟,转入SB培养液,在细菌感染回收后的免疫管中加入1mL洗脱液(0.1M HCL,0.1%BSA,pH2.2),37℃静置15分钟,用2M Tris中和至中性,加入2mL XL1-Blue菌,37℃孵育15分钟,转入SB培养液;
(6)扩培与诱导:37℃扩培3小时,加入2ml辅助噬菌体VCSM13(购自Agilent Technologies,产品目录号200251),30℃诱导过夜;
(7)收集:离心收集上清,加入适量PEG8000(购自碧云天,产品目录号ST483)和NaCl进行盐析,离心,去上清,并用37℃预热的1%BSA重悬沉淀,离心除杂;
(8)再次筛选:将收集到的重悬液重新加入到包被免疫管中再次淘选,总共进行4轮,筛选出结合较强的特异性噬菌体抗体。
从第3轮和第4轮盘上挑取200个克隆,加入VCSM13辅助噬菌体(购自Agilent Technologies,产品目录号200251),30℃培养过夜,离心收取上清中的噬菌体抗体,进行鉴定。
2、噬菌体抗体的鉴定
(1)ELISA实验鉴定
①包被:将磷酸化的Tau蛋白稀释至50μg/mL,包被ELISA板,37℃孵育1小时;
②封闭:PBS洗涤,用5%脱脂奶粉封闭1小时;
③孵育:加入收集的噬菌体抗体,37℃孵育1小时,随后孵育HRP-抗M13鼠mAb(购自Sino Biological,产品目录号11973-MM05-50);
④显色:磷酸盐缓冲液洗涤,加入OPD底物显色,酶标仪读取A490值。
ELISA检测结果显示,200个克隆中有27个克隆展示的单链抗体可特异性结合磷酸化的Tau蛋白。
(2)DNA指纹鉴定
采用DNA指纹鉴定27个克隆中是否存在相同的基因。具体步骤如下:挑选ELISA反应良好的样品为模板,采用引物1和引物2进行PCR扩增,得到PCR产物。
引物1:AATTCTATTTCAAGGAGACAGTCATA;
引物2:TAAACAACTTTCAACAGTAGCGGCCGC。
反应体系(50μl)如下:模板DNA 2μl、引物1 0.6μl、引物2 0.6μl、10×buffer 3μl、Mg2+1.8μl、dNTP 1.8μl、Taq酶0.3μl、ddH2O 19.9μl。反应程序如下:94℃预变性60秒→94℃变性40秒→56℃退火40秒→72℃延伸1分钟→30个循环→72℃7分钟→4℃保温。
用CL-6B凝胶微型柱离心纯化PCR产物,再以1:10的体积比加入限制性内切酶Mva I,在37℃条件下消化2小时,得到消化产物。取10μl消化产物进行PAGE电泳,EB染色后通过比较带型判断27个克隆是否具有相同基因,并将DNA指纹相同的样品归为一类。
分析结果显示,27个样品共具备7种不同的图谱,可分别对应7种抗体基因,也即筛选出7种与磷酸化的Tau蛋白特异性结合的噬菌体抗体。
用上述具有不同指纹图谱的7种噬菌体抗体感染HB2151菌(购自普如汀生物技术有限公司,产品目录号610036),结果有3个噬菌体感染HB2151菌后,单链抗体的可溶性表达呈阳性,分别将其表达的单链抗体记作scFV T1、scFV T2和scFV T3。
二、可溶性单链抗体的制备及分离纯化
1、可溶性单链抗体的制备
(1)分别将20μl步骤一中已鉴定的单链抗体scFV T1、scFV T2和scFV T3对应的噬菌体与1ml新鲜培养的HB2151菌液轻轻混匀,37℃放置15分钟,划线过夜培养。
(2)从LB平板上挑取单菌落,37℃过夜小培,按1:100的比例进行扩培至OD值0.6左右,调节温度为30℃,1mM IPTG诱导抗体表达,诱导时间16小时。收集菌液,6000rpm离心20分钟,取上清,上清中分别含有可溶性单链抗体scFV T1、scFV T2和scFV T3。
2、可溶性单链抗体的分离纯化
分别对含有可溶性单链抗体scFV T1、scFV T2和scFV T3的溶液进行纯化,分别得到纯化后的单链抗体scFV T1、纯化后的单链抗体scFV T2和纯化后的单链抗体scFV T3。具体步骤如下:
(1)硫酸铵沉淀目的蛋白
分别将上清液缓慢加入硫酸铵至饱和浓度为60%,充分搅拌使其溶解,4℃静置1小时,离心20分钟,保留沉淀。
(2)蛋白重溶与透析除盐
用10mM Tris-HCl(pH 7.5)缓冲液重新溶解蛋白沉淀,离心取上清,用透析袋过夜透析除去蛋白溶液中过量的硫酸铵。
(3)His-Trap亲和柱层析
①连接蛋白纯化体系,并用含10mM咪唑的10mM Tris-HCl缓冲液平衡,调节基线;
②将透析处理后的样品接入蛋白纯化体系,用平衡液洗杂至基线,并收集洗杂液;
③分别用含40mM与100mM咪唑的10mM Tris-HCl缓冲液洗脱,收集相应的洗脱峰,进行SDS-PAGE电泳分析。
电泳结果表明,大多数杂蛋白不与亲和柱结合,被低浓度咪唑(小于40mM)洗脱下来的几乎全是杂蛋白,目的蛋白可以被100mM咪唑洗脱下来,而且洗脱样品的纯度较高,因此收集100mM咪唑洗脱样品,用10mM Tris-HCl缓冲液透析过夜,超滤浓缩,分别得到纯化后的单链抗体scFV T1、纯化后的单链抗体scFV T2和纯化后的单链抗体scFV T3,用于后续实验。其中对单链抗体scFV T1的纯化过程得到的各样品进行的SDS-PAGE电泳分析结果如图3所示。
用考马斯亮蓝G-250法测定纯化后的单链抗体scFV T1的浓度为24.3μM,纯化后的单链抗体scFV T2的浓度为20.1μM,纯化后的单链抗体scFV T3的浓度为15.9μM。
三、单链抗体与磷酸化的Tau蛋白的结合能力检测
1、Western Blotting法验证scFv T1
①电泳:取纯化后的单链抗体scFV T1溶液样品进行SDS-PAGE电泳;
②平衡:将裁剪好的凝胶和滤纸放入转膜缓冲液中平衡30分钟,同时,用甲醇处理与凝胶等大的PVDF膜2分钟,随后立即转移至转膜缓冲液中平衡;
③转膜:干式转膜装置由上到下依次为阳极碳板—3层滤纸—PVDF膜—蛋白凝胶—3层滤纸—阴极碳板,恒流200mA-1.5小时;
④封闭:用0.01M磷酸盐缓冲液清洗PVDF膜,5分钟×4次,用5%脱脂奶粉封闭,37℃培养箱中放置1小时;
⑤孵育抗体:磷酸盐缓冲液清洗5分钟×4次,按1:2000比例加入抗V5标签的酶联抗体(anti-V5-HRP antibody,购自Thermo Fisher Scientific Inc.,产品目录号R96125),37℃-60rpm-1小时;
⑥显色:磷酸盐缓冲液清洗PVDF膜,放入显色液中显色。
Western Blotting检测结果表明,本发明制备的单链抗体样品可被抗V5标签的抗体识别,因此可用抗V5标签的抗体鉴定单链抗体是否结合磷酸化的Tau蛋白。
2、与磷酸化的Tau蛋白的结合能力
(1)ELISA法
用ELISA法分别检测三种纯化后的单链抗体scFv T1、scFv T2和scFv T3与磷酸化的Tau蛋白的结合能力,使用抗V5标签的酶联抗体(anti-V5-HRP antibody)识别可与磷酸化的Tau蛋白结合的单链抗体,并以Ovalbumin、Pepsin与BSA蛋白作为阴性对照。
ELISA检测结果表明,步骤一筛选并纯化得到的三种单链抗体scFv T1、scFv T2和scFv T3均能够结合磷酸化的Tau蛋白,其中scFv T1与磷酸化的Tau蛋白的结合能力最强,三种单链抗体scFv T1、scFv T2和scFv T3均不结合作为阴性对照的Ovalbumin、Pepsin与BSA蛋白,说明这三种单链抗体scFv T1、scFv T2和scFv T3对磷酸化的Tau蛋白的识别与结合具有特异性。
(2)Western Blotting法
①电泳:取磷酸化的Tau蛋白样品进行SDS-PAGE电泳;
②平衡:将裁剪好的凝胶和滤纸放入转膜缓冲液中平衡30分钟,同时,用甲醇处理与凝胶等大的PVDF膜2分钟,随后立即转移至转膜缓冲液中平衡;
③转膜:干式转膜装置由上到下依次为阳极碳板—3层滤纸—PVDF膜—蛋白凝胶—3层滤纸—阴极碳板,恒流200mA-1.5小时;
④封闭:用0.01M磷酸盐缓冲液清洗PVDF膜,5分钟×4次,用5%脱脂奶粉封闭,37℃培养箱中放置1小时;
⑤孵育scFv T1:磷酸盐缓冲液清洗5分钟×4次,按Tau:scFv T1=1:1比例加入纯化后的单链抗体scFV T1,37℃-60rpm-1小时;
⑥孵育抗V5标签抗体:磷酸盐缓冲液清洗5分钟×4次,按1:2000比例加入抗V5标签的酶联抗体(anti-V5-HRP antibody),37℃-60rpm-1小时;
⑦显色:磷酸盐缓冲液清洗PVDF膜,放入显色液中显色。
Western Blotting检测结果如图4所示。从图中可以看出,单链抗体scFv T1可特异性结合磷酸化的Tau蛋白。
四、单链抗体scFv T1的序列分析
经测序分析,单链抗体scFv T1的氨基酸序列为序列3,其编码基因序列为序列2,其中,单链抗体scFv T1的轻链可变区的氨基酸序列为序列3第23-133位,轻链可变区的编码基因序列为序列2第67-399位;单链抗体scFv T1的重链可变区的氨基酸序列为序列3第155-273位,重链可变区的编码基因序列为序列2第463-819位。
实施例3、单链抗体scFv对磷酸化的Tau蛋白聚集的影响
一、稀溶液中scFv对磷酸化的Tau蛋白聚集的作用
1、不同的scFv对磷酸化的Tau蛋白聚集的作用
按照单链抗体的不同分为如下各组研究单链抗体对磷酸化的Tau蛋白聚集的作用:
组1(对照):将磷酸化的Tau蛋白(实施例1中制备,终浓度为5μM)、肝素(购自Sigma-Aldrich,产品目录号H3149,终浓度为1.25μM)、DTT(购自Sigma-Aldrich,产品目录号D0632,终浓度为1mM)和Tris-HCl缓冲液(10mM,pH7.5)混匀,37℃孵育,于不同时刻使用ThT荧光法检测磷酸化Tau蛋白的聚集情况;
组2(scFv T1):将scFv T1(纯化后的样品,5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育不同时间,ThT法检测Tau蛋白的聚集情况;
组3(scFv T2):将scFv T2(纯化后的样品,5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育不同时间,ThT法检测Tau蛋白的聚集情况;
组4(scFv T3):将scFv T3(纯化后的样品,5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育不同时间,ThT法检测Tau蛋白的聚集情况。
ThT荧光法检测的具体步骤如下:将ThT(Thioflavin T,购自Sigma-Aldrich,产品目录号T3516)固体粉末溶于10mM Tris-HCl(pH 7.5)缓冲液,制备2.5mM储液。Tau聚集开始后,每隔一定时间取20μl Tau样品,加入980μl硫磺素T溶液,混合均匀,利用荧光分光光度计检测荧光强度。荧光检测条件:激发光440nm,发射光480nm,间隙5nm。检测结果处理方式:取荧光发射光谱480nm处的荧光强度绘制时间-荧光强度变化曲线。
结果如图5所示。三种不同的单链抗体中,单链抗体scFv T1对磷酸化的Tau蛋白聚集具有明显的抑制作用。
2、Tau蛋白-scFv的比例和其他蛋白对磷酸化Tau蛋白聚集的作用
根据Tau蛋白与scFv T1的比例不同分为如下各组研究单链抗体scFv T1对磷酸化Tau蛋白聚集的作用:
组1(对照):将磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育不同时间,ThT法检测Tau蛋白的聚集情况;
组2(1.25μM):将scFv T1(纯化后的样品,1.25μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育不同时间,ThT法检测Tau蛋白的聚集情况;
组3(2.5μM):将scFv T1(纯化后的样品,2.5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育不同时间,ThT法检测Tau蛋白的聚集情况;
组4(5μM):将scFv T1(纯化后的样品,5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育不同时间,ThT法检测Tau蛋白的聚集情况;
组5(10μM):将scFv T1(纯化后的样品,10μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育不同时间,ThT法检测Tau蛋白的聚集情况;
组6(BSA):将BSA(5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育不同时间,ThT法检测Tau蛋白的聚集情况;
组7(scFv A4):将scFv A4(针对人肌肌酸激酶筛选出的单链抗体,在文献“Li S,Sun C,Teng N,Yang W,Zhou L,Zhang Y.Chaperone-like effects of a scFv antibody on the folding of human muscle creatine kinase.Protein Eng Des Sel.2013,26(8):523-531.”中公开过)(5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育不同时间,ThT法检测Tau蛋白的聚集情况。
结果如图6所示:单链抗体scFv T1浓度越大,抑制效应越明显,且在磷酸化的Tau蛋白与单链抗体scFv T1的摩尔比为1:2时抑制效应最明显。作为对照,BSA对磷酸化的Tau蛋白的抑制作用不明显,具有与单链抗体scFv T1相似结构的单链抗体A4分子对磷酸化的Tau蛋白聚集同样无影响。由此推断单链抗体scFv T1的抑制效应与其抗原结合部位的特定结构相关,单链抗体scFv T1通过与磷酸化的Tau蛋白特异性结合,缓解其聚集现象的发生,说明本发明的单链抗体具有分子伴侣的功能。
3、透射电镜(TEM)法研究单链抗体scFv T1对Tau蛋白聚集的影响作用
利用透射电镜(TEM)法研究单链抗体scFv T1对Tau蛋白聚集的影响作用,根据是否添加单链抗体scFv T1,分为如下两组:
组1(对照):将磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育2小时,采用透射电镜法检测Tau蛋白的聚集情况;
组2(scFv T1):将scFv T1(纯化后的样品,10μM)、磷酸化Tau(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育2小时,采用透射电镜法检测Tau蛋白的聚集情况。
透射电镜法包括如下步骤:利用负染色法对样品进行处理,将适量蛋白样品滴于透射电镜检测用的铜网上,置室温放置2分钟,用水浸洗2次,用体积分数为2%的醋酸铀染液染色2分钟,晾干,用H-7650B透射电镜进行观察。
结果如图7所示。从图中可以看出:没加入单链抗体scFv T1时,磷酸化的Tau蛋白在2小时后形成了电镜中可被观测到的纤维化聚集物,按摩尔比1:2的比例将磷酸化的Tau蛋白与单链抗体scFv T1混匀后,磷酸化的Tau蛋白聚集程度有所减少,其聚集被单链抗体scFv T1抑制。
4、SDS-PAGE法研究单链抗体scFv T1对磷酸化Tau蛋白聚集的影响作用
利用SDS-PAGE法研究单链抗体scFv T1对磷酸化Tau蛋白聚集的影响作用,根据单链抗体scFv T1浓度的不同分为如下各组:
组1(对照):将磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育2小时,离心取沉淀,采用SDS-PAGE法检测Tau蛋白的聚集情况;
组2(1.25μM):将scFv T1(纯化后的样品,1.25μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育2小时,离心取沉淀,采用SDS-PAGE法检测Tau蛋白的聚集情况;
组3(2.5μM):将scFv T1(纯化后的样品,2.5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育2小时,离心取沉淀,采用SDS-PAGE法检测Tau蛋白的聚集情况;
组4(5μM):将scFv T1(纯化后的样品,5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育2小时,离心取沉淀,采用SDS-PAGE法检测Tau蛋白的聚集情况。
组5(10μM):将scFv T1(纯化后的样品,10μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育2小时,离心取沉淀,采用SDS-PAGE法检测Tau蛋白的聚集情况。
结果如图8所示。从图中可以看出:没加入单链抗体scFv T1时,由于发生聚集,磷酸化的Tau蛋白沉淀较多,单链抗体scFv T1的存在可以降低磷酸化Tau蛋白沉淀的数量,而且随着所加入单链抗体scFv T1的比例越来越高,这种效果越来越明显,且在磷酸化的Tau蛋白与单链抗体scFv T1的摩尔比为1:2时效果最明显。
二、拥挤环境中scFv对磷酸化Tau蛋白聚集的作用
根据上述实验结果设定合适的磷酸化Tau蛋白-单链抗体比例,在反应体系内加入大分子拥挤试剂Dextran 70(购自Sigma-Aldrich,产品目录号1179741)以模拟胞内环境,分别用ThT荧光法与透射电镜法检测拥挤环境中单链抗体scFv T1对磷酸化的Tau蛋白聚集的影响。根据单链抗体scFv T1浓度的不同分为如下各组:
组1(对照,0μM):将磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)、Dextran70(终浓度100mg/mL)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育2小时,分别采用ThT荧光法与透射电镜法检测Tau蛋白的聚集情况;
组2(1.25μM):将scFv T1(纯化后的样品,1.25μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)、Dextran 70(100mg/mL)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育2小时,采用ThT荧光法检测Tau蛋白的聚集情况;
组3(2.5μM):将scFv T1(纯化后的样品,2.5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)、Dextran 70(100mg/mL)、Tris-HCl(10mM,pH7.5)混匀,37℃孵育2小时,采用ThT荧光法检测Tau蛋白的聚集情况;
组4(5μM):将scFv T1(纯化后的样品,5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)、Dextran 70(100mg/mL)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育2小时,采用ThT荧光法检测Tau蛋白的聚集情况。
组5(10μM):将scFv T1(纯化后的样品,10μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)、Dextran 70(100mg/mL)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育2小时,分别采用ThT荧光法与透射电镜法检测Tau蛋白的聚集情况。
ThT荧光法的检测结果如图9所示,透射电镜的检测结果如图10所示。从图中可以看出:在拥挤环境中,单链抗体scFv T1也可抑制Tau蛋白聚集体的形成。该结果为单链抗体的体内研究提供了一定的基础和依据。
三、单链抗体scFv对Tau构象变化的影响
根据单链抗体scFv T1浓度的不同分为如下各组研究单链抗体scFv T1对Tau构象变化的影响:
组1(对照):将磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育,采用ANS荧光法检测Tau蛋白的聚集情况;
组2(1.25μM):将scFv T1(纯化后的样品,1.25μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育,ANS荧光法检测Tau蛋白的聚集情况;
组3(2.5μM):将scFv T1(纯化后的样品,2.5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育,ANS荧光法检测Tau蛋白的聚集情况;
组4(5μM):将scFv T1(纯化后的样品,5μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育,ANS荧光法检测Tau蛋白的聚集情况;
组5(10μM):将scFv T1(纯化后的样品,10μM)、磷酸化的Tau蛋白(5μM)、肝素(1.25μM)、DTT(1mM)和Tris-HCl(10mM,pH7.5)混匀,37℃孵育,ANS荧光法检测Tau蛋白的聚集情况。
上述ANS荧光法检测的步骤如下:Tau样品在孵育不同的时间后,取少量样品,用含20μM ANS的Tris-HCl缓冲液稀释10倍,用Fluoromax-4荧光分光光度计监测荧光强度,激发波长设为380nm,发射波长设为480nm。
结果如图11所示。磷酸化的Tau蛋白在聚集过程中,其构象发生可被ANS荧光检测到的显著变化,有较多疏水表面暴露,单链抗体scFv T1可以有效抑制Tau蛋白构象的变化,而且随着所加入单链抗体scFv T1的比例越来越高,这种效果越来越明显,且在磷酸化的Tau蛋白与单链抗体scFv T1的摩尔比为1:2时抑制效果最明显。
实施例4、单链抗体scFv T1对Tau细胞毒性的影响
本实施例利用果蝇模型来研究实施例2筛选出的scFv单链抗体是否影响Tau蛋白在生物体内的聚集和神经毒性。hTauR406W是一种Tau蛋白突变体,在某些FTDP-17(Frontotemporal dementia with parkinsonism linked to chromosome 17)病人中可发现这些突变体,其毒性比野生型Tau蛋白更强。GMR-GAL4属于GAL4/UAS二元基因表达体系,可使果蝇眼睛组织特异性地表达hTauR406W,使果蝇眼睛出现可被观测的退化表型。基于该果蝇模型,利用果蝇遗传学重组技术,在其眼睛中同时表达scFv T1单链抗体与hTauR406W,然后检测子代果蝇眼睛的发育情况。
一、果蝇体系的构建
GMR-Gal4与UAS-TauR406W果蝇体系购自美国印第安纳大学Bloomington果蝇品系库中心。利用分子克隆技术以及显微注射技术,构建UAS-scFvT1-FLAG转基因果蝇模型;利用遗传杂交法,构建表达hTauR406W的GMR-Gal4>UAS-TauR406W子代果蝇,表达scFvT1-FLAG的GMR-Gal4>UAS-scFvT1-FLAG子代果蝇,以及共表达hTauR406W与scFvT1-FLAG的GMR-Gal4>UAS-TauR406W、UAS-scFvT1-FLAG子代果蝇。具体步骤如下:
1、UAS-scFvT1-FLAG果蝇品系的构建
①利用DNA重组技术将序列4所示的scFvT1-FLAG DNA片段克隆至pUAST-{miniWhite}载体质粒(购自Drosophila Genomics Resource Center,产品目录号1000),DNA测序验证分子克隆构建成功,得到pUAST-scFvT1-FLAG质粒;pUAST-scFvT1-FLAG质粒表达带有FLAG标签序列的scFv T1蛋白,带有FLAG标签序列的scFv T1蛋白的氨基酸序列为序列5。
②利用Promega中提试剂盒提取pUAST-scFvT1-FLAG质粒;
③收集遗传背景为白眼的w1118果蝇品系(购自Bloomington果蝇品系库中心,产品目录号3605)的受精卵,显微注射pUAST-scFvT1-FLAG质粒以及表达介导实现DNA插入的转座酶delta2-3的辅助质粒(购自Drosophila Genomics Resource Center,产品目录号1001);
④收集显微注射后产生的子代果蝇(F0代果蝇),与白眼w1118果蝇回交,得到回交后代,筛选表型为红眼的回交后代,将其记作UAS-scFvT1-FLAG果蝇品系,保种。
2、表达hTauR406W的GMR-Gal4>UAS-TauR406W果蝇品系(对照果蝇)的构建
①收集GMR-Gal4果蝇品系处女蝇10只,收集UAS-TauR406W果蝇品系果蝇6只,进行遗传杂交;
②利用遗传学独立分配以及重组原理,按照文献“Brand AH,Perrimon N.Targeted gene expression as a means of altering cell fates and generating dominant phenotypes,Development 1993118:401-415.”中的方法,得到表达hTauR406W的GMR-Gal4>UAS-TauR406W果蝇品系,将其记作GMR-Gal4>UAS-TauR406W果蝇品系。GMR-Gal4>UAS-TauR406W果蝇品系单独表达hTauR406W。
3、表达scFvT1-FLAG的GMR-Gal4>UAS-scFvT1-FLAG果蝇品系的构建
①收集GMR-Gal4果蝇品系处女蝇10只,收集UAS-scFvT1-FLAG果蝇品系果蝇6只,进行遗传杂交;
②利用遗传学独立分配以及重组原理,按照文献“Brand AH,Perrimon N.Targeted gene expression as a means of altering cell fates and generating dominant phenotypes,Development 1993 118:401-415.”中的方法,得到表达scFvT1-FLAG的GMR-Gal4>UAS-scFvT1-FLAG果蝇品系,将其记作GMR-Gal4>UAS-scFvT1-FLAG果蝇品系。GMR-Gal4>UAS-scFvT1-FLAG果蝇品系单独表达scFvT1-FLAG。
4、hTauR406W和scFvT1-FLAG双表达果蝇品系的构建
①收集GMR-Gal4>UAS-TauR406W果蝇品系处女蝇15只,收集UAS-scFvT1-FLAG果蝇品系8只,进行遗传杂交;
②利用遗传学独立分配以及重组原理,按照文献“Brand AH,Perrimon N.Targeted gene expression as a means of altering cell fates and generating dominant phenotypes,Development 1993 118:401-415.”中的方法,得到hTauR406W和scFvT1-FLAG双表达果蝇品系,将其记作GMR-Gal4>UAS-TauR406W;UAS-scFvT1-FLAG果蝇品系。GMR-Gal4>UAS-TauR406W;UAS-scFvT1-FLAG果蝇品系共表达hTauR406W和scFvT1-FLAG。
二、果蝇模型的细胞毒性检测
每个果蝇模型各取24只成虫果蝇(雌雄各取12只),羽化后29℃培养7天,用适量浓度的CO2气体将果蝇暂时麻醉,置于观察台,利用体视显微镜观察果蝇复眼形态并进行微距拍照以及图片3D重组,对果蝇复眼的异常度进行评估。正常果蝇复眼由近750个单眼规则排布,而细胞毒性引发的病理导致果蝇眼睛变形,出现毛糙(rough eye)现象。
检测结果如图12所示。从图中可以看出,和w1118果蝇品系相比,单独表达hTauR406W的GMR-Gal4>UAS-TauR406W果蝇品系(对照果蝇)的果蝇眼睛变形,出现毛糙现象,hTauR406W在果蝇眼睛中的表达可导致可被观测到的细胞毒性;但hTauR406W和scFvT1-FLAG双表达果蝇品系可使果蝇模型的眼睛形态回复正常,可以有效抑制hTauR406W的细胞毒性。单独表达scFvT1-FLAG(GMR-Gal4>UAS-scFvT1-FLAG果蝇品系)对果蝇的生存与眼睛形状没有任何影响。本实验结果证明本发明筛选的抗体型分子伴侣scFv T1在生物体内也可有效抑制Tau蛋白聚集并降低其毒性,为阿尔茨海默病的治疗提供了新的方向。
序列表
<110>北京师范大学
<120>抑制Tau蛋白聚集的抗体型分子伴侣
<160>4
<210>1
<211>1323bp
<212>DNA
<213>人工序列
<220>
<223>
<400>1
atggctgagc cccgccagga gttcgaagtg atggaagatc acgctgggac gtacgggttg 60
ggggacagga aagatcaggg gggctacacc atgcaccaag accaagaggg tgacacggac 120
gctggcctga aagaatctcc cctgcagacc cccactgagg acggatctga ggaaccgggc 180
tctgaaacct ctgatgctaa gagcactcca acagcggaag atgtgacagc acccttagtg 240
gatgagggag ctcccggcaa gcaggctgcc gcgcagcccc acacggagat cccagaagga 300
accacagctg aagaagcagg cattggagac acccccagcc tggaagacga agctgctggt 360
cacgtgaccc aagctcgcat ggtcagtaaa agcaaagacg ggactggaag cgatgacaaa 420
aaagccaagg gggctgatgg taaaacgaag atcgccacac cgcggggagc agcccctcca 480
ggccagaagg gccaggccaa cgccaccagg attccagcaa aaaccccgcc cgctccaaag 540
acaccaccca gctctggtga acctccaaaa tcaggggatc gcagcggcta cagcagcccc 600
ggctccccag gcactcccgg cagccgctcc cgcaccccgt cccttccaac cccacccacc 660
cgggagccca agaaggtggc agtggtccgt actccaccca agtcgccgtc ttccgccaag 720
agccgcctgc agacagcccc cgtgcccatg ccagacctga agaatgtcaa gtccaagatc 780
ggctccactg agaacctgaa gcaccagccg ggaggcggga aggtgcagat aattaataag 840
aagctggatc ttagcaacgt ccagtccaag tgtggctcaa aggataatat caaacacgtc 900
ccgggaggcg gcagtgtgca aatagtctac aaaccagttg acctgagcaa ggtgacctcc 960
aagtgtggct cattaggcaa catccatcat aaaccaggag gtggccaggt ggaagtaaaa 1020
tctgagaagc ttgacttcaa ggacagagtc cagtcgaaga ttgggtccct ggacaatatc 1080
acccacgtcc ctggcggagg aaataaaaag attgaaaccc acaagctgac cttccgcgag 1140
aacgccaaag ccaagacaga ccacggggcg gagatcgtgt acaagtcgcc agtggtgtct 1200
ggggacacgt ctccacggca tctcagcaat gtctcctcca ccggcagcat cgacatggta 1260
gactcgcccc agctcgccac gctagctgac gaggtgtctg cctccctggc caagcagggt 1320
ttg 1323
<210>2
<211>888bp
<212>DNA
<213>人工序列
<220>
<223>
<400>2
atgaaatacc tattgcctac ggcagccgct ggattgttat tactcgcagc aagcggcgcg 60
catgcccagt ctgtgctgac gcagccgccc tcagtgtctg cggccccagg acagaaggtc 120
accatctcct gctctggaag cagctccaac attgggaata attatgtatc ctggtaccag 180
cagctcccag gaacagcccc caaactcctc atttatgaca ataataagcg accctcaggg 240
attcctgacc gattctctgg ctccaagtct ggcacgtcag ccaccctggg catcaccgga 300
ctccagactg gggacgaggc cgattattac tgcggaacat gggatagcag cctgagtgct 360
gtggtattcg gcggagggac caagctgacc gtcctagggt ccggagggtc gaccataact 420
tcgtataatg tatactatac gaagttatcc tcgagcggta cccaggtgca gctgttggag 480
tctgggggag gcttggtaca gcctgggggg tccctgagac tctcctgtgc agcctctgga 540
ttcaccttta gcagctatgc catgagctgg gtccgccagg ctccagggaa ggggctggag 600
tgggtctcag ctattagtgg tagtggtggt agcacatact acgcagactc cgtgaagggc 660
cggttcacca tctccagaga caattccaag aacacgctgt atctgcaaat gaacagcctg 720
agagccgagg acacggccgt atattactgt gcgaaagatc ccggccgggg cagtggctgg 780
tactactggg gccagggaac cctggtcact gtctcttcag ctagcggcaa accaatccca 840
aacccactgc tgggcctgga tagtactcac catcaccatc accattag 888
<210>3
<211>295
<212>PRT
<213>人工序列
<220>
<223>
<400>3
Met Lys Tyr Leu Leu Pro Thr Ala Ala Ala Gly Leu Leu Leu Leu Ala
1 5 10 15
Ala Ser Gly Ala His Ala Gln Ser Val Leu Thr Gln Pro Pro Ser Val
20 25 30
Ser Ala Ala Pro Gly Gln Lys Val Thr Ile Ser Cys Ser Gly Ser Ser
35 40 45
Ser Asn Ile Gly Asn Asn Tyr Val Ser Trp Tyr Gln Gln Leu Pro Gly
50 55 60
Thr Ala Pro Lys Leu Leu Ile Tyr Asp Asn Asn Lys Arg Pro Ser Gly
65 70 75 80
Ile Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Thr Leu
85 90 95
Gly Ile Thr Gly Leu Gln Thr Gly Asp Glu Ala Asp Tyr Tyr Cys Gly
100 105 110
Thr Trp Asp Ser Ser Leu Ser Ala Val Val Phe Gly Gly Gly Thr Lys
115 120 125
Leu Thr Val Leu Gly Ser Gly Gly Ser Thr Ile Thr Ser Tyr Asn Val
130 135 140
Tyr Tyr Thr Lys Leu Ser Ser Ser Gly Thr Gln Val Gln Leu Leu Glu
145 150 155 160
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
165 170 175
Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg
180 185 190
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser
195 200 205
Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile
210 215 220
Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu
225 230 235 240
Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Asp Pro Gly Arg
245 250 255
Gly Ser Gly Trp Tyr Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
260 265 270
Ser Ala Ser Gly Lys Pro Ile Pro Asn Pro Leu Leu Gly Leu Asp Ser
275 280 285
Thr His His His His His His
290 295
<210>4
<211>783bp
<212>DNA
<213>人工序列
<220>
<223>
<400>4
atgcagtctg tgctgacgca gccgccctca gtgtctgcgg ccccaggaca gaaggtcacc 60
atctcctgct ctggaagcag ctccaacatt gggaataatt atgtatcctg gtaccagcag 120
ctcccaggaa cagcccccaa actcctcatt tatgacaata ataagcgacc ctcagggatt 180
cctgaccgat tctctggctc caagtctggc acgtcagcca ccctgggcat caccggactc 240
cagactgggg acgaggccga ttattactgc ggaacatggg atagcagcct gagtgctgtg 300
gtattcggcg gagggaccaa gctgaccgtc ctagggtccg gagggtcgac cataacttcg 360
tataatgtat actatacgaa gttatcctcg agcggtaccc aggtgcagct gttggagtct 420
gggggaggct tggtacagcc tggggggtcc ctgagactct cctgtgcagc ctctggattc 480
acctttagca gctatgccat gagctgggtc cgccaggctc cagggaaggg gctggagtgg 540
gtctcagcta ttagtggtag tggtggtagc acatactacg cagactccgt gaagggccgg 600
ttcaccatct ccagagacaa ttccaagaac acgctgtatc tgcaaatgaa cagcctgaga 660
gccgaggaca cggccgtata ttactgtgcg aaagatcccg gccggggcag tggctggtac 720
tactggggcc agggaaccct ggtcactgtc tcttcagact acaaagacga tgacgacaag 780
tga 783
<210>5
<211>260
<212>PRT
<213>人工序列
<220>
<223>
<400>5
Met Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Ala Ala Pro Gly
1 5 10 15
Gln Lys Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
35 40 45
Leu Ile Tyr Asp Asn Asn Lys Arg Pro Ser Gly Ile Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Thr Ser Ala Thr Leu Gly Ile Thr Gly Leu
65 70 75 80
Gln Thr Gly Asp Glu Ala Asp Tyr Tyr Cys Gly Thr Trp Asp Ser Ser
85 90 95
Leu Ser Ala Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
Ser Gly Gly Ser Thr Ile Thr Ser Tyr Asn Val Tyr Tyr Thr Lys Leu
115 120 125
Ser Ser Ser Gly Thr Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu
130 135 140
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
145 150 155 160
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
165 170 175
Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr
180 185 190
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
195 200 205
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
210 215 220
Ala Val Tyr Tyr Cys Ala Lys Asp Pro Gly Arg Gly Ser Gly Trp Tyr
225 230 235 240
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Asp Tyr Lys Asp
245 250 255
Asp Asp Asp Lys
260
- 还没有人留言评论。精彩留言会获得点赞!
- 一种新的多肽——人分子伴侣cpn60蛋白26和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人分子伴侣cpn60蛋白8和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——分子伴侣cpn60蛋白15和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——分子伴侣cpn60蛋白10和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人分子伴侣蛋白18和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人分子伴侣蛋白14和编码这种多肽的多核苷酸的制作方法
- 含有分子内伴侣样序列的嵌合蛋白及其在胰岛素生产中的应用的制作方法
- 一种分子伴侣TSPcpn47和编码此分子伴侣的多核苷酸的制作方法
- 一种可溶性表达人脑利钠肽重组蛋白的方法和应用的制作方法
- 修饰的Cpn10以及PRR信号的制作方法